Method Article
モルホリノオリゴヌクレオチドの脳室マイクロインジェクションを使用した大人のゼブラフィッシュ脳における遺伝子発現のマイクロマニピュレーション
要約
本稿では、アンチセンスモルフォリノオリゴヌクレオチドを用いて成体ゼブラフィッシュの終脳の心室細胞における遺伝子発現の操作のための方法を示しています。私たちは、大人の脊椎動物の脳の機能的な研究のために使用することができ、効率的かつ迅速なプロトコルとして、この方法を提示する。
要約
組織における遺伝子発現の操作は、機能的研究を行う必要がある。本稿では、成人のゼブラフィッシュ脳における遺伝子発現を調節するための手段として、脳室マイクロインジェクション(CVMI)技術を実証する。 CVMIを使用することによって、物質が脳室液中に投与することができ、完全に脳のrostrocaudal軸に沿って分配される。我々は、特にin vivoでの遺伝子発現をノックダウンするための強力なツールであるアンチセンスモルホリノオリゴヌクレオチドの使用に焦点を当てる。本手法では、適用された場合、モルホリノ分子が心室の表面を覆う細胞によって取り込まれている。これらの細胞は、神経前駆細胞として機能する放射状グリア細胞を含む。したがって、放射状グリア細胞における遺伝子発現をノックダウンするゼブラフィッシュの広範な神経発生の応答を分析するために最も重要であり、また、脊椎動物は成人neurogenを維持することができるかについての洞察を提供するであろうESIS応答。このような理解は、人間の神経変性疾患、中枢神経系の再生における臨床応用のための努力を支援するだろう。したがって、私たちは大人ゼブラフィッシュ脳における遺伝子発現と神経新生応答を変更するために迅速かつ効率的な方法として、脳室マイクロインジェクション法を提示する。またCVMI手続きを行う方法に関するトラブルシューティングのヒントおよびその他の有用な情報を提供します。
概要
成体神経新生は、脊椎動物に共通する特徴ですが、有病率と効率性の程度は、系統発生1,2,3,4,5,6によって異なります。例えば、成人哺乳類の脳は硬骨魚のゼブラフィッシュは、その脳全体4,5,9,10で16の異なる幹細胞のドメインと関連する神経ゾーンが含まれている間、主に、前脳7,8に限定され、幹細胞の領域を含む。哺乳動物およびゼブラフィッシュの間のこの変化は、幹細胞の維持および前駆細胞の神経容量の機構における視差を反映しているかもしれない。ゼブラフィッシュの脳で採用分子メカニズムはヒトの神経変性疾患に取り組むために治療への応用のために活かされる可能性があるので、脳内の神経細胞を生成するためにゼブラフィッシュの生涯能力は、臨床影響をもたらす可能性があります。
成体ゼブラフィッシュ脳のいくつかの幹細胞ゾーンが分析されて、それが示されているそれらの領域の心室表面を覆う細胞が前駆細胞9,11-20として役立つ。ゼブラフィッシュの終脳内の詳細な分析は、例えば、神経前駆細胞19、20になるこの脳領域の心室表面の輪郭を描く放射状グリア細胞を同定した。これは、小脳や神経上皮細胞が神経入力16,21を提供する脳室内に配置視蓋、など他の地域にも当てはまる。この目的を達成するために、成人のゼブラフィッシュの脳内の広範な神経能力を支配する分子メカニズムを理解することは前駆細胞における遺伝子発現の操作を必要とします。
種々の方法は、以前はゼブラフィッシュで調節する遺伝子の機能について記載した。これらは単一のタンパク質、エレクトロポレーションまたは化学的処理に結合されたプラスミドベースフォーカル注射の所望の変異を表現条件トランスジェニック系統の生成を含む。我々は以前に設計され成体ゼブラフィッシュ脳22の心室細胞で調節する遺伝子機能を迅速かつ効率的な方法として、脳室マイクロインジェクションを用いた成人のゼブラフィッシュの脳へモルホリノオリゴヌクレオチドまたはタンパク質を含む様々な物質の投与方法。我々の研究では、生体内でのモルフォリノがあるため、共有結合などのエレクトロ23などの余分な透過処理を必要とせずに目的の細胞への効率的な配信を可能にする豊富な配信ペプチド、アルギニンにリンクモルホリノ分子を含む彼らの化学を用いた。これは、注射後に所望の組織を徹底的にターゲティングを可能にする、我々はゼブラフィッシュ成体終脳22で観察されただけで何が好きです。生体モルフォリノの使用したがって、そのようなエレクトロやDNA分子の焦点注射として標的組織の既存の方法よりも優れている。
ここで、我々は、この操作を実行し、どのように提供するか視覚的に示していステップ·バイ·ステップ·プロトコル。私たちは、注射液の準備と注入される魚の説明で始まり、射出装置の設定方法を示すことによって進みます。我々はマイクロインジェクターを用いたモルフォリノの頭蓋骨と注射で切開を生成伴う脳室注入法の説明を提供します。我々はまた、1つは、最適化やトラブルシューティングのガイドとして、それらを示すことによって全体の手順の間に慎重にする必要がある臨界点を詳述。
プロトコル
1。注射混合物の調製
- 細胞がより効率的に、通常のモルホリノ分子よりもそれらを内面として生体モルフォリノを使用してください。詳細については、メーカーの情報(:試薬および材料表1)を参照してください。
- 注入の精度を可視化する蛍光トラッキング色素( 例えば CellTracker赤CMTPX、Invitrogen)を使用します。この色素は、細胞内で代謝され、唯一の取り込み後の細胞内蛍光灯になります。したがって、このステップでは、効率的に脳室マイクロインジェクションによって目標とされているセルを決定することが重要です。
- 調製リン酸緩衝生理食塩水(PBS)(137mMの塩化ナトリウム、2.7mMのKClを、10mMのの Na 2 HPO 4、2mMのKH 2 PO 4、pH値:7.4)モルホリノ溶液を希釈する。モルホリノ溶液の希釈が必要な場合は、常にPBSを使用する。
- モルホリノ液9μlのと目の1μlのを追加することで、注入ミックス10μlのを準備電子セルトラッカー色素(希釈または希釈せずモルホリノソリューションの株式の濃度は500μMである我々の以前の結果22がモルホリノのそのいくつかの異なる投与量を示している- 。50μMから500μMまで-効率からノックダウンのさまざまなレベルで結果をhypomorphic表現型へのノックダウン)。溶液1μlのは1ゼブラフィッシュの脳内への注射で十分です。
- よく混ぜ、射出まで室温で保管してください。
2。注射装置の準備
- ニードルプラーを用いてガラス注射毛細血管を準備します。暖房サイクル値:463、サイクル値を引っ張っ:230、速度:1.5秒、時間:75ミリ秒以下のパラメータを使用します。
- 圧力源をオンにして、50 PSIまたは3.5バールまでの圧力設定を調整します。
- 次のようにマイクロインジェクターの設定を調整する:圧力20 psiの、イジェクト圧力10 psiの、ゲーの2.5と100ミリ秒の範囲の期間の値を保持する。
- ターンリング照明のオンと顕微鏡ステージ上のリングを見つけます。
- 顕微鏡の隣の適切な位置にキャピラリーホルダーを置きます。
- ホルダーにガラスキャピラリーを挿入します。 45度の噴射角を調整します。
- 細かいエンド鉗子を用いたガラスキャピラリーの先端をオフスナップ、オリフィスからの圧力出力を校正。これは、魚の水の中に針の先端を浸し、連続圧力パルスを与えることでテストする必要があります。生じた気泡が最適な圧力/オリフィスサイズの指標である1行だけ、でなければなりません。このキャリブレーションのデモ用のビデオを参照してください。
- 気泡をトラップせず注射液でガラスキャピラリーをロードします。
- ガラスキャピラリーの先端とロードされた注射液との間に空気を除去するために圧力を適用します。
3。麻酔
- 麻酔薬の原液を準備(0.1%MESAB - エチル -M-アミノ安息香酸メタン)。
- 水の十分な量のプラスチックマウスのケージやその他の輸送コンテナに自分のタンクから魚、所望の数を削除します。
- 麻酔原液5mlで魚の水200mlを混合することにより、小さなプラスチックの箱でanaesthetization溶液を調製。麻酔剤の最終濃度:0.0025%(v / v)である。
- 麻酔薬のプラスチックシャーレをハーフ埋める。注射のためにこの料理に使用します。
- 魚subduesまで麻酔で魚をインキュベートする。
4。切開と脳室マイクロインジェクション
- 魚のネットを使用してボックスから魚を外し、ペトリ皿に置きます。
- ゆっくりと、それは少し下向きに傾いているように鉗子やオリエント頭で魚を保持します。これは、切開が容易になる。
- 30ゲージ有刺鉄線エンド針を用いて頭蓋骨に小さなスリットを生成します。針の先端のみを使用し、複数の浸透しない十分にこのような脳には、脳組織を損傷し、出血などのマニフェストなります。
- 魚を保持したまま、切開部位を通じてガラスキャピラリーの先端を挿入します。
- オリエント終脳に向かってガラスキャピラリーの先端。これは組織の損傷を作成し、また、注入された液の分散を防ぐように脳組織に触れないようにしてください。
- ソリューションを注入する。液体は注射直後に分散させる。
5。回復と注入精度の分析
- 新鮮な魚と水とプラスチックの箱への注入のセットアップと場所から魚を外します。
- 回復を許可します。
- 簡潔に0.0025%のMESABで魚を再anaesthetize、蛍光顕微鏡下で魚を確認してください。赤色蛍光の徹底的な分散が注入された液体の広範な分布を示すものである。
- プラスチックの箱に戻って魚を置く。
- をtにプラスチックの箱を接続時間の長い期間のために酸素を送り込む魚や維持に、彼は循環システム。
- このような行動の分析など、目的の目的のために魚を使用するか、さらなる分析(組織染色、免疫組織化学、 など )に組織標本を準備するために注入した後、希望する時点で動物を生け贄に捧げる。 9,11,17-20,24-27:以下の参考文献は成体ゼブラフィッシュの脳を分析する方法の例を与える。効率的なノックダウン(50%以上ノックダウン)を観察する最速タイムは、私たちの研究では22 12時間であった。
6。推奨科学的コントロール
- ネガティブコントロールとして任意の表現型を引き起こすことが想定されていないミスマッチモルホリノ分子を使用してください。興味のあるすべての遺伝子について、標準モルホリノ分子又は特に設計モルホリノコントロールを使用します。また、MISMの非特異的効果や毒性を評価するためのさらなるネガティブコントロールとして(この場合はPBS)溶媒を用いるモルホリノ注射を制御/ ATCH。
- 陽性対照として以前に22記載PCNAのモルフォリノを使用します。このモルホリノは大人ゼブラフィッシュの脳(注射の1日以内の百分の75から95のノックダウン効率)22で効率的なノックダウンを引き起こす。
結果
脳室マイクロインジェクションは、注入されたソリューションの広範な分布につながる
図1に示されている脳室マイクロインジェクションのワークフローや技術的なスキームを使用して、我々は大人ゼブラフィッシュの脳にモルホリノオリゴヌクレオチドを投与した。正確な注入プロトコルは、心室面( 図2A)に近い細胞のターゲティング脳および効率的な全体に注入された液体の分散に繋がる。キャピラリーガラスは脳組織をimpales注射は注入点( 図2B)における高密度蛍光シグナルを持つことになります。注入量が十分でない場合、弱い蛍光シグナル( 図2C)が観察される。
脳室マイクロインジェクションは、成人のゼブラフィッシュ脳の脳室領域に遺伝子発現をノックダウンするために使用することができる
我々は目のを示しているin vivoでのモルフォリノで心室内面少数気泡径に浸透することができ、したがって、効率的に心室細胞( 図3A、3B)ターゲットにすることができます。モルホリノ注入は、対応するタンパク質( 図3C、3Dに示すような例があるPCNA)の産生を軽減するようにノックダウンする遺伝子発現することができる。我々は以前に、この技術を用いて遺伝子をノックダウンすると、成体のニューロン新生( 図3E、3F)又は再生応答( 図3G、3H)の間に機能的結果をもたらすことを実証した。我々は、効率的なノックダウンレンジが(50%以上ノックダウン)モルホリノ22の注入後約12時間で達成されることを実証した。我々はまた、効率的なノックダウン期間は約5日間PCNAタンパク質22注入後までであることを観察した。 70%以上のノックダウンは3日注射22後まで見られた。ノックダウン曲線は従属プレーヤーであるnは、内因性タンパク質およびモルホリノ分子の効率の発現レベルと、実験者はすべての遺伝子について決定されなければならない。我々の研究では、モルホリノ分子の投与が局所的であるため、おそらく、CVMI手順は動物の生存を危うくすることを見ていないと全身毒性を引き起こすことはありません。
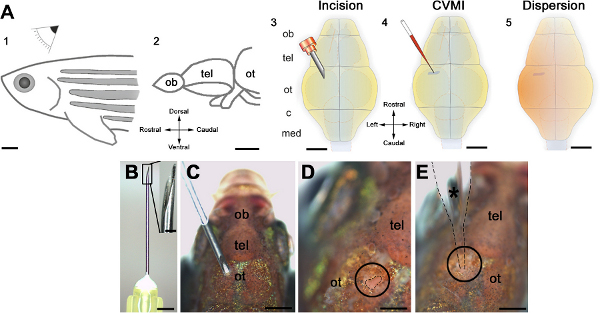
図1。脳室注入法の概略図。 (A)注入は視蓋のレベル(OT、2)における成人のゼブラフィッシュ(1)の背側から行われる。切開は、30ゲージの針(3)光ファイバ視蓋頭蓋骨プレートを介して行われます。ガラスキャピラリーを使用して、モルホリノ分子は心室液(4)に注入される。徹底した分散がある(5)瞬時chieved。(B)カニューレ及びその棘付きエンドは高倍率で示されている。(C)切開の前に針の向きは、(D)切開を丸で囲んだと破線で概説されている。(E)示され、噴射が行われるようにキャピラリ注入が配置されている。すべてのパネルは、REFから適応された22。 より大きい数字を表示するには、ここをクリックしてください 。
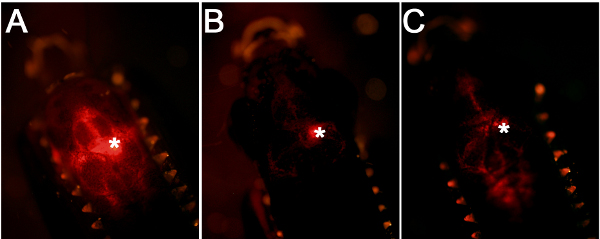
図2。注入効率と精度を比較する。(A)良い注入が近い心室表面への細胞の標的化につながる。 (B)ガラス毛管が脳組織内に挿入される場合、これは中央に位置する蛍光シグナルを生成する。 (C )噴射量が低い場合、これはより弱い蛍光シグナルをもたらす。
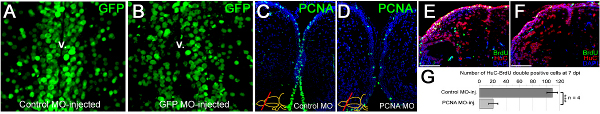
図3。 。GFP陽性核を示すトランスジェニックライン: モルホリノ浸透、遺伝子ノックダウンと機能的結果の効率は ()GFPコントロールモルホリノ注入Tgは(GFP H2A)の終脳の断面に免疫染色。 GFP陽性核を示すトランスジェニックライン:(B)GFPは、GFPセンスモルホリノ注入Tgは(GFP H2A)の終脳の断面に免疫染色。心室領域におけるGFP-信号の違いに注意してください。 V:心室。 (C)PCNAは、PCNA陽性細胞の広範な分布を示す制御モルホリノ注入脳で免疫染色。 ( D)PCNAはCVMIが内因性の遺伝子をノックダウンすることができますことを示す、PCNA陽性細胞の大幅に削減量を示すPCNAセンスモルホリノ注入脳に免疫染色。 (E)のBrdUとHUC / Dが22前述のBrdUパルスチェイス実験後新生児ニューロンを決定するために制御モルホリノ注入脳に免疫染色。 (F)のBrdUとHUC / Dが22前述のBrdUパルスチェイス実験後新生児ニューロンを決定するPCNAセンスモルホリノ注入脳に免疫染色。 (G)ノックダウンPCNAはCVMIの機能的結果をもたらす内在性遺伝子ノックダウンに使用することができることを示す、新生ニューロンの発生の大幅な削減につながる。すべてのパネルは、REFから適応された22は、 より大きい数字を表示するには、ここをクリックしてください 。
ディスカッション
我々はここで説明する方法では、成人のゼブラフィッシュの脳へモルフォリノの容易かつ迅速な管理を可能にします。我々は、注入法を効率的心室細胞及びニューロン新生応答の機能的結果をもたらすにおける遺伝子発現をブロックすることを実証した。
脳室マイクロインジェクションの実行中には慎重であるべき重要なポイントがあります。例えば、モルホリノ分子の効果は、使用される濃度に依存する。この濃度は、エンドユーザによって決定されなければならない。我々は標準的な胚の注入プロトコル28-30を使用して胚に注入することにより、事前テストに理想的に原液で始まる(500μM)と段階希釈を行ってお勧めします。以前、我々は、50μMから500μMの22までの範囲モルフォリノの濃度でノックダウン効率のさまざまなレベルを得た。第二に、ガラスキャピラリーのオリフィスがLARGすべきではありませんこのようにeは注射後の脳に広範な液体の流入につながる。これは適切な注入を防ぐことができます同様に、開口部が狭すぎてはいけません。一つは、水とのペトリ皿に空気をポンピングすることにより、最適なオリフィス圧力の組み合わせを決定することができる。生じた気泡がなく、複数の行の単一の行にする必要があります。我々は、ビデオでこれを実証している。第三に、麻酔薬で魚をインキュベートすることが重要です。魚は麻酔で2分より長く保持されるべきではない。これは、注射後の回復率が妨げられる。第四に、切開の位置が完全に注入された液体を分散させるために重要です。視蓋上心室領域が正中線上大きくなり、横方向に狭くなる。したがって、実験者は正中線に近く、終脳領域を覆う頭蓋骨プレートにジャスト尾頭蓋骨にスリットを生成する必要があります。
脳室充血の利点の一つN(CVMI)メソッドは、その迅速性です。 CVMIは遺伝子機能をアッセイするための迅速な方法である。一般的には数ヶ月かかる機能研究のためのトランスジェニック系統の世代と比較した場合、この機能は重要かつ有用である。フォーカル注射またはエレクトロポレーションと比較して、さらに、CVMIは、注入された液体の均一な分布につながるため、遺伝子活性の相対的に徹底した操作を提供します。 CVMIにより、複数の遺伝子が注入を調製することによって、同時にノックダウンすることができ、複数のモルフォリノオリゴヌクレオチドを含むミックス。 CVMIは、所定のモルホリノオリゴヌクレオチドの異なる濃度を注入するために使用することができるので、hypomorphicの表現型を分析するために使用することができる。最後に、この注射パラダイムは、毒性を引き起こすか、動物の生存を危うくすることはありません。
CVMI技術はそのような調節ペプチド、薬剤、プラスミドDNAまたはRNA調節カ月の注入のような他のタイプの試験のために展開されるかもしれないleculesまたは細胞の生理機能に影響を与える可能性のある他の物質。分子の組み合わせを検定し、用量反応分析を実行することは可能hypomorphic表現型を勉強できるように、我々の方法を使用しています。これらのプロパティを使用すると、CVMIは大人ゼブラフィッシュの脳内発現研究のための迅速かつ容易な測定法であることが判明し、かつ迅速なスクリーニングと機能解析を開きます。
成体ゼブラフィッシュの脳は、恒常的に全体rostrocaudal軸に沿って新たな神経細胞を生み出すことができますし、それはまた、外傷後に再生成することができます。これは限られた神経発生とすべての場合ではなく、貧しい人々再生能力を持つ哺乳類の脳とは全く対照的である。このような広範な幹細胞の活性および回復能力は、現在、ほとんど知られている中枢神経系の再生に必要な分子プログラムを理解するのに有用なモデル生物のゼブラフィッシュできる。したがって、ZEの再生適性の分子基盤を調査brafishの脳は魚や哺乳類の脳は損傷後に反応し、またヒトの再生医療治療のために道を与える方法の根本的な違いを説明するかもしれない研究の興味深い領域です。それらが神経前駆細胞3,8,20あるので、脊椎動物の脳の可塑性および再生の分子基盤を理解するために、グリア細胞が重要な研究領域となる。このように、ゼブラフィッシュの脳の放射状グリア細胞における遺伝子機能を変更するCVMI技術を使用して解明に尽力されどのように魚の脳が効率的な成体ニューロン新生と再生応答に結合前駆活動ができます。我々は最近、CVMI法を用いて可能になった大人のゼブラフィッシュの脳24,26,27、およびこれらの研究の再生神経新生応答にいくつかの要因とシグナル伝達経路の関与、要件を示している。全体的に、我々は、ゼブラフィッシュの脳から得る知識はリジェネを課すために利用することができた傷害に反応し、それ故に人間の神経疾患と急性傷害のための臨床治療を設計するのに役立ちます哺乳類グリア細胞へrative能力。
開示事項
利害の衝突は宣言されていない。
謝辞
この作品は、ドイツ学術振興(SFB 655)と欧州連合(ZF-ヘルス)によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| CellTracker Red CMTPX | Life Technologies, Invitrogen | C34552 | Use at 1:100 dilution for measuring the injection accuracy |
| MESAB (ethyl-m-aminobenzoate methanesulphonate) | Sigma-Aldrich | A5040 | For anesthetizing the fish |
| Petri dishes | Sarstedt | 821,472 | For handling the fish during injection and imaging |
| Phosphate-buffered saline | Life Technologies, GIBCO | 10010-056 | As sterile dilution medium |
| Vivo morpholinos | Gene Tools Inc. | Customized | More info on vivo morpholinos: www.gene-tools.com |
| Equipment | |||
| Barbed-end needle | Becton-Dickinson | 305178 | To generate the incision in the skull |
| Dissecting microscope | Olympus, Leica, Zeiss | Varies with the manufacturer | Part of the whole injection setup |
| Dumont Tweezers | World Precision Instruments | 501985 | To snap off the tip of the glass capillary |
| Fluorescence camera | Zeiss, Nikon, Leica | Varies with the manufacturer | To visualize the fluorescence after injection |
| Gillies Dissecting Forceps | World Precision Instruments | 501265 | To hold the fish in position |
| Glass injection capillaries | World Precision Instruments | TWF10 | For microinjection |
| PicoNozzle kit (microinjector holder) | World Precision Instruments | 5430-12 | For microinjection |
| Pneumatic PicoPump (microinjector) | World Precision Instruments | SYS-PV820 | For microinjection |
| Ring illuminator; Ring Light Guide | Parkland Scientific | ILL-RLG | For illuminating the specimen |
参考文献
- Stocum, D. . Regenerative Biology and Medicine. , (2006).
- Poss, K. D. Advances in understanding tissue regenerative capacity and mechanisms in animals. Nat. Rev. Genet. 11 (10), 710-722 (2010).
- Doetsch, F., Scharff, C. Challenges for brain repair: insights from adult neurogenesis in birds and mammals. Brain Behav. Evol. 58 (5), 306-322 (2001).
- Kaslin, J., et al. Proliferation, neurogenesis and regeneration in the non-mammalian vertebrate brain. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 363 (1489), 101-122 (2008).
- Kizil, C., et al. Adult neurogenesis and brain regeneration in zebrafish. Dev. Neurobiol. 72 (3), 429-461 (2012).
- Grandel, H., Brand, M. Comparative aspects of adult neural stem cell activity in vertebrates. Dev. Genes Evol. , (2013).
- Kempermann, G. . Adult Neurogenesis 2: Stem Cells and Neuronal Development in the Adult Brain. , (2010).
- Ihrie, R. A., Alvarez-Buylla, A. Cells in the astroglial lineage are neural stem cells. Cell Tissue Res. 331 (1), 179-191 (2008).
- Grandel, H., et al. Neural stem cells and neurogenesis in the adult zebrafish brain: origin, proliferation dynamics, migration and cell. 295 (1), 263-277 (2006).
- Chapouton, P., et al. Adult neurogenesis in non-mammalian vertebrates. Bioessays. 29 (8), 745-757 (2007).
- Adolf, B., et al. Conserved and acquired features of adult neurogenesis in the zebrafish telencephalon. Dev Biol. 295 (1), 278-293 (2006).
- Byrd, C. A., Brunjes, P. C. Neurogenesis in the olfactory bulb of adult zebrafish. Neuroscience. 105 (4), 793-801 (2001).
- Pellegrini, E., et al. Identification of aromatase-positive radial glial cells as progenitor cells in the ventricular layer of the forebrain in zebrafish. J. Comp. Neurol. 501 (1), 150-167 (2007).
- Lam, C. S., et al. gfap and nestin reporter lines reveal characteristics of neural progenitors in the adult zebrafish. 238 (2), 475-486 (2009).
- Wang, X., et al. Identification of Wnt-responsive cells in the zebrafish hypothalamus. Zebrafish. 6 (1), 49-58 (2009).
- Kaslin, J., et al. Stem cells in the adult zebrafish cerebellum: initiation and maintenance of a novel stem cell niche. J. Neurosci. 29 (19), 6142-6153 (2009).
- Ganz, J., et al. Heterogeneity and Fgf dependence of adult neural progenitors in the zebrafish telencephalon. Glia. 58 (11), 1345-1363 (2010).
- März, M., et al. Heterogeneity in progenitor cell subtypes in the ventricular zone of the zebrafish adult telencephalon. Glia. 58 (7), 870-888 (2010).
- Rothenaigner, I., et al. Clonal analysis by distinct viral vectors identifies bona fide neural stem cells in the adult zebrafish telencephalon and characterizes their division properties and fate. Development. 138 (8), 1459-1469 (2011).
- Kroehne, V., et al. Regeneration of the adult zebrafish brain from neurogenic radial glia-type progenitors. Development. 138 (22), 4831-4841 (2011).
- Ito, Y., et al. Characterization of neural stem cells and their progeny in the adult zebrafish optic tectum. Dev. Biol. 342 (1), 26-38 (2010).
- Kizil, C., Brand, M. Cerebroventricular microinjection (CVMI) into adult zebrafish brain is an efficient misexpression method for forebrain ventricular cells. PLoS One. 6 (11), e27395 (2011).
- Morcos, P. A., et al. Vivo-Morpholinos: a non-peptide transporter delivers Morpholinos into a wide array of mouse tissues. Biotechniques. 45 (6), 613-614 (2008).
- Kizil, C., et al. The chemokine receptor cxcr5 regulates the regenerative neurogenesis response in the adult zebrafish brain. Neural Dev. 7, 27 (2012).
- Chapouton, P., et al. her5 expression reveals a pool of neural stem cells in the adult zebrafish midbrain. Development. 133 (21), 4293-4303 (2006).
- Kizil, C., et al. Regenerative neurogenesis from neural progenitor cells requires injury-induced expression of Gata3. Developmental Cell. 23 (6), 1230-1237 (2012).
- Kyritsis, N., et al. Acute inflammation initiates the regenerative response in the adult zebrafish brain. Science. 338 (6112), 1353-1356 (2012).
- Rosen, J. N., et al. Microinjection of zebrafish embryos to analyze gene function. J. Vis. Exp. (25), e1115 (2009).
- Yuan, S., Sun, Z. Microinjection of mRNA and morpholino antisense oligonucleotides in zebrafish embryos. J. Vis. Exp. (27), e1113 (2009).
- Rikin, A., et al. A reverse genetic approach to test functional redundancy during embryogenesis. J. Vis. Exp. (42), e2020 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved