Method Article
解剖やゼブラフィッシュ胚の横方向の取付:脊髄発達の解析
要約
このような増殖、パターニング、分化、および軸索ガイダンスとして発生プロセスを容易にゼブラフィッシュ脊髄でモデル化することができる。この記事では、これらのイベントの可視化を最適化した、ゼブラフィッシュ胚の取付け手順を説明します。
要約
ゼブラフィッシュ脊髄はいくつかの理由で、神経系の研究のための効果的な調査モデルです。まず、遺伝子、遺伝子導入および遺伝子ノックダウンのアプローチは、神経系の発達の根底にある分子機序を調べるために利用することができる。第二に、発達上同期した胚の大クラッチは、大きな実験試料サイズを提供します。第三に、ゼブラフィッシュ胚の光学的透明度は、前駆細胞、グリアおよびニューロン集団を視覚化するために研究者を可能にします。ゼブラフィッシュ胚が透明であるが、試料厚さは、効果的な顕微鏡的視覚化を妨げることができます。この理由の一つは、脊髄体節組織とその上のタンデム開発である。もう一つの理由は、まだ初期の神経発生の期間中に存在する大規模な卵黄のボール、である。本稿では、マイクロダイセクションと周囲の体節組織を維持しながら微細な可視化を可能にする固定胚における卵黄の除去を実証する。私たちALSOゼブラフィッシュ胚の半永久的な取り付けを示しています。それは、組織の三次元性を保持し、これは、背腹方向および前後軸における神経発達の観察を可能にする。
概要
ゼブラフィッシュにおける脊髄の可視化は、多くの要因によって阻害される。原因の上にある体節の厚さや脊髄の内部の場所に、かなり長い作動距離は、高解像度の携帯に必要です。 (神経発生の初期段階で依然として存在している)卵黄球は、さらに、必要な作動距離を増加させ、容易にカバースリップからの圧力によって損傷される。また、損傷した卵黄からの破片は、組織の明確な可視化を禁止しています。背腹(DV)軸での断面が可能であるが、それらは容易に前後(AP)軸1に同時可視化を許可していません。
これらの障害を克服するために、胚を切開し、スライド上に搭載されている。この手順では、いくつかの利点があります。まず、ゼブラフィッシュ胚は容易にAP軸の可視化を容易にする、上に向けて側面に位置する。卵黄BALの第二、除去lは、必要な作動距離が減少し、デブリを制限する。第三に、この取り付け手順では、蛍光灯や明視野顕微鏡の両方を可能にします。第四に、マウントされた胚は、長時間の試料の可視化を可能にし、4℃で数ヶ月のために安定している。最後に、開発の進行は、セグメントは、後方のセグメントよりも成熟していることを、前方で発生します。上演一致脊髄hemisegmentsは胚との間で比較されることを保証するためには、上にある体節組織がガイドとして使用されている。例えば、第十最も後方体節は、ステージをマッチさせた胚における発生的に同等である第十脊髄hemisegmentを覆っている。完全な胚のこの取り付け手順では、体節を容易に識別することができます。
我々は発展途上の脊髄に軸索ガイダンスのメカニズムを研究するために遺伝学と遺伝子ノックダウン技術を使用しています。特に、我々はrobo2、robo3、およびDCCが交連一次ASCEのために必要とされることを決定したnding(COPA)軸索経路探索。ここで説明する取り付け手順を使用して、我々は腹側成長、正中線交差、交連幅、背側と前側の成長2,3を調べることができました。この取り付け手順は、DVまたは脊髄のAPパターニングに適用することができる。私たちは、脊髄のDVパターニング下流のWntエフェクターの異なる役割を決定するために、この手順を使用している。この実装を使用して、我々は単一細胞レベルでDVマーカーの解像度を取得し、変更されたWntシグナル受信4,5の結果として微細なパターニングシフトを決定することができた。この取り付け手順では、抗ホスホヒストン3またはBrdU標識(前駆増殖)分化5を通して分裂指数の計算が可能になります。
プロトコル
1。胚の取付け(例えば、免疫細胞として選択された可視化手法の完了時に、in situハイブリダイゼーションにおいて 、 等 )
- 選択したバッファ( 図1A)で満たされた35ミリメートルペトリ皿に胚を置きます。緩衝液の選択は、標識操作に基づいています。一般的に、PBSベースのバッファが適当である。
- 解剖顕微鏡とピンセットを使用しての下では、他のペア( 図1B)を廃止卵黄を引きながら鉗子の1対の頭を固定します。代わりに、そっと卵黄を引き離すために虫ピンホルダーに虫ピンを使用しています。
- 胚ポーカーを使用して(釣り糸(0.41ミリメートル径)キャピラリーチューブやパスツールピペットのいずれかに接着さ)卵黄の破片( 図1C-D)の多くを持っていないペトリ皿の部分に胚を移動します。
- ガラスパスツールピペットを用いて、できるだけ少ない液体中の胚を吸引、およびg本来的スライドさせます( 図1E)上にそれらをピペット。
- そっと研究室を使用してワイプ余分な液体を吸い取る。胚との接触を避ける。
- 胚へのメディアのマウントの1滴を追加します。蛍光標識の場合は、選択の退色防止剤を使用しています。比色信号の場合、70%のグリセロールを封入剤として使用することができる。
- 胚ポーカーを使用して、行( 図1F)での両側に胚を向けます。
- カバーガラス( 図1G)の各コーナーにワセリンまたは高真空グリースの1「DAB」を追加します。これは過度の圧縮からの胚の損傷を防止する。
- 胚( 図1H)の上にカバースリップ(ダウンワセリン側)を配置します。
- 封入剤(70%グリセロールまたは抗フェードマウント試薬)カバースリップに触れられるまでゆっくりと( 図1H)各コーナーでのカバーガラスをタップします。
- 必要な場合は、すぐ隣COVにピペッティングすることにより、より取付メディアを追加するerslip 20〜200 mlの範囲内ピペッターを使用して。それが下に吸い上げます。
- 研究室を使用すると、カバーガラスの周囲に完全にクリーンで拭いてください。これは、胚を損傷するように、カバーガラスに圧力をかけないことが確実であること。このエリアには、乾燥して、その上に何ワセリンまたは封入剤を持っていない必要があります。
- カバーガラス( 図1I)の縁の周りをシールするためにマニキュアを使用してください。
結果
そのような細胞のパターニング、分化、および軸索ガイダンスのような種々の発生事象の根底にあるメカニズムを解明する場合には、それらの組織のコンテキスト内で細胞を可視化できることが重要である。 PAX、NKX、あるいはdbxの家族 4における転写因子の発現領域での腹や背のシフトなどの典型的に存在背腹パターニング不良。時には、変更はわずか数細胞直径4を備え、微妙な場合があります。断面解析は、このタイプの分析を可能にする。しかし、弱い信号、またはAP軸に対して垂直でない断面を有する試薬が解釈を制限することができます。さらに、断面解析が容易に変更がAP軸に固執するかどうかを考慮に入れると、クライオスタットの利用可能性に依存していません。この制限は、脊髄の側面図によって回避される。 図2Bに見られるように、NKX6.1のmRNAをd前駆ドメイン内で、24時間後に受精(HPF)で、脊髄の約腹側半分にistributed。前駆細胞は、脊髄の内側部分に見出される床板の存在に起因する有糸分裂後の細胞から区別可能である。 DIC光学を使用して表示、個々の細胞は明らかに識別可能であり、発現細胞および非発現との間の定義された境界が明らかである。
前駆細胞周期の出口は、遺伝子発現の変化を伴う。たとえば、すべての有糸分裂後のニューロンは、免疫細胞の1,5で検出可能であるHUC / Dを発現する。 膵島、GATA、およびVSXの家族のためのmRNAプローブは、各脊髄hemisegment 6内で一貫位置や数の具体的な有糸分裂後ニューロンを標識する。また、このようなロボファミリーのもののような軸索 ガイダンス受容体は、分裂終了ニューロン( 図2C)の制限された集団において発現される 2,7,8。胚の横方向の取付けは、有糸分裂後のニューロンの正確なカウントが可能になります。同様に、分裂し続ける前駆細胞は、抗ホスホ - ヒストン3免疫細胞ならびにBrdU標識を用いて定量することができる。また、細胞死はTUNEL標識4-6で評価することができる。
24 HPFで、次の有糸分裂後のニューロンの軸索は、様々な方法で可視化することができ、単一細胞レベルで区別される。背側横昇順(DoLA)、交連プライマリ昇順(COPA)、交連セカンダリ昇順(COSA)、腹側縦降順(草原)、コールマー-Agdur(KA)、交連分岐/縦(COB / L)の周昇順(CIA)周降順(CID)、およびユニポーラ交連降順(UCoD)、Rohon - ベアード(RB)は、運動ニューロン( M)9。軸索は背側、腹側、前部および後部の方向にこれらのニューロンから伸びている。これらの枝、背側の両方を正中線を横断し、終了しますおよび腹側脊髄。共焦点レーザー走査顕微鏡と組み合わせると、これらの多様な細胞挙動は、免疫細胞化学などGFP 2などの遺伝的にコードされる蛍光タンパク質を用いて、横方向に取り付けられた胚において明らかである。 図2Dに、ZNP-1免疫細胞を開発する運動ニューロンを標識した。運動ニューロンは、周囲の発展途上の筋肉組織を刺激するために腹側脊髄を終了します。
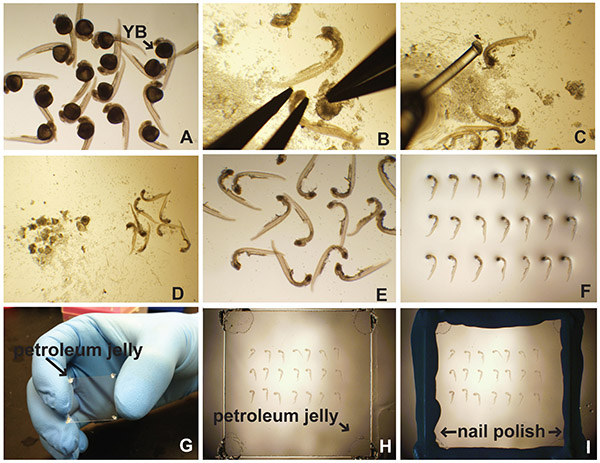
図1。切開およびゼブラフィッシュ胚のマウント横。(A)の免疫蛍光のために処理した後に、in situハイブリダイゼーションなどで 、胚を35ミリメートルのペトリ(0.5%トリトンX-100を含むPBS)PBTを充填した皿又はPTwは(PBSとに配置されている0.1%のTween-20)。卵黄ボール(YB)が明らかである。 (B)卵黄を注意深く切開に続いて、胚の頭部を固定することによって除去される。 (C)胚は、ポーカー(釣り糸をパスツールピペットに接着)の胚および卵黄破片(D)を分離するために使用される。清浄胚は、顕微鏡スライド(E)上にピペッティングし、(F)整列される。 (G)ワセリンを、カバースリップの角部に適用される。 (H)カバースリップ媒体を実装する際に胚の上に静かに置かれている。 (I)マニキュアはカバースリップの端をシールするために使用されます。 拡大画像を表示するには、ここをクリックしてください 。

<強い>図2。経路探索における遺伝子発現パターンおよび軸索の分析は、横方向にゼブラフィッシュ胚を装着。24ゼブラにおけるゼブラフィッシュ胚の(A)デッサン。 BDでは、卵黄嚢延長上およそ4 hemisegmentsは(箱入り領域)可視化する。 (B)NKX6.1、フロアプレート(FP)を含む腹側脊髄において発現される。 (C)robo3は、分裂終了ニューロン(PMN)で表される。床板および前駆ゾーンは、このより横焦点面に明らかではない。 Bでは、Cは 、脊髄は、画像の左側の括弧で囲まれている。 (D)共焦点顕微鏡は、腹側脊髄を出た運動軸索のラベル画像ZNP-1免疫蛍光に使用された。すべての画像では、前方が左にあり、背側がアップしています。 40X長作動距離、水浸漬(NA 0.8)レンズ(5.3 mm)を用いた。oad/50703/50703fig2highres.jpg "ターゲット=" _blank ">拡大画像を表示するにはここをクリックしてください。
ディスカッション
脊髄開発の固定ゼブラフィッシュ胚のエイズの可視化の横方向の取り付け。卵黄球の除去を介して、例外的な顕微鏡イメージングに必要なワーキングディスタンスが小さくなる。我々の代表的な結果は24ゼブラ段階に限られていた以前の胚による胚の大きさおよび組織の脆弱性に解剖するのがより困難であるものの、しかしながら、この技術は、早ければ18ゼブラとして使用することができる。この技術は、ゼブラ24歳以上の胚にも適用可能である。胚ゼブラフィッシュの光学的透明性、逆遺伝学、フォワード遺伝子スクリーニングを実行する機能、およびトランスジェニックアプローチに助けられ、いくつかの発生過程を調べることができる。これはBrdUおよび抗リン酸化ヒストン3 4-6とPAX、NKXと、dbx、およびoligファミリーをニューロンとグリア前駆マーカーの発現を通じてパターニングのようなマーカーを用いた神経細胞の前駆細胞の有糸分裂指数が含まれていS 1,4-6。グリアおよび(例えば、グリア線維性酸性タンパク質(GFAP)およびHUC / Dなど)、ニューロンの判定を報告1,4,5,10の試薬 を使用することができる。神経細胞サブタイプへの分化は、 島、VSX、エングレイルド 、およびGATA遺伝子 1,4-6の発現を介して分析することができます。そして最後に、軸索ガイダンスの分析は、抗アセチル化チューブリン、3A10のような抗体を介して可能であり、ZNP-1 2,11,12。他の脊椎動物モデル系(マウスやヒヨコ)が脊髄の発達を研究するために使用されているが、唯一のゼブラフィッシュは、無傷の胚内のすべての発達の軸を同時に見ることを可能にします。
この方法の明らかな制限は、ライブイメージングを排除する、胚が固定されていることである。実際に、迅速な胚の死卵黄結果(または損傷)の除去は、このように、この技術を用いて、ライブ胚における作動距離を低減することができない。しかし、高倍率脊髄CO生きた胚における番目のイメージングが可能である。ライブイメージング中に卵黄を保持するために、胚を試料とカバーガラスの間に大きな空間を提供する窪みスライドに配置することができる。代わりに、いくつかの22ミリメートル×22ミリメートルのカバースリップは、顕微鏡のスライドのX 1中3のいずれかのスライドに接着することができる。カバーガラスを覆っているカバーガラスのための「ブリッジ」としての役割を果たす。胚は18ゼブラよりも古い場合には、トリカインは、移動を防止するために、胚を麻酔するために使用される。 0.288ミリメートルの作動距離は24 HPFでdeyolked胚に必要ですが、アガロースに埋め込んだライブ胚を扱う場合、無傷の黄身で、3.3ミリメートルの作動距離を持つ微細なレンズで十分です。あるいは、deyolked胚に由来する外植片培養物は、血漿クロット固定化技術13を用いて可視化することができる。細胞の様々な集団は、GFP、mCherry、または光導などの遺伝的にコード化された蛍光タンパク質を利用して観察することができますvertible染料楓(数名)です。さらに、キメラ胚の中、蛍光標識された細胞はまた、このアプローチ14で表示することができます。
ヶ月間安定で一貫性のある実装技術が発達し、細胞生物学者のための重要なツールです。この簡単な技術は、異なる実験試験間比較が容易にできるように、再現性がある。さらに、行の胚の位置合わせが容易に後の分析のために、特定胚の識別を可能にします。
開示事項
競合する経済的利益は、作者のどちらかのために存在していません。
謝辞
スキッドモアファカルティ·ディベロップメント·グラントは、この原稿の作成と出版に資金を供給した。
資料
| Name | Company | Catalog Number | Comments |
Petri dishes 35 mm x 10 mm | VWR | 25373-041 | |
| Dumont Forceps #3 | Fisher Scientific | NC9839169 | |
| Cover glass | Fisher Scientific | 12-541-B22X22-1.5 | |
| Slides | Fisher Scientific | 12-550-343 | |
| SlowFade Gold | Fisher Scientific | S36936 | |
| ProLong Gold | Life Technologies | P36934 | |
| Petroleum Jelly | any grocery store |
| |
| Loop Holders | VWR | 80094-482 | |
| Insect Pins | Fine Science Tools | 26002-10 | |
| Nickel Plated Pin Holders | Fine Science Tools | 26016-12
| |
Olympus Stereomicroscope | Olympus | SZ61 |
参考文献
- Gribble, S. L., Nikolaus, O. B., Dorsky, R. I. Regulation and function of Dbx genes in the zebrafish spinal. Dev. Dyn. 236 (12), 3472-3483 (2007).
- Bonner, J., et al. Midline crossing is not required for subsequent pathfinding decisions in commissural neurons. Neural Dev. 7 (1), 18 (2012).
- Ross, A. B. J. Activation of Wnt signaling using Lithium Chloride: Inquiry-Based Undergraduate Laboratory Exercises. Zebrafish. , (2012).
- Bonner, J., et al. Proliferation and patterning are mediated independently in the dorsal spinal cord downstream of canonical Wnt signaling. Dev. Biol. 313 (1), 398-407 (2008).
- Gribble, S. L., et al. Tcf3 inhibits spinal cord neurogenesis by regulating sox4a expression. Development. 136 (5), 781-789 (2009).
- England, S., et al. Roles of Hedgehog pathway components and retinoic acid signalling in specifying zebrafish ventral spinal cord neurons. Development. 138 (23), 5121-5134 (2011).
- Challa, A. K., Beattie, C. E., Seeger, M. A. Identification and characterization of roundabout orthologs in zebrafish. Mech Dev. (1-2), 101-101 (2001).
- Lee, J. S., Ray, R., Chien, C. B. Cloning and expression of three zebrafish roundabout homologs suggest roles in axon guidance and cell. 221 (2), 216-230 (2001).
- Downes, G. B., Waterbury, J. A., Granato, M. Rapid in vivo labeling of identified zebrafish neurons. Genesis. 34 (3), 196-202 (2002).
- Kim, H., et al. Notch-regulated oligodendrocyte specification from radial glia in the spinal cord of zebrafish embryos. Dev. Dyn. 237 (8), 2081-2089 (2008).
- Sylvain, N. J., Brewster, D. L., Ali, D. W. Zebrafish embryos exposed to alcohol undergo abnormal development of motor neurons and muscle fibers. Neurotoxicol. Teratol. 32 (4), 472-480 (2010).
- de Soysa, T. Y., et al. Macondo crude oil from the Deepwater Horizon oil spill disrupts specific developmental processes during zebrafish embryogenesis. BMC Biol. 10 (40), (2012).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Dev Dyn. 228 (3), 464-474 (2003).
- Deschene, E. R., Barresi, M. J. Tissue Targeted Embryonic Chimeras: Zebrafish Gastrula Cell Transplantation. J. Vis. Exp. (31), (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved