Method Article
せん断応力のヒト肝類洞内皮条件のことを白血球の募集を研究するフロー接着アッセイ
要約
肝臓への白血球の動員は、固有の肝臓類洞内皮細胞で裏打ちされている肝正弦波の特殊なチャネル内に発生します。生理学的な剪断応力の条件下でヒト肝臓シヌソイド内皮を通過する白血球動員の位相差顕微鏡は、このプロセスの根底にある分子機構の解明を容易にすることができる。
要約
ヒト肝組織への白血球の浸潤は、すべての大人の炎症性肝疾患では一般的なプロセスです。慢性浸潤が肝硬変に線維症および進行の開発を推進することができます。肝臓に白血球動員を仲介する分子機構を理解することは、肝疾患のための重要な治療標的を同定できた。白血球の募集時の重要な相互作用は、せん断応力条件下で内皮と炎症性細胞のことである。肝臓への動員は、肝類洞内皮細胞(HSEC)によって裏打ちされている肝正弦波の低せん断チャンネル内で行われます。肝類洞内の条件は、特定の流量で人間HSEC単層が並んチャネルを通して白血球を灌流によってで要約することができます。これらの条件では、白血球は、内皮を横断クロールステップとその後の転生に続く活性化と強固な接着が続く短時間のテザリング段階を経る層。位相差顕微鏡を用いて、この「接着カスケード 'の各ステップは、可視化およびオフライン分析により追跡記録することができる。内皮細胞または白血球は、このプロセス中に特定の分子の役割を決定するために、阻害剤で前処理することができる。
概要
それが現在では一般的には白血球の募集は多段階の接着カスケード1のパラダイムに従っていることが確立されている。これは、血管壁を裏打ちする内皮細胞によって血液を流すの白血球の捕捉を伴う。最初に、白血球は、受容体または免疫グロブリンスーパーファミリーのメンバーセレクチンにより媒介される圧延工程を経る。これは、Gタンパク質共役受容体(GPCR)は、内皮糖衣上に提示ケモカインによって活性化される白血球の表面上で発現を可能にする。これは白血球表面上の「高親和性」状態にインテグリン確認の変更につながり、逮捕し、内皮への強固な接着。強固な接着は、その後、容器に白血球の形状変化とクロールが続いている。最後のステップは、傍細胞または経細胞経路を介して発生する可能性が内皮単層を介して、輪廻です。
多段階の接着カスケードは説明しながら、S本体内の白血球募集の一般的な機構は、器官特異的な違いがあります。肝臓では白血球の動員の大多数は募集は一般的に後毛細血管細静脈2内で発生した他の臓器とは対照的に肝類洞内で発生します。肝類洞は低剪断環境であり、白血球は、セレクチン依存しない2で接着を会社に前に簡単なテザリング段階を経る。これらのチャネルは、不連続であるとfenestraの複数形が含まれ、肝正弦内皮によって並ぶ直径開孔100〜200 nmであり、基底膜3を欠いている。ヒト肝正弦内皮を通過する白血球動員を仲介する分子機構を解明することは、炎症性肝疾患のための臓器特異的な治療標的を同定できた。
フロー接着アッセイは、白血球動員を研究する上で欠かせないツールです。彼らは、白血球の再構築を可能にするrecru明確に定義された力の下での密着性を分析するためのせん断応力の存在下でitment。アッセイのための最も頻繁に使用すると、培養内皮単層または精製された基材への研修白血球接着です。市販のフローチャンバーは、2つの平坦面との間の層流の条件下で細胞を灌流し、次いで顕微鏡4上に接着の動的なプロセスを視覚化するために使用される。以前のグループは、特定の接着相互作用しか流れの下で行われることが実証されていると、静的アッセイ5,6において研究することができない。
我々は、肝の正弦波を再現し、低せん断応力の条件下での白血球動員を研究するためにこの手法を使用している。初代ヒトHSECマイクロスライドおよび白血球で培養し、肝臓の洞様の中にせん断応力を再現するために計算された流量で、この単層の上に灌流することができます。せん断応力は、OPP等の表面に対して平行または接線方向の印加される応力である垂直な垂直応力にosed。境界に沿って移動している任意の流体は、その境界にせん断応力を発揮します。せん断応力は、リンパ球遊出7の必須成分であることが示されている。これらの条件下で接着カスケードの各ステップは、位相差顕微鏡によって可視化することができる。この方法は、従来の接着分子の研究8、ケモカインおよびケモカイン受容体9から11の役割、およびそのような血管接着タンパク質-1(VAP-1などの非定型接着分子を含む肝臓内白血球のリクルートに重要な洞察を可能にした)8,12および共通リンパや血管内皮受容体-1(CLEVER-1)13。このアッセイは、当社グループの出版物のいくつかに言及してきたが、その説明は簡潔されており、我々は、トラブルシューティングに役立つ技術的なエラーを防ぐためのステップガイドでは、詳細な手順を提供するために、この機会を取ったときの試みアッセイをING。さらに、我々は最近、せん断応力で正確な変更を可能にするマイクロスライドチャンバの調達を変更しました。我々は、これが他の内皮および免疫細胞へのアッセイの適用可能性を広げると信じています。以下の方法は、ヒト肝臓類洞内皮細胞および末梢血リンパ球とフローベースの接着アッセイを実施するための調製および技術が記載されている。
プロトコル
1。マイクロスライドの準備
- プレコートラット尾コラーゲンI型(220μg/ mlのの作業希釈を与え、PBSで1:100に希釈したRTC)と6チャンネルマイクロスライド。これは、直接チャネルに希釈されたRTCの溶液30μlを注入し、PBSで3回洗浄し、続いて37℃で2時間、インキュベートすることによって行われる。
2。マイクロスライド内の細胞を播種
- トリプシン-EDTAで(前に13説明されているように、肝臓組織から単離された)培養ヒト肝類洞内皮細胞の融合T75フラスコ(HSEC)を解離する、完全なメディア(ヒト内皮中3×10 6個/ mlのPBSで洗って、再懸濁基本培地は、2mMのL-グルタミン、100 U / mlペニシリンおよび100μg/mlのストレプトマイシン、10%熱不活性化ABヒト血清、血管内皮増殖因子の10 ng / mlのおよび肝細胞増殖因子の10 ng / mlの)を補充した。悲惨な細胞懸濁液30μLを注入CTLY各チャンネルに。
- 37の加湿インキュベーター中で1時間付着させた細胞を残す スライドラック上の5%のCO 2雰囲気でC°。細胞を、完全培地( 図1)、各チャネルの両側のポートを埋める付着させた。
3。細胞のサイトカイン刺激
- 24時間培養器内の細胞を残す。倒立位相差顕微鏡を用いて細胞増殖を評価する。従来接着アッセイ24時間、腫瘍壊死因子αおよびインターフェロンγによって補充した完全培地、10 ng / mlの少なくとも両方で成長培地を置き換えることによりサイトカインと内皮単層を刺激。
4。末梢血リンパ球を単離する
- 最初に800で25分間、適切な細胞遠心分離媒体を介して密度勾配遠心分離によって単核画分を精製することによって、全血から末梢血リンパ球を単離するXグラム。単球の接着を可能にするために1時間プラスチック上の細胞をインキュベートします。
- プラスチック吸引するために遵守以下のリンパ球は、上澄みを濃縮。リンパ球を洗浄し、流動媒体中で(典型的には1×10 6細胞/ ml(内皮細胞基本培地は、0.1%(v / v)のウシ血清アルブミン(BSA))で再懸濁します。
5。インヒビターを有する内皮や白血球の前処理
- 内皮media/0.1の%(V / V)BSA中に抗体または小分子阻害剤をブロックする機能が推奨される希釈液を準備します。 30分前にアッセイを流れるように選択したマイクロスライドチャネルで抗体/阻害剤溶液をブロッキング完全培地を交換してください。
- リンパ球上のケモカイン受容体の前処理が計画され、(v / v)のBSA、0.1%を含有するRPMI溶液中で単離された白血球を再懸濁し、ケモカイン受容体のGタンパク質共役受容体活性をブロックするために百日咳毒素200ngの/ mlでインキュベートする場所、あるいは特定の希機能推奨される希釈で抗体またはケモカイン受容体の小分子阻害剤を遮断する。次いで、流動媒体中で洗浄し、再懸濁し、30分間37℃で白血球をインキュベートする。
6。フローアッセイシステムのセットアップ
- 37にサーモスタット制御透明チャンバーを予熱し ℃、チャンバーはほとんどないデッドボリュームで細胞とメディアの間で切り替えることができる電子ソレノイドバルブ用のシリコンチューブと電子の供給を挿入するためのポートを持っている必要があります。チャンバは、位相差顕微鏡法を可能にするために倒立顕微鏡に装着されている。 図2は、顕微鏡ステージ上に載置されたフローチャンバーアッセイ、顕微鏡およびマイクロスライドを示す。
- 滅菌蒸留水10mlとルアーロックで50mlのガラスシリンジにあらかじめ、シリンジ口25センチメートルシリコーンチューブの長さを取り付ける。シリンジポンプに挿入します。に係るシリンジポンプの取出し速度を変化させる0.05 Paで(0.5ダイン/ cm 2、 図3)のせん断応力を維持するために、マイクロスライドの製造元の説明書。
- 、2 5ミリリットルの注射器を取るプランジャーを破棄して、シリコンチューブを用いた電子ソレノイドバルブの2の流入ポートに樽を添付します。
- アウトフローバルブにシリコンチューブ12センチ取り付けます。弁は、無細胞洗浄緩衝液(内皮media/0.1の%(v / v)のBSA)およびリンパ球懸濁液の間の交替を可能にする。
- 両方のシリンジバレル内の洗浄緩衝液を挿入し、バッファ一バレルからバルブを通って流出するシリコーンチューブに流入されたことを確認することによって、電子ソレノイドバルブをフラッシュする。
- 他のバレルへの代替、バッファが流れると、すべての気泡がシステムから削除されていることであることを確認するために、バルブスイッチを使用します。樽の1から洗浄バッファーを削除し、リンパ球のサスペンション図4aと交換してください。
- シリコンtubinを接続マイクロスライドのアダプタを介して選択したマイクロスライドチャネルの1ポートにシリンジポンプからのG。そして、マイクロスライドのアダプタを介して反対側のポートに流出弁からシリコンチューブを接続してください。シリコンチューブやアダプタは気泡がシステム( 図4b)を入力することを防ぐために、接続前に、洗浄緩衝液で満たされていることを確認します。
- フローシステムに接続されると、顕微鏡のステージ上のマイクロスライドを配置し、動きを防ぐために、クリップやテープで取り付けます。適切な位相設定と一緒に10倍の対物レンズを顕微鏡を設定します。内皮単層を接眼レンズを使用して可視化し、焦点が合っていることを確認してください。確保画像は、画像をモニタに中継し、記録することができる顕微鏡に取り付けられたカメラを介して撮像することができる。
7。分析のためのフローアッセイ技術と接着の記録
- withdrawaを開始することによって2分間洗浄緩衝液で内皮層を潅流破片または未結合のブロッキング抗体を除去し、次いで0.05 Paの一定の壁せん断応力における白血球溶液を5分間ボーラスを可能にするためのバルブを切り換えるシリンジポンプlの
- 白血球ボーラスの最後の2分の間に、マイクロスライドの長さに沿って10のランダムなフィールドの値を記録。これは内皮単層上のリンパ球の転がり/テザリングのオフライン解析が可能になります。次の移動する前に、約10秒間、各フィールドを記録し、記録が立て続けに二度同じローリング細胞を記録避けるために、流れの方向に対して行われていることを確認。
- そのスタート位置にバルブを返すことで、洗浄バッファーの5分のボーラスと白血球ボーラスに従ってください。このボーラスの最後の2分間でマイクロスライドの長さに沿って少なくとも10個の無作為に選択したフィールドを選択することによって、第二の記録段階を実行する。次の移動する前に、約5秒間、各フィールドを記録していることを確認し内皮単層、付着leucocytesは明確な焦点である。これは接着のパターンのオフライン解析が可能になります。
結果
このアッセイは、多段階の流れ接着カスケードを視覚化し、分子阻害剤を用いたものに対照実験の結果を比較することによって根本的な分子機構を解明する能力を有する。様々な血管床は、特定の内皮細胞を組み込み、せん断応力条件を変更することによってで要約することができます。
接着カスケードの各ステップは、プロトコルにおいて概説記録方法に従うことによりオフラインで分析することができる。接着カスケードの第一段階は、総接着細胞のパーセンテージとして表すことができる白血球のローリングである。オフライン解析は、接着細胞の数は、白血球ボーラス中に記録された各分野で列挙することができます。画像の再生がしっかりと付着性と内皮を通過するローリング運動を受けているものである細胞の比較を可能にする。ローリング運動は、この技術を用いて可視化することができ、各フィールドは、少なくとも10秒間記録されている。ローリング細胞は、細胞を流れると比べて内皮表面上のそれらの還元速度で識別されます。この動作は、剥離することなく、少なくとも5秒間立証されなければならない。肝類洞内の接着カスケードは、低剪断環境下で行われ、 インビボ研究だけ短いテザリングステップで最小の圧延を確認した。我々は、フローアッセイは、接着性白血球の10%未満が持続的にこれらのアッセイにおいて過剰HSECを刺激し、ロールすることを実証することにより、肝正弦波の環境を反映していることを確認した。
接着カスケードの次のステップは、強固な接着である。総付着を洗浄緩衝液のボーラス(工程7.3)の間に、記録の第二段階から計算することができる。オフライン分析は、しっかりと接着細胞の総数は、各フィールド( 図5)で計数することができる。しっかりと接着細胞は、静止または低速クロールの動作とshapechangedある細胞として定義されています。視野当たりの細胞の平均数を計算することができる。この図は、その後の程度を表現するために、リンパ球(典型的には1×10 6細胞/ ml)の濃度および流量を(格子線または同等物を使用して決定)、視野の全表面積に関連して、使用することができる付着細胞/ mmのリンパ球の接着を灌流2月 10 日6細胞。
密着性のパターンを研究することは、形状変更、クロールおよび経内皮移動を含む接着カスケードの最後の2段階の分析を含む。 HSEC単層の上面に付着白血球は、位相の明るい単分子層を介して移動しているものながら、位相暗い( 図6)が表示され表示されます。次に、細胞を、「静的」な接着(nonmigrated /ラウンド)を示すと分類「形状変更」形態または「移行」と、個々の区分は、その後のパーセンテージとして表すことができます総接着人口。

図1。フローチャンバー内で一次ヒト肝類洞内皮細胞の単層。 A)の前流接着アッセイの開始に内皮細胞の単層を含有する培地で満たした。コンフルエント内皮単層のB)位相コントラスト画像マイクロスライドは、内皮細胞は、マイクロスライドに播種されるべきで、これはであるべきであるヒト肝内皮細胞について(プレコートされているラット尾コラーゲンタイプ1)、それは内皮細胞が培養し、コンフルエントに健康であることが不可欠です。 拡大画像を表示するには、ここをクリックしてください 。

図2。検定チャンバを流れる。フローアッセイ室セットアップはここで分かるように、倒立顕微鏡に装着されている透明なチャンバからなる。ヒータは、チャンバ内に配置され、サーモスタットで37℃の温度を維持するように制御されるべきである外側に配置されているシリンジポンプに室内のマイクロスライドからシリコンチューブを接続するために利用可能なポートがあるはずです。マイクロスライドを顕微鏡ステージ上に直接配置されている。 拡大画像を表示するには、ここをクリックしてください 。

図3。シリンジポンプ 。シリンジポンプが接続されフローチャンバにシリコンチューブを介して編。ポンプはアッセイに必要とされる所望のせん断応力に応じて特定の引き出し速度に設定されています。 拡大画像を表示するには、ここをクリックしてください 。

図4。室を流れるようにバルブを接続する。A)電子ソレノイドバルブは、バルブがフラッシュされ、2つのバレルが設定されると、バルブから、事実上のデッドスペースを用いて細胞またはメディアのいずれかを含む2シリンジバレル。B)のシリコンチューブを切り替えることができますフローチャンバーに接続されている。これは、フローチャンバーのポートにシリコンチューブにアダプターを接続する際に液/液界面が存在することが重要です。 拡大画像を表示するにはここをクリックしてください。

図5。洗浄緩衝液ボーラス工程(プロトコールで概説した)、10個のランダムフィールドの最小値が記録されるべき最後の2分中の総白血球付着の測定 。これらは、オフラインで分析することができ、しっかりと付着細胞の総数は、それぞれのフィールドで計数することができる。白血球の全体付着は、制御チャンバおよびブロッキング抗体で前処理し、それらの間で比較することができ、ここでは対照スライドおよび細胞内接着分子-1(ICAM-1)抗体をブロッキングで前処理したスライドからの代表的なフィールドを示す。矢印はrepresentaで、付着性の白血球を強調するために追加されました対照スライドからTIVEフィールド識別さ25白血球の中の選択肢の一つであり、ICAM-1ブロックスライドで識別された13の白血球の合計があります。スケールバー=100μmとは。 拡大画像を表示するには、ここをクリックしてください 。
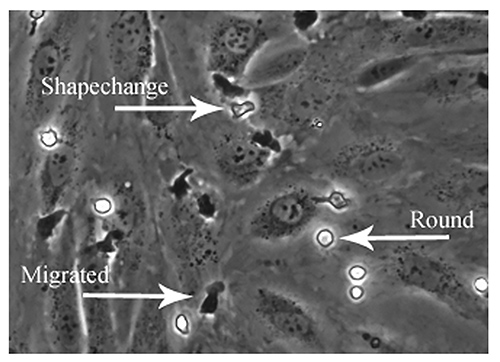
図6。記録されたフィールドの位相差顕微鏡による内皮単層上の白血球接着のパターンを分析する。オフライン分析はまた、白血球接着の方向および速度を研究するために使用することができる。接着カスケードの具体的なステップは、可視化し、位相コントラスト撮影を用いて定量することができる。相明るくしっかりと接着しているが、活性化されていない細胞のラウンド 'の接着と呼ぶことができる、活性化する細胞Dと位相明るい」形状を変更」と呼ぶことができると位相暗い細胞は内皮移動を経験したし、「移行」と呼ぶことができる細胞である。画像は、接着の各パターンの例を示しています。 拡大画像を表示するには、ここをクリックしてください 。
ディスカッション
首尾フローアッセイを実施するための最も重要なステップは、内皮細胞の健康でコンフルエント単層が前に流れ接着アッセイする準備ができていることを保証することである。初代内皮細胞は、培養が困難と培養方法の変化に敏感であることができる。それは、1)フローチャンバーが適切にかつ均一に単層の内皮細胞で被覆されることが重要である。HSECために、我々は、ラット尾部コラーゲンタイプIを使用するが、これは他の内皮集団について異なる場合があり、2)、培養培地は、細胞のタイプに適したHSEC私たちは、プロトコルのセクションで私達の完全培地を記載している。他の重要なステップは、せん断応力の生理学的レベルを反映するために適切な速度でシリンジポンプを設定することを含む。
フローアッセイ中には、内皮細胞単層に損傷を与えたり、内皮表面から免疫細胞を除去することができる流れ回路内の気泡を防止する必要がある。これは、英語を防止することができるすべてのシリコンチューブとアダプターは、すべての気泡が除去されることを、接続前に、洗浄緩衝液で灌流し、メディアは使用前に温めておいていることをしていることをジューリング。マイクロスライド上のポートにアダプタを接続する場合、接続時の液/液界面が存在することが非常に重要である任意の空気がある場合、これは、シリンジ離脱中の内皮単層を破壊するシステム内の空隙を形成するステップ。シリンジバレル内の白血球溶液は、細胞がこのようにして、実験を通して一定の細胞密度を維持し、沈降しないことを保証するために定期的な攪拌を必要とする。
記録工程の間には、内皮層の画像が適切に焦点を合わせ、正確なオフライン分析を可能にするためにクリアされていることを確認することが重要であり、それはフローアッセイ(ポスト白血球ボーラス)の第二ステップの間に十分な時間を、洗浄緩衝液中に残っている記録前相は、次のことを確認するために再開されるすべての非付着白血球が削除されます。同様に、狭い毛細血管内の流れパターンを妨害し得る細胞の損失を防止し、また位相差顕微鏡下でより大きな付着性の白血球から区別するのは難しいことができ、適切な濃度の単層の内皮細胞を使用することが必須である。我々はヒト肝類洞内皮細胞に最適な播種密度を記載しているが、これは別の内皮人口や種間で異なる場合があります。
著しい進歩が生体顕微鏡を用いて動物モデルにおける白血球動員を研究してなされたものである。流量接着アッセイ法の主な利点は、白血球動員が、初代ヒト内皮細胞を用いて二成分系で研究することができることである。さらに、これらの相互作用は、ずり応力の生理学的に適切なレベルの下で研究することができる。 differencがあるかもしれないとして、それは人間のセルラーシステムとの動物で生体内の研究の調査結果を確認することは重要である種間の内皮性質のES。フローアッセイの制限の1つは、白血球の動員は、内皮単層の単細胞環境において検討されていることである。白血球が内皮を通過付着し転生したらまた彼らは孤立し、下流の処理が施されるのに十分な数で存在していなくてもよい。
流量接着アッセイが習得された後、これらの制限にもかかわらず、白血球接着カスケードのさらなる分析を実行するために開発され、多細胞環境を再現するように構成することができる。単一フィールドおよびトラッキングソフトウェアの使用の延長記録が白血球のクロールの動作を分析するために使用することができる。さらにフローアッセイの完了時にマイクロスライドをより詳細に接着および遊走を研究するためにレーザー走査共焦点顕微鏡法および免疫蛍光標識を用いて調べることができる。さらに、我々は以前に開発してきた流れる白血球が肝細胞の存在によって調整肝内皮と相互作用することができるin vitroモデルを編このアッセイはまた、白血球の亜集団を研究するために開発することができる:私達のグループは、調節性T細胞、B細胞、および肝臓浸潤白血球などのサブセットを使用して研究を行った。
これらの研究は、フロー接着アッセイは、人間システムにおける一般的および臓器特異白血球動員を研究する強力なツールであることの証拠である。
開示事項
著者らは、競合する経済的利益を宣言していない
謝辞
SSはウェルカムトラストプログラムグラントウェルカムトラスト中間臨床フェローシップ、CWによって資金を供給される。
資料
| Name | Company | Catalog Number | Comments |
| Six channel microslide VI 0.4 flow chamber | Ibidi | 80601 | Other channel size and precoated slides are available depending on assay requirements. |
| Flow adaptors microslide VI 0.4 | Ibidi | 80646 | |
| Flow assay chamber | Solent Scientific | 33-3322 | These chambers are custom made by the company dpending on the model of microscope and accessories. |
| Inverted Microscope IX2 | Olympus, UK | Model IX50 | |
| Harvard Syringe Pump | Harvard Apparatus, UK | 702101 | |
| Electronic solenoid valve | Lee Products Limited, UK | Part Number LFYA1226032H | |
| Silicon Tubing large | Fisher Scientific | FB50855 | 2 mm inner diameter, 4 mm outer diameter |
| Silicone Tubing-small | Fisher Scientific | FB50853 | 1 mm inner diameter, 3 mm outer diameter |
| Harvard Glass Syringe | Harvard Apparatus, UK | 55-0962 | |
| Cell separation medium/Lympholyte | VH Bio | CL-5020 | |
| Rat Tail Collagen | Sigma Aldrich | C3867-1VL |
参考文献
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat. Rev. Immunol. 7, 678-689 (2007).
- Wong, J., et al. A minimal role for selectins in the recruitment of leukocytes into the inflamed liver microvasculature. Clin. Invest. , 2782-2790 (1997).
- Braet, F., Wisse, E. Structural and functional aspects of liver sinusoidal endothelial cell fenestrae: a review. Compar. Hepatol. 1, 1 (2002).
- Lawrence, M. B., Springer, T. A. Leukocytes roll on a selectin at physiologic flow rates: distinction from and prerequisite for adhesion through integrins. Cell. 65, 859-873 (1991).
- Finger, E. B., et al. Adhesion through L-selectin requires a threshold hydrodynamic shear. Nature. 379, 266-269 (1996).
- Lawrence, M. B., Kansas, G. S., Kunkel, E. J., Ley, K. Threshold levels of fluid shear promote leukocyte adhesion through selectins (CD62L,P,E). J. Cell biol. 136, 717-727 (1997).
- Cinamon, G., Shinder, V., Alon, R. Shear forces promote lymphocyte migration across vascular endothelium bearing apical chemokines. Nat. Immunol. 2, 515-522 (2001).
- Lalor, P. F., et al. Vascular adhesion protein-1 mediates adhesion and transmigration of lymphocytes on human hepatic endothelial cells. J. Immunol. 169, 983-992 (2002).
- Aspinall, A. I., et al. CX(3)CR1 and vascular adhesion protein-1-dependent recruitment of CD16(+) monocytes across human liver sinusoidal endothelium. Hepatology. 51, 2030-2039 (2010).
- Curbishley, S. M., Eksteen, B., Gladue, R. P., Lalor, P., Adams, D. H. CXCR 3 activation promotes lymphocyte transendothelial migration across human hepatic endothelium under fluid flow. Am. J. Pathol. 167, 887-899 (2005).
- Oo, Y. H., et al. Distinct roles for CCR4 and CXCR3 in the recruitment and positioning of regulatory T cells in the inflamed human liver. J. Immunol. 184, 2886-2898 (2010).
- Weston, C. J., Shepherd, E. L., Adams, D. H. Cellular localization and trafficking of vascular adhesion protein-1 as revealed by an N-terminal GFP fusion protein. J. Neural Transm. , (2013).
- Shetty, S., et al. Common lymphatic endothelial and vascular endothelial receptor-1 mediates the transmigration of regulatory T cells across human hepatic sinusoidal endothelium. J. Immunol. 186, 4147-4155 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved