Method Article
バイオベースの産業の原料としてたばこ木とポプラの評価のための転写産物および代謝物プロファイリング
Erratum Notice
要約
植物バイオマスは、燃料、飼料、食品、および様々な材料を含む複数の製品のための再生可能な資源を提供しています。本論文では、タバコの木( ニコチアナアラカシ )とバイオリファイナリーのパイプラインのためのポプラなどの適切な供給源の性質を調べる。
要約
食品、飼料、エネルギーと水の世界需要は、将来の世代のために、特別な課題を提起する。これは、再生可能な資源の探査のための堅牢なプラットフォームは、これらの課題を克服するために必要であることは明らかである。多国籍の枠組みMultiBioPro内で、我々は、植物バイオマスの利用を最大化するためにバイオリファイナリーのパイプラインを開発している。具体的には、我々は、糖化、イソプレノイド、長鎖炭化水素の内容、繊維品質、及びスベリンおよびリグニンの内容を改善するための標的作物種とし てポプラおよびタバコツリー( ニコチアナ·グラウカ ) を使用する。これらの出力を得るために使用される方法は、GC-MS、LC-MSおよびRNAシークエンシング·プラットフォームを含む。代謝産物は、当該パイプラインこれらのタイプのデータを生成するためのツールを確立するだけでなく、それだけ十分に特徴付け代謝産物の限界を用いることができる有する。深いシーケンシングは、私たちは、すべてのタバコの木の葉の発育段階の間に存在する転写産物が、Hを含めることができますタバコタバコのシーケンスに戻ってマップされるように。これらのセットアップでは、我々は、基礎となるプロセスの基本的な理解をして成果を活用するために、産業の枠組みを確立することを目指しています。より長期的な視点では、我々はここで生成されたデータは、原料としてポプラ、タバコの木を使用して、持続可能なバイオリファイナリープロセスのための手段を提供すると信じています。サンプル中の代謝物の基礎レベルとデートするために分析され、利用されたプロトコルは、この資料で提供されています。
概要
人口と経済成長は食料、水、燃料需要の増加を引き起こした。これらの電源の多くは、生産処理され、石油などの化石有限ベースの手段を用いて輸送される。それがこのような行為は、持続可能ではなく、代替資源の開発は、そのため非常に重要1となることは明らかである。多くの再生可能な資源は、現在、風、水の動き、太陽光、地熱など、悪用されて、程度の差は、であり、ベースのエネルギー源を振る。別の持続的かつ大幅に未開発資源は、植物からのバイオマスである。このリソースには、燃料2に太陽得られるエネルギーを変換するために、非常に費用効率的な方法を提供しています。別にバイオ系燃料を提供するから、植物バイオマスは、プラスチック、洗剤、貴重な化学物質を含む、代替製品のためのユニークな機会を提供しています。
主に糖ベースのポリマーで構成されて植物細胞壁、MAK植物のバイオマスの主要な大部分をESと多くの努力は、現在、バイオエタノールへの効率的な変換に投資されています。残りのバイオマスは、その後、バイオガスや石油関連製品3に加工すればよい。セルロース系バイオマスを大量に生成草や木などの多年生植物種、、の多くは、一般的に温帯で最高の成長。しかし、土地面積の約20%が半乾燥であり、また従って干ばつ4の傾向がある。明らかに、それはまた、効果的にエネルギーと物質の持続可能な生産に貢献できる植物とこれらの乾燥地を育成することは興味深いだろう。これらの植物は、最適な水利用効率および乾燥耐性を有するように、タバコツリー( ニコチアナ·グラウカ )およびリュウゼツラン属からの種を含むであろう必要がある。
MultiBioProコンソーシアムは、2つの重要なCRを使用して、統合バイオリファイナリーのパイプラインを実装することを目的とOP種、ポプラ、タバコの木。ポプラは、それが急速に成長しているように、有望なバイオ燃料作物として浮上して簡単にクローン増殖および気候や土壌条件の広い範囲に高度に適応している。また、木材、繊維、燃料、木材、その他の林産物5の広い範囲を提供します。タバコの木も、バイオ燃料やバイオリファイナリーの目的に適した植物として浮上している。それは、典型的にはバイオマスのかなりの量を生成する、非構造性炭水化物6を大量に含み、またバイオディーゼルに適している(長鎖C 29-C 31の飽和炭化水素およびトリテルペノイドを含む)は、容易に抽出可能な非食料油を大量に蓄積する珍しい能力を有する生産。タバコの木は、、また、遺伝的改良を受けやすい高い発芽能力を持っており、食糧生産に使用されていない半乾燥土壌で喜んで成長する。従って、ポプラ、タバコツリーの両方がmultipための固有の可能性を有すると思われるすなわち統合的なバイオベース産業用の新しい価値の高い化学原料として、作物をurpose。本稿では、どのように、タバコの木の預金長鎖炭化水素を識別するためのアプローチの多様なセットに焦点を当てています。
タバコの葉上の長鎖飽和炭化水素の産生と分泌に関与する基礎となる分子機構を同定する試みにおいて、我々は、現代の「オミクス」ベースの技術を適用する。これは発達葉シリーズ(10段)のRNA配列を含んでおり、マルチプラットフォーム代謝物プロファイリングは、使用して、LC-およびGC-MSに(極性および非極性代謝物およびリピドミクスのため)に近づく。これらのデータは、遺伝子発現と相関し、又は先行する、上記で示した分子の生合成の開始のためにマイニングするために使用される。これらの努力から有望現れる遺伝子および経路は、モデル種のシロイヌナズナの機能テストのために使用され、最終的にはTOBにおけるバイオテクノロジー、エンジニアリングのための影響を受けやすい可能性がACCOツリー。
プロトコル
1。植物材料
M2は、プロの成長培地を含む直径30cmの鉢にタバコグラウカの植物を育てる。 日中の20〜25℃の温度と15℃の夜間温度が、温室で植物を育てる補助光政権として16時間明及び8時間の暗闇のサイクルを使用してください。
2。サンプル調製
- 一次代謝産物の場合:
- 収穫植物材料(葉およびN.アラカシの茎)、すぐに材料を凍結する。
- 三日間凍結乾燥して凍結した植物材料を凍結乾燥する。
- 金属ボールミキサーミルで凍結乾燥試料を挽く。
- の2ml遠心チューブまたはガラスバイアルにアリコート微粒子接地乾燥材料。
- 二次代謝産物の場合:
- 収穫植物組織、凍結材料すぐに。
- mで凍結した植物組織を挽くステンレス鋼球または乳鉢と乳棒によるixerミル。
- 2ミリリットルの遠心分離管(約20mgの湿重量)に分量細挽き組織。
GC-MSによる一次代謝産物のための代謝物プロファイリングのため3。抽出プロトコール
- 2ミリリットル中の分量のグランドドライ植物材料(葉と茎材料の20mgを10 mg)を、スクリューキャップ、丸底チューブ。
- 10秒間100%メタノールと渦の1400を添加する。
- 10秒のための内部定量標準と渦としてリビトール60μlの(H 2 O中0.2 mg / mlのストック)を追加します。
- 1ステンレス鋼(またはジルコニア)ボールを追加し、25 Hzで2分間ミキサーミルを有する材料を均質化する。
- 遠心分離11,000×gで10分間混ぜる。
- ガラスバイアルに上清を移します。
- クロロホルム750μLを加える。
- H 2 Oを1,500μLを加え、10秒間ミックスをボルテックスする。
- から150μLを転送新しい1.5ml遠心管に上相(極性相)。
- スピードバックを用いたドライサンプル。これは、残留液体が存在しなくなるまでサンプルが、3〜24時間乾燥するまで減少することが肝要である。
- メトキシアミン塩酸塩(ピリジン中20 mg / ml)を40μlのを追加します。
- 37℃で2時間水平ヒートブロックシェーカーでミックスを振る
- 70μlのN-メチル-Nを追加- (トリメチルシリル) -トリフルオロMSTFAミックス。
- 37℃で2時間のミックスを振る
- 11,000×gで約1分の短い遠心分離することによりカバーの滴をスピンダウン。
- GC-MS分析に適したガラスバイアルに液体を移す。
LC-MSによる二次代謝物代謝物プロファイリングのため4。抽出
- 凍土サンプルに500μLのメタノールを追加します。
- 70℃(千秒-1)で15分間サーモミキサーで振る。
- 遠心分離機のサンプル(5マイルN 20,000×g)で、1.5 ml遠心管に移し、液相。
- 遠心エバポレーター(スピードバック)で液相を凍結乾燥。
- 乾燥ペレットに100μlのシクロヘキサン、100μlのミリQ水を追加します。
- 室温(使用ボルテックス)で5分間サンプルを振盪する。
- 遠心分離機のサンプル(5分20,000 XG)。
- LC-MS分析のための円錐底で、LC-MSの注射用バイアルに水相(下相)を80μlを移す。
5。データ解析
- Xcalibur、MarkerLynx、Metalign 7またはXCMS 8を設定し、処理すべきデータ分析]を選択します。
- 表1中の化合物のクラスに応じて、ご関心の検出されたピークのテーブルを準備します。
- 標準化合物の共溶出によってピークを同定。
- 続いてのMSn分析、構造解析アルゴリズム9,10、文献秒を使用して検出されたピークに注釈を付けるurveyおよび代謝物データベース検索11,12。
6。炭化水素の抽出13
- 収穫されたばかりのNを沈める2〜20分間、HPLC等級); グラウカ葉(メタノール、エタノール、クロロホルム、ヘキサン、石油エーテル(沸点40〜60℃又は60〜80℃)溶媒(〜200mg)の(5 mlである。
- 葉を削除し、回転蒸発により完全に溶媒を蒸発乾燥させます。
- ヘキサンに再懸濁サンプル(1ミリリットル、HPLCグレード)。
- ガスクロマトグラフィーおよび5973MSDにハイフン付きを使用して、GC-MS分析を実行します。以下のように動作条件はである必要があります。キャリアガスは、0.9ミリリットル分の流量でヘリウム-1 / 11ψ。 280℃でスプリットレスインジェクタとサンプル(1μL)を注入320℃まで4℃/分でランピングの前に5分間、70℃でガスクロマトグラフィーオーブンを保持67.5分の合計時間を作り、さらに10分間の最終温度を保持する。 280℃でのMSとPとのインターフェースを設定するerform 70 eVのEI +を使用して、フルスキャンモードでのMSと10〜800 Dからスキャンされた
- 最初に自動化されたMSのデコンボリューションおよび識別システムによってクロマトグラム成分を処理し、NIST 98 MSライブラリーを用いて同定されたもの。
- 既知の本格的な標準に保持時間および古典断片化パターンを比較することによって、長鎖飽和アルカン炭化水素(hexacosenol、ノナコサン、トリアコンタン、octacosenol、nonacosonal、ヘントリアコン、ドトリアコタンおよびトリトリアコタン)の識別を確認してください。
- 定量的に決定する真正標準から構成された用量応答曲線(0.07から2.5mg)と統合されたピーク面積を比較することにより炭化水素が挙げられる。
- Excelソフトウェアを使用することを意味し、平均の標準誤差(SEM)を計算します。
イソプレノイド14の7。分析
- セクション2で説明したように均質化を実行します。遠心管に均質化された凍結乾燥した粉末10mgを計量。
- 、粉末上に順次250ミリリットルのメタノールを加えて混ぜ、その後、500ミリリットルのクロロホルム(実験用試薬グレード)を追加し、ボルテックスで混ぜる。
- 20分間暗闇に氷上でサンプルを残す。
- 懸濁液に250ミリリットルのトリス - 塩酸緩衝液(100mM、pH7.5)に、または水(HPLCグレード)を追加し、ボルテックスで混和する。
- 水相から非極性を分離するために5分間12,000 rpmで(13523×g)で混合し遠心分離する。イソプレノイド抽出物を含む無極性クロロホルム相は下部にあります。
- 新しい遠心チューブに位相を転送します。
- 水相に、追加の500ミリリットルのクロロホルムを追加し、ボルテックスし、上記のように遠心分離することによって第二の抽出を行っています。
- クロロホルム抽出物を合わせ、分析まで-20℃で蒸発し、ストアを使用して乾燥するまでのサンプルを持参。
- 材料を再溶解し、乾燥イソプレノイド抽出物を50mlの酢酸エチル(HPLC等級)を添加する。
- C18に3ミリリットルを注入アクイティーUPLC分離モジュールを用いたカラム。顔料を分離するのに使用するグラデーションが含まれている必要があり; :メタノール/ H 2 O(50:50)およびB:アセトニトリル/酢酸エチル(75:25)であり、初期条件は、30%(v / v)でBが70%(v / v)の100に行くであるべきである6分間にわたる%のB。 0.6ml /分の流速を使用する。
- 250〜600 nmのフォトダイオードアレイ(PDA)検出器を連続して溶出液を監視します。
- 共同クロマトグラフィーおよび信頼できる標準、ベータカロチン(プロビタミンA)、フィトエン、リコピン、ルテインとゼアキサンチンの間のスペクトルの比較でコンポーネントを特定します。
- 用量反応曲線から定量化を行う。
- LC-MSを用いた化合物を確認してください。類似のクロマトグラフィー条件を使用しています。検出は、Q-TOF装置でポジティブモードでAPCIイオン化を使用して行われるべきである。
- 1.5時間、50℃で6%のKOHで抽出し、鹸化された25 mgの凍結乾燥させた材料とトコフェロールを決定するための修正を行います。
このプロトコルは、高品質のRNAを得るために、RNeasyキットでトリゾールRNA抽出を兼ね備えています。
- ミキサーミルで金属球2 mlの遠心管中で凍結した植物材料100mgを挽く。
- 1ミリリットルトリゾールを追加します。
- 4℃にて12,000×gで10分間遠心分離する材料を
- 新しい反応チューブに上清を移す。
- 、200μlのクロロホルムを追加するチューブを数回転倒させ、室温で3分間インキュベートする。
- 4℃で12,000×gで15分間のミックスを遠心分離
- 新しい反応チューブに上の水相(約700μl)を転送します。
- エタノールの約2.5容量(100%)を追加し、チューブを数回反転させ、-80℃で30分間インキュベートする
- キットからスピンカラムに沈殿物を含むサンプルを移動します。
- 8,000×gで15秒間カラムを遠心し、Fを破棄による低。
- 8,000 X gで15秒間スピンカラムや遠心に700μlのBuffer RW1を追加します。通る流れを捨てる。
- スピンカラムに500μlのBuffer RPEを加え、8,000 X gで15秒間カラムを遠心。通る流れを捨てる。
- 8,000 X gでスピンカラムと2分間遠心分離機に500μlのBuffer RPEを追加します。
- 新しい1.5 ml反応チューブにスピンカラムを配置し、50μlのRNaseフリー水を追加します。
- RNAを溶出するために8000×gで1分間カラムを遠心。
- メーカーの指示に従ってのAmbionのDNA-フリーキットを使用して残存DNAを除去します。
- RNAの品質を決定する。 RNAは8上記のRNAの完全性番号(RIN)を有するべきである。
- 次世代シーケンシングのためのRNAを送る。
結果
図1のHPLCプロフィールは、Nのイソプレノイド分析の代表的結果を示していますアラカシの葉の抽出物。上記のC40との異なるイソプレノイドは、フォトダイオードアレイ(PDA)検出器を用いて検出した。ピークは、ベータカロチン(プロビタミンA)、フィトエン、リコピン、ルテインとゼアキサンチン、共同クロマトグラフィーおよび信頼できる標準との間のスペクトルの比較に基づいて、注釈を付けた。 図2の2つのMSクロマトグラムN.からの一次代謝産物分析の結果を示すそれぞれグラウカ葉及び茎材料。セリン(矢印で示す)に対応するピークのMSスペクトルはまた、例として挙げられる。 図3は、バイオアナライザは、RNAの品質およびデバイスからの代表的な出力を決定するために使用示す。クロマトグラムの2つの主要なピークは、サンプル中の無傷のRNAを示し、18秒および25 SリボソームRNAに対応する。断片化されたリブの追加のピークosomal RNAは、部分的に又は頻繁に分解されたRNAの場合に現れる。
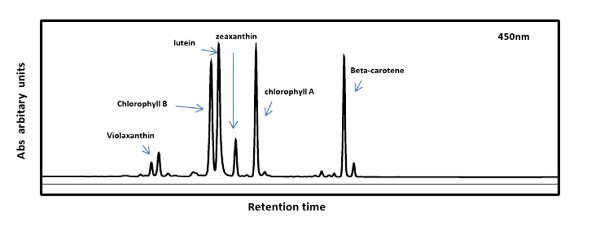
図1。Nから葉の抽出物中に存在イソプレノイドを示すHPLCプロフィールアラカシ。上記C40とほとんどのイソプレノイドは、GC-MS分析に適していない。そこで我々は、フォトダイオードアレイ検出でHPLC分離を使用していました。 450nmで記録された典型的なクロマトグラムを示す。カロテノイド色素はルテインが優勢と光合成組織の典型的なものである。また、高い光ストレス下に置かれない限り、めったに葉組織で発見されていない、ゼアキサンチン存在している。ゼアキサンチンのレベルがこの価値の高い化合物の良い情報源を確認します。 大きなVを表示するには、こちらをクリックしてください。この図のERSION。
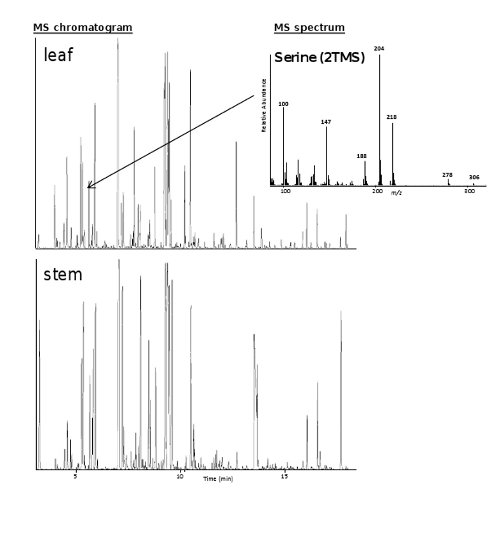
図2。NのMSクロマトグラムとスペクトルグラウカ組織抽出総イオンMS葉のクロマトグラム(TIC)とGC-MSにより測定した抽出物を、ステム(70〜600 メートル/ z)が提示される。 GC-MS分析は15で前述したように行った。検出されたピークは、質量スペクトルタグライブラリを使用して注釈が付けられた。セリン(2TMS)のMSスペクトルは、例として示されている。 MSクロマトグラム:X軸とY軸は保持時間(分)と信号の強度(存在度)を示し、MSスペクトル:X軸とY軸はM / Z比および信号の強度(存在度)を示し、それぞれ。 拡大表示するには、ここをクリックしてください画像。
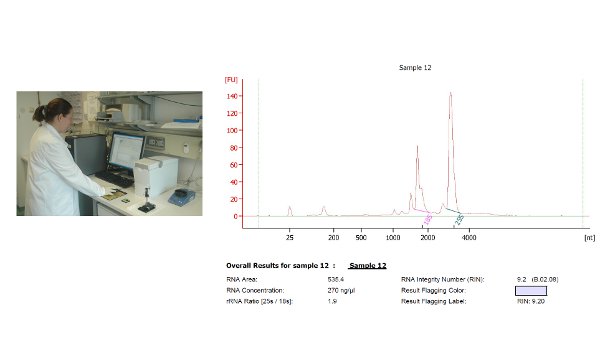
図3。N.のRNA配列のために準備されたRNAのバイオアナライザ測定アラカシの葉材料。我々はTrizol試薬を用いてRNAを抽出し、その後RNeasyミニキット(Qiagen、ヒルデン、ドイツ)から列を用いてRNAを精製したRNAの配列に必要な高純度のRNAを得た。我々は、バイオアナライザー(アジレント、ブロン、ドイツ)を用いてRNAの品質が左側に表示さを決定した。バイオアナライザの出力例は右側に与えられる。サンプルの2つの主要なピークは、18 Sと25 SリボソームRNAを表しています。このサンプルは、ウェル8の要求値を超えている9.2のRNA完全性番号(RIN)を示した。 彼女をクリックしてください拡大画像を表示する電子。
ディスカッション
ここで紹介するプロトコルは、代謝物および転写産物のためにタバコの木の葉を分析するための包括的なフレームワークを提供します。なお、これらの組み合わせの努力は、炭化水素と、この組織に存在価値の高い化合物の合成および押出しの基礎をなす過程に新たな洞察を私たちに提供しなければならないことが想定されている。これらのアプローチは、したがって、私たちに化合物が合成されている方法についてのより良い理解を与える必要があります。ワークのタバコツリーの態様に加えて、それはまた、特に、二次壁構造の木化を標的とするだけでなく、我々は貴重な化合物の抽出のための樹皮を使用できるかどうかを探索するために、ポプラバイオマスを改善することを目的とする。
本論文で提示の方法は、代謝物プロファイリングのための標準化された方法の若干の修正である。これらの方法は、もちろん公知の代謝プロファイルに限定されるものであり、それはいくつかの新しい代謝ピークがwのために得られることが可能であるHICHない化合物が知られていない。私たちは、発達時系列上の代謝物および転写産物の挙動を組み合わせることにより、他の代謝物へのコンテキストでこれらの化合物を置くことを願っています。
ここで紹介する方法のいずれも大幅に一般的に植物原料に使用した方法から変更されていません。興味深い点は、タバコの木の葉主に長鎖炭化水素の生産と修正のための基盤となるフレームワークを理解する方法を組み合わせにある。この情報を得るための重要なステップの一つは、異なるデータ型のその後の組み合わせである。我々は、最初の評価のようなデータは、開発上、これらのデータは、代謝産物の行動対転写物を推測するために使用され、潜在的な経路に特定の代謝産物を割り当てるために、その代謝産物/転写物の挙動に基づいて、異なるクラスタに分割されることを想定。加えて、より精巧なネットワークベースの分析は、次いで、tは想定されているO因果関係を利用する。
ここで紹介する分析的なプロトコルは、フィールド·トライアルやバイオマスの工業利用のための基礎を提供します。これを達成するために、MultiBioProコンソーシアムは、バイオディーゼル、バイオエタノールやその他の付加価値の高い化合物を送達するために目指して、更なるバイオマスを探求する能力を持っている、いくつかの産業界のパートナーが含まれています。バイオマス利用のこれらのタイプは、に基づいて評価される。 (1)生産のバイオ製品の堅牢性と品質をテストする(一般的な業界標準のテストが生成された製品は、良好な市場価値を持っていることを確認するために実施される)、(2)、技術の経済的、社会的、環境的な評価が行われます文献情報源、インタビューやフィールド試験およびパイロットプラントバイオリファイナリーの評価中に生成された素材を使用した。これらの活動は、費用便益とライフサイクル分析、環境関係書類の発生や市場とビジネスサービスが含まれますSS戦略。我々は、このパイプラインは、消費者の最終製品のために、さらにポプラ、タバコ樹木バイオマスに科学と産業の活用を適用し、学界の便利なブレンドになると考えています。
開示事項
これらの結果につながる研究が助成契約番号311804の下で、欧州第七枠組み計画([FP7/2007-2013])から資金提供を受けています。
謝辞
ドミニク·スウィントン(グリーン燃料)、トーマス·ローリー(グリーン燃料)、サム·Buekenhout(Capax)、そしてシルビアDrouven(Capax):MultiBioProまた、プロジェクトに貢献して、次の人々に感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Trizol reagent | Invitrogen | 15596-026 | |
| Chloroform | Merck | 102445 | |
| Ethanol | Merck | 101986 | |
| Rneasy Mini Kit | Qiagen | 74104 | |
| TURBO Dnase | Invitrogen | AM2238 | |
| RNA 6000 Nano Kit | Agilent | G2938-90034 | |
| 2100 Electrophoresis Bioanalyzer | Agilent | G2939AA | |
| 1.5 ml and 2 ml safe-lock tubes | Eppendorf | 0030 120.086, 0030 120.094 | |
| Steel balls | Geyer Berlin GmbH | VA2mm | |
| Mixer mill MM 300 | Retsch | YO-04182-09 | |
| Microcentrifuge | Eppendorf | 5424 |
参考文献
- Clark, J. H., et al. chemistry, biofuels, and biorefinery. Annu Rev Chem Biomol Eng. 3, 183-207 (2012).
- Carroll, A., Somerville, C. Cellulosic biofuels. Annu Rev Plant Biol. 60, 165-182 (1146).
- Vanholme, B., et al. Towards a carbon-negative sustainable bio-economy. Front Plant Sci. 4, (2013).
- . United Nations Environment Programme (UNEP). Global Environment Outlook: Environment for Development. 4, (2007).
- Boerjan, W. Biotechnology and the domestication of forest trees. Curr Opin Biotechnol. 16 (2), 159-166 (2005).
- Curt, M. D., Fernández, J. Production of Nicotiana glauca R.C. Graham aerial biomass in relation to irrigation regime. Biomass. 23 (2), 103-115 (1990).
- De Vos, R. C. H., et al. Untargeted large-scale plant metabolomics using liquid chromatography coupled to mass spectrometry. Nat Protoc. 2 (4), 778-791 (2007).
- Smith, C. A., et al. XCMS: Processing mass spectrometry data for metabolite profiling using Nonlinear peak alignment, matching, and identification. Anal Chem. 78 (3), 779-787 (2006).
- Morreel, K., et al. Mass spectrometry-based fragmentation as an identification tool in lignomics. Anal Chem. 82 (19), 8095-8105 (2010).
- Morreel, K., et al. Mass spectrometry-based sequencing of lignin oligomers. Plant Physiol. 153 (4), 1464-1478 (1104).
- Tohge, T., Fernie, A. R. Web-based resources for mass-spectrometry-based metabolomics: A user's guide. Phytochemistry. 70 (4), 450-456 (2009).
- Tohge, T., Fernie, A. R. Combining genetic diversity, informatics and metabolomics to facilitate annotation of plant gene function. Nat Protoc. 5 (6), 1210-1227 (2010).
- Mortimer, C. L., et al. The identification and rapid extraction of hydrocarbons from Nicotiana glauca: a potential advanced renewable biofuel source. Phytochem Lett. 5 (3), 455-458 (2012).
- Fraser, P. D., et al. Application of high-performance liquid chromatography with photodiode array detection to the metabolic profiling of plant isoprenoids. Plant J. 24 (4), 551-558 (2000).
- Lisec, J., et al. Gas chromatography mass spectrometry-based metabolite profiling in plants. Nat Protoc. 1 (1), 387-396 (2006).
Erratum
Formal Correction: Erratum: Transcript and Metabolite Profiling for the Evaluation of Tobacco Tree and Poplar as Feedstock for the Bio-based Industry
Posted by JoVE Editors on 6/30/2016. Citeable Link.
A correction was made to: Transcript and Metabolite Profiling for the Evaluation of Tobacco Tree and Poplar as Feedstock for the Bio-based Industry.
There was a spelling error in one of the authors' surname. The author's name was corrected from:
Juan Pedro Navarro
to:
Juan Navarro-Aviñó
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved