Method Article
用RNAscope
要約
頭頸部腫瘍組織において高リスクHPVの存在は、良好な転帰と関連している。 RNAscopeと呼ばれるin situハイブリダイゼーション法における最近開発されたRNAは、FFPE組織切片におけるHPV E6/E7 mRNAの直接可視化を可能にします。
要約
発癌性HPV検出のための「ゴールドスタンダード」は、腫瘍組織における転写的に活性な高リスクHPVのデモンストレーションです。しかしながら、定量的逆転写ポリメラーゼ連鎖反応(qRT-PCR)によってE6/E7 mRNAの検出は、形態学的相関のための重要な腫瘍組織コンテキストを破棄し、日常的な臨床実践において採用することが困難であったRNA抽出を必要とする。 in situハイブリダイゼーション技術、RNAscope我々 の最近開発されたRNA、任意のRNAバイオマーカーのin situ分析の高感度かつ特異可能にする、単一分子感度および単細胞解像度のホルマリン固定パラフィン包埋(FFPE)組織でのRNAの直接可視化を可能にする日常の臨床検体中。 RNAscope HPVアッセイは、遺伝子型特異的プローブのプールを用いてE6/E7 7高リスクHPV遺伝子型のmRNA(HPV16、18、31、33、35、52、および58)を検出するように設計された。それは、優れた感度を示したおよび定量RT-PCRによりE6/E7 mRNAを検出する現在の「ゴールドスタンダード」法に対する特異。 RNAscopeによって決定HPVの状態は、中咽頭癌患者の臨床転帰の強力な予後である。
概要
高リスクヒトパピローマウイルス(HR-HPV)感染アカウントのすべての癌の約5%のための世界的な1。 HPV関連口腔咽頭癌の発生率は、特に男性の間で、過去数十年の間に増加している。 HPV陽性中咽頭扁平上皮癌(OPSCC)おそらく今後20年間2年に米国のすべての頭頸部癌の大部分を構成する。 HPVに起因する口腔咽頭扁平上皮がんは、良好な生存と関連し、腫瘍のHPVの状態は、生存のための3強力かつ独立した予後因子であり、されています。
ウイルス性癌遺伝子E6およびE7の転写活性化のための証拠は、臨床的に関連するHPVの4の存在のためのゴールドスタンダードとみなされている。しかしながら、RT-PCR法による新鮮な腫瘍組織からのE6/E7のmRNAの検出は、日常的な臨床実践において実用的ではなく、研究室に限定されている。最近では、HAVeは、ホルマリン固定パラフィン包埋組織標本の単一のRNA分子感度(FFPE)5-10個々の細胞におけるマルチプレックス検出を可能にRNAscopeと呼ばれる新規RNA ISH技術を開発した。我々は、単一分子検出5の証拠の3行を提供した。まず、RNAscopeプローブの設計およびシグナル増幅システムは、HeLaおよびSK-BR-3細胞株における単一コピーHER2ゲノムDNA標的の検出を可能にした。 HER2ゲノムDNAシグナルと比較して第二の、HeLa細胞におけるHER2 mRNAシグナルドットの蛍光強度の分布は、ドット毎に1つの分子と一致した。第三に、細胞当たりのHER2 mRNAシグナルドットの数は、さらに、単一分子検出をサポートする、密接に溶液ベースの定量アッセイによって推定されたHER2 mRNAのコピー数と一致した。さらに、明視野顕微鏡、蛍光顕微鏡またはヘマトキシリンとDAPIで核の対比はWH、個々の核の可視化を可能にする今度はICHは、単一セル単位10上にRNA標的の検出及び定量を可能にする。日常の臨床検体で、その場での遺伝子発現を分析する能力は、特にFFPE組織切片をベースとするアッセイ10,11、RNAscope診断病理学のための有望なプラットフォームになります。我々は、遺伝子型特異的プローブのプールを使用して7高リスクHPV遺伝子型(HPV16、18、31、33、35、52、および58)のE6/E7のmRNAを検出するためのRNAscopeベースのHPVアッセイを開発した。 OPSCC我々の最近の研究は、RNAscope HPVアッセイはFFPE組織12-17にHPVの状態を決定するのに高感度かつ特異的であり、また、OPSCC 12,16の予後に通知することが示されている。
RNAscope技術の原理は、以前5に記載されている。ここでは、完全なRNAscopeアッセイプロトコルを記述し、FFPE腫瘍組織切片におけるHR-HPVの検出におけるその使用を実証する。
プロトコル
1。サンプル、機器、試薬の調製
- 室温(25℃)で16から32時間、新鮮な10%中性緩衝ホルマリンで固定し、パラフィンに埋め込んで、厚さが3〜4程度のブロックに組織標本をカット。 FFPEブロックから5±1μmの厚さのセクションにFFPEをカットし、スライドや空気乾燥に関するセクションをマウントします。注:スライドは最大3ヶ月間乾燥下、室温で保存することができる。マウント組織スライドの前RNAscopeアッセイを1時間にわたって60℃で乾燥した状態でベーキング処理をお願いします。
- 40℃へのハイブリダイゼーションオーブンをもたらす湿度制御トレイに加湿紙を置きます。それを完全に濡らすために加湿紙に50ミリリットルのdH 2 Oを追加します。使用前に少なくとも30分間予熱し、オーブンに覆われたトレイを挿入します。
- のdH 2 Oに10倍の前処理溶液を希釈して700ミリリットル1X前処理2溶液(10 NL、pHが6クエン酸緩衝液)を作る沸騰し1X前処理2ソリューションを加熱し、舞過沸騰防止しながら100-104℃の間の温度ntain。
- のdH 2 Oに予め温め50X洗浄バッファーを希釈することにより、3 L 1X洗浄バッファー(0.1×SSC)を作る
- ヒュームフードの下で脱パラフィンキシレンの2×200ミリリットル、100%エタノールで2回200ミリリットルを用意します。
- ヒュームフードの下でポスト染色に50%ヘマトキシリン染色液とブルーイング試薬(0.01%アンモニア水)を準備します。
- ヒュームフードの下に脱水キシレン200ミリリットル、200ミリリットルの70%、および2×200ミリリットル100%エタノールを準備します。
- 10分間40℃で予熱し標的プローブおよびRTU Amp1と、Amp2の、増幅器(Error Amp3)、AMP4、アンプ5 - ブラウン、およびAMP6ブラウンを含め、室温にRTU検出キットの試薬をもたらす、DAB発色ブラウン-Aとブラウン-Bを除く。
2。 RNAscopeアッセイ
脱パラフィンおよび脱水
焼成後、頻繁に攪拌しながら、2×5分間、キシレン中で組織切片を脱パラフィンし、脱水頻繁に撹拌しながら、2×3分間の100%EtOH中。空気が5分間乾燥し、疎水性バリアペンで組織切片の周囲に疎水性のバリアを描く。
前処理
- のdH 2 Oにすすぎ、内因性ペルオキシダーゼ活性のクエンチングをRTで10分間前処理1で組織切片をインキュベート
- をdH 2 Oで二回すすぎ、RNA検索のための15分間沸騰温度に維持前処理2で組織切片をインキュベート
- HybEZオーブン内タンパク質消化のために40°Cで30分間前処理3で組織切片をインキュベートし、をdH 2 Oで二回すすぎ
ターゲットプローブハイブリダイゼーション
標的プローブのHPV-HR 7プールが含まれます:HPV16、18、31、33、35、52、および58を。 3隣接組織切片上に別途のHPVプローブ、ユビキチンC(UBC)と細菌の遺伝子のdapBプローブを追加します。 2オーブンで40℃でハイブリダイズHRは、次いで室温で2×2分間1X洗浄緩衝液中ですすいでください。
シグナル増幅
- 15分間、40°C、40°Cで30分間増幅器(Error Amp3)(アンプ)、及びAMP4(標識プローブ)で15分間、40°C、Amp2の (バックグラウンド低減)で30分間Amp1と (前置増幅器)を用いて組織切片をインキュベートHybEZオーブンで40℃で。各ハイブリダイゼーション工程の後、RTで2×2分間、1×洗浄緩衝液でリンスする。
- RTで15分間、30分間、AMP5およびAMP6で組織切片をインキュベートする。各インキュベーション工程の後、RTで2×2分間、1×洗浄緩衝液でリンスする。
信号検出
RTで10分間ブラウン-Aとブラウン-Bの等量混合DAB 1:1混合物で組織切片をインキュベートし、をdH 2 Oで二回すすぎ
対比染色
室温で2分間50%ヘマトキシリン溶液で染色組織切片は、D.H. 2 Oですすいでください。ディップは5倍ののdH 2 O中0.01%のアンモニアにスライドとDH 2 O中5ディップで追跡スライド取り付け
2分毎に70%、100%、および100%EtOH中で組織切片を脱水し、キシレンで5分間、キシレン系封入剤でマウントする。
結果
RNAscope HPVアッセイワークフロー
RNAscopeアッセイは、IHC( 図1)に類似する高度に合理化されたワークフローを有する。前処理、ハイブリダイゼーション、シグナル増幅、検出:これは、4つの主要なステップで構成されています。これは、高忠実度の信号増幅5を確実にユニークプローブ設計戦略を採用している。 RNAscope HPVアッセイにおいて、七HR-HPVプローブセットは、すべての西洋ワサビペルオキシダーゼ(HRP)に連結された同一の信号増幅系によって認識され、プールされる。 HRPにより形成された褐色の析出物が、標準の明視野顕微鏡によって可視化することができる基質としてDABを用いた発色反応を触媒される特異的なハイブリダイゼーションシグナルが検出される。
HPV検出のための代表的な染色
図2は、頭頸部扁平上皮癌の染色されたFFPE切片からの画像例を示す図である。 HPV陽性の場合( 図UREの2A)、HR-HPVプローブは、腫瘍細胞に特異的に強い点状の信号を検出した。 UBCプローブは、腫瘍細胞および間質細胞( 図2B)の両方で多数の点状細胞質シグナルを検出した。細菌遺伝子のdapBプローブは、きれいな背景( 図2C)を示した。強い信号がUBCプローブ( 図2E)を用いて検出したのに対し、HPV陰性の場合、HR-HPVプローブとのdapBプローブの両方は、全く信号( 図2Dおよび2F)を検出していない。このアッセイでは、UBCは、バックグラウンド信号のための陰性対照として、組織RNAの品質とのdapBを評価するための陽性対照として役立つ。 HPVの状態を決定するためのスコアリングは、各ケースのすべての3つのスライドを検査することを含む。陰性コントロールスライド(ジピコリン酸)スライド上の染色レベルがカットオフとして使用されます。、HPV陽性が点状細胞質および/またはdabpBスライド上の信号を超えていた核染色の存在によって定義されます。
:FOクラス= "jove_content"
図1。 RNAscopeアッセイのフローチャート。RNAscopeアッセイワークフローのイラスト。 RNAscopeアッセイは、4つの主要なステップ、前処理、標的プローブハイブリダイゼーション、信号増幅や信号の検出が含まれています。全体アッセイ手順は、8時間で完了することができます。 拡大画像を表示するにはここをクリックしてください。
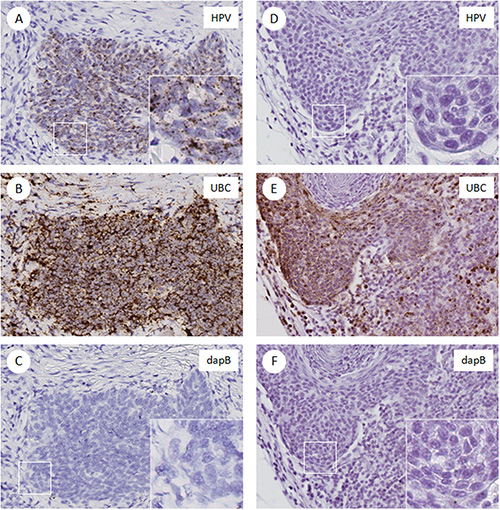
図2。 RNAscope染色スライドの画像例。HR-HPV、UBC(陽性対照)とのdapBためのプローブで染色されたFFPE切片(陰性対照)2患者147名から。 交流 。 HPV陽性の場合。腫瘍細胞において、HR-HPV E6/E7のmRNA発現。挿入図、点状の信号を示す40X倍率。B及びC)は、正のUBC染色(B)及びジピコリン酸(C)に対して陰性を示し、隣接する組織セクション。DF)HPV陰性の場合をD)HPV E6/E7 mRNAについて染色なし、ジピコリン酸ネガティブコントロール(F)E)UBC陽性染色に似ています。 拡大画像を表示するにはここをクリックしてください。
ディスカッション
RNAscope HPVアッセイは、HPV関連頭頸部扁平上皮癌においてその場で E6/E7 mRNAの直接可視化を可能にした。 RNAscopeアッセイは、日常的に固定された腫瘍組織との完全な互換性があり、病理組織学的な相関( 図2)のための組織形態を維持します。 CISH従来の方法に比べてRNAscopeアッセイの重要な利点は、それが特異的に背景雑音( 図2Cおよび2F)を増幅することなくハイブリダイゼーションシグナル( 図2Bおよび2E)を増幅することである。
実際には、RNAscope HPVアッセイ手順は、8時間以内に完了することができ、または好都合に2日間にわたって分割されている。 RNAscope HPVアッセイは参照方法16として定量RT-PCRを用いて、97%の感度および93%の特異性を示し、頭頸部扁平上皮癌におけるHPV 12-16状態を決定するために使用されている。従来のCHRHR-HPVのDNAのためomogenic ISHは非常に特異的であるが、約80〜12%の感度を持っています。携帯代理マーカーのP16のための免疫組織化学(IHC)染色は、優れた感度を示していますが、特にnonoropharyngeal頭頸部癌15における偽陽性の結果15,18を生成することができる。 HPV E6/E7 mRNA検出のための定量RT-PCRの現在の「ゴールドスタンダード」メソッドは、研究室にその使用を制限し、最適な結果を得るために、新鮮な凍結組織が必要であり、技術的に複雑である。また、それは不可能で組織病理HR-HPV E6/E7のmRNA発現を相関させることができるRNA抽出を必要とする。
RNAscopeアッセイの成功のためのいくつかの重要な要因があります。まず、最良の結果を得るために、組織は、ASCO / CAPガイドライン19に従って16から32時間室温で新鮮な10%中性緩衝ホルマリンで固定してください。それは有効なので、二番目、HybEZオーブンを強くお勧めしますプローブハイブリダイゼーションおよびシグナル増幅工程のための温度および湿度の最適制御。第三に、各工程の前に過剰の残留緩衝剤を除去し、それでも、これらのステップのいずれかの間に、乾燥から組織切片を維持することが重要である。
ここで説明する手動RNAscope手順が完全に商業スライド自動染色システム10に自動化されている。これは大幅にアッセイ条件の標準化を促進し、臨床病理検査室での貴重な肉体労働を節約する必要があります。また、専用の画像解析ソフトウェアは、自動的に主観性を排除し、得点に再現性を向上させるために役立つはずデジタルスライド上の細胞と染色シグナルを同定するために10に開発された。
要約すると、RNAscope HPVアッセイは、FFPE組織におけるその場での HR-HPV E6/E7のmRNA転写物の存在を検出する。それは、臨床病理学実験室によく知られているワークフローを持って組織切片において、これらの直接可視化を可能にすることによって保守党。それは、(FFPE)組織サンプルを検査するための理想的なプラットフォームを提供しており、簡単に診断病理学研究室で採用することができる。
開示事項
すべての著者は、アドバンスト·セル診断社の株式でかつ独自の採用されている
謝辞
YLにNIHの助成金(R43/44CA122444)とDOD BRCP助成金(W81XWH-06-1から0682)によって部分的にサポート。
資料
| Name | Company | Catalog Number | Comments |
| SuperFrost Plus slides | Fisher Scientific | 12-550-15 | |
| HybEZ Oven, Tray, and Rack | Advanced Cell Diagnostics | 310011, 310012, 310014 | |
| RNAscope 2.0 FFPE Reagent Kit - Brown | Advanced Cell Diagnostics | 310035 | |
| RNAscope HPV-HR7 Probe for HPV 16, 18, 31, 33, 35, 52, and 58, E6/E7 mRNA | Advanced Cell Diagnostics | 312351 | |
| ImmEdge Hydrophobic Barrier Pen | Vector Laboratory | H-4000 | |
| 100% EtOH | American Master Tech Scientific | ALREAGAL | |
| Xylene | Fisher Scientific | X3P-1GAL | |
| Gill's Hematoxylin I | American Master Tech Scientific | HXGHE1LT | |
| Ammonia hydroxide | Sigma-Aldrich | 320145-500mL | |
| Cover Glass 24 mm x 50 mm | Fisher Scientific | 12-545-F | |
| Hot Plate | Fisher Scientific | 11-300-49SHP | |
| Drying Oven | Capable of holding temperature at 60±1 °C | ||
| Water Bath | Capable of holding temperature at 40±1 °C |
参考文献
- Parkin, D. M. The global health burden of infection-associated cancers in the year 2002. Int. J. Cancer. 118 (12), 3030-3044 (2006).
- Chaturvedi, A. K., et al. Human papillomavirus and rising oropharyngeal cancer incidence in the United States. J. Clin. Oncol. 29 (32), 4294-4301 (2011).
- Ang, K. K., et al. Human papillomavirus and survival of patients with oropharyngeal cancer. N. Engl. J. Med. 363 (1), 24-35 (2010).
- Smeets, S. J., et al. A novel algorithm for reliable detection of human papillomavirus in paraffin embedded head and neck cancer specimen. Int. J. Cancer. 121 (11), 2465-2472 (2007).
- Wang, F., et al. RNAscope: a novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. J. Mol. Diagn. 14 (1), 22-29 (2012).
- Liu, X., et al. Specific regulation of NRG1 isoform expression by neuronal activity. J. Neurosci. 31 (23), 8491-8501 (2011).
- Yan, K. S., et al. The intestinal stem cell markers Bmi1 and Lgr5 identify two functionally distinct populations. Proc. Natl. Acad. Sci. U.S.A. 109 (2), 466-471 (2012).
- Payne, R. E., et al. Viable circulating tumour cell detection using multiplex RNA in situ hybridisation predicts progression-free survival in metastatic breast cancer patients. Br. J. Cancer. 106 (11), 1790-1797 (2012).
- Bordeaux, J. M., et al. Quantitative in situ measurement of estrogen receptor mRNA predicts response to tamoxifen. PLoS One. 7 (5), (2012).
- Wang, Z., et al. Automated quantitative RNA in situ hybridization for resolution of equivocal and heterogeneous ERBB2 (HER2) status in invasive breast carcinoma. J. Mol. Diagn. 15 (2), 210-219 (2013).
- Tubbs, R. R., et al. Ultrasensitive RNA in situ Hybridization for Detection of Restricted Clonal Expression of Low Abundance Immunoglobulin Light Chain mRNA in B-Cell Lymphoproliferative Disorders. Am. J. Surg. Pathol. In press, (2013).
- Ukpo, O. C., Flanagan, J. J., Ma, X. J., Luo, Y., Thorstad, W. L., Lewis, J. S. High-risk human papillomavirus E6/E7 mRNA detection by a novel in situ hybridization assay strongly correlates with p16 expression and patient outcomes in oropharyngeal squamous cell carcinoma. Am. J. Surg. Pathol. 35 (9), 1343-1350 (2011).
- Lewis, J. S., et al. Transcriptionally-active high-risk human papillomavirus is rare in oral cavity and laryngeal/hypopharyngeal squamous cell carcinomas--a tissue microarray study utilizing E6/E7 mRNA in situ hybridization. Histopathology. 60 (6), 982-991 (2012).
- Lewis, J. S., et al. Partial p16 staining in oropharyngeal squamous cell carcinoma: extent and pattern correlate with human papillomavirus RNA status. Mod. Pathol. 25 (9), 1212-1220 (2012).
- Bishop, J. A., et al. Detection of transcriptionally active high-risk HPV in patients with head and neck squamous cell carcinoma as visualized by a novel E6/E7 mRNA in situ hybridization method. Am. J. Surg. Pathol. 36 (12), 1874-1882 (2012).
- Schache AG, ., et al. Validation of a novel diagnostic standard in HPV-positive oropharyngeal squamous cell carcinoma. Br. J. Cancer. 108 (6), 1332-1339 (2013).
- Mehrad, M., et al. Papillary Squamous Cell Carcinoma of the Head and Neck: Clinicopathologic and Molecular Features With Special Reference to Human Papillomavirus. Am. J. Surg. Pathol. Jun. , (2013).
- Jordan, R. C., et al. Validation of methods for oropharyngeal cancer HPV status determination in US cooperative group trials. Am. J. Surg. Pathol. 36, 945-954 (2012).
- Hammond, M. E., et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer (unabridged version). Arch. Pathol. Lab. Med. 134 (7), 48-72 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved