Method Article
ボクセルからの知識へ:複雑な電子顕微鏡3D-データのセグメンテーションの実用ガイド
要約
携帯3D電子顕微鏡のためのボトルネックは非常に複雑な3D密度マップにおける特徴抽出(セグメンテーション)です。私たちは、このように効果的なセグメンテーションのための出発点を提供し、セグメント化アプローチ(手動、半自動、または自動で)異なるデータ型に最も適しているに関するガイダンスを提供する基準のセットを開発した。
要約
近代的な3D電子顕微鏡のアプローチは、それらの細胞骨格および細胞小器官などの高次構造は、同様に、そのような接着複合体のような大きな高分子マシンの視覚化を可能にする、細胞および組織の3次元超微細組織への前例のない洞察を最近許可されているそれぞれの細胞および組織のコンテキスト。細胞のボリュームの固有の複雑さを考えると、まず視覚化、定量化、従って、それらの三次元組織の理解を可能にするために、関心のある特徴を抽出することが不可欠である。各データセットは個別の特性によって定義され、 例えば信号対雑音比、サクサク簡単に識別できるように特徴的な形状のデータ、その機能の不均一性、特徴の混雑、有無(シャープネス)、およびパーセント関心のある特定の領域が占めるボリューム全体の。すべてのこれらの特性を考慮する必要があるセグメンテーションのために取るためにどのアプローチを決定する際に。
提示六つの異なる3次元超微細構造のデータセットは、3つの異なる撮像により得られた近づく:染色された電子線トモグラフィーを埋め込み樹脂は、イオンbeam-と穏やかに染色し、激しく染色されたサンプルの連続ブロックface-走査電子顕微鏡法(FIB-SEM、SBF-SEM)、集束であった。これらのデータセットの場合、四つの異なるセグメンテーションアプローチが適用されている:(1)完全に手動モデル構築は、単にモデルの視覚化に続いて、表面レンダリングに続く(2)データのマニュアルトレースセグメント化、(3)半自動化されたアプローチは、その後表面レンダリング、または表面レンダリングおよび定量分析を行った(4)自動化されたカスタム設計のセグメント化アルゴリズムによる。データセットの特性の組み合わせによっては、これらの4つのカテゴリの手法の典型的には、1つが他よりも優れていることが判明したが、基準の正確な配列に依存して、カ再複数のアプローチが成功する場合があります。これらのデータをもとに、客観的なデータセットの特性と異なるデータセットを分析するための主観的個人の基準の両方を分類トリアージ方式を提案する。
概要
伝統的に、電子顕微鏡(EM)フィールドが1に分割されている)は、典型的に有する高分子複合体の三次元(3D)構造を調査するために平均化暗黙的または明示的なデータと組み合わされ、高、超高分解能TEMを用いた構造生物学支店定義された組成と、典型的には、比較的小さなサイズ1-4、全体の細胞風景が1,5,6を可視化されている2)細胞イメージングブランチ。構造生物学の枝が最後の40年間の壮大な発展を遂げてきたが、細胞生物学の枝は主に、多くの場合、より少なくより最適に保存されたサンプルに、2次元に限定されていた。だけ過去10年間電子線トモグラフィーの出現により、細胞生物学的な超微細構造イメージングは、一般的に平均化が細胞の風景のように行うことができないので、関心のある特徴は、一般的にユニークである三次元5,7へと拡大してきました。
可視化され、携帯のシーンは、多くの場合、目には美しいですが、正確なタンパク質組成は通常不明であるため、関心とそのような高度に複雑な細胞容積のその後の定量分析の特徴を効率的に抽出は、したがって、それが困難なこれらの細胞を解釈すること、部分的には、遅れ3Dボリューム。この今日まで、広範囲の生物学的専門知識は、多くの場合、複雑な断層像を解釈する、あるいは3Dボリュームに重要な領域とを必須成分を特定するために必要とされる。さらに合併症として、3次元ボリュームの可視化は著しく非自明です。 3Dボリュームがあると考え、したがって、2D画像のスタックとして視覚化することができる。シーケンシャル2D画像のスライスごと検査は複雑さを軽減し、それはまた、限界が2次元に抽出し、このようにして定量分析を備えています。しかし、ほとんどの3Dオブジェクトのために、3Dボリュームの描写は、単に連続した平面のスタックは不完全につながる特定のシステムの3D自然に歪んだ視点はd。目視検査の代替モードは、携帯の頻繁に密な自然に与えられたいずれかのボリュームレンダリングやサーフェスレンダリング、必要とするボリュームを、することができますので、インタラクティブな手動セグメンテーションを困難にし、簡単にネストされたオブジェクトの妨げビューにつながるか、完全にユーザーを圧倒する。
、自動化された特徴抽出(セグメンテーション)の多種多様なこれらの障壁を改善するためのアプローチは密度-又は勾配ベースの8-10のいずれか、典型的には開発されてきた。しかし、これらの方法にかかわらず、いくつかの最近の方法は、アクチンフィラメント11のような関心のある特定の機能をターゲットにすることができますが、専門家にとって関心のある地域や特徴のセグメントにボリューム全体を傾向がある。流域immersioを適用する場合に加えて、自動化されたセグメンテーションを実行するプログラムは、時にはサブボリューム( 例えば 、多数の産生をもたらすことができ多くの場合、関心の全機能を含む、またはさらに細分化を施しても中に手動でバックマージする必要のnセグメンテーション)。これは、このように、ほとんどのレンダリングコンピュータアルゴリズムを忠実に関心のある特徴のみを抽出することができない、と専門家による大幅なキュレーションの努力は、多くの場合、必要なセグメント化されたボリュームを生成するために必要とされる、特に複雑で混雑したデータセットについても同様である。
また、高度に特異的な問題へのカスタムソリューションは、多くの場合、それらの数学の分野の詳細な知識を持っていない研究者がアクセスできる広範かつ包括的なツール作る上で無重点がほとんどで、科学的な会議の論文として公開されている、コンピュータサイエンス、および/またはコンピュータグラフィックス。画像解析ライブラリの範囲を含むカスタマイズ可能なプログラミングソフトウェア環境は、ユーザが効率的に正確なセグメンテーションのための独自のモジュールを記述することを可能にする強力なツールのセットであり得る。しかし、このアプローチは、内線を必要とするensive訓練とその多くの機能や画像解析のための機能を利用するために、コンピュータサイエンスの背景。一つは、それらの周囲12,13から関心のあるオブジェクトを分離するために「テンプレート」のユニークな幾何学的形状に依存して、強力な形状ベースのアプローチを利用することによって、特徴がよりスパースである特定のデータセットについて、 例えば 、そのような汎用性の高いソフトウェア環境内で動作することができ。
コンピュータグラフィックスの可視化パッケージの公正さまざまなインタラクティブな手動セグメンテーションとモデル構築のために存在する。カリフォルニア大学サンフランシスコ校キメラ14、コロラドIMOD 15校、テキサス大学オースティンVolumeRover 16:他の人が学術的起源のものであり、そのように、無料で配布しながら、いくつかのパッケージは、市販されている。しかし、これらのプログラムが持つ機能と能力の広い範囲と複雑さは、EAのための学習曲線を急勾配CH。特定の視覚化プログラムは、複雑な3Dボリュームの簡略化モデルを作成するために、密度マップに入れることができるさまざまな大きさのボールとスティックのような単純な幾何学的モデルを提供する。これらのモデルは、単純な幾何学的および体積測定を可能にし、したがって、単に "きれいな絵」を越えて行く。オブジェクトのようなマニュアルトレースは、オブジェクトの数が少ないトレースして抽出する必要があるボリュームに適しています。しかしながら、集束イオンビーム走査電子顕微鏡法(FIB-SEM)17-20またはシリアルブロックフェイス走査電子顕微鏡(SBF-SEM)のいずれかを使用して大量の3D超微細構造の画像化の最近の開発21は、3Dデータのサイズというさらなる合併症を提示するセットは、数十ギガバイトと数百ギガバイト、さらにはテラバイトの範囲とすることができる。したがって、このような大型の3Dボリュームは、手動特徴抽出と実質的にアクセス不可能であるので効率的なユーザーガイド半自動偉業URE抽出は予見可能な将来における3Dボリュームの効率的な解析のためのボトルネックの1つになるでしょう。
ここに提示日常的に生体画像タイプの広い範囲で使用される4つの異なるセグメンテーションアプローチがある。これらの方法は、次に、生物学者は、自分のデータの有効な特徴を抽出するための最良のセグメント化アプローチであるかもしれないものを判断するためのガイド内にコンパイルを可能にする、データセットの異なるタイプのそれらの有効性について比較する。詳細なユーザーマニュアルが記載されたプログラムのほとんどに利用可能であるとして、その目的は、これらの特定のパッケージのいずれかに精通している潜在的なユーザーにすることではありません。その代わりに、目標は、多様な特性を持つ6のデータセットの例にそれらを適用することにより、これらの異なるセグメント化戦略のそれぞれの強みと限界を実証することである。この比較により、基準のセットは、いずれかの客観的な画像特性に基づいて開発されているそのようなそのようなセグメンテーションのための所望の目的として主観的な考慮からのデータのコントラスト、鮮明さ、混雑、および複雑さ、またはステムなどの3Dデータセットは、特徴の形態での画分を意味する、関心のある特徴の人口密度、セグメント化される関心特徴、そしてどのように1収益最適にそのような時間とスタッフの可用性などの有限な資源で占める体積。これらの異なるデータセットの例は、これらの客観的および主観的基準は、データセットの特定の種類の特定の特徴抽出手法のペアを生成するためにさまざまな組み合わせで連続的に適用することができる方法を示す。指定された勧告は、うまくいけば、セグメンテーションオプションの多種多様に直面して、初心者が自分の3Dボリュームのための最も効果的なセグメンテーションアプローチを選択するのに役立ちます。
この論文の焦点は、データ収集と前処理データの特徴抽出、注意であるが効率的なのに不可欠であるegmentation。しばしば、試料の染色が不均一にすることができ、したがって、潜在的な染色アーチファクトがセグメンテーション手順で考慮されるべきである。しかし、染色は通常、より高い信号対雑音を与え、したがって、潜在的にアーチファクトが生じる可能性があり、携帯ボリュームの少ないフィルタリングや他の数学的処理を必要とします。それぞれの生画像データセットは、正確なコントラストおよびカメラピクセルの設定で取得した位置合わせ、及び3Dボリュームに再構築する必要がある。断層像については、整列された画像は、重み付け逆投影を使用して、典型的には再構築された後、データセットは、通常、非線形異方性拡散22、バイラテラルフィルタリング23、または24のフィルタリング再帰中央値として雑音除去アルゴリズムが施される。 FIB-SEMおよびSBF-SEM撮像データは、ImageJの25 XY利用プログラムで相互相関の連続切片により整列される。コントラスト強調とフィルタリングの機能を高めるために適用することができる関心ので、デノイズに画像スタック。フィルタリングアプローチは計算上高価であることができるように、フィルタリングは、選択または選択されたサブボリューム上のサブボリュームの前に、ボリューム全体のいずれかを行うことができる。時には、ノイズ低減および/またはファイルサイズ縮小のために使用される、(ビニング)データのサンプリングダウンデータが著しく予想解像度に比べてオーバーサンプリングされた場合にのみ推奨される。
ノイズ低減の後、処理された画像は、その後、さまざまな方法によってセグメント化することができ、そしてこの研究の焦点は、以下の4つである:(1)マニュアル抽象化モデル生成、(2)のマニュアルトレースを球棒モデルを作成を通じて関心のある特徴、(3)自動化されたしきい値ベースの密度、およびプロジェクト固有の分割のためのスクリプト(4)を介してカスタマイズされた自動化されたセグメント化の。境界セグメンテーション8と没入流域セグメンテーション10は、単純なしきい値へのより良い代替手段ですが、tはちょっと同じカテゴリーに属し、この議論の中で明示的に含まれていません。
密度の手動トレースはスライスごとのそれぞれの細胞内領域の元の密度の保持を可能にする、関心のある特徴を概説する必要があります。このアプローチは、セグメント化プロセスの最大制御を可能にするが、退屈で労働集約的なプロセスです。
アルゴリズムはユーザ定義パラメータのセットに基づいてピクセルを選択する場合、自動化されたしきい値ベース(および関連する)密度セグメンテーションアプローチは、半自動である。そのようなCHIMERAにより作成、IMOD、フィジー26、VolumeRoverなどのいくつかのアカデミック(無料)可視化パッケージは、パッケージ(有料のライセンスを必要とする)利用可能なだけでなく、商業であり、両方のタイプは、一般的に、これらのセグメント化の方法のいずれかまたは複数を含む。これらの異なる方法を説明するために本研究で使用されているソフトウェアパッケージは商用プログラムやアカデミックオープンの両方が含まれる手動で抽象モデルだけでなく、手動および自動密度セグメンテーションを生成するためのソースプログラム。しかし、オープンソースソフトウェアは、時には、カスタマイズの可能性を通じて、より高度なオプションを提供することができます。
データセットの異なるタイプを使用してこれらの技術の比較は、ルールや知識にまだ公開されていない多様な生物学的データの3Dボリュームのセグメントにアプローチする方法に関するガイダンスの次の提示につながった。したがって、これは最初の体系の異なるアプローチの比較は、異なる目的を持つユーザーのために特性を変化させたデータセットに対するそれらの有用性がある。
プロトコル
1マニュアル抽象モデル生成
注:以下に記載される方法論の詳細はキメラに特異的であるが、他のソフトウェアパッケージを用いてもよい。唯一の目的ではなく、オブジェクトのボリューム形状を表示する場合に比べ、幾何学的な測定を行うために、幾何学的モデル( 例えば 、ボールとスティックモデル)を作成するときに、この方法を使用します。
- マニュアル抽象化モデル生成のための適切なプログラムにデータボリュームをインポートします。
- [ファイルを開く]ダイアログをプルアップするファイル]> [ 開くマップを選択します。目的のマップのファイルの場所に移動します。
- 異なるレンダリングスタイルを持つデータを表示するボリュームビューア([ツール]> [ボリュームデータ > ボリュームビューア )を選択特長 > 表示スタイルの引き上げます。
- ボリュームビューアでヒストグラムに垂直バーをドラッグして表示するためのしきい値を調整しますウィンドウ。
- 3Dボリュームをナビゲート( 例えば 、スライスによるスライス)がセグメンテーションのための関心領域を選択し、必要に応じてより小さなサブボリュームをトリミングします。
- ボリュームビューア]ダイアログで、X、Y、またはZを選択し、Axisをクリックします。
- ボリュームビューア]ダイアログボックスで、[ 機能 ]> [ 飛行機 。左のボックスの数値に対応する平面を表示するように深さを設定するために一つをクリックして、すべての面を表示するには、[すべて ] をクリックします。
- ボリュームビューア]ダイアログボックスで、[ 機能 ]> [ メコン選択 。
- 関心領域の周りに長方形のボックスを作成するにはクリックしてドラッグします。
- 関心のある特徴に沿ってマーカーを置き、モデルが完了するまで(多くの場合、プログラムによって自動的に行われる)適切なリンカーを接続します。
- ボリュームビューアのメニューバーから、[ツール]> [ボリュームトレーサダイアログがボリュームトレーサ]ダイアログを開きます。ボリュームトレーサ]ダイアログで、[ファイル ]> [ 新規マーカーセット中。
- 連続して選択されたマーカーをボリュームトレーサ]ダイアログで、、、高品質のデータ·プレーンの上に置いてマーカーをマウス > 置きマーカーを確認し、選択マーカーにマーカーリンク新しいマーカーを移動し、サイズ変更 、およびリンク 。
- マーカー色見本をクリックし、色を選択します。 リンクの色ごとにこの手順を繰り返します。
- マーカーおよびリンクモデル構築要素のための半径を入力します。
- ボリュームトレーサ]ウィンドウで、[右]マウスボタンを使用して置きマーカーを選択して、マーカーやリンクのための半径を挿入します。
- 右のマーカーを敷設を開始するボリュームデータをクリックしてください。マーカーは自動的に接続されます。
- ボリュームトレーサ]ダイアログで、[ ファイル ]> [ 現在のマーカーセットを保存し 、その後> 閉じるマーカーセットファイル 。
- 興味のある第2の所望の特徴にモデルの構築を開始するために、新しいマーカーセット(ステップ1.3.1)を開きます。特徴の違いを強調するために、マーカーセット間の対照的な色を利用している。
関心のある特徴2。手動トレース
注:以下に記載される方法論の詳細はアミラに固有であるが、他のソフトウェアパッケージを用いてもよい。人口密度が比較的小さく、特徴抽出の精度が最優先事項であるとき、マニュアルトレースのように時間のかかるアプローチであるときに、このアプローチを使用する。
- マニュアルトレースオプションを使用してプログラムにインポートボリュームデータ。この機能を持つソフトウェアは、一般に、少なくとも基本的なブラシツールを提供します。
- 大量または断層像では( 例えば 、16ビットの2048 X 2048以上.recまたはIMODに.mrc生成された断層像):[開く]を選択しデータ > filename.rec>フォーマットを右クリックして...> LargeDiskDataとして生を選択 > OK>ロード 。 OK>ヘッダ情報から、適切な生データのパラメータを選択します。新規として切り替えて、 保存 filename.amのは、以下の手順で使用するためのファイル。
- 小さ い3D画像スタックファイルの場合( 例えば 、3次元.TIFまたは.mrcまたは.rec): オープンデータ >を選択filename.tifまたはfilename.mrc。 名前を付けて保存を切り替え、右クリック> filename.am 。エラーが発生したか、プログラムが応答しない場合、ファイルが大きすぎていてもよく、ステップ2.1.1に従うことによって開くことができる。
- 分割のための3Dサブボリュームを選択したスライスをナビゲートしてから、関心のあるこのエリアに切り抜く。
- 3Dビューアウィンドウでは、画像ファイルを開くにはOrthosliceを選択します。スライスを移動するには下部にあるスライダを使用してください。
- >プールウィンドウでファイル名トグル、LargeDiskDataとして開かれ、より大きなデータをトリミングする権利> LatticeAccessをクリックします。エンテrは希望ボックスサイズ> 適用します 。新しいファイルを保存します。
- セグメンテーションファイルを作成します。
- プールウィンドウでファイルを切り替え>右> ラベリング > labelFieldプロパティ ] をクリックします。新しいファイルが作成され、自動的にセグメンテーションエディタ]タブにロードされます。
- 手や使用するソフトウェアに固有のコマンドを使用してトレースを埋めた後、目的の第一の特徴の境界をトレースします。すべてのスライスを通じて関心特徴に従って、マニュアルトレースセグメンテーションを繰り返します。アミラを使用して次のコマンドを使用します。
- ペイントブラシツールを使用するには、必要に応じてブラシのサイズを変更し、関心のある特徴の境界をトレースするには、マウスポインタを使用しています。
- ショートカット「F」と、トレースエリアを埋める。プラス記号の付いたボタンをクリックすることで選択範囲を追加するか、ショートカットの「a」。必要に応じて、Enterキーを押し、「U」は取り消し、および「S」を減算または消去することができます。
- 可視化と基本的な定性的またはソフトウェアユーザーガイド命令あたりの定量分析のための表面レンダリングを生成します。
- オブジェクトプール]タブで、右> SurfaceGenクリック>プール·ウィンドウにファイル名-labels.amを切り替えます。
- 所望の表面のプロパティを選択> 適用します 。新しいファイルfilename.surfはプール内に作成されます。
- セグメント化されたボリュームを視覚化するために、プール·ウィンドウにfilename.surf切り替える>右> SurfaceViewをクリックします。
- 移動、回転、3Dボリュームにズームする3DViewerウィンドウのツールを使用してください。
- 正確な密度を抽出し、ボリュームや表面積などの測定値を決定する。より高度な表示、解析およびシミュレーションのための他のプログラムにエクスポートします。
- 3DViewerウィンドウで、 適切なオプション (2Dの長さと2次元角度測定のための単一の2D平面上に、3Dの長さと3Dの角度を選択 > 計測ツールをクリックします3Dボリュームの測定のために)。
- 希望の長さ、距離、角度を測定するためにメッシュサーフェスをクリックします。値は、[プロパティ]ウィンドウに一覧表示されます。
3自動密度に基づくセグメンテーション
注:以下に記載される方法論の詳細はアミラに固有であるが、他のソフトウェアパッケージを用いてもよい。
- 興味のある密度を撤回する、コントラスト、鮮明さ、または混雑のいずれかさまざまなデータセットで、この方法を使用します。
- 自動セグメンテーションのためのしきい値、魔法の杖、または他の密度ベースのツールを装備したプログラムにインポートボリュームデータ。マニュアルトレース用の方向に2.1-2.1.2で説明されている手順に従ってください。
- スライスをナビゲートし、セグメンテーションのための領域を選択します。必要な場合には、セグメント化のためのより小さな3Dサブボリュームを切り取る。マニュアルトレース用の方向に2.2-2.2.2で説明されている手順に従ってください。
- の濃度を選択します通常機能のマークまたはアンカーポイントをクリックするか、配置することによって、目的の機能、。ソフトウェアで許可された場合は、その機能のピクセル強度を包含する番号の範囲を入力し、必要に応じて、この許容値を調整します。機能に属する密度は、アンカーのピクセルまたは許容値の強度に合わせてピックアップされます。アミラを使用する場合は、次のコマンドを使用します。
- 識別可能なマージンの機能に魔法の杖ツールを使用してください。
- 機能が完全にハイライト表示されるように、正しい値の範囲をキャプチャするためにディスプレイとマスキングでスライダを調整した後、関心のある領域をクリックします。ショートカットの「a」で選択範囲を追加します。
- 明確に区別余白せずに機能するためのしきい値のツールを使用してください。
- しきい値のアイコンを選択します。関心のある特徴のみがマスクされるように、所望の範囲内で濃度を調整するスライダを調整します。 [選択]ボタンをクリックし、ショートカットで選択範囲を追加する220; A」。
- セグメント全体のボリュームに、選択範囲を追加する前に、 すべてのスライスを選択します。
- 、ノイズを除去するセグメンテーションを選択> 諸島および/ またはセグメンテーション > スムーズラベルを削除する。
- 識別可能なマージンの機能に魔法の杖ツールを使用してください。
- マニュアルトレースセクション2.6-2.6.2で説明したように可視化および定性分析のための表面を生成します。必要に応じて、適切な3D表示、定量分析やシミュレーションのための他のプログラムにエクスポートする。
4。カスタム仕立ての自動セグメンテーション
注:コンピュータサイエンスのバックグラウンドでの経験を必要としますが、大容量の精密な密度モデルを作成する機能を可能にする自動セグメンテーションのためにカスタマイズされたスクリプトを作成するには、この方法を使用します。
- ツール(MATLAB 27シェイプ教師付きセグメンテーションの具体例)
- 画像前処理:雑音除去、背景除去及び画像強調を実行する次のパイプラインを使用することにより:
- 関数imreadコマンドを使用してイメージをロードします。
- コマンドラインでは、次のように入力します>>イム= imreadは$のIMAGE_PATHを分析しようとするイメージの場所です($のIMAGE_PATH)。
- 画像処理ツールボックスから、推定または既知のノイズパワー対信号比(NSR)を使用して、ウィナーフィルタを呼び出します。
- 以前に処理された画像上で、その後、背景レイヤーを推定するためにimopen画像opening関数を呼び出して別のマスクとして成果を割り当てる。
- コマンドラインでは、次のように入力します。>>背景= imopen(イム、STREL別($ shape_string、$サイズ))、この方法では、$ shape_stringはサイズがアナライザによって与えられている変数$ 'ディスク'に等しく、 すなわち >>背景= imopen(イム、STREL( 'ディスク'、15))。
- 背景がフィルタリングされた画像を引きます。
- コマンドラインでは、次のように入力します>> IM2 =イム -背景
- 結果の質に応じて、画像処理ツールボックスから関数関数imadjustを使って呼び出すことができ、適応大津の方法28の有無にかかわらず、画像の正規化を行う。
- コマンドラインでは、次のように入力します>> IM3 =関数imadjust(IM2)
- 正規化された画像をトリミングすることにより、関心領域を制限する、セグメンテーションのために関心のある特徴を準備します。
- >> im3_crop = imcrop(IM3、[X1、Y1×2 Y2])、ベクトル[×1 Y1×2 y2は]に対応:imtoolコマンドを使用して、トリミングされ、コマンドに座標を提供することにある関心領域を探索クロップされる正方形の領域。
- 関数imreadコマンドを使用してイメージをロードします。
- 認識/教師形状分類形状:オブジェクトのそれぞれ異なるカテゴリの具体的な例(関心のある特徴を横断2D画像における線形トレース)を提供することによって、アルゴリズムを訓練。
- VLFEAT 29 APIが正常にインストールされていることを確認し、より詳細な資料についてはVLFEATのホームページをご利用ください。
- コマンドラインでは、次のように入力します>> [TREE、ASGN] = VL_HIKMEANS(im3_crop、$ K、$ NLEAVES)$ Kを使用するためにクラスタの数や観察者が中にデータを配置したいクラスの数であり、と$ NLEAVES すなわち >> [TREE、ASGN] = VL_HIKMEANS(im3_crop、4,100)リーフクラスタの所望の数である
- VLFeatの入力として手動でセグメント化された機能を使用してください。
注:このオープンソースのCベースライブラリは、ピクセルのパッチ、パッチクラスタ化、およびデータセットに最適に動作するように選択した方法の種類に応じて、クラスタ中心の位置決めを行います。利用可能なオプションは、ベースをテキストンでk-平均クラスタリングの範囲に30に近づき、出力は特徴が与えられた手本に基づいて、所望記述する数値配列です。
- 画像前処理:雑音除去、背景除去及び画像強調を実行する次のパイプラインを使用することにより:
- セグメンテーション:このFUを使用してくださいLLYさらなる可視化と分析のための独立したマップとして書き出されます同時にオブジェクトのセグメント複数のクラスに計算コストが高い、アプローチが、自動化された。
- 以前に生成された数字の配列(モデル)をロードします。
- モデル入力としてセグメント化される画像を用いて、VLFeatにおけるサポートベクトルマシン(SVM)関数を呼び出す。
- コマンドラインで次のように入力します。>> xは、元の画像im2_cropとyをトリミングさ= vl_svmtrain(X、Y、0.1)、[B、W]対象画像、手動でセグメント化された画像である。クラスタリングによって生成されたラベルに従って結果を着色する>> ISEG = VL_IMSEG(I、ラベル)を使用します。
注:モデルの特性に基づいて、VLFeat最初から割り当てられたクラス(関心のある特徴)の数に画像を分類する。所望の精度の程度に応じて、他のアプローチまたは推定CLUSTこの方法を組み合わせることが可能であるそのような船体とクラスタ中心として小胞体パラメータ。 SVMアルゴリズムの出力は、確率モデルと新たなデータセット中の所望のクラスの複数のバイナリマスクである。
- コマンドラインで次のように入力します。>> xは、元の画像im2_cropとyをトリミングさ= vl_svmtrain(X、Y、0.1)、[B、W]対象画像、手動でセグメント化された画像である。クラスタリングによって生成されたラベルに従って結果を着色する>> ISEG = VL_IMSEG(I、ラベル)を使用します。
- コマンドを入力して、結果を保存:$フォーマットが 'いさかい'と$ filenameは、出力ファイルのパスです>> imwriteは(IM、$フォーマット、$ファイル名)。
- >> imshowは(IM):画像を可視化するために、コマンドを入力します。
結果
図1は、電子線トモグラフィー、FIB-SEM、及びSBF-SEMを含む3次元電子顕微鏡細胞イメージングのための一般的なワークフローを示しています。ワークフローが選択されたセグメンテーション·ソフトウェアの有効性を最大にするために関心領域をクロッピング、生データの収集、3Dボリュームへのデータのアライメントおよび再建、フィルタリングを通じてノイズリダクション、及び必要な場合が含まれる。このような前処理されたデータは、次に、特徴抽出/セグメント化の準備ができています。
図2は、FIBから生じる他の二つと、電子線トモグラフィー( 図2A、2B)により記録された樹脂包埋サンプルであるそのうちの2つ(以下にさらに導入される)は、4つの異なるデータセットを図1にレイアウトされたワークフローを示すそれぞれ-semとSBF-SEM( 図2C、2D)。図2の列1の画像が投影されアライメント·復興の際に3Dボリュームに組み立てられる景色であった( 図2A1、2B1)とブロックの表面画像( 図2C1、2D1)、、。列2は、フィルタリング(列3)に基づいノイズの大幅な低減を示し、したがって、多くの場合、より鮮明な表示さなどの3Dボリュームを通してスライスを示しています。 (カラム4)を選択し、関心領域に大きな3Dボリュームをトリミングした後、関心(列5)のセグメント化された特徴の3Dレンダリングを分析定量的に得られ、さらなる検査、色分けすることができる。
6 3Dデータセットの合計は、いずれかの電子線トモグラフィー(3データセット)を介して得られた画像のスタックを含むそれぞれは、FIB-SEM(2データセット)、またはSBF-SEM(1データセット)を、どのようにそれぞれを比較するために使用される4分割方法( 図3)を行う。データセットは、実験室での異なる研究プロジェクトのさまざまな由来ため、ARを提供典型的な実験データセットのeasonably多様なセット。全てのデータセットは、1つの特定のアプローチに最も精通しているそれぞれの人の4つの独立した研究者によって調べ、それらは6つのデータセットのそれぞれに最適な結果を提供することに仕込んだ。
以下のようなデータセットは、サンプルからである:1。図3A1-3A5:高圧凍結、凍結置換し、樹脂包埋ひよこ内耳有毛細胞不動毛31、2。 図3B1-3B5:高圧凍結、凍結置換し、樹脂包埋植物細胞壁(未発表)、3。 フィギュア3C1-3C5:高圧凍結、凍結置換し、樹脂包埋内耳有毛細胞運動毛(未発表)、4。 フィギュア3D1-3D5:高耐圧人間の乳腺上皮細胞のラミニン豊かextracell中で培養されたHMT-3522 S1腺房に位置ミトコンドリアの凍結し、凍結置換および樹脂包埋ブロックウラルマトリックス32,33、5。 図3E1-3E5:無染色卓上型処理され、硫酸減速細菌バイオフィルムの樹脂包埋ブロック(投稿準備中)、および6 図3F1-3F5:HMTの隣接細胞の膜の境界-3522 S1腺房。
図3から分かるように、異なるセグメント化アプローチは、他のデータ·タイプの一部のデータセットのタイプの大部分は同様の結果が、完全に異なる結果をもたらすことができる。例えば、有毛細胞不動データセット( 図3A)が解釈し、測定するために最も明確であること、専門家のユーザによって生成されたマニュアル抽象化モデルを持つすべての4つのアプローチで、合理的なセグメンテーションボリュームをもたらす。この場合、そのようなモデルは、フィラメント、フィラメントの距離の迅速な測定を可能にする細長いフィラメント間に見られるリンクの数のカウント、ならびに対応する密度マップの欠落部分の決定試料が試料調製34中に破損した場所へ。このような情報は、特注の自動抽出は、純粋密度ベースのしきい値よりも良好な結果を提供するが、他の三つのセグメンテーション手法を用いて取得することがはるかに困難である。
植物細胞壁( 図3B)は、マニュアルモデル生成は、他のアプローチのいずれも達成していない細胞壁、中程度の感覚を伝える最も効率的であるように見えた。しかし、抽象化されたモデルは、データセット内のオブジェクトの混雑をキャプチャしません。手動で関心のある特徴をトレースすると、密度ベースまたは形状監督の手法よりも良い結果が得られているようだ。一方、マニュアルトレースは非常に労働集約的であり、特徴の識別境界はやや主観的である。したがって、自動化されたアプローチは、精度との間の潜在的なトレードオフで大量のセグメント化することが好ましい場合があるマニュアルセグメンテーションに費やさ資源。
運動毛データセット( 図3C)は、マニュアル抽象化モデル生成は、最もクリーンな結果が得られ、運動毛の中心に3微小管の予想外のアーキテクチャを明らかにし、トリミングされたデータに容易に見えるディテールが、すべての他のアプローチで失わおそらく染色の不均一に起因する。しかし、密度マップの他の潜在的に重要な機能には、抽象モデルの手動生成に失敗している。これは手動モデル形成の主観的な性質は、モデル形成の間に主観的解釈に従って、観察される実際の密度の理想化と抽象化につながり、という事実に起因する。したがって、この例では、うまく抽象化されたモデル生成は1が3Dボリュームの特定の側面に集中することができますどのようにマニュアルを示しています。しかし、選択的知覚と単純化は、すべてのタンパク質の共同の完全なアカウントを与えることができないデータセット内に存在mplexes。目的は、データの複雑さを示すことであるしたがって、1つが他の三つのアプローチのいずれかを添えて優れています。
3Dマトリックス培養乳腺腺房( 図3D)の場合には、コントラストの高いミトコンドリアの機能を手動でトレースがあまりにも意外に汚染の最低量(最良の結果が得られていないと、簡単にすべての4つのアプローチによってセグメント化されている図3D3)。ただし、手動トレースは非常に労働集約的であり、従って、大量のための限定的な使用のです。クリーンアップのための更なるトリックが使用される場合には、濃度しきい値ベースと形状監修自動化されたセグメント化の両方が、非常によくミトコンドリアを抽出し、ほぼ完全なセグメンテーションをもたらすであろう( 例えば 、ボクセル密度の特定のしきい値以下にあるすべてのオブジェクト排除)利用できるようにする異なるパッケージ。この場合は、手動の抽象化モデル構築は得られなかった有望な結果、部分的にはミトコンドリアが簡単にボールとスティックモデルで近似することができないため。
細菌の土壌コミュニティ/バイオフィルム( 図3E)に関しては、4つのアプローチの3つが手動モデル生成は、幾何学的形状により、原因細菌のような生物学的対象を表すの挑戦にうまく行っていないと、妥当な結果が得られます。細菌から生じる細胞外の付属マニュアル機能トレースにおいても自動化されたセグメント化の手法で検出されませんすることができます。シェイプ監督特注の自動化されたセグメント化はさらにさえ、非常に大規模なデータセットを簡単に定量化を可能にした(データは示していない)が、同様の密度にもかかわらず、細菌から細胞外の機能を分離することができます。これは、もともと非常に大規模なデータセットであるため、カスタマイズされた自動化されたセグメント化は、明らかに、他のすべてのアプローチをoutcompetedが、低複雑性の恩恵を受けている可能性があります関心のある対象物の比較的まばらな分布(低い混雑)。
組織様文脈における2つの真核生物細胞( 図3F)との間のインタフェースを検査するとき、関心のある特徴の唯一のマニュアルトレースは良好な結果が得られた。自動化された密度ベースのセグメンテーション手法は、完全に、隣接するセル間の膜境界を検出できず、セルの形状が容易に近似さや形状と同一視されていないためであっても特注のアプローチ細菌のために明確な成功にもかかわらず、部分的に失敗したバイオフィルム内( 図3E5)。
セグメンテーションアプローチはいくつかのデータセットではなく、他でよく行うことが図3から観察は、これらのデータセットのそれぞれを特徴付けるかという問題につながっており、データ特性またはに現れ個人の目的の種類を分類することができたかどうか彼らのrespectivとよく一致して電子アプローチ。このトピックの系統的な研究は、以前に行われていないので、最初のステップとして、画像特性と個人的な目的の実証リストの確立は、それぞれのデータセットの特徴抽出のための最適なアプローチを見つけるために彼らの試みで、初心者を導くことがあります。
8項目は、有意は、 図4に示すように同定され、それらは2つの主要なカテゴリーに分けることができる:ややれたデータセットに固有の(1)特徴、および(2)研究者の個人的な目的および他の考慮事項同様に重要ではあるが、主観的。主に3つの追加データセットが導入されると、 図3の 6つのデータセットから引き出される示す例:一方( 図4A1)は、 シロイヌナズナ(Arabidopsis thaliana)植物細胞壁の凍結切片の凍結断層像であり、第二( 図4A2 、4B1、4D1 ) フィギュア3F1-3F5に描かカテゴリーに収まらなくても、以上の実質的に複雑である可能性が非常に複雑で入り組んだ組織をある内耳血管条のFIB / SEMデータセット、第三は( 図4B2 、4D2)はFiguress 2A1-2A5と3A1-3A5における縦断面図に示されているサンプルコンテンツと同様の断面図での内耳有毛細胞不動の樹脂部分の断層像、である。
画像特性のような客観的基準の分類については、データセットに固有の4特性が重要であることが提案されている。
- データのコントラストは、このような明確な細胞小器官、または他の顕著な特徴に立った携帯風景のように低温電子顕微鏡断層像、(2)中間体( 図4A2)に典型的な、または(3)ハイ(1)低い( 図4A1)とすることができる( 図4A3)、kinociの場合のようにz方向内の明確に分離糸状要素のアライメントに起因liary断層像や断面で不動、。
- データが急激に定義された境界を持つような組織中の細胞のような2つの近接して配置するオブジェクト、または鮮明な( 図4B2)、との間には目に見えて明確な境界と、( 図4B1)ファジーすることができます。これは、部分的にFIB-SEMに比べて、電子断層約2-4倍に本質的に高いデータ·セットの解像度の関数である。当然のことながら、シャープな境界は、マニュアルだけでなく、自動化されたセグメント化のアプローチの両方にとって望ましいが、後者のアプローチのために必須である。
- 細菌が実質的に容易に自動化された画像セグメンテーションをレンダリング分離を例示コロニー内にあるように、緊密に間隔を置いた植物細胞壁成分、またはまばら( 図4C2)によって反映されるように、密度マップは、いずれかの混雑した( 図4C1)であってもよい。
- 密度マップは、多くの場合、血管( 図4D1)またはそのような断面において不動と同様の組織と明確に定義された細胞小器官のようなオブジェクト、(周りの線条vascularis組織のような不規則な形状で非常に異なる機能を備えた非常に複雑になる可能性があります図4D2)。
また、比較はやや困難にすべての異なる例において非常に異なるスケールの点に注意してください。
別にそのような画像特性など、より客観的な基準から、適切なパスの選択をガイドします4非常に主観的な基準も提案されています。
- 所望の目的:目的は、その複雑さの毛束不動毛を可視化するために、物体( 図4E1)の形状を決定および確認する、または密度マップに組み込まれている単純化され抽象化されたボールとスティックモデルを作成することであるとことができ、高速カウントndは幾何学的なオブジェクト(フィラメントの長さ、距離、接続数)の測定( 図4E2)。
- 機能形態は非常に不規則など、アクチンフィラメント、クロスなどの大部分は細胞間相互作用のようなミトコンドリア( 図4F2)とやや同様にいくつかのバリエーションで輪帯( 図4F1)、、、または同一形状、などの細胞のように複雑になることがあります縦向き( 図4F3)での毛束内のリンク。
- 一セグメントに3Dデータセット内のすべての機能を望む可能性がある植物細胞壁( 図4G1)、または細胞容積の小さな部分だけの場合のように関心(人口密度)の機能の割合は、重要であるとしては、異種の細胞のシーン( 図4G2)におけるミトコンドリアの場合である。データセットのサイズとセグメント化を必要とする体積の割合に応じて、使用するのが最も効率的である手動のアプローチ。そのような一つのさまざまな機能に関心がある場合など、他の場合では、単に半自動セグメンテーションアプローチを使用する代替はありません。
- もう一つの重要な主観的な基準は1つがセグメント化プロセスに投資する用意があるリソースの量で、忠実度のレベルは、生物学的な質問に答えるために必要とされている。一つは、必要と多くの注意が、正確な定量的情報( 図4H1)を得るために必要とされ得る場合には(例えば、サイズ、体積、表面積、長さ、他の機能からの距離、のような)機能の体積パラメータを定量化する必要があるかもしれないまたは目的は、単に、その3次元形状( 図4H2)の写真をスナップする場合があります。リソースが無制限である理想的な世界で、人は明らかに妥協をするのではなく、ユーザー支援マニュアルの特徴抽出の最も正確なパスを選ぶのは嫌だ。これは多くのデータセットのために働くことができますが、近い将来に3Dボリュームは、WIL lは10K以上により10Kによって10K程度であり、マニュアルセグメンテーションは、もはやそのような巨大な空間を分割するに重要な役割を果たしていることができないでしょう。データ及び他のデータ特性の複雑さに応じて、半自動セグメント化が必要になることがある。
図5では、長所と短所を簡単に4セグメンテーションアプローチを記載されています。各アプローチとペアリングすることができます。図4で特定の個人の目的と画像特性も同様に概説されている。 図6は、6つのデータセットの個人的な目標および画像特性データをトリアージし、最善のアプローチを決定する方法を例示する。どちらも、5と6は議論で合意展開されるフィギュア 。
ロード/ 51673 / 51673fig1highres.jpg "幅=" 500px "/>
生物学的なイメージング·復興および分析のための図1のワークフロー。このチャートは、さまざまな収集するためにとった措置及び断層撮影によって収集されたプロセス画像の概要を示し、イオンビームSEMを集中し、シリアルブロック面のSEM。 2Dチルトシリーズまたは連続切片における生データの収集結果。これらの2D画像セットは、ノイズを低減し、関心のある特徴のコントラストを高めるために、ろ過、3次元に配列し、再構成されなければならない。最後に、データをセグメント化することができ、最終的には、3Dモデルで、その結果、分析した。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図2。断層撮影法及びFIB-SEMとは異なるデータ·タイプのワークフローの例として、ワークフローの各ステップは、データ収集は、4つのデータセット(行AD)を介して示された後:。縦断不動の樹脂埋め込 み染色された断層撮影、植物細胞壁の樹脂埋め込 み染色された断層撮影法セルロース、乳房上皮細胞のミトコンドリアのFIB-SEM、及びE.のSBF-SEM 大腸菌 。生データを介して2Dスライスがカラム1に示され、そしてアラインメントおよび三次元再構成後のデータからの画像は以下の通りで列2、列3に適用されるフィルタリング技術を含む:メディアンフィルタ(A3)を、非異方性拡散フィルタ(B3)、ガウスぼかし(C3)、およびMATLABの関数imadjustフィルタ(D3)。 3Dは、列5にスケールバーのレンダリングなどの関心のトリミングされたエリア(列4)から各データ·セットのための最良のセグメンテーションの例が表示されます。A1〜A3 = 200nmで、A4 = 150nmで、A5 = 50nmとし、 B1-B3 = 200nmで、B4-B5 = 100nmで、C1-C3 = 1mmのC4-C5 = 500nmで、D1〜D3 = 2ミリメートル、D4-D5 = 200nmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。

4分割の図3。応用例のデータセットへのアプローチシックスのデータセットの例は、すべての4つのアプローチによってセグメント化された:。マニュアル抽象化モデル生成、マニュアルトレース、自動化された密度ベースのセグメント、およびカスタマイズされた自動化されたセグメント化。目的は、定量的な目的のためのモデルを作成するのではなく、密度を抽出することであったように手動抽象化モデル生成は、不動毛(A)の染色された断層撮影埋め込み樹脂に有効であった。樹脂としては、植物細胞壁(B)の染色された断層撮影、自動化された密度に基づくsegmenta組み込みションはすぐに手動の方法は、データの唯一のいくつかのスライスに多くの手間がかかったように、多くのスライスを、通ってセルロースを抽出するための最も効果的な方法であった。他の分割方法はしなかったしながら、マニュアル抽象化モデル生成は、運動毛(C)の染色断層撮影における微小管トリプレットを生成し、まだ2自動化されたアプローチは、より迅速に密度を抽出し、そのため好ましかった。による乳房上皮細胞(D)のFIB-SEMからのミトコンドリアの形状に、マニュアルトレースはきれいな結果を提供し、低人口密度が迅速なセグメンテーションに許容される補間方法の使用と組み合わせる。セグメント化するために必要な大量の与えられた、カスタマイズされた自動化されたセグメンテーションは、SBF-SEM細菌データ(E)セグメントに最も効率的であることが判明したが、両方の自動アプローチは同等であった。時間がかかるが、乳房上皮細胞膜のFIB-SEM(F)を抽出するための唯一の方法はマニュアルトレースあっスケールバー:A1〜A5 = 100nmで、B1〜B5 = 100nmで、C1-C5 = 50nmで、D1〜D5 = 500nmであり、E1〜E5 = 200nmで、F1〜F5、バー= 500nmで。 見るにはこちらをクリックしてください。この図の拡大版。
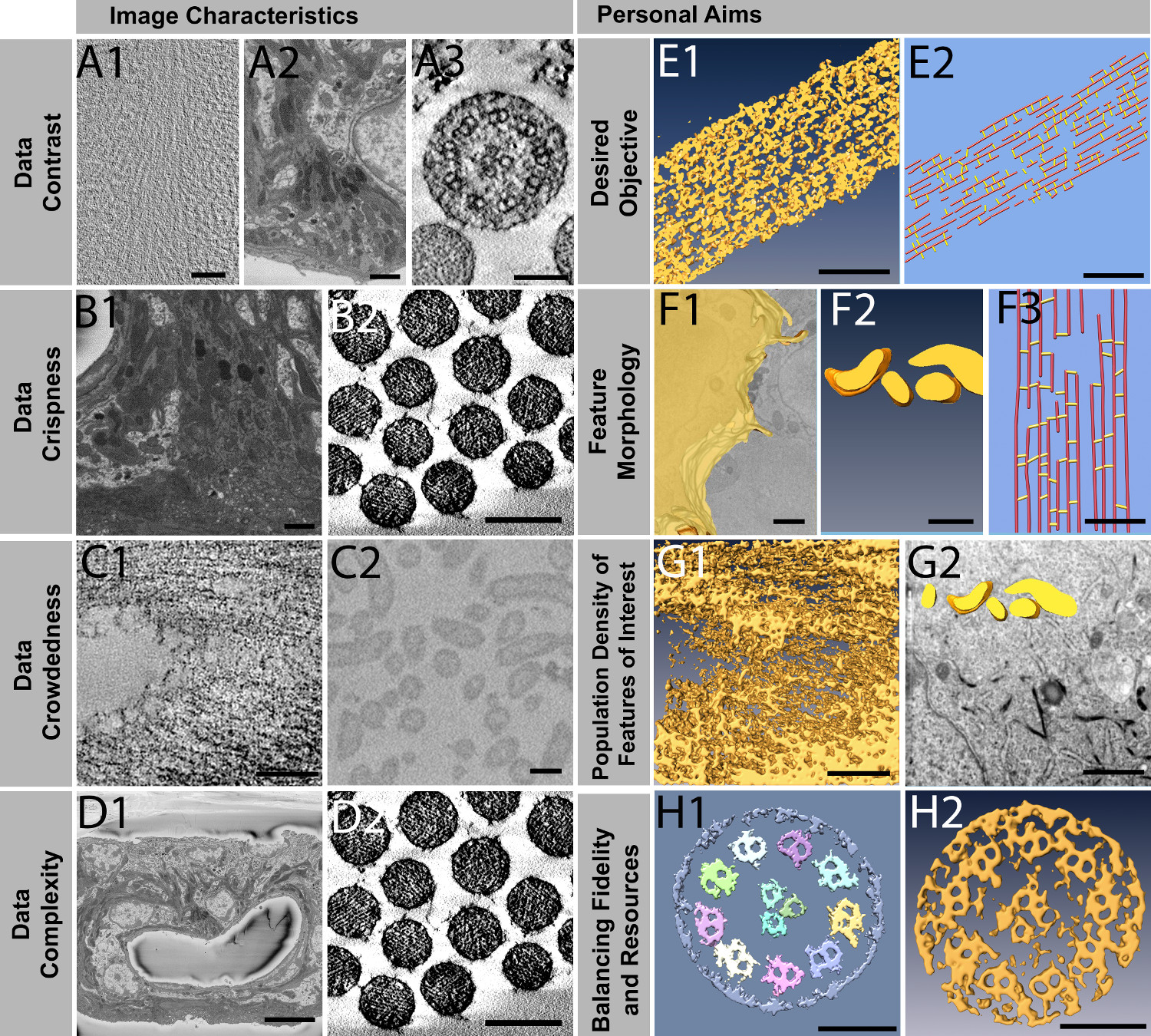
データセットを切り分けるために、図4客観的画像特性と主観的個人的な目的を、データセットの特性の例を使用しては、基準を使用するセグメンテーションアプローチするかの判定を通知するために提案されている。客観的な特性に関しては、データは本質的にファジーまたはクリスプ(B1-B2)であっても、低いコントラスト、中、高(A1-A3)を有することができる、(C1-C2)間隔をあけ、または混雑し、持つ複雑なまたは単純組織化された特徴(D1-D2)。主観の個人的な目的は、目的のOが含まれ bjective単純化したモデルを対象に、または正確な濃度(E1-E2)を抽出、関心(F1〜F3)の特徴である複雑なシート、複雑なボリューム、または線形の形態を特定する、関心のある特徴の高いまたは低い人口密度を選択する(G1-G2)、およびそのような時間(H1-H2) スケールバーとして投資の収穫逓減のための高忠実度と高リソース割り当ての間にはトレードオフの際に決定する:A1 = 50nmで、A2 = 1500nmで、A3 = 100nmで、B1 = 1500nmで、B2 = 200nmで、C1 = 100nmで、C2 = 200nmで、D1 = 10mmのD2 = 200nmで、E1 = 100nmで、E2 = 50nmで、F1-F2 = 500nmであり、F3 = 50nmで、G1 = 100nmで、G2 = 1ミリメートル、H1-H2 = 100nmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ピクセル "/>
図5の比較データ特性のテーブルと主観的には、異なるセグメント化アプローチのための適切な目的としています。このテーブルには、各セグメント化アプローチの長所と短所をまとめたものです。 図4からの基準は、分割方法に適したデータセットを特定するのに役立ちます。これらの客観的な画像特性と主観の個人の目標は、それぞれのアプローチの最適な使用のために選択したが、別の組み合わせは、セグメント化の効率を妨げるか、助けることができる。 この図の拡大版をご覧になるにはこちらをクリックしてください。

効率的なtについて図6意思決定フローチャートセグメンテーションのキャリッジは、さまざまな特性を持つデータ·セットに近づく。特性に基づいて、図4で強調表示、この図は、4つの基準は、 図3から、各データセットのための最良のセグメンテーション·アプローチに関する最終決定に最も寄与した。各データセットである示して色はすぐに、または同じアプローチにつながらない可能性があり、代替パスを反映原発意思決定プロセスを表す太い線と同様に、点線に従うようにコード化された。運動毛、細菌、および植物細胞壁のデータセットは、最高の2自動化アプローチとセグメント化された。これとは対照的に、細胞膜やミトコンドリアのパスは常に、それらの困難な特性にマニュアルトレースにつながる。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
3次元電磁界ボリュームから関連する特徴を抽出するための効果的な戦略が緊急に、最近の生物学的イメージングにヒットしたデータ津波についていくために必要とされている。データが数時間または数日で生成することができるが、これは深さ3Dボリュームを分析するために何ヶ月もかかる。したがって、画像解析は科学的発見のためにボトルネックとなっていることが明らかである。これらの問題に適切な解決策なしに、イメージング科学者は、自らの成功の犠牲者になる。これは、高いデータの複雑さと、典型的には、タンパク質およびタンパク質複合体の境界を別のと本質的には、グレースケール密度の連続勾配として現れる生物細胞において見出さ高分子混雑に一部である。この問題は、試料調製及びイメージング不完全性によって複雑に、そしてある場合には、画像再構成アーチファクト、完全に自動化されたアプローチのための課題を提起することができ最適な体積測定データよりも少ないにつながっているエス。最も重要な、しかし、試料調製、イメージング、および生物学的解釈の専門家はほとんどうまく計算科学に精通していないため、効果的に特徴抽出と分析にアプローチする方法についてのガイダンスを必要としているという事実である。そのため、さまざまな例を使用することにより、プロトコルはセグメンテーションのためのデータだけでなく、マニュアル抽象化モデル生成、自動化された密度ベースのセグメント、関心のある特徴の手動トレース、およびカスタマイズされた自動化されたセグメント化のための手順を準備する方法について説明します。手順で概説した手動および自動のアプローチがここで言及され、そのうちのいくつかのセグメント化ソフトウェア、多種多様に見出すことができるが、その他は同様の機能を実行し、同等に良く適している。
結果は、3次元セグメンテーションアプローチのそれぞれの有効性は、データセットのそれぞれの異なる種類ごとに異なることを示している。異なるアプローチは、s質的に生産さにもかかわらず最終製品としてimilar 3Dレンダリングは、時間と労力の量が大きく変化セグメンテーションプロセス中に各に費やされる。適切な画像特性とセグメンテーションアプローチごとの個人の目的のための推奨事項は、以下の4つのサブセクションで説明します。図5に要約されている。これらの基準は、 図6の判定のフローチャートに示すように六のデータセットに適用した。 図5および図6は 、単に設定する方法と、基準のそれぞれが意思決定プロセスで重み付けされた各データの論理的根拠を提供することを意図しているが、機能だけでは万全の指導ではなく、出発点を提供しない。意思決定プロセスに影響をあまりにも多くの基準が単にあります。他の人がそのような所望の目的など、より主観的な基準であり、一方でいくつかは、そのようなデータセットの特性などの客観的な基準である。これは、高レフを表示、そのデータ·セットを言うことは安全です鋭い鮮明な境界を有するコントラストのエル、よく分離し、比較的均質な(あまりにも多様ではない)と、多数のオブジェクトのための密度モデルを表示する目的で処理されている機能を持っていないためにも、自動化されたアプローチは、優れていることになる手動のアプローチは、単にリソース(時間)-prohibitiveだろうという事実。コントラストが低い場合には、データがあいまいであるため、専門家の知識を必要とする一方、オブジェクトが混雑しており、特徴は、高い多様性を示し、したがって、不均一であり、人は/手動特徴抽出以外の選択肢を持っていない可能性がありセグメンテーション。
マニュアル抽象モデル生成
マニュアル抽象化されたモデルのトレースは、種子ポイントを自動的に接続することができます(ボール)(スティック)を提供する、線状要素をセグメント化に特に有効である。このようなボールとスティック·モデルは、長さaを測定することは非常に強力なことができますNDこのようなモデルの向きや定性検査と定量分析の両方に適切に抽象化されたモデルを提供する。分析に費やさリソースを最小化する際に一般的に使用されているマニュアル抽象化モデル生成は、元のデータの形状への絶対忠実よりも重要である。これは、興味のある直線的で均質な特徴( 例えば 、フィラメント、チューブ)で最も成功している。データのコントラスト、鮮明さ、および混雑限り、人間の目が対象物を認識できるように、この方法の成功を決定する上で主要な役割を果たさない。時には、このようなモデルはまた、セグメントに骨格骨格の周りのゾーン内の3Dマップとして利用することができる。モデルは抽象的ではなく、正確な密度の反映であるが、それは3D密度のスケルトンバージョンを表し、したがって、すっきり可視化および定性分析が可能になります。そのような長さの定量的測定は、近似モデルから決定することができる。ためにマニュアル抽象化モデル生成とは、ソフトウェアの例は、オンラインでキメラの詳細なユーザガイドをご覧くださいhttp://www.cgl.ucsf.edu/chimera/current/docs/UsersGuide/index.html 。
関心のある特徴の手動トレース
マニュアル絵筆のトレースは、ほとんどすべてのデータ特性とうまく動作しますが、それはまた、メソッド最も時間のかかるです。時には、このような薄くて入り組んだ細胞膜などの機能、多種多様を含む複雑な画像セットから関心のある特徴を抽出するための唯一の手法である。興味のある機能がスムーズに変化したときにいくつかのプログラムで利用可能な一つの有用なツールが断続的にセグメント化されたスライス間の補間を可能にします。データは鮮明な、高コントラスト媒体を有する場合にマニュアルトレースは、最も効率的に適用することができるが、それはまた、利用することができるより挑戦的なデータセットのため、限り、ユーザーが関心のある対象に精通しているよう。データの複雑性は、離散的なオブジェクトからオブジェクトが密集している複雑かつ混雑データセット、の範囲とすることができる。自動アプローチは、多くの場合、セグメントに所望の容積を苦労して過不足を抽出として後者の場合、マニュアルセグメンテーションは、唯一の選択肢かもしれません。そのような畳み込まシートまたはボリュームとして困難な機能形態は、また、この方法によって抽出することができる。ただし、ユーザーが関心のある特徴の高い人口密度のセグメンテーションは時間が法外になるように関心のある特徴の人口密度が低い場合には、いくつかの困難な特性を持つデータセットのみにセグメント化することができるということを覚えておいてください。マニュアルトレースとソフトウェアの例については、オンラインでアミラの詳細なユーザガイドをご覧くださいhttp://www.vsg3d.com/sites/default/files/Amira_Users_Guide.pdf。
自動化された密度に基づくセグメンテーション
手動技術とは対照的に、自動化されたアプローチは、大量の画像スタックをセグメント化する際に考慮すべき重要な要因であり、一般的にあまり時間がかかる。しかし、単純なしきい値処理は、正確でないかもしれない、と多くの時間を自動的にセグメント化されたボリュームの洗練とキュレーションに費やされることがあります。自動化された密度ベースのセグメントは、すべてのセグメント化を必要とする対象の類似した特徴を多数表示するデータセットに最適です。データをより複雑な場合、これらの自動化技術はまだ初期段階としての役割を果たすことができますが、おそらく関心のある特徴を含んでいるサブボリュームを指定するためにラインの下のいくつかの手動操作が必要になります。この戦略は、一般的にリニアな形態や複雑なボリュームに適していますが、それは、次のような細い入り組んシーツめったに成功している細胞膜。高忠実度と引き換えに時間など、いくつかのユーザー·リソースを消費しながら、自動化されたアプローチと最小限のユーザの介入は、大小のボリュームを通じてセグメンテーションを可能にします。自動化された密度ベースのセグメントとソフトウェアの例については、オンラインでアミラの詳細なユーザガイドをご覧くださいhttp://www.vsg3d.com/sites/default/files/Amira_Users_Guide.pdf 。
特注の自動セグメンテーション
カスタマイズされた自動化されたセグメント化は、特定のデータセットに対するアルゴリズムのパワーのカスタマイズを可能にするが、それはしばしば機能特性の限られた数の適切なデータ·セットまたはデータ型に特異的であり、容易に一般化することはできない。ここで紹介手順は、流域の浸漬およびその他のレベルなどの一般的な自動化されたセグメント化のアプローチとは異なりますこれらのシード点から急速マーチングキューブの拡張に続いて重大なシード点のプログラムされた決定に依存しているsetメソッド、、。このテーマに関するバリエーションは、勾配ベクトル情報は、特徴の境界を知らせる境界セグメンテーションである。対照的に、ここで使用されるカスタマイズされたスクリプトは、ユーザーが手動でいくつかの例をトレーストレーニング段階に依存している。機械学習を通じ、特定のアルゴリズムを検出した後、独立して一貫してトレースで見つかったプロパティとデータ特性を認識することを学習します。アルゴリズム再訓練およびより実施例を含むことによってセグメント化の精度を向上させることができる専門家ユーザは、特徴基準の大きいセットを提供するトレース。キュレーションは単にマニュアルトレースなどの労働集約としてされ得るように全体的には、閾値化および関連のアプローチ、さらにはカスタマイズされたアプローチは、細胞小器官や形状の複雑な多様性を有する画像から関心のある単一の特徴を抽出するように有用ではないかもしれない。
">データのトリアージとセグメンテーションアプローチを選択するための戦略
図5に、図4および適切なデータセットの概要で提示主観的および客観的基準を与え、 図6に示す意思決定方式は、データセットの多種多様のための特徴抽出戦略の効果的な評価を支援することができる。データセットは、 図4に導入され4つのそれぞれの目的並びにの4主観的基準のいずれかを含むことができるそれぞれが4つの連続した意思決定にトリアージされている。例として、 図6は、6個のデータのそれぞれをトリアージするため合理的であるセットは、 図3に示す。確かに、そこに単一の固有パスではありませんが、それぞれのデータセットtをつながる可能性があり、意思決定のための異なる基準以下この行列を通してではなく、異なるパスデータ分割のための同じ又は異なる勧告O。すべてのデータセットが期待できない性質の独自のセットを持っていますが、6つの例は、それぞれ、好ましい特徴抽出/セグメンテーションアプローチの背後にある理論的根拠の説明とペアになって、与えられている。また、ほとんど同じまたは異なるセグメント化手法の使用をもたらした( 図6)のいずれか、その代わりの意思決定ルートの提案が含まれています。
運動毛が成功する自動化されたアプローチが可能性が高くなり、明確に定義された境界を有する鮮明なデータセットです。関心のあるすべての機能が十分に再自動化アプローチを好む、分離されている。また、関心のある特徴は、カスタマイズされたセグメンテーションのための比較的均質なデータセット理想的に互いに類似している。最後に、目的は、半自動化されたアプローチを好む、全体の特徴を抽出することであった。結果として、それは自動化された閾値(結論づけられた緑の実線)だけでなく、カスタム設計( 例えば 、監督セグメンテーション、形状)アプローチ(緑色の点線)は、両方のこのデータセットでうまくやって可能性が高い。
同様の基準は、意思決定ネットワーク内の異なる順序で置かれているが、細菌の場合に適用されます。このデータセットが非常に大きいため、カスタマイズされたアプローチは、部分的にはお勧めします。したがって、限られたリソースは、労働集約的な手作業による介入/セグメンテーションアプローチを禁止しています。しきい値は、許容可能な結果が得られているだろうが、カスタム設計のアプローチは、細菌で、間に、または右隣の細菌のいずれかに位置して、細胞外金属堆積物から丸みを帯びた細菌の形状を分離するための研究の主要な目的を実行することができましたので、カスタマイズされたアプローチが好まれた。
不動のデータ·セットの場合、最初の考慮事項は、所望の目的でした。目標は、全体の密度を表示するためにいずれかであることができるまたは幾何学的なモデルを作成します。関心体積は、混雑したエリアで、その目的は、セグメントに続いなどこれは参考になりました長さ、数、距離、方向性、などの定量的な容量分析を実行するために、分離されたオブジェクトなどのオブジェクトが多数であったことのオブジェクト関心は、主に線形であったが、これは選択の方法をトレース幾何学モデルを作った。代わりに、目的は全体の密度を表示するようになっている場合は、線形フィーチャの形態だけでなく、鋭く定義された境界を持つ比較的高いコントラストが自動化された閾値化プロトコルが実現可能になるだろう。
それぞれ、畳み込まれたシートおよびボリューム:細胞膜やミトコンドリアデータケースは、機能形態学の彼らの分類のために自動化されたアプローチに挑戦している。目標は、正確に細胞やミトコンドリアの輪郭をトレースすることですが、そうするための唯一の有限な資源があります。インターを加えて、特徴ESTミトコンドリアデータ用に細菌に要したカスタマイズされたスクリプトのアプローチは、おそらくさらにカスタマイズして適用することができる設定しているが、複雑であり、簡単に、自動的に検出さや形状、エンコードできない。幸いなことに、自分自身だけで、ボリューム全体のごく一部を表しているので、膜およびミトコンドリアは、マニュアルトレースは、時間のかかるアプローチではあるが簡単です。コントラストがかなり低く、境界がむしろあいまいである場合マニュアルトレースはまた、そのようなデータセットのための選択の方法である。これらは、データセットの重要な部分を構成している場合でも、その結果、そのような複雑なシートは手動で簡単によるより良い代替手段がないために、トレースされている必要があります。
目標は、セグメントに密に間隔を置いて混雑した風景を構成するすべてのオブジェクト、であったため、プラントデータセットは、独自の課題を提起した。そのまま密度を表示すると、物体の形状や組織についての測定を可能にするが、Bになるecause手動で各糸状オブジェクトをセグメント化することはあまりにもコストがかかり、自動しきい値処理が代わりに使用した。
3Dモデルを作成する際のさまざまなステップおよび対応する結果がここに表示されているが、より重要なことに、データ特性及びセグメンテーションの最適パスを決定する際に重要であることが見出さパーソナル基準も解明されている。画像データそのものの重要な特徴は、コントラスト、混雑、パリパリ感、および(例えば細胞小器官、フィラメント、膜のような)異なる形状や機能の数としてここに記載されているものが含まれる。セグメンテーションの所望の目的(測定/カウント、データのスケルトン表現/ 3Dレンダリングのボリュームを表示する)が含まれ、考慮すべき主観的な基準は、目的の機能(線形、細長い、ネットワーク化され、複雑な、入り組ん)の形態学的特徴の密度ボリューム全体(であるオブジェクトの割合に関連して関心のある特徴重要かつ抽出する必要がある)と、元のデータと資源の実質的により高い配分のための漸進的な改善をもたらし投資の減少収益セグメンテーションの忠実度に消費するリソースのトレードオフのバランスをとる。
画像分割の分野は大幅に近年成熟した、まだ特効薬、それをすべて行うことができますがないアルゴリズムまたはプログラムが存在しない。データセットのサイズは、ギガバイトのに日常的に数十数百メガバイトから成長してきた、と彼らは今は不可能に近いマニュアルセグメンテーションを行う、テラバイトを超え始めている。したがって、より多くのリソースは、人間の意思決定プロセスを模倣する巧妙な、時間効率の高い特徴抽出手法に投資する必要がある。このような努力は、(2)データ抽象化技術( すなわち 、移行する、(グーグルアースに類似)セマンティック階層データ·ベースをベース(1)地理情報システム(GIS)と組み合わされる必要がありますコンピュータ支援設計(CAD)ソフトウェアは、それらが頻繁に使用されているように、(3)シミュレーション技術、かなりのデータ量を低減し、したがって、より大きなボリューム35の表示を可能にするためにインと互換性の幾何学/体積表現にボクセル)から(ゲーム業界のために開発されたものと同様の)フライスルーアニメーションなどのエンジニアリング分野と同様に、(4)高度なアニメーションや映画制作能力。
明らかに、効率的な特徴抽出及びセグメンテーションは、異なるデータタイプのために採取した細胞の高分解能イメージング中の今度の回転の中心でより良いアプローチが常に必要とされる一方、および、原理は、ここに提示、ならびにどのようなアプローチの例はある、取るために接近する上で決定を行うためのいくつかの貴重な情報を提供する。
開示事項
The authors declare they have no competing financial interests.
謝辞
We would like to acknowledge and thank Tom Goddard at University of California San Francisco for his endless help with Chimera, Joel Mancuso and Chris Booth at Gatan, Inc. for their help with SBF-SEM data collection of bacteria dataset, Doug Wei at Zeiss, Inc. for his help with the FIB-SEM data collection of epithelial cell dataset, Kent McDonald at University of California Berkeley Electron Microscopy Lab for advice on sample preparation, TEM imaging and tomography, Roseann Csencsits at Lawrence Berkeley National Laboratory for her help taking the cryo-TEM image, Elena Bosneaga for cryo-sectioning of the plant dataset, Jocelyn Krey at Oregon Health and Science University for the dissection of utricle tissue, David Skinner at National Energy Research Scientific Computing Center (NERSC) and Jitendra Malik at University of California Berkeley for their advice in software infrastructure, and Pablo Arbelaez at University of California Berkeley for his codes contributions to the custom-tailored script presented in this article.
Research was supported by the U.S. Department of Energy, Office of Science under contract No. DE-AC02-05CH11231 [David Skinner], as well as U.S. National Institutes of Health (NIH) grant No. P01 GM051487 [M.A.] for the inner ear hair cell project and microscopy instrumentation use.
資料
| Name | Company | Catalog Number | Comments |
| Amira | FEI Visualization Sciences Group | http://www.vsg3d.com/amira/overview | |
| Chimera | UCSF | http://www.cgl.ucsf.edu/chimera/ | |
| Fiji/ImageJ | National Institute of Health | http://fiji.sc/Fiji, http://rsbweb.nih.gov/ij/ | |
| IMOD | Boulder Laboratory for 3D Electron Microscopy of Cells | http://bio3d.colorado.edu/imod/ | |
| Photoshop | Adobe | http://www.adobe.com/products/ photoshopfamily.html | |
| MATLAB | MathWorks | http://www.mathworks.com/ | |
| VLFeat | VLFeat | http://www.vlfeat.org/ |
参考文献
- Auer, M. Three-dimensional electron cryo-microscopy as a powerful structural tool in molecular medicine. J Mol Med (Berl). 78 (4), 191-202 (2000).
- Johnson, M. C., Rudolph, F., Dreaden, T. M., Zhao, G., Barry, B. A., Schmidt-Krey, I. Assessing two-dimensional crystallization trials of small membrane proteins for structural biology studies by electron crystallography. Journal of visualized experiments JoVE. (44), e1846(2010).
- Jun, S., Zhao, G., Ning, J., Gibson, G. A., Watkins, S. C., Zhang, P. Correlative microscopy for 3D structural analysis of dynamic interactions. Journal of visualized experiments JoVE. (76), e50386(2013).
- Meng, X., Zhao, G., Zhang, P. Structure of HIV-1 capsid assemblies by cryo-electron microscopy and iterative helical real-space reconstruction. Journal of visualized experiments JoVE. (54), e3041(2011).
- Chen, S., McDowall, A., et al. Electron Cryotomography of Bacterial Cells. Journal of visualized experiments JoVE. (39), e1943(2010).
- Meyerson, J. R., White, T. A., et al. Determination of molecular structures of HIV envelope glycoproteins using cryo-electron tomography and automated sub-tomogram averaging. Journal of visualized experiments JoVE. (58), e2770(2011).
- Lucic, V., Forster, F., Baumeister, W. Structural studies by electron tomography: from cells to molecules. Annu Rev Biochem. 74, 833-865 (2005).
- Bajaj, C., Yu, Z., Auer, M. Volumetric feature extraction and visualization of tomographic molecular imaging. J Struct Biol. 144 (1-2), 132-143 (2003).
- Lin, G., Adiga, U., Olson, K., Guzowski, J. F., Barnes, C. A., Roysam, B. A hybrid 3D watershed algorithm incorporating gradient cues and object models for automatic segmentation of nuclei in confocal image stacks. Cytometry A. 56 (1), 23-36 (2003).
- Volkmann, N. A novel three-dimensional variant of the watershed transform for segmentation of electron density maps. Journal of Structural Biology. 138 (1), 123-129 (2002).
- Rigort, A., Günther, D., et al. Automated segmentation of electron tomograms for a quantitative description of actin filament networks. Journal of structural biology. 177 (1), 135-144 (2012).
- Cremers, D., Rousson, M., Deriche, R. A Review of Statistical Approaches to Level Set Segmentation. Integrating Color, Texture, Motion and Shape. International Journal of Computer Vision. 72 (2), 195-215 (2007).
- Lin, Z., Davis, L. S. Shape-based human detection and segmentation via hierarchical part-template matching. IEEE Trans Pattern Anal Mach Intell. 32 (4), 604-618 (2010).
- Pettersen, E. F., Goddard, T. D., et al. UCSF Chimera--a visualization system for exploratory research and analysis. J Comput Chem. 25 (13), 1605-1612 (2004).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. J Struct Biol. 116 (1), 71-76 (1996).
- Zhang, Q., Bettadapura, R., Bajaj, C. Macromolecular structure modeling from 3D EM using VolRover 2.0. Biopolymers. 97 (9), 709-731 (2012).
- Giannuzzi, L. A., Stevie, F. A. A review of focused ion beam milling techniques for TEM specimen preparation. Micron. 30 (3), 197-204 (1999).
- Heymann, J. A. W., Hayles, M., Gestmann, I., Giannuzzi, L. A., Lich, B., Subramaniam, S. Site-specific 3D imaging of cells and tissues with a dual beam microscope. Journal of structural biology. 155 (1), 63-73 (2006).
- Knott, G., Rosset, S., Cantoni, M. Focussed ion beam milling and scanning electron microscopy of brain tissue. Journal of visualized experiments JoVE. (53), e2588(2011).
- Wirth, R. Focused Ion Beam (FIB) combined with SEM and TEM: Advanced analytical tools for studies of chemical composition, microstructure and crystal structure in geomaterials on a nanometre scale. Chemical Geology. 261 (3-4), 217-229 (2009).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLoS Biol. 2 (11), e329(2004).
- Frangakis, A. S., Hegerl, R. Noise reduction in electron tomographic reconstructions using nonlinear anisotropic diffusion. Journal of structural biology. 135 (3), 239-250 (2001).
- Jiang, W., Baker, M. L., Wu, Q., Bajaj, C., Chiu, W. Applications of a bilateral denoising filter in biological electron microscopy. Journal of Structural Biology. 144 (1), 114-122 (2003).
- Van der Heide, P., Xu, X. P., Marsh, B. J., Hanein, D., Volkmann, N. Efficient automatic noise reduction of electron tomographic reconstructions based on iterative median filtering. Journal of structural biology. 158 (2), 196-204 (2007).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- MathWorks. MATLAB. , (2012).
- Otsu, N. A Threshold Selection Method from Gray-Level Histograms. Systems, Man and Cybernetics, IEEE Transactions on. 9, 62-66 (1979).
- Vedaldi, A., Fulkerson, B. VLFeat: An Open and Portable Library of Computer Vision Algorithms. , (2008).
- Zhu, S. C., Guo, C., Wang, Y., Xu, Z. What are Textons? International Journal of Computer Vision. 62 (1-2), 121-143 (2005).
- Gagnon, L. H., Longo-Guess, C. M., et al. The chloride intracellular channel protein CLIC5 is expressed at high levels in hair cell stereocilia and is essential for normal inner ear function. The Journal of neuroscience the official journal of the Society for Neuroscience. 26 (40), 10188-10198 (2006).
- Briand, P., Petersen, O. W., Van Deurs, B. A new diploid nontumorigenic human breast epithelial cell line isolated and propagated in chemically defined medium. In vitro cellular & developmental biology journal of the Tissue Culture Association. 23 (3), 181-188 (1987).
- Petersen, O. W., Rønnov-Jessen, L., Howlett, A. R., Bissell, M. J. Interaction with basement membrane serves to rapidly distinguish growth and differentiation pattern of normal and malignant human breast epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 89 (19), 9064-9068 (1992).
- Shin, J. B., Krey, J. F., et al. Molecular architecture of the chick vestibular hair bundle. Nature neuroscience. 16 (3), 365-374 (2013).
- Yang, W., Zeng, Z., Max, N., Auer, M., Crivelli, S. Simplified Surface Models of Tubular Bacteria and Cytoskeleta. Journal of Information & Computational Science. 9 (6), 1589-1598 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved