Method Article
リアルタイム細胞外フラックス分析を用いた偏光M1、M2の骨髄由来マクロファージの代謝特性評価
要約
Metabolic reprogramming is a characteristic and prerequisite for M1 and M2 macrophage polarization. This manuscript describes an assay for the measurement of fundamental parameters of glycolysis and mitochondrial function in mouse bone marrow-derived macrophages. This tool can be applied to investigate how particular factors affect the macrophage’s metabolism and phenotype.
要約
Specific metabolic pathways are increasingly being recognized as critical hallmarks of macrophage subsets. While LPS-induced classically activated M1 or M(LPS) macrophages are pro-inflammatory, IL-4 induces alternative macrophage activation and these so-called M2 or M(IL-4) support resolution of inflammation and wound healing. Recent evidence shows the crucial role of metabolic reprogramming in the regulation of M1 and M2 macrophage polarization.
In this manuscript, an extracellular flux analyzer is applied to assess the metabolic characteristics of naive, M1 and M2 polarized mouse bone marrow-derived macrophages. This instrument uses pH and oxygen sensors to measure the extracellular acidification rate (ECAR) and oxygen consumption rate (OCR), which can be related to glycolytic and mitochondrial oxidative metabolism. As such, both glycolysis and mitochondrial oxidative metabolism can be measured in real-time in one single assay.
Using this technique, we demonstrate here that inflammatory M1 macrophages display enhanced glycolytic metabolism and reduced mitochondrial activity. Conversely, anti-inflammatory M2 macrophages show high mitochondrial oxidative phosphorylation (OXPHOS) and are characterized by an enhanced spare respiratory capacity (SRC).
The presented functional assay serves as a framework to investigate how particular cytokines, pharmacological compounds, gene knock outs or other interventions affect the macrophage’s metabolic phenotype and inflammatory status.
概要
マクロファージは事実上すべての疾患において中心的な役割を果たしているが、その表現型を調節する分子メカニズムはまだ完全に解明さではありません。マクロファージは、高い不均一性を表示し、微小環境に応じて異なる表現型1を採用しています。 LPS(+IFNγ)は、古典的に活性化したM1またはM(LPS)マクロファージは炎症を促進し、微生物の脅威2の異なる種類に対して宿主を保護誘発しました。その他には、M1分極を誘発するための刺激として、TNF単独で、または組み合わせてIFNγを使用しています。 IL-4および/ またはIL-13は、代替のマクロファージ活性化を誘導し、これらのM2又はM(IL-4)の細胞は、強力なサプレッサーおよび3進行中の免疫応答のコントローラです。偏マクロファージはLPS活性化のM1マクロファージは強化された解糖4-6に代謝スイッチを受けると細胞代謝の明確な規制を表示します。逆に、強化された脂肪酸酸化(FAO)およびミトコンドリアoxidativEのリン酸化(OXPHOS)は、IL-4によって誘導されるM2マクロファージ7-9に持続的なエネルギーを提供します。したがって、改変された代謝は、それは、適切な偏光および炎症調節のための前提条件は、だけでなく偏マクロファージサブセットの特徴もあります。重要なことには、解糖もしくはOXPHOSの阻害/ FAOは、それぞれ8,10、M1またはM2の活性化を損なうことが実証されています。このように、マクロファージにおける特定の代謝の変化は、その偏光状態および炎症の可能性を評価するためのツールとして適用することができます。
マクロファージの代謝を測定一貫したアッセイは、したがって、薬物、遺伝子ノックダウンするかどうかを予測するために使用することができ、あるいは他の治療は、マクロファージ分極および機能に影響を与えます。この動画では、細胞外フラックス分析器は、ナイーブM1及びM2マクロファージの生体エネルギープロファイルを特徴付けるために使用されます。
この原稿は、測定を可能にする最適化されたプロトコルの詳細を関連するすべての解糖パラメータ(解糖、最大解糖および解糖予備)と1回のアッセイにおけるミトコンドリア機能特性(総呼吸、基底ミトコンドリア呼吸、ATP産生、プロトンリーク、最大呼吸と予備呼吸容量)の。この実験を用いて、生体エネルギーを制御し、「変更」の間で比較することができる(例えば遺伝子は、トランスジェニック過剰発現または薬理学的治療をノックダウン)細胞。
プロトコル
1.培養し、偏光骨髄由来マクロファージ
- 0日目:関心の6-10週齢のマウス(このアッセイにおいてC57BL / 6)から大腿骨と脛骨の骨を分離します。
- 骨から筋肉組織を削除し、氷冷PBSで満たされた9センチメートルペトリ皿に骨を置きます。
- 70%エタノールで満たさ9センチメートルペトリ皿に骨を移し、静かに30秒間プレートを振ります。
- 氷冷滅菌PBSで満たされた新鮮9センチメートルペトリ皿に骨を移します。
- 滅菌はさみで両端の大腿骨と脛骨をカットします。
- 10ミリリットルの注射器と25 Gの針を用いて10ミリリットルの氷冷滅菌PBSで骨をフラッシュします。 50mlのチューブで骨髄を収集します。
- 23Gの針を使用して、新しい50mlチューブに骨髄細胞を転送します。
- 25 G針で、この手順を繰り返します。注:これらのステップは、細胞塊と骨の残留物を除去するために必要とされます。
- 4℃で5分間、300×gで遠心分離します。
- SUPを破棄ernatant、40mlの細胞培養培地(RPMI-1640プラス2mMのL-グルタミン、10%FCS、ペニシリン(100 U / ml)を、ストレプトマイシン(100μg/ ml)および15%濾過L-929細胞中で細胞を再懸濁( ATCC、CCL-1)は、M-CSF(または代わりに10ng / mlの組換えM-CSFの代わりにL-929細胞馴化培地)を含有する培地を-conditioned。
注:L-929細胞馴化培地の発生が早く、このジャーナルで2013年11で詳述されました - 文化37℃、5%CO 2インキュベーター中でプレートあたり20ミリリットルの培地中の2つの15センチメートルペトリ皿(マクロファージは、このプラスチックから離れないので、細胞培養処理プレートを使用していない)内の1つのマウス由来の細胞。
- 20 mlのに古い細胞培養培地を除去することなく、3日目に10 mlの新鮮な細胞培養培地を加えます。
- これを行うと6日目に20ミリリットル新鮮な培養培地で各プレートの古い培地を交換し、非接着細胞も削除されます。
- 8日目:
- 彼らに5メートルをインキュベートすることによって細胞を切り離し37℃での10ml中のクエン酸生理食塩水で(135mMの塩化カリウムを加え、H 2 O中の 15mMのクエン酸ナトリウム、オートクレーブ処理)および10 mlのPBSで洗浄します。セルカウンターを使用して8日目に成熟した骨髄由来マクロファージ(BMDM)をカウントします。
- 目視検査によって、またはフローサイトメトリーによって成熟の形成(のCD11b + F4 / 80 +)BMDMを確認してください。 100μlのPBS中で20分間、PBS中1/100抗CD16 / CD32とのブロック10 5個の細胞を 、室温で抗CD11b-FITC 1/200プラス1/200抗F4 / 80-APC-Cy7のでインキュベート、洗浄フローサイトメトリーによって分析します。
注意:マウス骨髄由来マクロファージを培養する英ら 11によって以前本誌で詳細に掲載されました。
- 100μlの培養培地中の細胞培養マイクロプレートにおいてウェル当たり50,000個の細胞種(最適な細胞数が最適化される必要があります)。バックグラウンド補正のウェル中の細胞(A1、A12、H1、H12)をシードし、これらのウェルに培地のみ(細胞)を入れないでくださいヒント:角αでピペットを保持途中で最も均一な細胞層のための井戸の側を下に試合。
- 細胞を1時間細胞培養フード内で室温で安定するようにします。これも細胞分布を促進し、エッジ効果を減少させます。 37℃、5%CO 2インキュベーター中で、顕微鏡や文化を使用して遵守を監視します。
- めっき後の3時間は、それぞれ、M1またはM2マクロファージを生成するために10ng / mlのLPS、または20 ngの/ mlの組換えマウスIL-4で24時間細胞を刺激します。コントロールとして未処理のナイーブ(M0)マクロファージを含めます。 IL-6のLPS誘導性の分泌を測定することによって、適切なM1とM2マクロファージ偏光を評価し、IL-12、TNF(ELISA)およびIL-4誘発性のアルギナーゼ-1活性および/またはMMR(CD206)およびMGL(CD301)の表面発現先に説明したように3,11(フローサイトメトリー)。
注:この時点で、細胞は、(プレ)とすることができる他の因子を刺激することができる関心またはマクロファージの薬理学的化合物で処置されました。以来、別々のウェル間の変動は潜水艦であるかもしれませんtantial、条件あたり少なくとも4、理想的には6井戸を使用することをお勧めします。
細胞外フラックスアッセイの調製
- 1日アッセイを実行する前に、センサカートリッジを水和:
- 次のユーティリティプレートに逆さまセンサカートリッジを置きます。
- 較正溶液200μlとユーティリティプレートの各ウェルを記入し、較正溶液にセンサーを沈めるユーティリティ板上にセンサカートリッジを下げてください。
- 較正液レベルは非CO 2、37℃のインキュベーターO / Nに沈めセンサーと場所を維持するのに十分な高さを確認してください。
- 以下のようにアッセイの日にアッセイ培地を準備します。
- 37°Cまでのウォーム50ミリリットルXFベース媒体。
- 2 mMの最終濃度を得るために、500μlの200mMのL-グルタミンを追加します。
- 1 N NaOHを用いてpHを7.4に調整し、0.2μmのフィルターで滅菌し、37℃でアッセイ培地を保ちます。
- ゆっくり( 例えば、ELISA、適切なマクロファージの偏光を調べるために)偏マクロファージからの細胞培養培地を除去し、将来の使用のために-20℃で保管してください。 100μlのアッセイ培地で細胞を洗浄し、ウェル当たり180μlのアッセイ培地を追加し、細胞が洗い流されなかった顕微鏡で確認してください。アッセイの実行の前に1時間、CO 2なしで37℃のインキュベーター内で細胞培養プレートを置きます。
- 表1に記載されているように7.4、フィルター滅菌するためにpHを調整、37°C まで暖かく、Dまでの10×注入化合物の混合物Aを準備します。
- 細胞培養ウェル中の10倍の最終濃度で、これらの混合物中のすべての化合物を作成し、各細胞型のためのこれらの濃度を最適化します。
- ポートA、B、CおよびD、respeで調製された10倍噴射化合物混合物の示された容積( 表1)を備えた装填ガイドを使用して、センサカートリッジをロードしますctively。
| 混合/注入 | 化合物 | ボリュームは10倍混合物(μl)を取得するために追加されました | ボリュームアッセイ培地(ミリリットル) | 実行中に注入された容量(μL) | アッセイにおける最終濃度 |
| A | 2.5 M(45%)グルコース | 300 | 2.7 | 20 | 25mMの |
| B | Aオリゴ5ミリ(OM) | 9 | 3.0 | 22 | 1.5μM |
| C言語 | 5 mMのFCCP | 9 | 2.7 | 25 | 1.5μM |
| 100 mMのピルビン酸ナトリウム液 | 300 | 1 mMの | |||
| D | 5 mMのアンチマイシンA(AA) | 15 | 3.0 | 28 | 2.5μM |
| 5mMのロテノン(腐敗) | 7.5 | 1.25μM |
表1注入の混合物が含まれます。
細胞外フラックスアナライザーを使用して偏光M1とM2 BMDMの3生体エネルギー特性評価
- 2分のMIXと測定時間と(少なくとも)3ミックスと速度の測定は4回の注射( 表1)のそれぞれの前に、最後の注射後にループ3分で分析ウィザードを使用して分析テンプレートを作成します。
注:これらの濃度は、骨髄由来マクロファージおよびRAW264.7マクロファージ細胞株に対して有効であるが、各細胞型のために最適化されるべきです。 FCCP混合物中のピルビン酸を追加すると、最大の呼吸を燃料に必要とされています。 - スタート底を押して実行を開始し、装置の指示に従ってください。最初の車をロード水和プローブとtridgeプレートが装置と次のロードセルプレートによりキャリブレーションを可能にします。
- 分析した後、慎重にすべてのアッセイ培地を廃棄し、供給者により詳細に記載されるように、細胞増殖アッセイキットを用いて、将来のセルの正規化のために-20℃で分析した細胞培養マイクロプレートを格納します。
- 簡単に説明すると、蒸留水に成分B 20倍に希釈し、1×細胞溶解緩衝液を調製し、化合物を1×細胞溶解緩衝液で400倍に希釈します。 、ウェルあたり200μlを添加し、室温で5分間インキュベートし、〜180 nm励起と〜520 nmの発光極大を持つ蛍光を測定します。
注:非接着細胞を操作する場合、または乏しい密着性が懸念される場合に、このプロトコルは、全てのアッセイ培地を捨てる必要がないので、直接の細胞増殖キットは、代替として使用することができます。しかし、この直接のプロトコルは、このラボで使用されるプロトコルに比べてわずかにあまり敏感ではありません。
- 簡単に説明すると、蒸留水に成分B 20倍に希釈し、1×細胞溶解緩衝液を調製し、化合物を1×細胞溶解緩衝液で400倍に希釈します。 、ウェルあたり200μlを添加し、室温で5分間インキュベートし、〜180 nm励起と〜520 nmの発光極大を持つ蛍光を測定します。
- 蛍光測定した後、正規化それぞれのセルの数だけでなく、全てのナイーブなマクロファージのウェルの平均細胞数が1に設定された比率。
注:(たとえば、BCAアッセイを用いて)タンパク質定量は、細胞数を正規化するための代替方法として使用することができます。しかし、私たちの手で、このアッセイは、細胞増殖アッセイキットに比べて感度が低いでした。
結果
細胞外フラックスアッセイおよび細胞定量化の終了後、データは、細胞計数のために正規化し、分析することができます。 図1Aおよび図1Bに示すように、これは、典型的にはECARとOCRのプロットが得られます。
グルコース(A)の注入後、ECARの増加は、解糖速度を表します。オリゴマイシン(B)とATP合成酵素阻害後のECARで追加の増加は、解糖予備と容量( 図1A)に関する情報を提供します。 OCR値を分析する場合、注射(B)オリゴミトコンドリアのATP合成に使用される酸素消費量の計算を可能にします。 FCCP(C)は、ミトコンドリア呼吸の脱共役と対応するOCR測定は、最大のスペア呼吸能力に関するデータが得られます。最後に、ロテノンの注射(腐敗)及びアンチマイシンA(AA)ブロックミトコンドリア複合体IおよびIIIと残留OCRは、非ミトコンドリア酸素短所を表し、umption( 図1B)。
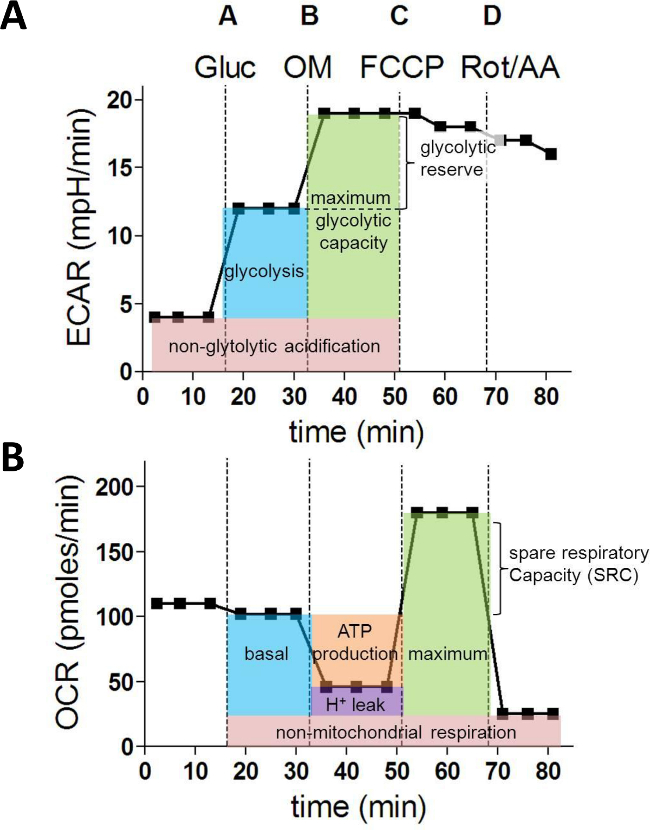
図1:XF細胞外フラックスアッセイ由来代謝パラメータ 。解糖、最大解糖能力と解糖リザーブ:携帯解糖の(A)以下のパラメータは(MPH /分で)ECAR値から計算されます。基礎呼吸、ATP産生、プロトンリーク、最大呼吸スペア呼吸容量:(ピコモル/分で)(B)のOCR測定は、ミトコンドリア機能の次の基本的なパラメータを計算するために使用されます。 Glucを=グルコース; OM =オリゴマイシンA; FCCP =カルボニルシアン化4-(トリフルオロメトキシ)フェニルヒドラゾン; AA =アンチマイシンA;腐敗=ロテノンは、 この図の拡大版をご覧になるにはこちらをクリックしてください。
実行した後、ECARとOCR測定1 TIL各ウェルについてのL 15は、Excelにエクスポートすることができ、次のように次のような解糖系のパラメータはECARの測定値から計算することができます。
非解糖酸性化=平均。 ECAR(1,2,3)
解糖=平均。 ECAR(4,5,6) -平均。 ECAR(1,2,3)
最大解糖容量=平均。 ECAR(7,8,9) -平均。 ECAR(1,2,3)
解糖準備金は、平均を=。 ECAR(7,8,9) -平均。 ECAR(4,5,6)
OCR率から、次代謝特性を決定することができます。
非ミトコンドリア呼吸=平均。 OCR(13,14,15)
基礎呼吸=平均。 OCR(4,5,6) -平均。 OCR(13,14,15)
ATP産生=平均。 OCR(4,5,6) -平均。 OCR(7,8,9)
プロトンリーク=平均OCR(7,8,9) -平均。 OCR(13,14,15)
最大呼吸=平均。 OCR(10,11,12) -平均。 OCR(13,14,15)
スペア呼吸容量(SRC)=平均OCR(10,11,12) -平均。 OCR(4,5,6)
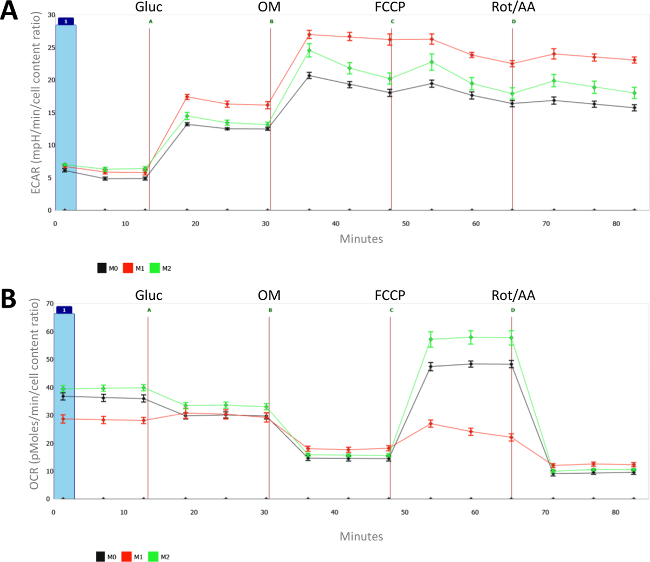
図2:代謝ナイーブ(M0)の特性、LPS-(M1)およびIL-4(M2)偏マクロファージ各測定のために、平均および8個々のウェルの平均(SEM)の標準誤差が示されています。 (A)は、細胞外酸性化速度(MPH /分でECAR、)と(B)と酸素消費率は(OCR、ピコモル/分で)示差偏光(M1とM2)とナイーブマクロファージ(M0)を測定します。全ての測定は、細胞計数のために正規化した(をCyQuantで測定される)およびナイーブなマクロファージの平均細胞数は1に設定しました。ジェクションA =グルコース; B =オリゴマイシン; C = FCCP。 DはアンチマイシンA +ロテノンを=。 この図の拡大版をご覧になるにはこちらをクリックしてください。
図2Aに示すように、LPSによるマクロファージの活性化を増加解糖代謝を誘導します。 図2Bの酸素消費率(OCR)を見たときのLPSおよびIL-4で処理したマクロファージとの間の差異はより一層明らかです。最大酸化的代謝は、高度にM(LPS)に抑えつつ実際に、IL-4は、M2マクロファージに基礎、特に最大呼吸を誘導します。一つは、増加した解糖をM(LPS)マクロファージにかなり独特であり、M(IFNγ)マクロファージは解糖を向上させる表示されませんので、必ずM1マクロファージの特徴ではないことに注意してください。
全体的に、この細胞外フラックス解析は股関節を実証LPS活性化マクロファージの表示が解糖代謝を強化し、任意の予備の呼吸能力を持たない一方で、TのIL-4誘発性のM2マクロファージは、強化された酸化的代謝、特に高い予備呼吸容量(SRC)によって特徴付けられます。
ディスカッション
我々の研究室の目的は、アテローム性動脈硬化症および他の炎症状態12の結果を改善するための究極の目標に影響を与えることができる方法をマクロファージ偏光と機能を理解することです。マクロファージの偏光を評価するためには、典型的には、ELISAにより(IL-6、IL-12、TNFおよびNO分泌を決定し、M1とM2のマーカー遺伝子のLPS(+IFNγ)誘導及びIL-4誘導性の遺伝子発現(定量PCR)を測定そして、グリース反応)およびフローサイトメトリーによるIL-4によって誘導されるCD71、CD206、CD273およびCD301表面発現()およびアルギナーゼ活性3,13を調べます。さらに、(DII-oxLDLの取り込み、LipidTOX中性脂質染色による)アポトーシスアッセイ(アネキシンV / PI染色によって)(蛍光ラテックスビーズ、および/ またはpHrodo 大腸菌を含む)、食作用アッセイおよび泡沫細胞形成アッセイを行うことができますマクロファージの機能14を評価します 。さらに、細胞外フラックス分析は、偏光MACの生体エネルギープロファイルを測定するために行うことができます新しい代替機能読み出しとしてrophages。
この原稿は、マクロファージの偏光が、エネルギー源として増加した解糖への切り替えLPS誘導マクロファージと代謝リプログラミングを誘導することを示しています。逆に、IL-4によって誘導されるM2マクロファージは、ATPの主な情報源としてミトコンドリアの酸化的リン酸化を使用しています。重要なことは、代謝再プログラミングは、M1とM2偏マクロファージの特定の要件のためのエネルギーを提供するだけでなく。実際、代謝の変化は、マクロファージの表現型10,15,16の直接的な調節因子である代謝物の濃度に影響を与えます。したがって、マクロファージ代謝が(ここでは、図2に示すように)の特性だけでなく、明確なマクロファージの偏光状態のドライバだけではなく、この新しい知識は、年の最後のカップルの間にimmunometabolismの研究分野の急速な成長をサポートしていました。
ただし、マクロ内の代謝プロファイルの強固な測定ファージは困難残り、その制限がありました。本研究では、細胞外フラックスアナライザーは堅牢にリアルタイムで解糖、解糖リザーブ、最大解糖能力、非解糖の酸性化、基礎および最大呼吸、ATP産生、予備の呼吸容量、プロトンリークと非ミトコンドリア呼吸を測定するために適用されますマクロファージの最小限の量で存在します。
したがって、我々は次のように変更して、製造業者のプロトコルを改善しました。標準水戸ストレステスト(#103015から100)は、グルコースおよびピルビン酸と3回の注射(OM、FCCP、AA /腐敗)とプロトコルを含む培地を使用することを示唆しています。私たちはこのように、グルコース/ピルビン酸を含まない培地でアッセイを開始する(解糖ストレステスト#103020から100のように)ポートAの最初の注射としてグルコースを追加し、ポートCのFCCPの脱共役剤と一緒にピルビン酸を追加することを選びます、関連するすべての解糖パラメータはECARの測定1-9とmitochondriに関するすべての関連情報から導出されていますOCRの測定4-15からアル機能。
それは脱共役時に最大の呼吸を燃料にFCCPと一緒にピルビン酸を注入することが重要であることに注意してください。この組み合わされたプロトコルを使用する前に、1つはまた、2-デオキシ-D-グルコース(2-DG)は、基底値(1-3)に分析した後、ECARレベルを低下させることを確認する必要がありますし、記録ECAR率4-6は確かに起因していること解糖へ。さらに、一本原稿に使用される化合物の濃度および細胞数は、骨髄由来マクロファージおよびRAW264.7マクロファージ細胞株に対して有効であり、他の細胞型のために最適化されるべきであることを理解すべきです。また、人は、骨髄由来マクロファージを生成するために使用されるM-CSFは、M2のような抗炎症性の表現型を促進することに注意すべきです。骨髄由来マクロファージから提示された結果は、したがって、細胞culturi中にM-CSFを必要としない一次組織の常在マクロファージまたはマクロファージ細胞株を用いた測定に完全に匹敵しなくてもよいですNG。
既存の方法と比較して、このプロトコルは、マクロファージの最小量を必要とし、すぐに実質的にすべての基本的な代謝細胞特性を提供します。これは、他の免疫学的アッセイを行うために十分な余剰細胞をもたらし、生体エネルギープロファイリングに使用しても、細胞はまだ検定後に目的と他のに使用することができます。また、特定の96ウェルプレートフォーマットを同時にリアルタイムで複数の条件を評価することができます。しかし、個々のウェル間の変動はかなりすることができ、したがって、条件当たり少なくとも4つのウェルを使用することがしばしば望まれます。アカウントにこの制限を考慮すると、説明した細胞外フラックス解析は、まだ伝統的な技法よりもはるかにある、10以上の実験条件(N = 6)を1回で実行することができます。
全体的に、この記事では、関連するすべての解糖およびミトコンドリアのparamを測定することができ、簡単かつ再現性のある機能的アッセイを提供します偏マクロファージサブセットにおけるメータ。この手法は、マクロファージの(代謝)の表現型に(例えば、遺伝子ノックダウン、新しい医薬品、)マクロファージ機能を評価し、個別の操作の効果を評価するために、将来のアプリケーションとして提供することができます。このように、細胞外フラックスデータは、マクロファージの活性化状態の詳細な特徴付けを可能にするために他のアッセイと組み合わせて使用することができます。
開示事項
この記事への無料アクセスがシーホース・バイオサイエンスが主催しています。
謝辞
Jan Van den Bossche received a Junior Postdoc grant from the Netherlands Heart Foundation (2013T003) and a VENI grant from ZonMW (91615052). Menno de Winther is an Established Investigator of the Netherlands Heart Foundation (2007T067), is supported by a Netherlands Heart Foundation grant (2010B022) and holds an AMC-fellowship. We also acknowledge the support from the Netherlands Cardiovascular Research Initiative, Dutch Federation of University Medical Centers, the Netherlands Organization for Health Research and Development and the Royal Netherlands Academy of Sciences for the GENIUS project “Generating the best evidence-based pharmaceutical targets for atherosclerosis” (CVON2011-19). We acknowledge Seahorse Bioscience for making open access publication possible. The authors thank Riekelt Houtkooper and Vincent de Boer (Laboratory Genetic Metabolic Diseases, Academic Medical Center, Amsterdam, The Netherlands) for all previous assistance with the Seahorse analyzer.
資料
| Name | Company | Catalog Number | Comments |
| 23G and 25G needles | Becton Dickinson | #300800 and #300600 | To flushed bone marrow |
| 10 ml syringes | Becton Dickinson | #307736 | To flushed bone marrow |
| Petri dishes | Greiner | #639161 | To culture bone marrow cells |
| CyQUANT Cell Proliferation Assay kit | Molecular Probes | #C7026 | For cell quantification at a later time point (works only for adherent cells) |
| CyQUANT Direct Cell Proliferation Assay kit | Molecular Probes | #35011 | For cell quantification immediately after assay (non-adherent cells) |
| XFe96 cell culture microplate | Seahorse Bioscience | #101085-004 | 96 well plate in which cells are cultured and in which assay is done |
| recombinant mouse interleukin-4 (IL-4) | Peprotech | #214-14-B | Used to induced alternative macrophage activation |
| lipopolysaccharide (LPS) | Sigma | #L2637 | Pro-inflammatory stimulus |
| Seahorse Sensor Cartridge | Seahorse Bioscience | #102416-100 | Contains the probes for pH and O2 measurement |
| Seahorse XF Calibrant | Seahorse Bioscience | #100840-000 | Needed to hydrate the probes overnight |
| XF base medium | Seahorse Bioscience | #102353-100 | Buffer-free medium that allows efficient measurement of pH changes |
| L-glutamine | Life Technologies | #25030-081 | |
| D-(+)-Glucose | Sigma | #G8769 | Fuels glycolysis once added to the cells |
| oligomycin A | Sigma | #75351 | Inhibits mitochondrial ATP synthase |
| FCCP( Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone) | Sigma | #C2920 | Uncouples mitochondrial respiration |
| 100 mM Sodium Pyruvate solution | Lonza | #BE13-115E | Allows maximal mitochondrial respiration without the need for glycolysis |
| Antimycin A | Sigma | #BE13-115EA8674 | Inhibits complex III of the mitochondria |
| Rotenone | Sigma | #BE13-115EA8674R8875 | Inhibits complex I of the mitochondria |
| Casy Cell Counter | Roche Diagnostics | #05 651 697 001 | Instrument to count cells |
| anti-CD16/CD32 | eBioscience | #14-0161 | Fc receptor block flow cytometry |
| anti-F4/80-APC-eFluor780 | eBioscience | #47-4801 | Antibody to stain macrophages |
| anti-CD11b-FITC | eBioscience | #11-0112 | Antibody to stain macrophages |
参考文献
- Murray, P. J., et al. Macrophage activation and polarization: nomenclature and experimental guidelines. Immunity. 41, 14-20 (2014).
- Hoeksema, M. A., et al. IFN gamma Priming of Macrophages Represses a Part of the Inflammatory Program and Attenuates Neutrophil Recruitment. J Immunol. , (2015).
- Vanden Bossche, J., et al. Pivotal Advance Arginase 1 independent polyamine production stimulates the expression of IL 4 induced alternatively activated macrophage markers while inhibiting LPS-induced expression of inflammatory genes. Journal of leukocyte biology. 91, 685-699 (2012).
- Pearce, E. L., Pearce, E. J. Metabolic pathways in immune cell activation and quiescence. Immunity. 38, 633-643 (2013).
- Yang, L., et al. PKM2 regulates the Warburg effect and promotes HMGB1 release in sepsis. Nature communications. 5, 4436(2014).
- Freemerman, A. J., et al. Metabolic reprogramming of macrophages glucose transporter 1 (GLUT1) mediated glucose metabolism drives a proinflammatory phenotype. The Journal of biological chemistry. 289, 7884-7896 (2014).
- Tavakoli, S., Zamora, D., Ullevig, S., Asmis, R. Bioenergetic profiles diverge during macrophage polarization implications for the interpretation of 18F FDG PET imaging of atherosclerosis. J Nucl Med. 54, 1661-1667 (2013).
- Vats, D., et al. Oxidative metabolism and PGC 1beta attenuate macrophage mediated inflammation. Cell metabolism. 4, 13-24 (2006).
- Huang, S. C., et al. Cell intrinsic lysosomal lipolysis is essential for alternative activation of macrophages. Nature immunology. 15, 846-855 (2014).
- Tannahill, G. M., et al. Succinate is an inflammatory signal that induces IL 1beta through HIF 1alpha. Nature. 496, 238-242 (2013).
- Ying, W., Cheruku, P. S., Bazer, F. W., Safe, S. H., Zhou, B. Investigation of macrophage polarization using bone marrow derived macrophages. J Vis Exp. (76), (2013).
- Hoeksema, M. A., et al. Targeting macrophage Histone deacetylase 3 stabilizes atherosclerotic lesions. EMBO Mol Med. 6, 1124-1132 (2014).
- Vanden Bossche, J., et al. Alternatively activated macrophages engage in homotypic and heterotypic interactions through IL 4 and polyamine induced E cadherin catenin complexes. Blood. 114, 4664-4674 (2009).
- Van den Bossche, J., et al. Inhibiting epigenetic enzymes to improve atherogenic macrophage functions. Biochem Biophys Res Commun. 455, 396-402 (2014).
- Galvan Pena, S., O Neill, L. A. Metabolic reprograming in macrophage polarization. Frontiers in immunology. 5, 420(2014).
- Zhu, L., Zhao, Q., Yang, T., Ding, W., Zhao, Y. Cellular metabolism and macrophage functional polarization. International reviews of immunology. 34, 82-100 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved