Method Article
Caractérisation métabolique des polarisée M1 et M2 macrophages dérivées de moelle osseuse Utilisation en temps réel Analyse extracellulaire Flux
Dans cet article
Résumé
Metabolic reprogramming is a characteristic and prerequisite for M1 and M2 macrophage polarization. This manuscript describes an assay for the measurement of fundamental parameters of glycolysis and mitochondrial function in mouse bone marrow-derived macrophages. This tool can be applied to investigate how particular factors affect the macrophage’s metabolism and phenotype.
Résumé
Specific metabolic pathways are increasingly being recognized as critical hallmarks of macrophage subsets. While LPS-induced classically activated M1 or M(LPS) macrophages are pro-inflammatory, IL-4 induces alternative macrophage activation and these so-called M2 or M(IL-4) support resolution of inflammation and wound healing. Recent evidence shows the crucial role of metabolic reprogramming in the regulation of M1 and M2 macrophage polarization.
In this manuscript, an extracellular flux analyzer is applied to assess the metabolic characteristics of naive, M1 and M2 polarized mouse bone marrow-derived macrophages. This instrument uses pH and oxygen sensors to measure the extracellular acidification rate (ECAR) and oxygen consumption rate (OCR), which can be related to glycolytic and mitochondrial oxidative metabolism. As such, both glycolysis and mitochondrial oxidative metabolism can be measured in real-time in one single assay.
Using this technique, we demonstrate here that inflammatory M1 macrophages display enhanced glycolytic metabolism and reduced mitochondrial activity. Conversely, anti-inflammatory M2 macrophages show high mitochondrial oxidative phosphorylation (OXPHOS) and are characterized by an enhanced spare respiratory capacity (SRC).
The presented functional assay serves as a framework to investigate how particular cytokines, pharmacological compounds, gene knock outs or other interventions affect the macrophage’s metabolic phenotype and inflammatory status.
Introduction
Alors que les macrophages jouent un rôle central dans pratiquement toutes les maladies, les mécanismes moléculaires qui régulent leur phénotype ne sont pas encore entièrement démêlé. Les macrophages présentent une forte hétérogénéité et en réponse à la micro-environnement 1 adoptent différents phénotypes. LPS (+ IFN-y) induite par les macrophages activés classique M1 ou M (LPS) favorisent l'inflammation et protègent l'hôte contre différents types de menaces microbiennes 2. D'autres utilisent IFNy seul ou en combinaison avec le TNF comme stimuli pour provoquer une polarisation M1. IL-4 et / ou IL-13 induit l'activation des macrophages et ces alternatif M2 ou M (IL-4) sont des cellules suppresseurs et les contrôleurs de réponses immunitaires en cours 3 puissants. Macrophages polarisées affichent un règlement distinct du métabolisme cellulaire avec les macrophages M1 LPS-activés subir un commutateur métabolique à l'amélioration de la glycolyse 4-6. Oxydation Inversement, amélioré l'acide gras (FAO) et oxidativ mitochondriale phosphorylation (OXPHOS) fournit de l'énergie durable dans les macrophages M2 IL-4-induites 7-9. Ainsi, une modification du métabolisme est non seulement une caractéristique de sous-ensembles macrophages polarisés, il est également une condition préalable pour la polarisation appropriée et la réglementation inflammatoire. Surtout, l'inhibition de la glycolyse ou OXPHOS / FAO a été démontré à porter atteinte à l'activation M1 ou M2, respectivement 8,10. En tant que tel, l'identification des changements métaboliques dans les macrophages pourraient être appliquées comme un outil pour évaluer leur état de polarisation et le potentiel inflammatoire.
Un essai qui mesure conforme métabolisme des macrophages pourrait donc être utilisée pour prédire si un médicament, gène abattre ou d'un autre traitement affecte la polarisation et de la fonction des macrophages. Dans cette vidéo, un analyseur de flux extracellulaire est utilisé pour caractériser les profils de bioénergétiques, les macrophages M1 et M2 naïfs.
Ce manuscrit détaille un protocole optimisé qui permet la mesurede tous les paramètres pertinents de la glycolyse (de la glycolyse, la glycolyse maximale et de réserve de la glycolyse) et les caractéristiques de la fonction mitochondriale (de la respiration totale, la respiration mitochondriale basale, la production d'ATP, fuite de protons, respiration maximale et la capacité respiratoire de secours) en un seul essai. L'utilisation de ce dispositif expérimental, bioénergétique peuvent être comparées entre le contrôle et «altéré» (par exemple gène abattre, la surexpression transgénique ou traitement pharmacologique) cellules.
Protocole
1. Les macrophages en culture et de polarisation dérivées de moelle osseuse
- Jour 0: fémur et le tibia Isoler os de 6-10 semaine souris âgées d'intérêt (C57BL / 6 dans cet essai).
- Retirer le tissu musculaire à partir des os et placez-les dans un os 9 cm boîte de Pétri remplie de PBS glacé.
- Transférer les os dans un plat de 9 cm de Pétri remplie avec 70% d'éthanol et secouez doucement la plaque pendant 30 sec.
- Transférer les os à une nouvelle boîte de Pétri de 9 cm rempli de glace-froid PBS stérile.
- Couper le fémur et le tibia aux deux extrémités avec des ciseaux stériles.
- Rincer les os avec 10 ml glacé PBS stérile en utilisant une seringue de 10 ml et d'une aiguille G 25. Recueillir la moelle osseuse dans un tube de 50 ml.
- Transférer les cellules de la moelle osseuse à un nouveau tube de 50 ml en utilisant une aiguille 23 G.
- Répétez cette étape avec une aiguille 25 G. Remarque: Ces étapes sont nécessaires pour éliminer les amas de cellules et résidus osseux.
- Centrifugeuse à 300 g pendant 5 min à 4 ° C.
- Jeter le supernatant et remettre en suspension les cellules dans un milieu de 40 ml de cellules de culture (RPMI-1640 plus 2 mM de L-glutamine, 10% de FCS, de la pénicilline (100 U / ml), streptomycine (100 ug / ml) et 15% filtré L-929 cellules ( ATCC, CCL-1) moyen Climatisé contenant M-CSF (ou encore 10 ml de M-CSF ng / recombinant à la place de la L-929 milieu conditionné de cellules).
Remarque: La génération de L-929 milieu conditionné de cellules a été détaillé précédemment dans ce journal en 2013. 11 - Culture des cellules provenant d'une souris à deux 15 cm des boîtes de Pétri (ne pas utiliser des plaques de culture traitée cellulaires depuis macrophages ne se détache pas de cette plastique) dans 20 ml de milieu de culture par plaque dans un 37 ° C, 5% de CO 2 incubateur.
- Ajouter 10 ml de milieu de culture cellulaire frais au jour 3, sans avoir à retirer les 20 ml de milieu de culture cellulaire âgée.
- Remplacer l'ancien milieu de chaque plaque avec 20 ml fraîche milieu de culture le jour 6. Faire cela, les cellules non-adhérentes seront également supprimés.
- Jour 8:
- Détacher les cellules en les incubant 5 mdans à 37 ° C dans 10 ml de solution saline de citrate (135 mM de chlorure de potassium ainsi que le citrate de sodium 15 mM dans H 2 O, à l'autoclave) et on lave avec 10 ml de PBS. Comptez macrophages osseuses matures dérivées de la moelle (BMDM) le jour 8 en utilisant un compteur de cellules.
- Vérifiez la formation de maturité (CD11b + F4 / 80 +) BMDM par inspection visuelle ou par cytométrie de flux. Bloc 10 5 cellules avec 1/100 anti-CD16 / CD32 dans du PBS pendant 20 min dans 100 pi de PBS, incuber avec anti-CD11b 1/200-FITC 1/200, plus anti-F4 / 80-APC-Cy7 à la température ambiante, lavage et analyser par cytométrie de flux.
Remarque: les macrophages dérivés de la moelle osseuse de souris La culture a été publiée en détail plus tôt dans ce journal par Ying et al 11..
- Seed 50.000 cellules (nombre de cellules optimales doivent être optimisés) par puits dans une microplaque de culture cellulaire dans un milieu de culture de 100 ul. Ne pas ensemencer les cellules dans des puits de correction de fond (A1, A12, H1, H12) et de mettre le milieu seulement (pas de cellules) dans ces puits. Astuce: Maintenez la pipette à un angle uncombat à mi-chemin du côté des puits pour la couche cellulaire la plus homogène.
- Permettre aux cellules de se déposer à la température ambiante dans une hotte de culture cellulaire pendant 1 heure. Cela permettra de promouvoir encore la distribution de cellules et de réduire les effets de bord. Surveiller le respect à l'aide d'un microscope et de la culture dans un 37 ° C, 5% de CO 2 incubateur.
- Trois heures après l'étalement, stimuler les cellules pendant 24 heures avec 10 ng / ml de LPS, ou 20 ng / ml de souris recombinant IL-4 pour générer macrophages M1 ou M2, respectivement. Inclure non traités macrophages naïfs (M0) comme témoin. Évaluer approprié M1 et M2 des macrophages polarisation en mesurant induite par le LPS sécrétion d'IL-6, IL-12, TNF (ELISA) et d'IL-4 induit arginase-1 l'activité et / ou MMR (CD206) et MGL (CD301) l'expression de surface (cytométrie de flux) comme décrit précédemment 3,11.
Remarque: À ce stade, les cellules peuvent être (pré) a traité des composés pharmacologiques avec des intérêts ou des macrophages peut être stimulée avec d'autres facteurs. Depuis, la variation entre les puits distincts pourrait être sous-marinstantial, il est conseillé d'utiliser au moins 4 et, idéalement, 6 puits par condition.
2. Préparation de la Composition extracellulaire Flux
- Hydrater la cartouche du capteur un jour avant l'exécution de l'essai:
- Placer la cartouche du capteur à l'envers côté de la plaque de secteur.
- Remplir chaque puits de la plaque d'utilité avec 200 ul de solution d'étalonnage et d'abaisser la cartouche de capteur sur la plaque d'utilité submergeant les capteurs dans la solution d'étalonnage.
- Vérifiez le niveau de la solution de calibration est assez élevée pour maintenir les capteurs immergés et les placer dans un non-CO 2 37 ° C incubateur O / N.
- Préparer milieu d'essai le jour de l'essai comme suit:
- Chaud moyen de 50 ml de base XF à 37 ° C.
- Ajouter 500 pl 200 mM de L-glutamine pour obtenir une concentration finale 2 mM.
- Ajuster le pH à 7,4 en utilisant du NaOH 1 N et stériliser avec un filtre de 0,2 uM et maintenir le milieu d'essai à 37 ° C.
- Retirez délicatement le milieu de culture cellulaire à partir des macrophages polarisés et le stocker à -20 ° C pour une utilisation ultérieure (par exemple ELISA pour examiner la polarisation des macrophages bon). Laver les cellules avec un milieu de dosage de 100 pi, ajouter 180 milieu d'essai par puits et de vérifier sous le microscope que les cellules ne sont pas emportés. Placer la plaque de culture de cellules dans un incubateur à 37 ° C sans CO 2 pendant 1 heure avant la série de tests.
- Préparez 10 x composé d'injection mélanges A jusqu'à D comme décrit dans le tableau 1, chaud à 37 ° C, ajuster le pH à 7,4 et stériliser par filtration.
- Ajouter tous les composés dans ces mélanges à 10 fois la concentration finale dans les puits de culture cellulaire et d'optimiser ces concentrations pour chaque type de cellule.
- Chargez la cartouche du capteur en utilisant les guides de chargement prévues avec des volumes indiqués (tableau 1) de la préparés 10x mélanges de composés d'injection dans les ports A, B, C et D, respectively.
| Mélange / Injection | Composés | Volume ajouté pour obtenir 10x mélange (ul) | Volume milieu de dosage (ml) | Volume injecté pendant l'exécution (ul) | La concentration finale dans l'essai |
| UN | 2,5 M (45%) glucose | 300 | 2.7 | 20 | 25 mM |
| B | 5 mM oligomycine A (OM) | 9 | 3.0 | 22 | 1,5 pM |
| C | MM FCCP 5 | 9 | 2.7 | 25 | 1,5 pM |
| Solution 100 mM de pyruvate de sodium | 300 | 1 mM | |||
| ré | 5 mM antimycine A (AA) | 15 | 3.0 | 28 | 2,5 pM |
| MM roténone 5 (Rot) | 7.5 | 1,25 uM |
Tableau 1. mélanges d'injection.
3. Caractérisation de la bioénergétique polarisée M1 et M2 BMDM l'aide d'un analyseur de Flux extracellulaire
- Créer un modèle de test avec l'assistant de dosage avec 2 minutes et 3 fois MIX minutes de mesurer et (au moins) 3 mix et de taux mesures boucles avant chacun des 4 injections (tableau 1) et après la dernière injection.
Note: Ces concentrations sont valables pour les macrophages dérivés de la moelle osseuse et de cellules RAW264.7 macrophages lignes, mais doivent être optimisées pour chaque type de cellule. Ajout de pyruvate dans le mélange FCCP est nécessaire pour alimenter la respiration maximale. - Démarrez la course en appuyant sur le bas de début et de suivre les instructions de l'appareil. Première charge la voitureplaque cartouche avec les sondes hydratés pour permettre la calibration par l'appareil et la charge prochaine de la plaque de cellule.
- Après l'essai, jeter soigneusement tout milieu de test et mémoriser la culture cellulaire analysé microplaque à -20 ° C pendant avenir normalisation de cellules en utilisant le kit de dosage de la prolifération des cellules comme décrit en détail par le fournisseur.
- En bref, préparer un tampon de lyse cellulaire par dilution 1x composant B 20 fois dans de l'eau distillée et diluer le composé A 400 fois dans le tampon de lyse cellulaire 1x. Ajouter 200 pi par puits, incuber 5 min à température ambiante et mesurer la fluorescence avec ~ 180 nm excitation et ~ 520 nm des maxima d'émission.
Remarque: Lorsque vous travaillez avec des cellules non adhérentes ou si une mauvaise observance est un sujet de préoccupation, le kit de prolifération cellulaire directe peut être utilisé comme une alternative puisque ce protocole ne nécessite pas de se défaire de toute milieu de dosage. Pourtant, ce protocole directe est légèrement moins sensible par rapport au protocole utilisé dans ce laboratoire.
- En bref, préparer un tampon de lyse cellulaire par dilution 1x composant B 20 fois dans de l'eau distillée et diluer le composé A 400 fois dans le tampon de lyse cellulaire 1x. Ajouter 200 pi par puits, incuber 5 min à température ambiante et mesurer la fluorescence avec ~ 180 nm excitation et ~ 520 nm des maxima d'émission.
- Après la mesure de la fluorescence, de normaliserle nombre de cellules dans chaque puits comme un rapport dans lequel la numération cellulaire moyenne de tous les puits de macrophages naïfs est fixé à 1.
Remarque: la quantification des protéines (par exemple en utilisant un dosage BCA) pourrait être utilisé comme une alternative à normaliser comptages de cellules. Cependant, dans nos mains ce dosage était moins sensible par rapport à la trousse de dosage de la prolifération cellulaire.
Résultats
Après avoir terminé l'essai et la cellule de flux quantification extracellulaire, les données peuvent être normalisées par le nombre de cellules et analysés. Cela donne habituellement ECAR OCR parcelles et comme représenté sur la figure 1A et la figure 1B.
Après l'injection de glucose (A), l'augmentation de la ECAR représente le taux de glycolyse. L'augmentation supplémentaire ECAR après inhibition de l'ATP synthase avec oligomycine (B) fournit des informations sur la réserve et de la capacité (figure 1A) de la glycolyse. Lorsque l'on analyse les valeurs ROC, oligomycine injection (B) permet le calcul de la consommation d'oxygène utilisé pour la synthèse d'ATP mitochondrial. FCCP (C) découple respiration mitochondriale et les mesures correspondantes OCR fournissent des données sur le maximale et la capacité respiratoire de secours. Enfin, l'injection de la roténone (Rot) et antimycine A (AA) bloquent mitochondrial complexes I et III et l'OCR résiduelle représente les inconvénients non-mitochondriales oxygèneumption (figure 1B).
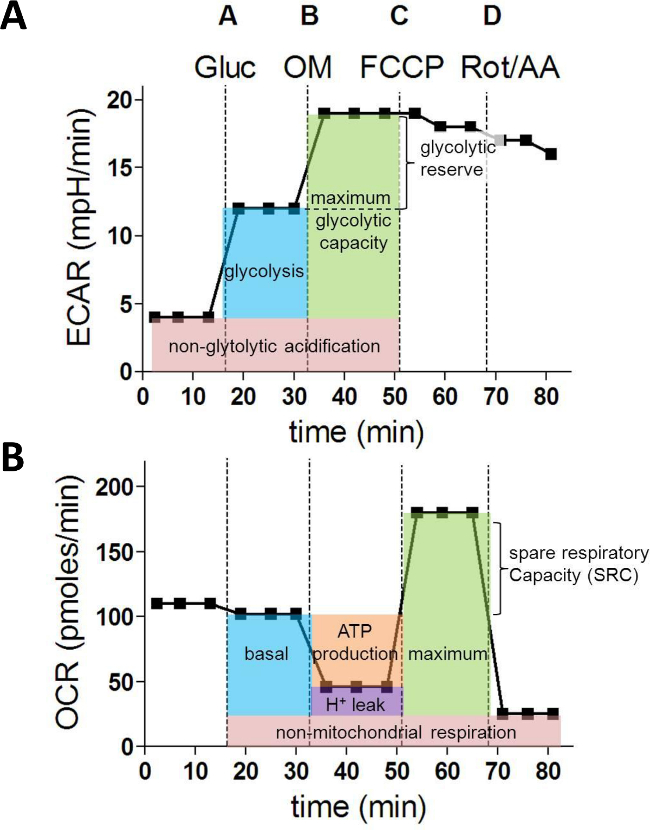
Figure 1: paramètres métaboliques issus d'un test de flux XF extracellulaire. (A) À la suite des paramètres de la glycolyse cellulaire sont calculés à partir des valeurs ECAR (en mph / min): la glycolyse, la capacité maximale de la glycolyse et réserve de la glycolyse. Mesures (B) OCR (en pmoles / min) sont utilisés pour calculer les prochaines paramètres fondamentaux de la fonction mitochondriale: respiration basale, la production d'ATP, fuite de protons, respiration maximale et la capacité respiratoire de secours. Gluc = glucose; OM = oligomycine A; FCCP = carbonyle cyanure 4- (trifluorométhoxy) phénylhydrazone; AA = antimycine A; Rot = roténone S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
Après la course, l'ECAR et OCR mesures 1 till 15 pour chaque puits peut être exporté vers Excel et les paramètres de la glycolyse suivantes peut être calculée à partir des mesures de ECAR comme suit:
Acidification non-glycolytique = avg. ECAR (1,2,3)
Glycolyse = avg. ECAR (4,5,6) - avg. ECAR (1,2,3)
La capacité maximale de la glycolyse = avg. ECAR (7,8,9) - avg. ECAR (1,2,3)
Réserve glycolytique = avg. ECAR (7,8,9) - avg. ECAR (4,5,6)
De les taux de ROC, les prochaines caractéristiques métaboliques peuvent être déterminées:
La respiration mitochondriale non = avg. OCR (13,14,15)
Respiration basale = avg. OCR (4,5,6) - avg. OCR (13,14,15)
La production d'ATP = avg. OCR (4,5,6) - avg. OCR (7,8,9)
Fuite de protons =avg. OCR (7,8,9) - avg. OCR (13,14,15)
Respiration maximale = avg. OCR (10,11,12) - avg. OCR (13,14,15)
La capacité respiratoire de secours (SRC) = avg. OCR (10,11,12) - avg. OCR (4,5,6)
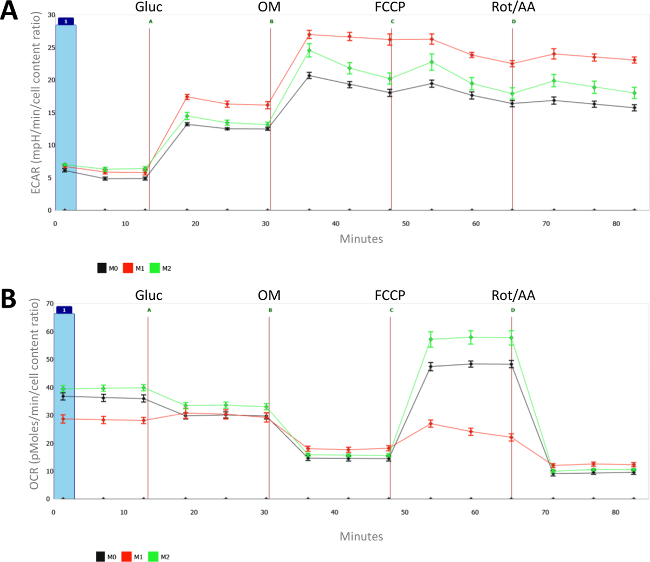
Figure 2:. Caractéristiques métaboliques de naïve (M0), LPS (M1) et IL-4- (M2) des macrophages polarisés Pour chaque mesure, la moyenne et l'écart type de la moyenne (SEM) de 8 puits individuels est présenté. (A) les taux d'acidification extracellulaire (ECAR, en MPH / min) et (b) les taux de consommation d'oxygène (OCR, en pmoles / min) sont mesurées pour différentielle polarisée (M1 et M2) et les macrophages naïfs (M0). Toutes les mesures ont été normalisées pour le nombre de cellules (telle que mesurée avec CyQUANT) et la numération cellulaire moyenne des macrophages naïfs a été fixée à 1. Dansinjection A = glucose; B = oligomycine; C = FCCP; D = A + antimycine roténone. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
Comme le montre la Figure 2A, l'activation des macrophages par le LPS induit une augmentation du métabolisme glycolytique. Les différences entre les macrophages LPS et IL-4-traitées sont encore plus évident quand on regarde les taux de consommation d'oxygène (OCR) dans la figure 2B. En effet, alors que le métabolisme oxydatif maximale est fortement réprimée dans M (LPS), la IL-4 induit la respiration basale et maximale en particulier dans les macrophages M2. Il faut noter que l'augmentation de la glycolyse est assez unique à M (LPS) et de macrophages est pas nécessairement une caractéristique des macrophages M1 puisque M (IFN-y) macrophages ne présentent pas d'améliorer la glycolyse.
Dans l'ensemble, cette analyse démontre flux extracellulaire that IL-4 induit les macrophages M2 sont caractérisés par un métabolisme oxydatif améliorée et surtout une capacité respiratoire de secours haute (SRC), tandis que l'affichage LPS-macrophages activés amélioré le métabolisme glycolytique et ne possèdent aucune capacité respiratoire de secours.
Discussion
Le but de notre laboratoire est de comprendre comment la polarisation et la fonction des macrophages peuvent être influencés dans le but ultime d'améliorer le résultat de l'athérosclérose et d'autres états inflammatoires 12. Pour évaluer macrophages polarisation, on mesure habituellement le LPS (+ IFNy) induites et d'IL-4 induit l'expression du gène de M1 et des gènes marqueurs M2 (qPCR), détermine l'IL-6, IL-12, TNF et NO sécrétion (par ELISA et réaction de Griess) examine et IL-4 induite par CD71, CD206, CD273 et CD301 expression de surface (par cytométrie de flux) et activité arginase 3,13. En outre, des dosages d'apoptose (par l'annexine-V / PI coloration), des tests de phagocytose (avec des billes fluorescentes de latex et / ou pHrodo E. coli) et des dosages de formation de cellules spumeuses (par Dil-oxLDL absorption, LipidTOX neutre coloration des lipides) peuvent être effectuées à évaluer la fonctionnalité des macrophages 14. En outre, l'analyse de flux extracellulaire peut être effectuée pour mesurer la bioénergétique profils de mac polariséerophages comme une nouvelle solution de rechange et de lecture fonctionnelle.
Ce manuscrit montre que la polarisation des macrophages induit reprogrammation métabolique avec des macrophages induite par LPS de commutation à l'augmentation de la glycolyse comme leur source d'énergie. Inversement, les macrophages M2 IL-4 induit la phosphorylation oxydative mitochondriale utilisent comme source principale de l'ATP. Surtout, métabolique reprogrammation non seulement fournit de l'énergie pour les besoins particuliers de M1 et M2 macrophages polarisées. En effet, des changements métaboliques effet sur les concentrations de metabolites qui sont des régulateurs directs du phénotype de macrophage 10,15,16. Par conséquent, le métabolisme des macrophages est non seulement une caractéristique (comme montré ici dans la figure 2), mais aussi un pilote d'états de polarisation macrophages distinctes et ces nouvelles connaissances soutenu la croissance rapide de la zone de recherche de immunometabolism cours des deux dernières années.
Cependant, les mesures robustes de profils métaboliques dans macrophages resté difficile et avaient leurs limites. Dans cette étude, un analyseur de flux extracellulaire est appliquée pour mesurer robuste glycolyse, Réserve de la glycolyse, la capacité glycolytique maximale, l'acidification non-glycolytique, basale et la respiration maximale, la production d'ATP, la capacité respiratoire de secours, fuite de protons et de la respiration non mitochondrial en temps réel dans une quantité minimale de macrophages.
Par conséquent, nous avons modifié et amélioré les protocoles du fabricant comme suit. Le test de stress Mito standard (# 103015 à 100) suggère en utilisant le milieu avec du glucose et du pyruvate et un protocole avec 3 injections (OM, FCCP, AA / rot). Nous optons pour démarrer le test avec / milieu sans pyruvate-glucose, ajouter le glucose comme une première injection dans l'orifice A (comme dans la glycolyse Stress Test # 103020 à 100) et ajouter pyruvate avec le découplant FCCP au port C. De cette façon, , tous les paramètres de la glycolyse en question proviennent de mesures ECAR 1-9 et tous les renseignements pertinents au sujet mitochondrial fonction à partir de mesures OCR 4-15.
Notez qu'il est essentiel d'injecter pyruvate avec FCCP pour alimenter la respiration maximale sur le découplage. Avant d'utiliser ce protocole combiné, il faut également vérifier que le 2-désoxy-D-glucose (2-DG) abaisse le taux de ECAR après l'essai aux valeurs de base (1-3) et que les taux d'ECAR enregistrées 4-6 sont en effet en raison de la glycolyse. En outre, il faut comprendre que les concentrations de composé et le nombre de cellules utilisées dans ce manuscrit sont valables pour les macrophages dérivés de la moelle osseuse et de cellules RAW264.7 macrophages lignes et doivent être optimisées pour d'autres types de cellules. En outre, il faut noter que le M-CSF, qui est utilisé pour générer des macrophages dérivés de la moelle osseuse favorise un phénotype anti-inflammatoire semblable à M2. Les résultats présentés à partir de macrophages dérivés de la moelle osseuse peuvent donc pas entièrement comparable à des mesures avec les macrophages résidents de tissu primaire ou des lignées de cellules macrophages qui ne nécessitent pas de M-CSF pendant Culturi cellulaireng.
Par rapport aux méthodes existantes, ce protocole exige des quantités minimes de macrophages et fournit rapidement la quasi-totalité des caractéristiques fondamentales métaboliques cellulaires. Il en résulte dans les cellules excédentaires suffisantes pour effectuer d'autres tests immunologiques et même les cellules utilisées pour la bioénergétique profilage pourrait encore être utilisés pour d'autres résolu après le dosage. En outre, le format de la plaque notamment 96 puits permet d'évaluer plusieurs conditions en temps réel dans le même temps. Cependant, la variation entre les puits individuels peut être considérable et donc l'utilisation d'au moins 4 puits par condition est souvent souhaitable. Prise en compte cette limitation, l'analyse des flux extracellulaire décrit permet toujours d'exécuter plus de 10 conditions expérimentales (n = 6) à la fois, ce qui est beaucoup plus que les techniques traditionnelles.
Dans l'ensemble, cet article propose une analyse fonctionnelle facile et reproductible qui permet de mesurer toute la glycolyse pertinente et param mitochondrialparamè- en sous-ensembles de macrophages polarisée. Cette technique peut servir une demande future pour évaluer la fonction des macrophages et d'évaluer l'effet des manipulations distinctes (par exemple gène abattre, de nouveaux produits pharmaceutiques, etc.) sur (métabolique) le phénotype de macrophage. En tant que tel, les données de flux extracellulaires peuvent être utilisés en conjonction avec d'autres analyses pour permettre la caractérisation approfondie de l'état d'activation des macrophages.
Déclarations de divulgation
Accès gratuit à cet article est sponsorisé par Seahorse Bioscience.
Remerciements
Jan Van den Bossche received a Junior Postdoc grant from the Netherlands Heart Foundation (2013T003) and a VENI grant from ZonMW (91615052). Menno de Winther is an Established Investigator of the Netherlands Heart Foundation (2007T067), is supported by a Netherlands Heart Foundation grant (2010B022) and holds an AMC-fellowship. We also acknowledge the support from the Netherlands Cardiovascular Research Initiative, Dutch Federation of University Medical Centers, the Netherlands Organization for Health Research and Development and the Royal Netherlands Academy of Sciences for the GENIUS project “Generating the best evidence-based pharmaceutical targets for atherosclerosis” (CVON2011-19). We acknowledge Seahorse Bioscience for making open access publication possible. The authors thank Riekelt Houtkooper and Vincent de Boer (Laboratory Genetic Metabolic Diseases, Academic Medical Center, Amsterdam, The Netherlands) for all previous assistance with the Seahorse analyzer.
matériels
| Name | Company | Catalog Number | Comments |
| 23G and 25G needles | Becton Dickinson | #300800 and #300600 | To flushed bone marrow |
| 10 ml syringes | Becton Dickinson | #307736 | To flushed bone marrow |
| Petri dishes | Greiner | #639161 | To culture bone marrow cells |
| CyQUANT Cell Proliferation Assay kit | Molecular Probes | #C7026 | For cell quantification at a later time point (works only for adherent cells) |
| CyQUANT Direct Cell Proliferation Assay kit | Molecular Probes | #35011 | For cell quantification immediately after assay (non-adherent cells) |
| XFe96 cell culture microplate | Seahorse Bioscience | #101085-004 | 96 well plate in which cells are cultured and in which assay is done |
| recombinant mouse interleukin-4 (IL-4) | Peprotech | #214-14-B | Used to induced alternative macrophage activation |
| lipopolysaccharide (LPS) | Sigma | #L2637 | Pro-inflammatory stimulus |
| Seahorse Sensor Cartridge | Seahorse Bioscience | #102416-100 | Contains the probes for pH and O2 measurement |
| Seahorse XF Calibrant | Seahorse Bioscience | #100840-000 | Needed to hydrate the probes overnight |
| XF base medium | Seahorse Bioscience | #102353-100 | Buffer-free medium that allows efficient measurement of pH changes |
| L-glutamine | Life Technologies | #25030-081 | |
| D-(+)-Glucose | Sigma | #G8769 | Fuels glycolysis once added to the cells |
| oligomycin A | Sigma | #75351 | Inhibits mitochondrial ATP synthase |
| FCCP( Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone) | Sigma | #C2920 | Uncouples mitochondrial respiration |
| 100 mM Sodium Pyruvate solution | Lonza | #BE13-115E | Allows maximal mitochondrial respiration without the need for glycolysis |
| Antimycin A | Sigma | #BE13-115EA8674 | Inhibits complex III of the mitochondria |
| Rotenone | Sigma | #BE13-115EA8674R8875 | Inhibits complex I of the mitochondria |
| Casy Cell Counter | Roche Diagnostics | #05 651 697 001 | Instrument to count cells |
| anti-CD16/CD32 | eBioscience | #14-0161 | Fc receptor block flow cytometry |
| anti-F4/80-APC-eFluor780 | eBioscience | #47-4801 | Antibody to stain macrophages |
| anti-CD11b-FITC | eBioscience | #11-0112 | Antibody to stain macrophages |
Références
- Murray, P. J., et al. Macrophage activation and polarization: nomenclature and experimental guidelines. Immunity. 41, 14-20 (2014).
- Hoeksema, M. A., et al. IFN gamma Priming of Macrophages Represses a Part of the Inflammatory Program and Attenuates Neutrophil Recruitment. J Immunol. , (2015).
- Vanden Bossche, J., et al. Pivotal Advance Arginase 1 independent polyamine production stimulates the expression of IL 4 induced alternatively activated macrophage markers while inhibiting LPS-induced expression of inflammatory genes. Journal of leukocyte biology. 91, 685-699 (2012).
- Pearce, E. L., Pearce, E. J. Metabolic pathways in immune cell activation and quiescence. Immunity. 38, 633-643 (2013).
- Yang, L., et al. PKM2 regulates the Warburg effect and promotes HMGB1 release in sepsis. Nature communications. 5, 4436(2014).
- Freemerman, A. J., et al. Metabolic reprogramming of macrophages glucose transporter 1 (GLUT1) mediated glucose metabolism drives a proinflammatory phenotype. The Journal of biological chemistry. 289, 7884-7896 (2014).
- Tavakoli, S., Zamora, D., Ullevig, S., Asmis, R. Bioenergetic profiles diverge during macrophage polarization implications for the interpretation of 18F FDG PET imaging of atherosclerosis. J Nucl Med. 54, 1661-1667 (2013).
- Vats, D., et al. Oxidative metabolism and PGC 1beta attenuate macrophage mediated inflammation. Cell metabolism. 4, 13-24 (2006).
- Huang, S. C., et al. Cell intrinsic lysosomal lipolysis is essential for alternative activation of macrophages. Nature immunology. 15, 846-855 (2014).
- Tannahill, G. M., et al. Succinate is an inflammatory signal that induces IL 1beta through HIF 1alpha. Nature. 496, 238-242 (2013).
- Ying, W., Cheruku, P. S., Bazer, F. W., Safe, S. H., Zhou, B. Investigation of macrophage polarization using bone marrow derived macrophages. J Vis Exp. (76), (2013).
- Hoeksema, M. A., et al. Targeting macrophage Histone deacetylase 3 stabilizes atherosclerotic lesions. EMBO Mol Med. 6, 1124-1132 (2014).
- Vanden Bossche, J., et al. Alternatively activated macrophages engage in homotypic and heterotypic interactions through IL 4 and polyamine induced E cadherin catenin complexes. Blood. 114, 4664-4674 (2009).
- Van den Bossche, J., et al. Inhibiting epigenetic enzymes to improve atherogenic macrophage functions. Biochem Biophys Res Commun. 455, 396-402 (2014).
- Galvan Pena, S., O Neill, L. A. Metabolic reprograming in macrophage polarization. Frontiers in immunology. 5, 420(2014).
- Zhu, L., Zhao, Q., Yang, T., Ding, W., Zhao, Y. Cellular metabolism and macrophage functional polarization. International reviews of immunology. 34, 82-100 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon