Method Article
戦略的な内皮細胞管形成アッセイ:細胞外マトリックスおよび成長因子の比較は、細胞外マトリックスを削減しました
要約
This manuscript describes a tube formation assay to quantify the effects of a given compound or condition on angiogenesis by using endothelial cell tube formation in a controlled environment.
要約
Malignant tumors require a blood supply in order to survive and spread. These tumors obtain their needed blood from the patient's blood stream by hijacking the process of angiogenesis, in which new blood vessels are formed from existing blood vessels. The CXCR2 (chemokine (C-X-C motif) receptor 2) receptor is a transmembrane G-protein-linked molecule found in many cells that is closely associated with angiogenesis1. Specific blockade of the CXCR2 receptor inhibits angiogenesis, as measured by several assays such as the endothelial tube formation assay. The tube formation assay is useful for studying angiogenesis because it is an excellent method of studying the effects that any given compound or environmental condition may have on angiogenesis. It is a simple and quick in vitro assay that generates quantifiable data and requires relatively few components. Unlike in vivo assays, it does not require animals and can be carried out in less than two days. This protocol describes a variation of the extracellular matrix supporting endothelial tube formation assay, which tests the CXCR2 receptor.
概要
生存に必要な栄養素を得るために、悪性腫瘍は、患者の血流へのアクセスを必要とします。そのアクセスを得るために、腫瘍細胞は、このように、血管新生2として知られている正常な生理学的プロセスをハイジャック、腫瘍への新しい血管の成長を刺激する化学的信号を放出します。これは、転移( すなわち、他の臓器への癌の広がりが)発生する可能性があること、血管新生を介して作成血管を通してです。血管形成のプロセスは、癌のような多種多様の進行に非常に重要であるので、抗癌治療の研究3で魅力的な標的です。
血管形成を定量するために使用される一つの方法は、細胞外マトリックス上に配置されたときに管を形成するための内皮前駆細胞の能力を測定することです。これらの管の形成は、環境条件( 例えば、存在または指定された共同の欠如をテストし、血管新生において重要な初期段階であるため、mpound)を刺激または阻害することができる管形成は、血管新生を阻害するために標的とすることができる具体的な手順についての洞察を提供します。内皮細胞のチューブ形成アッセイは、チューブを形成する細胞の能力を測定する最も広く使用されている4 のin vitro方法の一つです。これは、比較的少数の部品と短い培養期間5を必要とする 、シンプルなアッセイです。おそらく最も重要な、しかし、このタイプのアッセイから得られたデータは定量化可能であるということです。
管形成アッセイの使用の例は、成長因子低減(GFR)は、細胞外マトリックス対細胞外マトリックス上で成長した血管内皮細胞の管の開発を比較することを含みます。ラミニン、IV型コラーゲン、成長因子およびプロテオグリカンは、細胞外マトリックスは、肉腫細胞、およびその主要な構成要素から単離された基底膜様材料です。いくつかの化合物は、内管を形成する細胞の能力に異なる効果を有します減少した成長因子および減少ヘパラン硫酸プロテオグリカン(HSPGは)ある環境。 HSPGにはかなりGFR細胞外マトリックスに低減され、細胞外マトリックスの成分です。一例として、仮説は、このようなのHSPGが豊富な管形成を中断するためにかなり弱い能力を有する遮断CXCR2受容体を、SB225002、血管新生阻害剤は、次いで、細胞外マトリックス及びGFR外マトリックスにおける管形成活性の比較であることがある場合HSPGの制御を介した血管新生阻害の可能性を探る重要。
一般的に、血管新生に対する化合物の効果を決定するために使用される他のアッセイは、 インビボの方法です 。この顕著な例は、鶏の卵を使用して、ニワトリ漿尿膜(CAM)アッセイ6であり、in vivoでのマトリゲルは、マウスを用いた血管新生アッセイ7を差し込みます。 インビボ方法は、トンで血管新生を測定しながら、HREE寸法およびインビトロ管形成アッセイに比べ、人体の多くの代表的なものであるが、それらは、かなり多くの時間を必要とする欠陥を被るとかなり実行するのが困難です。 CAMアッセイおよび細胞外プラグアッセイの両方が比較して、管形成アッセイは一日で行うことができますが、実行するには、少なくとも8週取ると、それは動物の使用を必要としません。
なお、本報告書で使用された内皮細胞はヒト臍帯静脈内皮細胞(HUVEC)であることに留意することが重要です。これらの細胞は、血管芽及び血管の成長に重要な役割を果たし、そしてインビトロおよびインビボ実験9の両方において抗血管形成活性を評価するために使用される癌で内皮細胞に十分に類似しています。このような一次微小血管内皮細胞などの他の細胞を使用してもよいです。
より低い有する以外ことに留意することも重要です正常な細胞外マトリックスと比較した場合のHSPG、GFR外マトリックスのレベルは、多くの成分のレベルが低下しています。これには、これらに限定されない:EGF、IGF-1、PDGFおよびTGF-β。血管新生に関連して、これらの化合物の重要性を研究するものを行う実験は、GFR外マトリックスを使用してに興味があるかもしれません。
プロトコル
1.細胞培養
- シード3×10 75センチメートルフラスコ中の完全増殖培地10の10ミリリットルで5 HUVEC細胞。
- 70〜80%コンフルエンスまで5%CO 2中37℃で細胞をインキュベートします。
2.細管形成アッセイ
- 4℃で氷の上で一晩増殖因子低減(GFR)は、細胞外マトリックスまたは通常の細胞外マトリックスのいずれかを解凍します。
注:「細胞外マトリックス」簡潔にするために、以後GFRと正常細胞外マトリックスの両方を参照するために使用されます。それらを準備するためのプロセスは同じです。 - 氷上で96ウェル培養プレートを維持し、よく予め冷却したチップを使用してあたりチルド細胞外マトリックスの50μlを添加します。唯一の正常な細胞外マトリックスを含む5ウェルの三重を準備します。のみGFR細胞外マトリックスを含む5ウェルの別の三連を準備します。
- 30分間、37℃で96ウェルプレートをインキュベートします。
- HUVECをを洗います一度リン酸緩衝溶液を用いて、カルシウムとマグネシウム(PBS)なし、および1ミリリットルを0.05%トリプシン-EDTAを追加します。ほとんどの細胞は切り上げになるまで細胞分ごとにチェックし、1-5分間37℃で皿をインキュベートします。一度フラスコをタップすることで細胞を取り除きます。
- 5 mlのに基礎培地を追加し、1%ウシ胎児血清(FBS)を用いて( 例えば、(何もせずに、すなわち、内皮細胞増殖培地、補充物)を加えました)。ピペットでフラスコ内の細胞を収集し、15mlチューブに移します。 5分間、200×gで細胞を遠心分離し、上清を捨てます。
- 、2ミリリットル基礎培地で再懸濁血球計数器を用いて細胞をカウントし、2-3×10 5細胞/ mlに細胞濃度を調整します。
- 11μM、5.6μM、1.1μM、0.56μMおよび0μM(コントロール):基礎培地中でCXCR2阻害剤SB225002の以下の10倍の濃度の100μlのを準備します。
- 各5 MICRにHUVEC懸濁液300μLをピペットocentrifugeチューブ。阻害剤濃度の33μLを加える(11μM、5.6μM、1.1μM、0.56μMおよび0μM)1チューブにHUVECを、と渦を含む各。
- 細胞外マトリックスの個々のウェルに細胞懸濁液(1〜1.5×10 4細胞)のそれぞれのピペットを50μl。三連で各懸濁液をプレートし、37℃、5%CO 2で4〜16時間インキュベートします。
- 4-16時間後、よく倒立顕微鏡カメラ11(元の倍率×100)を使用して、あたりに形成されたチューブの4写真を撮ります。
3.細管破壊アッセイ
- 管形成アッセイ(2.3から2.1ステップ)と同じ仕様に応じて、細胞外マトリックス、プレートを準備します。
- 手順で説明したように、2.4GHz管形成アッセイ、アリコートの2.4.2を細胞外マトリックスを含む96ウェルプレートにウェル当たり50μlのでHUVEC懸濁液を準備します。
注:プレートに十分な井戸秒薬物処置あたり3ウェルがあることO。 - 37℃、5%CO 2で4時間、細胞外マトリックス上で細胞を増殖させます。薬物治療を開始する前に画像を取ります。
- 管形成アッセイのステップ2.5で説明したようにCXCR2阻害剤SB225002の2倍の濃度を用意し、HUVECをを含む96ウェルプレートのウェルあたり各濃度の50μlを添加します。三連で各濃度をプレート。
- 37°C、5%CO 2で別の2-12時間プレートをインキュベート。各ウェル倒立顕微鏡カメラ(100×元の倍率)11を使用して形成されたチューブの4つの画像を取ります。
4.定量化データ
- 顕微鏡カメラソフトウェアを使用して、4つのランダムな顕微鏡視野内のチューブの総管長を測定することにより、画像内に捕捉管形成を評価します。
- 顕微鏡カメラのソフトウェアで画像を開き、「注釈および測定をクリック9 ;. 「長さ」セクションで、「シンプルライン」ツールを選択します。次に右クリックし、チューブの長さに沿って線を引き、画像をクリックしてください。
注:ソフトウェアが自動的にピクセル単位の線の長さを計算し、ファイルにデータを配置します。 - 「シンプルライン」ツールを選択することで、画像内のすべての管ラインのための手順を繰り返します。次に右クリックし、チューブの長さに沿って線を引き、画像をクリックしてください。
注:ソフトウェアは、各ラインの長さを記録し、データを画面に表示します。 - 画像内のすべてのチューブを測定した後、「エクスポート」をクリックし、[スプレッドシートに長さ 'を選択しました。
注:長データをスプレッドシートにエクスポートされます。 - 総管の長さを取得するには、スプレッドシートからチューブの長さのすべてを追加します。計算し、チューブの平均の長さを記録します。
注:四つの反復は、平均値と決定された標準偏差で推奨されています。
細胞外マトリックスの文化から5.回復の細胞
- 培養チューブ形成アッセイを行うには、十分な細胞数が得られないであろう、96ウェルプレートのように大規模に(セクション2を参照します)。 12ウェルプレートの場合は、細胞外マトリックスの500μlのとHUVEC細胞懸濁液(1.5×10 5細胞)の500μLを使用しています。
- チューブを形成するために、4-16時間、細胞をインキュベートします。その後、細胞培養培地を吸引します。カルシウムとマグネシウムを含まない冷たい1×1mlのPBSで細胞を洗浄します。
- 文化への氷冷PBS-2.5 mMのEDTA緩衝液の1ミリリットルを加え、氷上で10分間続けます。
- 冷たい15mlチューブに移すその後、カットオフ、および、氷冷PBS-2.5 mMのEDTAの4ミリリットルとよく洗う先端で千μlのピペットチップを使用して、皿から細胞と細胞外マトリックス混合物を除去し、チューブに入れ。
- 1-4時間氷上にチューブを入れて、外のすべてのまで、チューブを数回転倒マトリックスが溶解されています。
- 0℃で、1620×gで10分間遠心
- 氷上の1.ml管に1ミリリットルの冷PBSで細胞ペレットを再懸濁します。
- 遠心分離を再び0℃で3,000×gで5分間、その後、上清を廃棄。
- -80℃で細胞を保管してください。
結果
かなりの、健康な内皮チューブ形成を容易に顕微鏡画像で阻害管形成に対比することができます。健康管形成は、毛細血管様構造( 図1)の組織化されたウェブとして表示されます。比較して、阻害管形成は散乱細胞( 図2)として現れます。管形成アッセイデータは、キャピラリーチューブ( 表1)の総管長を測定することによって定量化されます。総管長以外に、分岐点の平均チューブ長さ、チューブの合計数、又は数を測定することができます。構造化管形成は、散乱を阻害し、チューブの成長よりも大きい正味管の長さが得られます。 図3においては、用量反応曲線は、GFR外マトリックスおよびCXCR2の阻害剤SB225002のHUVECの実験条件下でIC 50の計算を可能にします。

細胞外マトリックス、成長因子低減(GFR)は、細胞外マトリックスのUBE形成 T 図1 内皮 。2つの画像は、細胞外マトリックス(A)及びGFR外マトリックス(B)に成功した管形成を示します。チューブの相互接続されたネットワークは、明らかに、チューブの成長はこれらのHUVECで健康であることを示しています。スケールバー=10μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。

上の因子減少(GFR)CXCR2阻害剤SB225002(5.6μM)による細胞外マトリックス外と成長。管形成の 図2. 阻害 2つの画像は、チューブを表示します細胞外マトリックス(A)及びGFR外マトリックス(B)上のCXCR2阻害剤SB225002(5.6μM)によって阻害された形成。この画像で見られるHUVEC細胞の単離された塊は、細胞が相互に接続するために必要なチューブを形成することができなかったことを示します。スケールバー=10μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
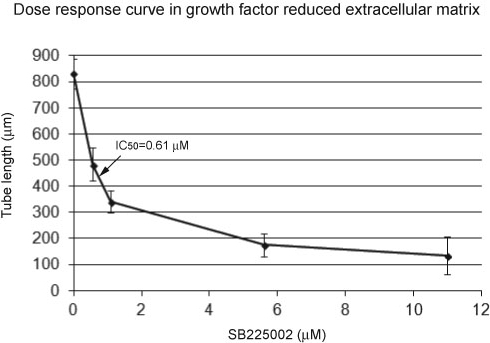
成長因子低減(GFR)は、細胞外マトリックスの 図3 の用量応答曲線は、X軸は管の長さを示し、Y軸は、CXCR2の阻害剤の濃度を示します。用量応答曲線は、GFR外マトリックスのCXCR2阻害剤に対するHUVEC応答は用量依存性であることを示しています。 IC 50(半最大阻害剤Y濃度)は、例えば、ソフトウェア13を使用し、細胞外マトリックスの用量応答曲線と比較することができることにより算出しました。 IC 50は、50%の応答を低下させる阻害剤の濃度です。エラーバーは標準偏差を表します。
| (GFR)は、細胞外マトリックスおよび阻害剤 (4がそれぞれを複製する) 成長因子低減 | 総チューブの長さの平均(ピクセル)(1 ピクセル= 0.34ミクロン) | 標準偏差 | P値 |
| GFR細胞外マトリックス制御 | 2447 | 168.174 | |
| GFR細胞外マトリックス+ 0.56μMのSB225002 | 1422.5 | 185.4218 | 0.000395 |
| GFR細胞外マトリックス+ 1.1μMのSB225002 | 1004 | 126.1784 | 2.14×10 -5 |
| GFR細胞外マトリックス+ 5.6μMのSB225002 | 519.25 | 129.6368 | 4.19×10 -6 |
| GFR細胞外マトリックス+ 11μMSB225002 | 393.75 | 212.6857 | 1.21×10 -5 |
表1.様々な条件の下で成長因子減少(GFR)は、細胞外マトリックス上の総管の長さを定量化する。CXCR2阻害剤の濃度を変えGFR細胞外マトリックス上で成長したサンプルで記録された合計チューブの長さを使用して、テーブルの一部。データは、CXCR2の阻害剤は、管形成を阻害しないことを示しています。 、四複製、標準偏差の平均値、及びP値と関連した値が含まれます。表示するピクセル単位で測定エクスポートされたデータ。 IC 50は、統計ソフトウェア13を用いて算出することができます。 (1ピクセル= 0.34ミクロン)
ディスカッション
このアッセイを行う場合には、特に断らない限り、常に氷上または4℃で細胞外マトリックスを維持するために不可欠です。細胞外マトリックスは、4℃以上加温する場合には重合し、そしてアッセイが台無しにされます。細胞外マトリックスと接触するもの( 例えば、ピペットチップ、プレート)は、前述の理由で予備冷却されることを保証することも重要です。各ウェルに播種した細胞の数が重要である、あまりにも少数の細胞は、対照試料において予想されるウェブを与えることはありませんあまりにも多くの細胞が大きな細胞塊または単分子層を形成し、アッセイは有効になりません。このアッセイの成功のもう一つの重要な要因は、HUVECの細胞継代数です。継代数は常にそうしないと強固な管形成が発生しないことがあり、10以下となるようにして下さい。また、1は、使用される細胞培養培地の有効期限が切れていないか、または細胞が生存可能でないことを確認する必要があります。 Alternatively、1は、媒体とそのコンポーネントを分取し、有効期限後に一定期間保持するために-20℃で保存することができます。もちろん、有効期限前に媒体を使用することが好ましいです。
すべての手順と同様に、内皮細胞管形成アッセイを実施するにはいくつかの欠点があります。一つの大きな問題は、内皮細胞および支持マトリックスの異なるタイプがあるため、アッセイの結果は、細胞およびマトリックスの種類が使用されるに応じて大きく変化することができる、ということです。使用内皮細胞(HUVEC、HAECsまたはHMVECをは)彼らは不死化細胞と比較して変動を取得し、持っている高価であり、主要な細胞です。初代細胞は、使用のために制限された通路を有し、したがって長期の血管新生実験14には適していません。信頼性の高いデータの場合、1は常にアッセイのための同じタイプを使用する必要があります。 インビトロアッセイの他のように、管形成アッセイの結果は、詐欺であるべきです二次元の組織培養の制御された人工的な条件からの結果は、常に生体の複雑な生物系に反映されない可能性があるため、 生体内で確定。このタイプのアッセイは、唯一の内皮細胞のチューブ形成を実証するために使用することができ、セルを形成する他の非内皮チューブをテストするために使用されるべきではないことを覚えておくことも重要です。
このアッセイは、化合物の血管新生の可能性を定量化するためのかなり簡単かつ迅速な方法です。また、単独として、それは、化合物が実際に血管形成プロセスに影響を与えることによって、特定のメカニズムに関する情報が得られない、更なる実験のためのプラットフォームを形成します。しかし、様々な細胞外マトリックスの使用は、さらに一般的に使用されていない研究課題のためのフレームワークを作成する方法の例です。の成分を標的とする特異的阻害剤を含む化合物の具体的な生化学的機構を研究するアプローチがあります血管新生経路。別のアプローチは、内皮細胞からRNAを抽出し、アッセイにおいて観察された増殖挙動を引き起こす可能性がある遺伝子発現の変化を分析するためにRT-PCR(リアルタイムPCR)12を使用することができます。この方法の将来のアプリケーションは、血管新生経路の具体的な手順のためのノックダウンアッセイを作成するためのHUVECをトランスフェクト含まれます。リンパ管経路を研究するためにこのアプローチを適用する可能性があります。細胞外マトリックス成分を変更することによって、癌において血管新生を支持マトリックスおよび細胞プロセスの相互作用をさらに解明することができます。これらの特定の条件下で内皮細胞からのRNAおよびタンパク質の抽出は、データを画像化するために対応する追加の定量化データを提供します。
開示事項
The authors declare that they have no competing financial interests.
謝辞
The work was funded by the Fund for Medical Research and Education, Wayne State University, Detroit, MI.
資料
| Name | Company | Catalog Number | Comments |
| EGM-2 complete growth medium (EGM-2 bullet kit CC-3162 ) | Fisher | NC9525043 | HUVEC complete growth medium: EGM-2 base medium mixed with BBE (Bovine Brain Extract), hEGF (Human Epidermal Growth Factor), Hydrocortisone, GA-1000 (Gentamicin, Amphotericin-B), 2% FBS (Fetal Bovine Serum), VEGF (Vascular Endothelial Growth Factor), hFGF-β (Human Fibroblast Growth Factor Beta), R3-IGF-1 (Long R Insulin-like Growth Factor One), Ascorbic Acid, and Heparin. Aliquot the medium and its components and store them at -20 °C, warm in 37 °C before use. |
| MATRIGEL MATRIX 10ML Growth Factor Reduced (GFR); 10 ml; LDEV-Free | Fisher | CB-40230 | Growth Factor Reduced (GFR) extracellular matrix, keep in -20 °C, warm in 4 °C before use. |
| MATRIGEL MATRIX 10ML; 10 ml; LDEV-Free | Fisher | CB-40234 | extracellular matrix, keep in -20 °C, warm in 4 °C before use. |
| SB225002 | Fisher | 559405 | CXCR2 inhibitor, keep in -20 °C, warm in room temperature before use. |
| Primary human umbilical vein endothelial cells (HUVEC) | ScienCell Research Laboratories | 8000 | culture it according reference 10. |
| Trypsin 0.05%-EDTA phenol red | Invitrogen | 25300-054 | keep in 4 °C, warm in 37 °C before use. |
| Nikon ECLIPSE Ti | Nikon | Inverted Research Microscope. | |
| NIS-Elements AR 4.20.02 64 bit | Nikon | Inverted Research Microscope software | |
| Graph-pad Prism 5 | GraphPad Software, Inc. | scientific 2D graphing and statistics software, to calculate IC50. |
参考文献
- Sharma, B., Nawandar, D. M., Nannuru, K. C., Varney, M. L., Singh, R. K. Targeting CXCR2 enhances chemotherapeutic response, inhibits mammary tumor growth, angiogenesis, and lung metastasis. Mol Cancer Ther. 12 (5), 799-808 (2013).
- Birbrair, A., et al. Type-2 pericytes participate in normal and tumoral angiogenesis. Am J Physiol Cell Physiol. 307 (1), 25-38 (2014).
- Ferrara, N., Kerbel, R. S. Angiogenesis as a therapeutic target. Nature. 438 (7070), 967-974 (2005).
- Speyer, C. L., Hachem, A. H., Assi, A. A., Johnson, J. S., DeVries, J. A., Gorski, D. H. Metabotropic glutamate receptor-1 as a novel target for the antiangiogenic treatment of breast cancer. PLoS One. 9 (3), 88830 (2014).
- Gu, X., et al. Human Apurinic/Apyrimidinic Endonuclease siRNA Inhibits the Angiogenesis Induced by X-Ray Irradiation in Lung Cancer Cells. International Journal of Medical Sciences. 10 (7), 870-882 (2013).
- Manjunathan, R., Ragunathan, M. Chicken chorioallantoic membrane as a reliable model to evaluate osteosarcoma-an experimental approach using SaOS2 cell line. Biol Proced Online. 17, 10 (2015).
- Nidhyanandan, S., Boreddy, T. S., Chandrasekhar, K. B., Reddy, N. D., Kulkarni, N. M., Narayanan, S. Phosphodiesterase inhibitor, pentoxifylline enhances anticancer activity of histone deacetylase inhibitor, MS-275 in human breast cancer in vitro and in vivo. Eur J Pharmacol. 764, 508-519 (2015).
- Li, Y., et al. Copper improves the anti-angiogenic activity of disulfiram through the EGFR/src/VEGF pathway in gliomas. Cancer Lett. Aug. , (2015).
- Park, H. J., Zhang, Y., Georgescu, S. P., Johnson, K. L., Kong, D., Galper, J. B. Human umbilical vein endothelial cells and human dermal microvascular endothelial cells offer new insights into the relationship between lipid metabolism and angiogenesis. Stem Cell Rev. 2 (2), 93-102 (2006).
- de Wit, C., Fautz, C., Xu, Y. Real-time quantitative PCR for retrovirus-like particle quantification in CHO cell culture. Biologicals. 28 (3), 137-148 (2000).
- Jaffe, E. A., Nachman, R. L., Becker, C. G., Minick, C. R. Culture of human endothelial cells for derived from umbililcal veins. Identification by morphologic and immunologic criteria. J Clin Invest. 52 (11), 2745-2756 (1973).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved