Method Article
Strategico cellule endoteliali tubo saggio Formazione: Confronto tra matrice extracellulare e fattore di crescita ridotto matrice extracellulare
In questo articolo
Riepilogo
This manuscript describes a tube formation assay to quantify the effects of a given compound or condition on angiogenesis by using endothelial cell tube formation in a controlled environment.
Abstract
Malignant tumors require a blood supply in order to survive and spread. These tumors obtain their needed blood from the patient's blood stream by hijacking the process of angiogenesis, in which new blood vessels are formed from existing blood vessels. The CXCR2 (chemokine (C-X-C motif) receptor 2) receptor is a transmembrane G-protein-linked molecule found in many cells that is closely associated with angiogenesis1. Specific blockade of the CXCR2 receptor inhibits angiogenesis, as measured by several assays such as the endothelial tube formation assay. The tube formation assay is useful for studying angiogenesis because it is an excellent method of studying the effects that any given compound or environmental condition may have on angiogenesis. It is a simple and quick in vitro assay that generates quantifiable data and requires relatively few components. Unlike in vivo assays, it does not require animals and can be carried out in less than two days. This protocol describes a variation of the extracellular matrix supporting endothelial tube formation assay, which tests the CXCR2 receptor.
Introduzione
Per ottenere i nutrienti necessari per la sopravvivenza, tumori maligni richiedono l'accesso al flusso sanguigno del paziente. Per ottenere l'accesso, le cellule tumorali rilasciano segnali chimici che stimolano la crescita di nuovi vasi sanguigni del tumore, dirottando così il processo fisiologico normale noto come angiogenesi 2. È anche attraverso i vasi sanguigni creati tramite angiogenesi che le metastasi (cioè, la diffusione del cancro ad altri organi) può verificarsi. Poiché il processo di angiogenesi è così vitale per la progressione di una così ampia varietà di tumori, è un obiettivo attraente nella ricerca terapia antitumorale 3.
Un metodo utilizzato per quantificare l'angiogenesi è misurare la capacità delle cellule progenitrici endoteliali a formare tubi quando posto su una matrice extracellulare. Poiché la formazione di questi tubi è un primo passo critico nella angiogenesi, testando condizioni ambientali (ad esempio, presenza o assenza di un dato compound) in grado di stimolare o inibire la formazione del tubo permette di comprendere misure specifiche che possono essere mirate per inibire l'angiogenesi. Il saggio formazione del tubo delle cellule endoteliali è uno dei 4 metodi più utilizzati in vitro che misura la capacità delle cellule di formare tubi. Esso è un test semplice, richiede relativamente pochi componenti e un breve periodo di coltura 5. Forse la cosa più importante, tuttavia, è che i dati ottenuti da questo tipo di test è quantificabile.
Un esempio per l'utilizzo del test formazione del tubo comporta il confronto lo sviluppo di tubi da cellule endoteliali vascolari coltivate su matrice extracellulare vs fattore di crescita ridotta (GFR) matrice extracellulare. La matrice extracellulare è un materiale di membrana simile seminterrato isolati da cellule di sarcoma e dei suoi principali componenti sono laminina, collagene di tipo IV, fattori di crescita e proteoglicani. Alcuni composti hanno effetti diversi sulla capacità della cellula di formare tubi quando inun ambiente con fattori di crescita ed un ridotto proteoglicani eparan solfato (HSPGs). HSPGs sono una componente della matrice extracellulare che è significativamente ridotto in matrice extracellulare GFR. Ad esempio, se l'ipotesi è che gli inibitori dell'angiogenesi, come SB225002, che blocca il recettore CXCR2, hanno notevolmente più debole capacità di interrompere la formazione del tubo quando HSPGs sono abbondanti, quindi un confronto tra l'attività formazione del tubo della matrice extracellulare e la matrice extracellulare GFR è importante per esplorare la possibilità di inibizione dell'angiogenesi tramite il controllo di HSPGs.
Altri test che vengono comunemente utilizzati per determinare gli effetti dei composti sulla angiogenesi sono metodi in vivo. Notevoli esempi di questo sono il pulcino membrana corioallantoidea (CAM) saggio 6 utilizzando uova di gallina, e in vivo Matrigel spina saggio di angiogenesi 7 utilizzando topi. Mentre i metodi in vivo misurano angiogenesi in tdimensioni hree e sono più rappresentativi del corpo umano rispetto alla vitro formazione in tubo, soffrono il difetto di richiedere molto più tempo e sono molto più difficili da eseguire. Sia il test CAM e il test spina extracellulare prendono almeno una settimana 8 da fare, mentre in confronto, il saggio di formazione del tubo può essere fatto in un solo giorno e non richiede l'utilizzo degli animali.
È importante notare che le cellule endoteliali qui utilizzati sono vena ombelicale cellule endoteliali umane (HUVEC). Queste cellule svolgono un ruolo chiave nel germoglio e crescita dei vasi sanguigni vascolare e sono sufficientemente simili alle cellule endoteliali nei tumori ad essere utilizzato per valutare l'attività anti-angiogenesi sia in vitro ed in vivo 9. Altre cellule, come le cellule endoteliali microvascolari primari possono anche essere utilizzati.
E 'anche importante notare che oltre ad avere minorelivelli di HSPGs, la matrice extracellulare GFR ha anche ridotto i livelli di molti componenti rispetto alla matrice extracellulare normale. Questo include, ma non è limitata a: EGF, IGF-1, PDGF e TGF-beta. Quegli esperimenti che svolgono studiano il significato di questi composti in relazione alla angiogenesi possono essere interessati ad utilizzare GFR matrice extracellulare.
Protocollo
Cultura 1. cellulare
- Seme 3x10 5 cellule HUVEC in 10 ml di mezzo di crescita completo 10 in un pallone 75 cm.
- Incubare le cellule a 37 ° C in 5% CO 2 al 70-80% di confluenza.
2. tubulo saggio Formazione
- Scongelare sia il fattore di crescita ridotta (GFR) matrice extracellulare o matrice extracellulare normale durante la notte sul ghiaccio a 4 ° C.
Nota: Per brevità 'matrice extracellulare' d'ora in poi essere utilizzato per fare riferimento sia GFR e della matrice extracellulare normale. Il processo per prepararli è identico. - Mantenere piastre di coltura a 96 pozzetti su ghiaccio, e aggiungere 50 ml di matrice extracellulare refrigerata per pozzetto con punte pre-raffreddato. Preparare triplice copia di 5 pozzetti contenenti solo la matrice extracellulare normale. Preparare un triplice copia di 5 pozzetti contenenti solo GFR matrice extracellulare.
- Incubare la piastra a 96 pozzetti a 37 ° C per 30 min.
- Lavare il HUVECsuna volta con soluzione tamponata con fosfato senza calcio e magnesio (PBS), e aggiungere 1 ml di 0,05% tripsina-EDTA. Incubare il piatto a 37 ° C per 1-5 minuti, controllando le cellule ogni minuto fino a quando la maggior parte delle cellule completano. Sloggiare i cellule toccando il pallone una volta.
- Aggiungere 5 ml di mezzo basale (vale a dire, endoteliali terreno di coltura cellulare senza nulla (ad esempio, supplementi) aggiunto) con 1% siero fetale bovino (FBS). Raccogliere le cellule nel pallone pipettando e trasferire in una provetta da 15 ml. Centrifugare le cellule a 200 xg per 5 minuti e scartare il surnatante.
- Risospendere con 2 ml di media basale, contare le cellule utilizzando un emocitometro e regolare la concentrazione cellulare a 2-3 x 10 5 cellule / ml.
- Preparare 100 ml di 10x seguenti concentrazioni di inibitore CXCR2 SB225002 in terreno di base: 11 micron, 5,6 micron, 1,1 micron, 0,56 micron e 0 micron (controllo).
- Dispensare 300 microlitri della sospensione HUVEC in ogni 5 MICRtubi ocentrifuge. Aggiungere 33 ml di concentrazioni inibitori (11 mM, 5,6 mM, 1,1 mM, 0,56 mM e 0 pM) in una provetta ciascuna contenente la HUVEC, e vortex.
- Pipettare 50 ml di ciascuna delle sospensioni cellulari (1-1,5 x 10 4 cellule) a singoli pozzetti di matrice extracellulare. Piatto ogni sospensione in triplicato e incubare per 4-16 ore a 37 ° C, 5% CO 2.
- Dopo 4-16 ore, prendere 4 immagini dei tubi formati per pozzetto utilizzando una fotocamera microscopio invertito 11 (ingrandimento originale x 100).
3. tubulo Turbativa Assay
- Preparare la matrice extracellulare e le piastre secondo le stesse specifiche come il tubo di saggio Formazione (passaggi da 2.1 a 2.3).
- Preparare la sospensione HUVEC come descritto nei passaggi 2,4 2.4.2 del tubo saggio Formazione e aliquota in una piastra a 96 pozzetti contenente la matrice extracellulare a 50 ml per pozzetto.
Nota: Piatto abbastanza pozzi so che ci sono 3 pozzetti per trattamento farmacologico. - Crescere le cellule sulla matrice extracellulare per 4 ore a 37 ° C, 5% CO 2. Prendere le immagini prima dell'inizio del trattamento farmacologico.
- Preparare concentrazioni 2x del inibitore SB225002 CXCR2 come descritto al punto 2.5 del saggio tubo Formazione, e aggiungere 50 ml di ciascuna concentrazione per pozzetto della piastra ben 96 contenente il HUVECs. Piastra ogni concentrazione in triplice copia.
- Incubare la piastra per un altro 2-12 ore a 37 ° C, 5% CO 2. Prendere 4 immagini dei tubi formate in ciascun pozzetto utilizzando una fotocamera microscopio invertito (ingrandimento originale × 100) 11.
4. Quantificare dati
- Valutare formazione del tubo catturati nelle immagini misurando la lunghezza totale del tubo di tubi in quattro campi microscopici casuali utilizzando il software della fotocamera microscopio.
- Aprire l'immagine nel software della fotocamera microscopio, e fare clic su 'annotazioni e misure9 ;. Nella sezione 'lunghezza', selezionare lo strumento 'semplice linea'. Clicca sull'immagine, quindi tracciare una linea lungo la lunghezza del tubo, quindi fare clic destro.
Nota: Il software calcola automaticamente la lunghezza della linea in pixel e mettere i dati in un file. - Ripetere la procedura per tutte le linee della metropolitana nell'immagine selezionando lo strumento 'semplice linea'. Clicca sull'immagine, quindi tracciare una linea lungo la lunghezza del tubo, quindi fare clic destro.
Nota: Il software registrare la lunghezza di ogni linea e visualizzare i dati sullo schermo. - Dopo aver misurato ogni tubo nella foto, fare clic su 'Esporta', poi ha scelto 'Lunghezza al foglio di calcolo'.
Nota: I dati di lunghezza saranno esportati in un foglio di calcolo. - Aggiungere tutti le lunghezze dei tubi dal foglio di calcolo per ottenere la lunghezza del tubo totale. Calcolare e registrare la lunghezza media dei tubi.
Nota: quattro repliche sono consigliati con media e deviazione standard determinati.
5. Recupero cellule dalla matrice extracellulare Cultura
- Cultura e eseguire un test di formazione del tubo (vedere la sezione 2) su una scala più ampia, come un piatto ben 96 non produrrà conta delle cellule sufficiente. Per piastre da 12 pozzetti, utilizzare 500 ml di matrice extracellulare e 500 microlitri della sospensione cellulare HUVEC (1,5x10 5 cellule).
- Incubare le cellule per 4-16 ore per formare tubi. Poi, aspirare il mezzo di coltura cellulare. Lavare le cellule con 1 ml di PBS freddo 1x senza calcio e magnesio.
- Aggiungere 1 ml di ghiaccio freddo PBS-2,5 mM EDTA sulla cultura e tenere in ghiaccio per 10 minuti.
- Rimuovere le cellule e la miscela matrice extracellulare dal piatto con una punta della pipetta 1000 ml con punta tagliata, e poi trasferire in una provetta da freddo 15 ml, lavare il bene con 4 ml di ghiaccio freddo PBS-2,5 mM EDTA e posta in un tubo .
- Mettere i tubi in ghiaccio per 1-4 ore e invertire il tubo di un paio di volte fino a quando tutte le extracellularematrice viene disciolto.
- Centrifugare per 10 minuti a 1.620 xg a 0 ° C
- Risospendere il pellet di cellule con 1 ml di PBS freddo ad un tubo 1.ml sul ghiaccio.
- Centrifugare ancora per 5 min a 3000 xga 0 ° C, quindi smaltire il surnatante.
- Conservare le cellule a -80 ° C.
Risultati
Notevole, sana formazione del tubo endoteliale può essere facilmente contrastata alla formazione tubo inibito nelle immagini di microscopia. Formazione del tubo sano appare come una rete organizzata di strutture capillari simili (Figura 1). In confronto, formazione del tubo inibito si manifesta come cellule sparse (Figura 2). Tubo dati dosaggio formazione è quantificato misurando la lunghezza totale del tubo di tubi capillari (Tabella 1). Oltre lunghezza totale del tubo, la lunghezza media del tubo, il numero totale di tubi, o il numero totale di punti di ramificazione possono essere misurati. formazione del tubo strutturato produce una maggiore lunghezza del tubo rete di dispersi crescita tubo inibito. In figura 3, una curva dose-risposta permette calcolo IC 50 nelle condizioni sperimentali di HUVEC su GFR matrice extracellulare e un inibitore CXCR2 SB225002.

Figura 1. endoteliale formazione t Ube sulla matrice extracellulare e il fattore-ridotta (GFR) matrice extracellulare crescita. Due immagini mostrano la formazione del tubo di successo su matrice extracellulare (A) e GFR matrice extracellulare (B). La rete interconnessa di tubi mostra chiaramente che la crescita dei tubi è sano in questi HUVECs. Barra di scala = 10 micron. Cliccate qui per vedere una versione più grande di questa figura.

Figura 2. L'inibizione della formazione del tubo su extracellulare e fattore di crescita-ridotta (GFR) matrice extracellulare da un SB225002 inibitore CXCR2 (5,6 micron). Due immagini mostrano tuboformazione che è stata inibita da un inibitore CXCR2 SB225002 (5.6 mM) sulla matrice extracellulare (A) e GFR matrice extracellulare (B). I ciuffi isolati di cellule HUVEC visto in questa mostra immagine che le cellule non erano in grado di formare i tubi necessari per collegare tra loro. Barra di scala = 10 micron. Cliccate qui per vedere una versione più grande di questa figura.
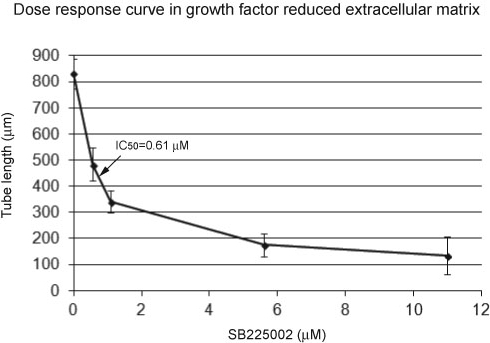
Figura curva di risposta 3. Dose sul fattore di crescita ridotto (GFR) matrice extracellulare. L'asse X indica la lunghezza del tubo e l'asse Y indica la concentrazione di un inibitore CXCR2. La curva dose-risposta dimostra che la risposta HUVEC per l'inibitore CXCR2 sulla matrice extracellulare GFR è dose-dipendente. L'(inibitore massimo la metà IC50y concentrazione) è stato calcolato utilizzando il software 13 e può essere confrontato con una curva dose-risposta per matrice extracellulare, per esempio. IC50 è la concentrazione di inibitore che diminuisce la risposta al 50%. barre di errore rappresentano la deviazione standard.
| Fattore di crescita ridotta (GFR) matrice extracellulare e inibitore (4 replicati ciascuno) | Tubo totale lunghezza media (pixel) (1 pixel = 0,34 micron) | Deviazione standard | P Valore |
| GFR di controllo matrice extracellulare | 2447 | 168,174 | |
| GFR extracellulare SB225002 matrice + 0,56 micron | 1.422,5 | 185.4218 | 0.000395 |
| GFR extracellulare SB225002 matrice + 1,1 micron | 1004 | 126.1784 | 2.14 x 10 -5 |
| GFR extracellulare SB225002 matrice + 5,6 micron | 519,25 | 129.6368 | 4.19 x 10 -6 |
| GFR extracellulare SB225002 matrice + 11 micron | 393,75 | 212.6857 | 1.21 x 10 -5 |
Tabella 1. Quantificare lunghezza totale tubo sul fattore di crescita ridotta (GFR) matrice extracellulare in condizioni variabili. Una parte di una tabella utilizzando le lunghezze dei tubi totali registrate nei campioni cresciuti su matrice extracellulare GFR con concentrazioni variabili di inibitore CXCR2. I dati indicano che l'inibitore CXCR2 inibisce la formazione del tubo. Sono inclusi valori associati come la media di quattro repliche, la deviazione standard, e il valore P. Misurato in pixel per mostrareI dati che vengono esportati. IC 50 può essere calcolato utilizzando il software statistico 13. (1 pixel = 0,34 micron)
Discussione
Nell'effettuare questa analisi, è essenziale per mantenere la matrice extracellulare in ghiaccio oa 4 ° C in ogni momento se non diversamente specificato. Se la matrice extracellulare è lasciata riscaldare superiore a 4 ° C, si polimerizza, e il saggio sarà rovinato. E 'anche importante assicurare che tutto ciò che entra in contatto (ad esempio, puntali, piatto) con la matrice extracellulare è pre-raffreddata per il motivo suddetto. Il numero di cellule seminate in ogni pozzetto è critico, troppo poche cellule non darà il web previsto nel campione di controllo, troppe cellule si formano grandi gruppi di cellule o un monostrato e il test non saranno valide. Un altro fattore importante per il successo di questo saggio è il numero cellulare di passaggio del HUVECs. Il numero di passaggio deve essere sempre inferiore a dieci, altrimenti robusta formazione del tubo non può verificarsi. Inoltre, si dovrebbe assicurare che il terreno di coltura cellulare in uso non è scaduto, o le cellule non sarà praticabile. Alternativavamente, si può Aliquotare il mezzo ei componenti e conservare a -20 ° C per mantenere per un periodo di tempo dopo la data di scadenza. Naturalmente, è ancora preferibile usare il mezzo prima della data di scadenza
Come tutte le procedure, ci sono alcuni svantaggi per lo svolgimento del test formazione del tubo delle cellule endoteliali. Un problema importante è che, perché ci sono diversi tipi di cellule endoteliali e matrici di supporto, i risultati del dosaggio può variare notevolmente a seconda che si utilizza il tipo di cellula e la matrice. Le cellule endoteliali utilizzati (HUVECs, HAECs o HMVECs) sono cellule primarie, sono costosi da ottenere e avere variabilità rispetto alle cellule immortalizzate. Le cellule primarie hanno passaggi limitati per l'uso, e quindi non sono adatti per gli esperimenti angiogenesi lungo termine 14. Per i dati affidabili, si dovrebbe sempre usare gli stessi tipi per il saggio. Come con altri saggi in vitro, i risultati di un test di formazione del tubo deve essere conconfermato in vivo, in quanto risulta dalle condizioni controllate e artificiali di coltura dei tessuti bidimensionali non possono sempre essere riflesse nel complesso biosistema di un organismo vivente. E 'anche importante tenere presente che questo tipo di test può essere utilizzato solo per dimostrare endoteliali formazione del tubo cellule, e non dovrebbe essere usato per testare altri, non-endoteliali, cellule tubo formatore.
Questo test è un metodo piuttosto semplice e rapido per quantificare il potenziale angiogenico di un composto. Esso costituisce anche una piattaforma per ulteriori esperimenti, come solo, non produce informazioni riguardanti il meccanismo specifico con cui il composto in realtà colpisce il processo di formatura recipiente. Tuttavia, l'uso di varie matrici extracellulari è un esempio di come creare ulteriormente un quadro per questioni di ricerca che non è comunemente utilizzato. Ci sono approcci per studiare i meccanismi bio-chimici specifici del composto, tra cui gli inibitori specifici che colpiscono i componenti diil percorso angiogenesi. Un altro approccio può essere per estrarre l'RNA dalle cellule endoteliali e utilizzando RT-PCR (Real Time PCR) 12 per analizzare alterazioni dell'espressione genica che possono causare il comportamento di crescita osservata nel saggio. Le future applicazioni di questo metodo includono trasfettate HUVECs per creare saggi smontabili per le fasi specifiche del percorso di angiogenesi. Esiste la possibilità di applicare questo approccio per studiare il percorso linfoangiogenesi. Modificando i componenti della matrice extracellulare, l'interazione tra matrice e processo cellulare supporto angiogenesi nel tumore può essere ulteriormente chiarita. L'estrazione di RNA e proteine dalle cellule endoteliali in queste condizioni specifiche forniscono dati quantificabili supplementari corrispondenti a l'imaging dei dati.
Divulgazioni
The authors declare that they have no competing financial interests.
Riconoscimenti
The work was funded by the Fund for Medical Research and Education, Wayne State University, Detroit, MI.
Materiali
| Name | Company | Catalog Number | Comments |
| EGM-2 complete growth medium (EGM-2 bullet kit CC-3162 ) | Fisher | NC9525043 | HUVEC complete growth medium: EGM-2 base medium mixed with BBE (Bovine Brain Extract), hEGF (Human Epidermal Growth Factor), Hydrocortisone, GA-1000 (Gentamicin, Amphotericin-B), 2% FBS (Fetal Bovine Serum), VEGF (Vascular Endothelial Growth Factor), hFGF-β (Human Fibroblast Growth Factor Beta), R3-IGF-1 (Long R Insulin-like Growth Factor One), Ascorbic Acid, and Heparin. Aliquot the medium and its components and store them at -20 °C, warm in 37 °C before use. |
| MATRIGEL MATRIX 10ML Growth Factor Reduced (GFR); 10 ml; LDEV-Free | Fisher | CB-40230 | Growth Factor Reduced (GFR) extracellular matrix, keep in -20 °C, warm in 4 °C before use. |
| MATRIGEL MATRIX 10ML; 10 ml; LDEV-Free | Fisher | CB-40234 | extracellular matrix, keep in -20 °C, warm in 4 °C before use. |
| SB225002 | Fisher | 559405 | CXCR2 inhibitor, keep in -20 °C, warm in room temperature before use. |
| Primary human umbilical vein endothelial cells (HUVEC) | ScienCell Research Laboratories | 8000 | culture it according reference 10. |
| Trypsin 0.05%-EDTA phenol red | Invitrogen | 25300-054 | keep in 4 °C, warm in 37 °C before use. |
| Nikon ECLIPSE Ti | Nikon | Inverted Research Microscope. | |
| NIS-Elements AR 4.20.02 64 bit | Nikon | Inverted Research Microscope software | |
| Graph-pad Prism 5 | GraphPad Software, Inc. | scientific 2D graphing and statistics software, to calculate IC50. |
Riferimenti
- Sharma, B., Nawandar, D. M., Nannuru, K. C., Varney, M. L., Singh, R. K. Targeting CXCR2 enhances chemotherapeutic response, inhibits mammary tumor growth, angiogenesis, and lung metastasis. Mol Cancer Ther. 12 (5), 799-808 (2013).
- Birbrair, A., et al. Type-2 pericytes participate in normal and tumoral angiogenesis. Am J Physiol Cell Physiol. 307 (1), 25-38 (2014).
- Ferrara, N., Kerbel, R. S. Angiogenesis as a therapeutic target. Nature. 438 (7070), 967-974 (2005).
- Speyer, C. L., Hachem, A. H., Assi, A. A., Johnson, J. S., DeVries, J. A., Gorski, D. H. Metabotropic glutamate receptor-1 as a novel target for the antiangiogenic treatment of breast cancer. PLoS One. 9 (3), 88830 (2014).
- Gu, X., et al. Human Apurinic/Apyrimidinic Endonuclease siRNA Inhibits the Angiogenesis Induced by X-Ray Irradiation in Lung Cancer Cells. International Journal of Medical Sciences. 10 (7), 870-882 (2013).
- Manjunathan, R., Ragunathan, M. Chicken chorioallantoic membrane as a reliable model to evaluate osteosarcoma-an experimental approach using SaOS2 cell line. Biol Proced Online. 17, 10 (2015).
- Nidhyanandan, S., Boreddy, T. S., Chandrasekhar, K. B., Reddy, N. D., Kulkarni, N. M., Narayanan, S. Phosphodiesterase inhibitor, pentoxifylline enhances anticancer activity of histone deacetylase inhibitor, MS-275 in human breast cancer in vitro and in vivo. Eur J Pharmacol. 764, 508-519 (2015).
- Li, Y., et al. Copper improves the anti-angiogenic activity of disulfiram through the EGFR/src/VEGF pathway in gliomas. Cancer Lett. Aug. , (2015).
- Park, H. J., Zhang, Y., Georgescu, S. P., Johnson, K. L., Kong, D., Galper, J. B. Human umbilical vein endothelial cells and human dermal microvascular endothelial cells offer new insights into the relationship between lipid metabolism and angiogenesis. Stem Cell Rev. 2 (2), 93-102 (2006).
- de Wit, C., Fautz, C., Xu, Y. Real-time quantitative PCR for retrovirus-like particle quantification in CHO cell culture. Biologicals. 28 (3), 137-148 (2000).
- Jaffe, E. A., Nachman, R. L., Becker, C. G., Minick, C. R. Culture of human endothelial cells for derived from umbililcal veins. Identification by morphologic and immunologic criteria. J Clin Invest. 52 (11), 2745-2756 (1973).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon