Method Article
末梢血からの微小胞の単離とキャラクタリゼーション
要約
Extracellular vesicles present in blood have been suggested as novel biomarkers for various diseases. Here, we present a protocol for the isolation of large plasma membrane-derived microvesicles from peripheral blood samples and their subsequent analysis by conventional flow cytometry and Western Blotting.
要約
小さなエンドソーム由来のエキソソーム(EXOS、直径<100 nm)を大型プラズマ膜由来微小胞(MVは、直径> 100 nm)を含む細胞外小胞(電気自動車)のリリースにはすべての生きた細胞内で発生した基本的な細胞プロセスです。これらの小胞輸送タンパク質、脂質およびそれらの起源の細胞およびin vitro試験中の特定の核酸は、細胞間コミュニケーションのメディエーターとしてその重要性を強調しています。電気自動車が正常に様々な体液から単離されており、特に血液中の電気自動車は、癌または感染性疾患のためのバイオマーカーを約束として同定されています。血液中のMVの亜集団の研究を可能にするために、我々は、末梢血サンプルからのMVの標準化された単離および特徴付けのためのプロトコルを提示します。 MVが分画遠心分離によりEDTA抗凝固血漿試料からペレット化し、典型的には100の直径保有している - 600 nmのを。それらのより大きなサイズに、彼らがすることができます簡単にフローサイトメトリー、日常的にほとんどの研究室での臨床診断および利用可能に使用されている技術によって研究されます。孤立MVの品質管理アッセイのためのいくつかの例を説明すると、血液中の異なるMV亜集団を区別するために使用することができるマーカーが提示されます。
概要
最後の年ではin vitro試験での多くは、細胞外小胞(電気自動車)の間コミュニケーションにおいて重要な役割を果たしていることを実証しました。生きている細胞は常にサイズ、コンテンツおよび生合成において異なる小胞を流しました。最も研究電気自動車は、それらが多胞体内腔内小胞として保存されているエンドソームシステムから発信エキソソームです。原形質膜と後者のヒューズたら、含まれる小胞は、エキソソームとしてリリースされている(EXOS、直径30から100 nmの1)。原形質膜2から直接出芽-最後の年でますます注目を集めているEVの第二の集団は、大きな微小胞(1000nmでのMV、直径100)です。
5、そして、彼らは隣のCに転送することができ、タンパク質の過多-小胞の両方のタイプは、 例えば、DNA、mRNA、またはmiRNAの3を脂質二重層に囲まれ、核酸を含有していますells。一般的に、小胞のタンパク質組成物は、起源の細胞の状態を反映しているが、いくつかのタンパク質は、選択的に標的と電気自動車1に濃縮されているように見えます。主要な研究関心は、新規バイオマーカーとしての電気自動車の使用を可能にするかもしれない特定のEVシグネチャを定義するために、異常と疾患細胞から電気自動車を特徴付けることです。特に、多くの場合、腫瘍自体は簡単にアクセスすることはできませんした癌で、血液中の腫瘍特異的な電気自動車をターゲットに液体生検は、治療応答のモニタリングを可能にするか、侵襲的処置6を必要とせずに、原発腫瘍を特徴付けるに役立つかもしれません。
確かに、電気自動車はすでに正常尿7、CSF 8、母乳9または血液10を含む様々な体液から単離されています。いくつかの研究は、異なるヒト疾患におけるEVの数と組成の変化を同定しました。例えば、敗血症患者にプロ凝固剤MVの数です大幅に健康な個体11と比較して増加しました。また、重度の脳マラリア患者において血中の総のMVの増加を観察することができ、血小板由来のMVの数は、コマの深さおよび血小板12と相関します。他の研究では、これが心血管イベント13,14のより高い確率と相関し、全身性エリテマトーデスまたは心不全患者で、後者の場合には内皮由来の小胞の上昇数を報告しています。
特に癌で、血液中の電気自動車は、現在、診断および予後値を有する新規バイオマーカーとして議論されています。このようなMUC1、EGFRまたはFAKなどの腫瘍関連タンパク質を発現するMVのレベルは、乳癌患者15,16の血液中で上昇しているように見えます。 EXOSために、最近の研究は、乳癌のための膵臓癌またはデル-1のためにそのようなグリピカン-1などの腫瘍特異的抗原を担持する血液由来EXOS早期疾患脱可能にすることもを示しました高い特異性と感度17,18とtection。さらに、血清由来の腫瘍EXOSは、治療予測19のためのそれらの使用を示唆しているKRASおよびp53のような突然変異の検出のために使用することができるDNAを含んでいてもよいです。最近の進歩は、特定のマイクロ流体チップを用いて、神経膠芽腫患者の血液中のEXOSの分析を示した治療20の監視を可能にします。まとめると、これらの知見は、小胞の疾患特異的亜集団の分析は、診断、予後だけでなく、治療の選択肢と成功についての貴重な情報を与えることを示唆しています。
しかし、血液からEXOSの単離および分析には時間がかかり、特殊な実験室装置を必要とし、したがって、まだ日常的な臨床診断のために適していません。対照的に、MVSははるかに高速に絶縁さと、それらのより大きなサイズにすることができ、容易に必要とすることなく、フローサイトメトリーによって分析することができる結合するそれらのラテックスビーズがEXOS 18のために必要であるように、21。したがって、ここでは、血液試料からのMVの標準化された単離およびフローサイトメトリーによるMV亜集団のその後の特徴付けのために使用することができるプロトコルを提示します。このプロトコルは、日常の臨床診断のためのMVを使用するために必要とされる大規模な患者群におけるさらなる研究とMVプロファイルの深さの特徴付けにできるようになります。
プロトコル
ヒト被験者を含む全ての実験は、地元の倫理委員会(承認なし。3/2/14)によって承認されています。患者の選択のためには、年齢、性別、現在の治療レジメンと、より多くのようないくつかの要因が、血液中のMVの組成に影響を与えることができ、したがって、前のサンプル収集22,23に考慮されるべきであることに留意すべきです。
血漿サンプルの調製
- EDTA(1.6ミリグラム/ mLの血液)を含有するバキュテナー採血管に21ゲージのバタフライ針を通してドナーあたりの血液の2チューブ - 1を描画します。効率的な血液抗凝固を保証するために、チューブ(複数可)を数回反転させていることを確認してください。
注: - 15 mLのその後のフローサイトメトリーおよびウエスタンブロット分析のための血液の推奨量は5です。 MVの分解及び損失を防止するために、血液試料を30分採血後<取り扱われるべきです。 - で1200×gで15分間サンプルを遠心分離して血漿試料を調製室温(RT)。
- 残りの血液細胞(=下層)からの血漿(=上層)の分離を助けるために、バルブフィルタを適用します。
- 15 mLのチューブにプラズマを転送します。
- 1500×gで15分間遠心し、RTは、より大きな細胞破片をペレット化し、残りの血小板を除去しました。
- 15 mLのチューブに上清を移し、直接-20℃で6ヶ月までのためのMV分離またはストアサンプルを進めます。
注:提示プロトコルは、細胞培養上清からのMV(およびEXOS)を単離するために使用することができます。 24のための80%の密集度 - - そうするためには、60で細胞を培養小胞枯渇FCSを添加した培地で48時間、その後、上清を収集します。 750×gで5分間、4°Cの遠心分離機は、残留浮遊細胞を枯渇させる大きな細胞残屑をペレットに1,500×gで、4℃で5分間、再度新しい15 mLチューブと遠心分離機に上清を充填します。この上清を、次いでMVの単離のために使用することができます2.16 - ステップ2.1で説明したように。
MVの2の単離
- 適切な遠心チューブに血漿サンプルを転送します。必要であれば、試料を希釈し、遠心分離手順の間に薄肉管の崩壊を防ぐためにPBSでチューブを埋めます。
- 14,000×gで、4℃で35分間の遠心分離。
- 上清をデカント、管が逆さまになって、ペーパータオル上に置いておきます。すべての残りの上清は、タオルに浸漬し、それによって試料から除去されるまで5分 - 3を待ちます。
- 千μLPBSでMVペレットを再懸濁し、卓上遠心機で14,000×gで、4℃で35分間、1.5 mLのチューブと遠心分離機に移します。
- 上清を吸引。
- ペレットの大きさに応じて、500μLのPBS - 50にMVペレットを再懸濁します。あるいは、溶解のMV直接、 例えば 、RIPA緩衝液(150mMのNaCl / 0.1%SDS / 0.5%デオキシコール酸Na / 1%トリトンX-100 / 50mMのトリス、pH7.2)でその後のウェスタンブロット分析のために。 -20℃で保存するのMV。彼らは、数ヶ月間安定したままですが、繰り返し凍結融解サイクルを回避することができます。
- オプション:次の実験のためのMVの収量や用量のMVを評価するために、タンパク質アッセイ( 例えば 、ブラッドフォードやローリー法)とMVのタンパク質濃度を決定します。
- 追加EXOSは、血漿サンプルから単離する場合は、11万XG、4°Cで2時間超遠心チューブと遠心分離機にステップ2.3から上清をデカント。ステップ2.3で説明したように上清を除去、千μLのPBSにエキソペレットを再懸濁し、小(1.5 mL)を超遠心チューブに移します。
- 75μLPBSまたはRIPA緩衝液 - 11万×gで、4°C、上清を吸引し、50でエキソペレットを再懸濁で2時間超遠心機。
フローサイトメトリーによるMVの3キャラクタリゼーション
- 転送15μLのPBS + 1%の小胞枯渇ウシ胎児血清(FフローサイトメトリーチューブでCS)。
注:ベシクル枯渇FCSを11万×gで18時間熱不活化(56℃、30分)FCS遠心分離し、先に説明したように24、0.2μmのフィルターを通して上清を濾過することによって調製されます。 - PBS中のMVの5μgの(3μgのも適用可能であり、低利回りの場合)を追加します。
- MV表面に非特異的結合部位をブロックし、それによりバックグラウンド染色を減少させるために室温で30分間、サンプルをインキュベートします。
- タンパク質の関心に対する蛍光標識抗体を追加します。最適濃度を決定し、低い信号対雑音比を保証するために使用する前に、染色のために使用される抗体の量を滴定します。また、陰性対照として未染色のMVと1チューブと(1μgの抗体が使用される場合、例えば 、また、アイソタイプコントロールAN1μgのを使用するのと同じ濃度で一致するアイソタイプ対照抗体で染色したMVの1チューブを含むようにしてくださいバックグラウンド染色を定量するtibody)。
注:これは、異なる蛍光色素に結合された複数の抗体を添加することにより、多色フローサイトメトリーを行うことも可能です。 - 暗所でRTで20分間インキュベートします。
- 250μLのPBSを加え、フローサイトメーターを用いて、試料の測定を進めます。
- ケースではサンプルがすぐに測定することができないことを、4°Cでのサンプルや店舗を修正するために150μLのPBSおよび50μLの4%パラホルムアルデヒド(PFA)を追加します。注意:PFAは有毒です。手袋、適切な個人用保護具を使用します。
- 可能な限り低い値にフローサイトメーターのしきい値を減らして、対数スケールで側方散乱(SSC)プロット対前方散乱(FSC)を使用して、MVの人口を検索します。 MV集団に対するゲートとは、対応するヒストグラムの蛍光シグナルを評価します。
ウェスタンブロッティングによるMVの4キャラクタリゼーション
- 直接MVペレットを再懸濁適切な溶解バッファー( 例えば 、RIPAバッファー)。
- 適切な溶解緩衝液( 例えば 、RIPA緩衝液)中で1:MVペレットを既にPBS中に再懸濁された場合に、それを少なくとも1希釈します。
- ローリーアッセイによって、例えば 、MVのサンプルのタンパク質濃度を決定します。
- 22.5μLRIPA緩衝液中のMVの20μgの - 10を準備します。次いで、95℃で5分間、7.5μL4倍のLaemmliローディング緩衝液と熱を加えます。
- ポリアクリルアミドゲル上の負荷サンプルとは、標準的なプロトコルに従って電気泳動およびイムノブロッティングを行います。
- メンブレンにタンパク質を転写した後、標準的なプロトコルに従ってローディングコントロールとしてポンソー染色を行います。
- 室温で5分間TBST中で脱色膜。
- TBST中の5%BSA中、室温で1時間に30分までのブロック膜。
- 一晩または室温で2時間4℃で一次抗体と共に膜をインキュベートします。
- TBST 3×5分で膜を洗浄します。
- 5%BSA 10,000:1の希釈でHRP結合二次抗体で膜をインキュベートします。注:高いバックグラウンド信号の場合には、代わりにBSAの粉乳を使用します。
- TBST 3×5分で膜を洗浄します。
- ECL検出試薬を有する膜を開発し、化学発光フィルムまたは化学発光画像化システムの信号を検出します。
注:EXOSからのMVを識別するために、チューブリンのようなタンパク質は、使用することができる4アクチニン又はmitofilin主のMV 16,25上に存在する必要があります。 EXOSのためのマーカーとして使用される最もテトラスパニン抗体( 例えば、CD9、CD81)は、還元条件下で動作しないため、70℃で10分間加熱することにより、非還元ローディング緩衝液中で調製されるべき注意を払ってください。
結果
記載プロトコルに従って単離することができるMVの収量を定量化するために、我々は10人のドナーの血液サンプルから単離されたMVの量を計算しました。ローリー法で評価したMVの収率は、mLの血液あたり19.2μgのMVを( 表1)の平均値と10の最大30μgの範囲でした。ナノ粒子追跡分析(NTA)によって決定される粒子濃度は、1.66×10 9からmLの血漿サンプルあたり5.9×10 9粒子( 表2)の平均値で2.36×10 10でした。透過型電子顕微鏡によるMVのさらなる特徴は、脂質二重層に囲まれた、任意の細胞小器官( 図1A)を含んでいなかった直径> 100nm以下と小胞の集団を明らかにしました。 NTAは、単離されたMVのサイズは100から最大600 nmの( 図1B)を範囲であり、平均MVサイズは201であることを確認しましたnmの( 図1C)。ウェスタンブロッティングによる典型的なMVとエキソマーカーの染色はEXOSがチューブリン陰性であったとCD9およびCD81( 図2)に富むながら孤立したMVは、チューブリンのために陽性であったとだけCD9とCD81のわずかな発現を示したことを実証しました。
フローサイトメトリー( 図3A)によって単離されたMVの分析は、通常、細胞培養上清から単離されたMVのために使用したのと同じパラメータを使用してゲート制御することができる定義されたベシクル集団を明らかにし、それは、PBSの測定により得られたバックグラウンドシグナルとは明らかに異なっていました+ 1%のMV( 図3B)を添加せずにFCSの小胞が枯渇します。血液中に存在する異なるMV集団を分析するために、のMVは、 例えば 、CD62P血小板由来のMVのために、CD45白血球由来のMVは、CD235a、異なる血液細胞集団について確立マーカーで染色しました内皮細胞由来のMVのための赤血球由来のMVとCD62E( 図4)。この特徴付けは、MVの大部分は、全ての試料中の血小板によって流されるように見えた一方で、MV亜集団の割合は、調査したドナーの血液サンプル間で異なりことが示されました。
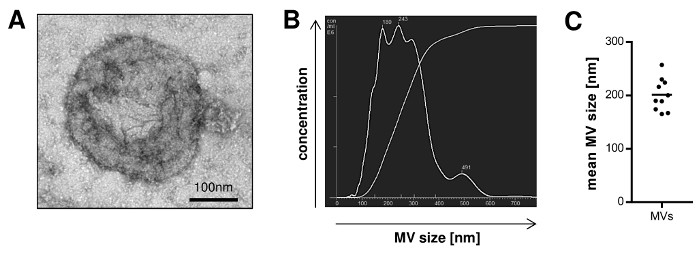
図1:末梢血から分離したMVのサイズ分布。 、単離されたMVは、透過型電子顕微鏡により可視化しました。 B、小胞のサイズ分布を示すMVの代表的なナノ粒子追跡分析(NTA)。 Cは、10の独立した調製物からの平均MVサイズはNTA(平均)で測定しました。 アルをご覧になるにはこちらをクリックしてください。この図のargerバージョン。
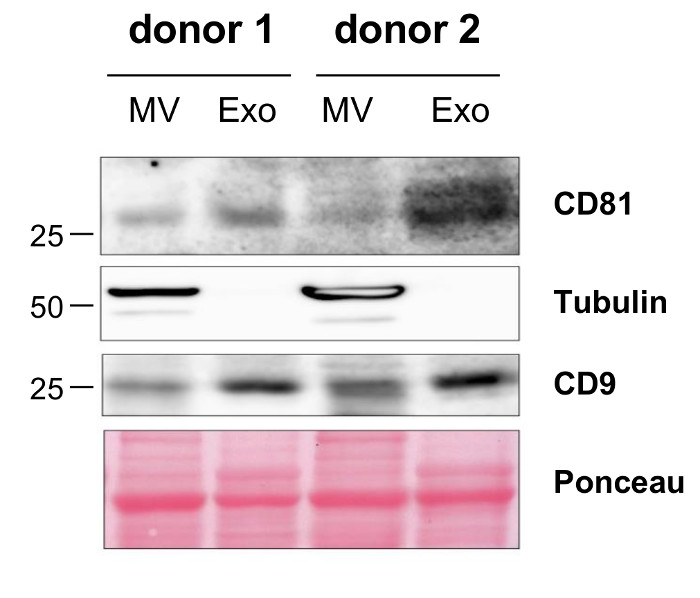
図2: ウェスタンブロッティングによって単離されたMVのキャラクタリゼーション。 2人のドナーから単離されたMVおよびEXOSの示差タンパク質発現をウエスタンブロッティングにより可視化しました。 この図の拡大版をご覧になるにはこちらをクリックしてください。
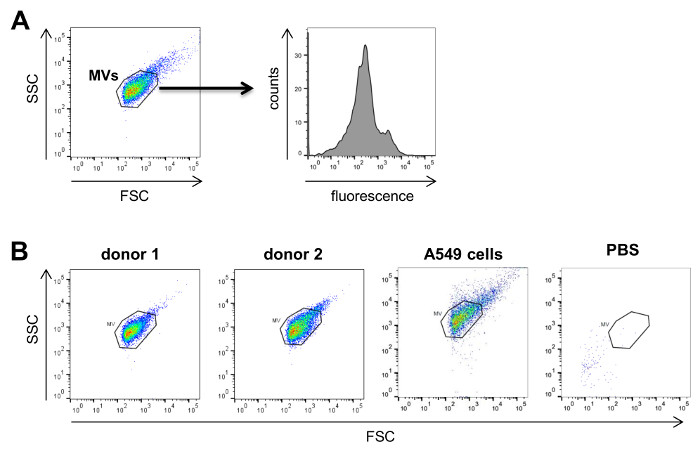
図3: フローサイトメトリーによるMVの分析。 、のMVは、まずそれぞれのMV集団に対してゲートにsidescatter(SSC)プロット対前方(FSC)で可視化されています。その後、これらのMVは、目的の抗原によるために特徴付けられています抗原に対する蛍光標識抗体を用いました。 B、2人のドナーの血漿から単離さMVのためのSSCプロット対典型的なFSC。比較として、唯一のPBS + 1%ベシクル枯渇のMVなしFCSを用いた細胞培養上清、ならびに陰性対照から単離されたA549肺癌細胞由来の腫瘍細胞由来のMVのための典型的なプロットが右側に示されています。 この図の拡大版をご覧になるにはこちらをクリックしてください。
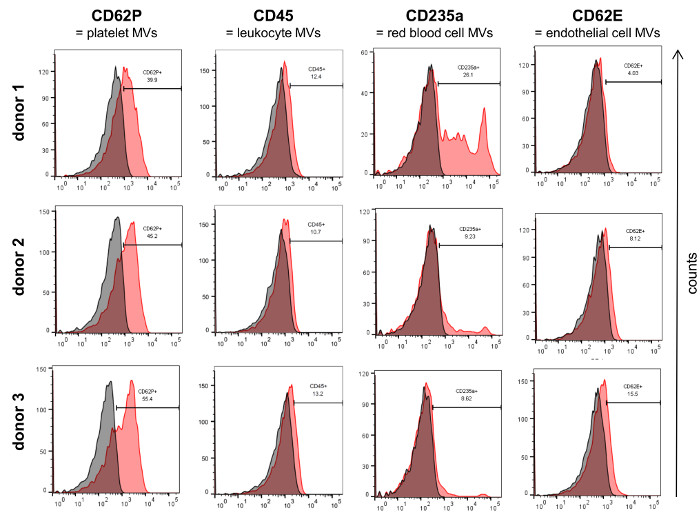
図4: フローサイトメトリーにより単離されたMVのキャラクタリゼーション。 3人のドナーからのMVは、フローサイトメトリーによって確立された血液細胞マーカー(赤)の発現について特徴付けました。それぞれのアイソタイプコントロールはグレーで表示されます。http://ecsource.jove.com/files/ftp_upload/55057/55057fig4large.jpg "ターゲット=" _空白"> この図の拡大版をご覧になるにはこちらをクリックしてください。
| サンプル | MV / mLの血[μgの] |
| #1 | 29.4 |
| #2 | 10.3 |
| #3 | 15.2 |
| #4 | 31.1 |
| #5 | 18.8 |
| #6 | 22.7 |
| #7 | 19.1 |
| #8 | 18.7 |
| #9 | 15.0 |
| #10 | 11.9 |
表1:末梢血サンプルからのMVタンパク質収量。 10ドナーから採取したmLの末梢血あたりのMVの量も示されています。 MV収率はローリーアッセイにより定量しました。
| サンプル | MV / mLの血漿[粒子数] |
| #1 | 6.42E + 09 |
| #2 | 2.36E + 10 |
| #3 | 1.88E + 09 |
| #4 | 6.51E + 09 |
| #5 | 3.48E + 09 |
| #6 | 4.57E + 09 |
| #7 | 2.09E + 09 |
| #8 | 1.66E + 09 |
| #9 | 2.54E + 09 |
| #10 | 6.20E + 09 |
表2:末梢血サンプルからMV粒子収率。 MVの栄はナノ粒子追跡分析によって決定した10人のドナーと粒子数の血漿サンプルから単離しました。 3つの独立した測定値の平均値が示されています。
ディスカッション
血液中の電気自動車に関する最近の研究は、EV組成とカウントは、いくつかの疾患の原因の間に変化することを明らかにしました。したがって、これらの電気自動車の分析およびさらなる特徴は、さらに、診断および予後のための疾患バイオマーカーとしてのそれらの潜在的使用を評価するために、または治療応答を評価するために、高い関心が持たれています。私たちがここで紹介するプロトコルは、任意の細胞小器官を含まない最大600ナノメートルの直径を有する小胞の単離を可能にします。これらの観察は、MVの現在の定義に沿ったものであり、アポトーシス体2の存在を除外します。ウェスタンブロッティングを使用して、私たちはしばしばエキソマーカーとして使用されているテトラスパニンCD9とCD81はわずかしか発現していた一方で、単離されたMVは、チューブリンの高い発現を示すことを実証することができました。これは、MVSがEXOSとは異なり、最近の綿密な特性評価およびプロテオミクス25の両方によってEV集団の比較に適合することを確認します。
血液サンプルの取得時に内容が ">は、MVの劣化を防止するために、静脈穿刺、できるだけ短い血漿調製物の間の時間を維持することが重要である。また、血液試料の長期保存を向上MVを引き起こす血液細胞の活性化につながる可能性が脱落し、最終的にアポトーシス体の放出をもたらす。MVの単離のためのもう一つの重要な考慮事項は、血漿タンパク質または小さいEXOSとMV製剤の汚染を防止するためであるアポトーシス。したがって、スピンダウンした後、可能な限り上清をできるだけ多く除去することが重要です高速超遠心分離によって調製中に凝集体を形成する傾向が14,000 X gでのMV。ペレットは、通常、可視及びしっかりチューブの壁に取り付けられているので、上清を容易にピペットチップを用いて除去することができる。EXOSとは対照的にと頻繁に再懸濁するのは難しいです、この問題は、MVSでは発生しません。我々の研究は、それがpossiであることを示していますフローサイトメトリーによる血中に存在するMVの亜集団を特徴づけることがBLE。ほとんどのフローサイトメーターの検出限界は約200であるが - は300nm、のMVを再現明らかに背景信号からそれらの区別を可能にした同じ分析のパラメータおよびゲートを有するドナーならびに細胞培養サンプルで測定しました。 PBSは、フローサイトメトリー( 図3)の間に高いバックグラウンドを引き起こす可能性のある汚染粒子が含まれていない分析に使用し、測定する前に確認することが重要です。いくつかの小さい方のMVは、フローサイトメトリー法で捕獲されていないかもしれないが、我々はすべての主要な血液細胞集団( 例えば 、血小板、赤血球、白血球、内皮細胞)からのMVを検出しました。 29 -我々の分析では、以前のMV 26日に発見されている別の血液細胞のための標準的なマーカーを使用していました。なお、Tフローサイトメトリーによって、可能な限り最高の結果を得るためにすべての抗体の彼量と濃度は、目的の抗原を発現するMVサンプルに滴定する必要があります。血液中の特定のMV亜集団は、高い特異性で特定されなければならない場合、それぞれのMV上に存在する二つの異なる抗原に対する二重染色を行い、わずか23を分析し 、後続のすべての二重陽性のMVを考慮することが可能です。現在、健康な個体23,30の血液中のMV亜集団の標準範囲を定義するための努力があります。これらの研究は、すでに血小板由来のMVは、私たちの観察と対応している血液中のMVの最大の人口を構成していることが示されています。
MVサンプルを特徴付けるためにフローサイトメトリーの一つの利点は、この方法は、すでによく日常臨床診断におけるバイオマーカーとしてのMVの可能な使用を可能にする最も臨床センターにおける診断目的のために確立されることです。主にフォーカスを持っている血液中の電気自動車に関するこれまでの研究小さいEXOSに編、選択的に目的のエキソの標的集団31,32を分析したり、分析前18にビーズをラテックスにEXOSのカップリングと時間がかかる(2日)分離工程を必要とするように、特定の並べ替え手順のいずれかに依存しています。我々自身の未発表の観察は、全血液製剤からのMVのフローサイトメトリー分析はさらに、そのような選択プロセスなしに、腫瘍由来のMVのようなMVの検出を可能にすることを示唆しています。
ここで紹介するプロトコルは、標準的な実験室の機器との末梢血液サンプルからMVの高速分離を可能にし、それらのその後の特徴付けは、フローサイトメトリーおよびウェスタンブロッティング使用して、一緒になって。全体のプロセスは、疾患のバイオマーカーとしてのMVの可能性を評価するために必要とされる患者の血液中のMVプロファイルに関する今後の研究を促進するであろう約2時間で行うことができます。
開示事項
The authors have nothing to disclose.
謝辞
The authors acknowledge Meike Schaffrinski for excellent technical assistance. We would like to thank the following people for their help in the collection of peripheral blood samples (all from University Medical Center Göttingen): Henrietta Vida (Dept. of Transfusion Medicine), Kia Homayounfar, Lena-Christin Conradi (Dept. of General, Visceral and Pediatric Surgery), Leila Siam, Bawarjan Schatlo (Dept. of Neurosurgery), Hendrik A. Wolff, Martin Canis (Dept. of Otorhinolaryngology, Head and Neck Surgery) as well as all employees of the interdisciplinary short-term oncology. We acknowledge Dirk Wenzel (Max Planck Institute for Biophysical Chemistry, Göttingen) for his help with the electron microscopy of MVs.
The study was funded by the German Ministry of Education and Research (BMBF) project MetastaSys (grant no. 0316173) as well as the German Cancer Aid (grant no. 109615).
資料
| Name | Company | Catalog Number | Comments |
| butterfly needle (21 gauge) | Hospira Deutschland GmbH | 490P29201 | |
| Bovine serum albumin Fraction V | Roth | 8076.3 | For 10x TBS weigh 24.2 g Tris base and 80 g NaCl, ad 1 L H2O and adjust pH to 7.6 |
| For 1x TBS-T mix 100 mL 10x TBS with 900 mL H2O and add 1 mL Tween-20 | |||
| CD235a-PE | Beckman Coulter | A07792 | use 5 µl for staining |
| CD45-FITC | Beckman Coulter | 7782 | use 5 µl for staining |
| CD62E-PE | Biolegend | 336008 | use 0.8 µg for staining |
| CD62P-PE | Biolegend | 304905 | use 0.1 µg for staining |
| CD81 antibody | Biolegend | 349501 | 1:2,000 in 5% BSA in TBS-T; use non-reducing conditions for Western Blotting |
| CD9 antibody | Immunotools | 21270091 | 1:1,000 in 5% BSA in TBS-T; use non-reducing conditions for Western Blotting |
| Chemiluminescence imager ImageQuant LAS-4000 | Fujitsu Life Sciences | ||
| DC protein assay kit II | Bio-Rad | 5000112 | |
| ECL detection reagent | GE Healthcare | RPN2232 | |
| EDTA vacutainers for blood collection | Sarstedt | 01.1605.001 | |
| FACSCanto II | BD Biosciences | ||
| fetal calf serum (FCS) | Invitrogen | 10091148 | heat-inactivated (30 min, 56 °C) |
| filter 0.22 µm | Sarstedt | 83.1826.001 | |
| HRP-coupled anti-mouse secondary antibody | santa cruz | sc-2005 | use 1:10,000 in 5% milk powder in TBS-T |
| HRP-coupled anti-rabbit secondary antibody | santa cruz | sc-2004 | use 1:10,000 in 5% milk powder in TBS-T |
| 4x Laemmli loading buffer, Roti-Load 1 | Roth | K929.1 | |
| microfuge SIGMA 1-15K | Sigma Laborzentrifugen | ||
| milk powder (Blotting-Grade Blocker, nonfat dry milk) | BioRad | 170-6404 | |
| multifuge 3 L-R | Heraeus | ||
| NanoSight LM10 | NanoSight Ltd. | ||
| PBS, w/o Ca and Mg | Pan biotech | P04-36500 | |
| perfusor syringe 50 mL | Braun | 8728844F | |
| Ponceau-S staining solution | PanReac AppliChem | A2935,0500 | |
| rotor Sw32.1 Ti for ultracentrifugation (6 x 17 mL) | Beckman Coulter | ||
| rotor TLA-120.2 for ultracentrifugation (10 x 1.5 mL) | Beckman Coulter | ||
| tubes for flow cytometry (5 mL, round-bottom) | BD Biosciences | 352054 | |
| tubes for ultracentrifugation (15 mL) | Beckman Coulter | 344061 | |
| tubes for ultracentrifugation (11* 34 mm) | Beckman Coulter | 343778 | |
| Tubulin antibody | Millipore | 05-829 | 1:5,000 in 5%BSA in TBST |
| ultracentrifuge Optima L-80 XP | Beckman Coulter | ||
| ultracentrifuge TL-100 | Beckman Coulter | ||
| valve filter Seraplas V15 | Sarstedt | 53,428 | |
参考文献
- Raposo, G., Stoorvogel, W. Extracellular vesicles: Exosomes, microvesicles, and friends. J Cell Biol. 200 (4), 373-383 (2013).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. J Extracell Vesicles. 4 (0), (2015).
- Guescini, M., Genedani, S., Stocchi, V., Agnati, L. F. Astrocytes and Glioblastoma cells release exosomes carrying mtDNA. J Neural Transm (Vienna). 117 (1), 1-4 (2010).
- Balaj, L., et al. Tumour microvesicles contain retrotransposon elements and amplified oncogene sequences. Nat Commun. 2, 180(2011).
- Lee, T. H., et al. Oncogenic ras-driven cancer cell vesiculation leads to emission of double-stranded DNA capable of interacting with target cells. Biochem Biophys Res Commun. 451 (2), 295-301 (2014).
- Chi, K. R. The tumour trail left in blood. Nature. 532 (7598), 269-271 (2016).
- Pisitkun, T., Shen, R. -F., Knepper, M. A. Identification and proteomic profiling of exosomes in human urine. Proc Natl Acad Sci USA. 101 (36), 13368-13373 (2004).
- Harrington, M. G., et al. The morphology and biochemistry of nanostructures provide evidence for synthesis and signaling functions in human cerebrospinal fluid. Cerebrospinal Fluid Res. 6, 10(2009).
- Admyre, C., et al. Exosomes with Immune Modulatory Features Are Present in Human Breast Milk. J Immunol. 179 (3), 1969-1978 (2007).
- Caby, M. -P., Lankar, D., Vincendeau-Scherrer, C., Raposo, G., Bonnerot, C. Exosomal-like vesicles are present in human blood plasma. Int Immunol. 17 (7), 879-887 (2005).
- Nieuwland, R., et al. Cellular origin and procoagulant properties of microparticles in meningococcal sepsis. Blood. 95 (3), 930-935 (2000).
- Mfonkeu, J. B. P., et al. Elevated Cell-Specific Microparticles Are a Biological Marker for Cerebral Dysfunctions in Human Severe Malaria. PLoS One. 5 (10), e13415(2010).
- Parker, B., et al. Suppression of inflammation reduces endothelial microparticles in active systemic lupus erythematosus. Ann Rheum Dis. 73 (6), 1144-1150 (2014).
- Nozaki, T., et al. Prognostic value of endothelial microparticles in patients with heart failure. Eur J Heart Fail. 12 (11), 1223-1228 (2010).
- Galindo-Hernandez, O., et al. Elevated concentration of microvesicles isolated from peripheral blood in breast cancer patients. Arch Med Res. 44 (3), 208-214 (2013).
- Menck, K., et al. Tumor-derived microvesicles mediate human breast cancer invasion through differentially glycosylated EMMPRIN. J Mol Cell Biol. 7 (2), 143-153 (2015).
- Moon, P. -G., et al. Identification of Developmental Endothelial Locus-1 on Circulating Extracellular Vesicles as a Novel Biomarker for Early Breast Cancer Detection. Clin Cancer Res. 22 (7), 1757-1766 (2016).
- Melo, S. A., et al. Glypican-1 identifies cancer exosomes and detects early pancreatic cancer. Nature. 523 (7559), 177-182 (2015).
- Kahlert, C., et al. Identification of Double-stranded Genomic DNA Spanning All Chromosomes with Mutated KRAS and p53 DNA in the Serum Exosomes of Patients with Pancreatic Cancer. J Biol Chem. 289 (7), 3869-3875 (2014).
- Shao, H., et al. Protein typing of circulating microvesicles allows real-time monitoring of glioblastoma therapy. Nat Med. 18 (12), 1835-1840 (2012).
- Lässer, C., Eldh, M., Lötvall, J. Isolation and Characterization of RNA-Containing Exosomes. J Vis Exp. (59), (2012).
- Witwer, K. W., et al. Standardization of sample collection, isolation and analysis methods in extracellular vesicle research. J Extracell Vesicles. 2 (0), (2013).
- Gustafson, C. M., Shepherd, A. J., Miller, V. M., Jayachandran, M. Age- and sex-specific differences in blood-borne microvesicles from apparently healthy humans. Biol Sex Differ. 6, (2015).
- Shelke, G. V., Lässer, C., Gho, Y. S., Lötvall, J. Importance of exosome depletion protocols to eliminate functional and RNA-containing extracellular vesicles from fetal bovine serum. J Extracell Vesicles. 3 (0), (2014).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogeneous populations of extracellular vesicle subtypes. Proc Natl Acad Sci USA. 113 (8), E968-E977 (2016).
- Dignat-George, F., Boulanger, C. M. The Many Faces of Endothelial Microparticles. Arterioscler Thromb Vasc Biol. 31 (1), 27-33 (2011).
- Esser, M. T., et al. Differential Incorporation of CD45, CD80 (B7-1), CD86 (B7-2), and Major Histocompatibility Complex Class I and II Molecules into Human Immunodeficiency Virus Type 1 Virions and Microvesicles: Implications for Viral Pathogenesis and Immune Regulation. J Virol. 75 (13), 6173-6182 (2001).
- Canellini, G., et al. Red blood cell microparticles and blood group antigens: an analysis by flow cytometry. Blood Transfus. 10 (2), s39-s45 (2012).
- Scholz, T., Temmler, U., Krause, S., Heptinstall, S., Lösche, W. Transfer of tissue factor from platelets to monocytes: role of platelet-derived microvesicles and CD62P. Thromb Haemost. 88 (6), 1033-1038 (2002).
- Berckmans, R. J., et al. Cell-derived microparticles circulate in healthy humans and support low grade thrombin generation. Thromb Haemost. 85 (4), 639-646 (2001).
- Rupp, A. -K., et al. Loss of EpCAM expression in breast cancer derived serum exosomes: role of proteolytic cleavage. Gynecol Oncol. 122 (2), 437-446 (2011).
- Taylor, D. D., Gercel-Taylor, C. MicroRNA signatures of tumor-derived exosomes as diagnostic biomarkers of ovarian cancer. Gynecol Oncol. 110 (1), 13-21 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved