Method Article
示差走査熱量測定 - タンパク質抗原の熱安定性および立体配座を評価するための方法
要約
示差走査熱量測定は、タンパク質を変性させるのに必要な熱転移温度(S)との総熱エネルギーを測定します。得られた結果は、ワクチン製剤中のタンパク質抗原の熱安定性を評価するために使用されます。
要約
示差走査熱量測定(DSC)は、温度の関数として試料のモル熱容量を測定する分析技術です。タンパク質サンプルの場合には、DSCプロファイルは、熱安定性に関する情報を提供し、ある程度の構造的立体配座を評価するために使用することができる構造の「指紋」として働きます。 (; T mの融解温度)および三次構造の安定化相互作用を破壊するために必要なエネルギー(エンタルピーを、ΔH)タンパク質の、それを熱転移温度を測定し、示差走査熱量計を用いて行われます。比較は、製剤だけでなく、製造ロット間で行われ、得られた値の違いは、熱安定性および高次構造の違いを示しています。安定性研究のための工業環境でのDSCの使用を示すだけでなく、主要な製造工程を監視データは、このプロの有効性の証明として提供されていますトコール。タンパク質の立体構造の熱安定性を評価するための他の方法と比較して、DSCは、費用対効果のある、いくつかの試料調製工程を必要とし、また、タンパク質アンフォールディングプロセスの完全な熱力学的プロフィールを提供します。
概要
示差走査熱量測定(DSC)を直接規制温度変化1、2、3、4、5、6、7、8、9時の基準に対する試料で行われる熱エネルギー吸収の差を測定する実験的方法であります、10、11、12。示差走査熱量計で行う、方法は、同じ時刻2にわたる細胞の両方の温度を上昇させながら、 同時に試料セル及び基準セルに13の熱エネルギーを導入することを含みます14。サンプル及び基準の組成の違い、エネルギーの異なる量の細胞を2、12、13の温度を上昇させるために必要とされるであろう。したがって、セル間の温度差を補償するために必要なエネルギーの過剰な量が測定され、直接試料1,3の特定の熱力学的特性に相関します。
1960年代には、MJオニールとパーキンエルマーのE.ワトソンは固体材料2、3、4の熱流を測定するための第一の示差走査熱量計を開発しました。並行して、物理学研究所のPLプリバーロフとDR Monaseldze EL、グルジア共和国(旧ソ連)はfoを使用することができるユニークな差動断熱熱量計を作成しましたR生化学研究5、6。その後、グルジアの物理学研究所、共和国でAndronikashviliのチームは、このようなDSC 7、8、9を使用して繊維質や球状タンパク質、DNA、およびRNAなどの生体分子の熱容量を報告しました。スターテバント10、11、12、はBrandts 13、およびプリバーロフ14、15、16が率いるいくつかのチームは、理論とタンパク質のアンフォールディングの熱力学詳細を調査するために、DSCの実用的なアプリケーションの開発に焦点を当てました。このようなファージ、葉緑体、リン脂質液晶、および食肉タンパク質などの大規模な超分子構造を研究する上でDSCの値も17を報告されています >、18、19、20のsup。
DSCは現在、生体分子の熱安定性の評価のために、特にタンパク質1、21、22医薬品の研究・開発では一般的となっています。これは、実験23、24を実行するために使用される計測器の感度と自動化の観点から主に進歩によるものです。ここでは、DSC実験、温度の関数として、すなわち、モル熱容量の最終結果は、次の熱力学的パラメータを推定するために使用される(熱容量(ΔCP)、エンタルピー(ΔH)、エントロピーの変化(ΔS)以下の式を用いて、およびギブスの自由エネルギー(ΔG)):
eq1.jpg "/>(1)
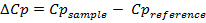 (2)
(2)
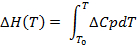 (3)
(3)
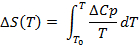 (4)
(4)
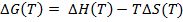 (5)
(5)
ここで、Cpは熱容量を測定します。 qは、試験物質への熱の流れです。 T 0とTは、それぞれ22、25移行の初期及び最終温度です。これは、上記の式は、2つの状態遷移と22を展開可逆熱を受けることができる単一ドメインタンパク質に適用されることも注目に値します。より複雑なタンパク質( 例えば 、非二状態タンパク質、およびオリゴマー)の解析時間Friere らによって報告されてAVE。 26; Johnson ら。 27;そして、Kasimova ら 。 28。
タンパク質は、2つの状態遷移を起こしたり熱変性中の中間体を形成するかどうかを決定するために、実験的に誘導されたエンタルピー(ΔHは、またとして熱量測定エンタルピーΔH カルと呼ぶ)も(下記のファントホッフの式を用いて導出エンタルピーと比較され、ファントホッフのエンタルピーと呼ばれる;ΔHVH):
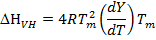 (6)
(6)
T mは転移の中間点温度である場合、Rは理想気体定数(1.987校正モル-1 K -1)であり、Yは、展開状態16、29中のタンパク質の集団の画分です。もしΔHVHは ΔH カルに等しいです。またはΔHVH /ΔH カルが 1に等しい場合、タンパク質は、「全か無か」の遷移( すなわち 、二状態遷移)16、25、29を受けます。しかし、ΔHVHは ΔH カル未満である場合、またはΔHVH /ΔH カルが 1未満である、タンパク質は、非二状態遷移16、25、29を受けます。 ΔHVH /ΔH カルの割合も、熱力学協同組合単位またはドメイン26として融解タンパク質構造の割合に相当します。
ΔGおよびΔHのような上記の熱力学的パラメータは、生物学的製剤を含む、タンパク質の熱安定性に関する有用な情報を提供します 30。彼らはこのプロトコルのために報告されている値であるためしかし、重点は、このマニュアルでT mとΔH上に置かれます。 T mは 、折り畳まれたタンパク質の折り畳まれていない状態が平衡状態にある遷移( すなわち 、ΔG= 0)25、31の中間点温度です。その熱安定性31より高い、タンパク質のT mより高いです。 DSC実験16、25の終了時に生成ΔHは(またサーモグラムとしても知られる)対温度グラフ熱容量(S)ピーク下の面積に相当します。これは、タンパク質を変性させるために必要なエネルギーであり、以下の式を使用して、タンパク質製剤中の活性画分(Fのa)から ( すなわち、試料中の活性なコンフォメーションを有するタンパク質の割合)を推定するために使用することができます。
jove_content ">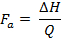 (7)
(7) ΔHは、タンパク質試料の実験的に誘導されるエンタルピーであり、Qは、十分に特徴付け参照または標準化されたタンパク質22に対して決定エンタルピーです。 F aの推定は、製品のリアルタイムの安定性を監視するだけでなく、ICH指針32によって必要とされるストレス条件下で安定性試験を行うために重要です。 ΔHの比較はまた、タンパク質31の三次構造の立体構造のコンパクト化に関する情報を提供します。
このプロトコルは、工業環境でのタンパク質の熱安定性を評価するための手順を詳述し、広くワクチンの処方のために使用されてきました。これは、再現性のある結果Fを生成する自動化された示差走査熱量計を使用して開発されましたまたは300 / mlのような低いタンパク質濃度。
プロトコル
1.機器の起動
- 示差走査熱量計に切り替えて、サンプルの沸騰を抑えるだけでなく、形成は高温で泡を防止するために、細胞内の圧力を増加させます。これは、典型的には、システム内に窒素を供給することによって達成されます。
- 電池の構成材料( 例えば 、タンタル、金、白金など )に応じて、細胞の損傷を避けるために、メーカーの推奨圧力に応じて窒素ガス供給の圧力を調整します。例えば、この手順を開発するために使用される器具45 psiの窒素ガスの供給圧力を設定し、80 psiの上記圧力は、細胞に損傷を与えることができます。
- すべての洗浄剤貯留が必要量に満たされていることを確認してください。必要な洗浄剤は、各サンプルの実行後に、それぞれの細胞を洗い、きれいにする洗剤と水を含んでいます。
- 試料保持室の温度を設定します。適切な値は、好ましくは5℃に、実験の前に、サンプルの完全性を維持します。
2.試料の調製
- 実験のための基準として使用されるバッファーに対してサンプルを透析。あるいは、タンパク質精製( すなわち、カラム溶出)の最終段階で収集溶出緩衝液を使用することができます。
- このようなKjedahl法33やローリー法34として最も適切なタンパク質濃度決意法を用いたタンパク質試料の濃度を決定します。結果の客観的な比較のために、同じ研究内で一貫して同じメソッドを使用します。必要な濃度範囲は、機器の機種に依存して変化し得ます。 1mg / mlの - このプロトコルで使用される機器については、好適な動作範囲は0.5です。
- ボリュームinaccurを引き起こす可能性がありますマイクロバブルを取り除くために、真空中でサンプルとリファレンス・バッファを脱気ACY。このステップは、新しい熱量計モデルのためにスキップすることができます。
- 層流生物学的封じ込めのキャビネット内にマイクロピペットと滅菌チップを使用して、楽器との互換性96ウェルプレートにペア内のサンプルとそれぞれのバッファーをロードします。それぞれバッファバッファと水のスキャンのための水のバッファと、最後の2組でウェルの最初の2つのペアを入力します。バッファバッファスキャンは計測(計装エラーのすなわちアセスメント)をサンプリングするだけでなく、ベースラインを確立する前に、機器の適合性を検証します。水のスキャンが実行されている間、細胞をきれいにします。
- 封止フィルムで96ウェルプレートを覆い、ウェルを適切に試料汚染を避けるために安全キャビネットの外板を取る前に密封されていることを確認してください。
- 適切な方向での試料保持区画内にプレートを置きます。
3.実験パラメータ設定
注意:iに応じて、nstrumentation、サンプルを手動でシリンジを用いて、または自動的にオートサンプラーを用いて細胞内にロードすることができます。この場合( すなわち、工業環境)において、オートサンプラーは、時間を節約するために使用されます。
- 取得ソフトウェアを使用して、プレートを、2.4節ごとにロードされた順序でサンプル情報を入力します。利用可能な場合は濃度を入力し、そうでない場合は、前のデータ解析(セクション4.2)に解析ソフトに濃度値を入力します。
- 何の洗剤残留物を細胞内に残っていないされていることを確認するために、複数の水すすぎ工程により従うべきすべてのサンプルスキャン、前に洗剤での細胞の洗浄を保証するオプションを選択します。
- 20°Cまでの実験の開始温度を設定するが、これは、試料の事前の知識に依存して変化し得ます。低い開始温度が未知のサンプルに適用することができるが知られているタンパク質を、予め定め開始温度は、使用することができます。
- 最終温度を設定実験の、 例えば 100°C。最終温度は、試料の事前の知識に依存して変化し得ます。
- 典型的な走査速度で実験のスキャン速度、 例えば 60℃/ hに設定します。しかし、スキャン速度は、サンプルの予備知識、 例えば、90°C /時間、または120°C /時間に応じて変えることができます。展開の動態を評価するために、異なるスキャン速度における未知のサンプルをスキャンすることをお勧めします。
- 熱変性の可逆性を調査するための再スキャンのサンプル。第2のスキャンについて得られたエンタルピーは、最初のスキャンのためのエンタルピー値の少なくとも80%である場合、タンパク質のアンフォールディングが可逆的と考えられています。
- 熱量計の細胞の完全性を維持するために10℃にポスト実験サーモスタットを設定します。
- 実験のセットアップパラメータは、実験を実行する前に、正しいことを確認します。すべての場所にある場合は、実験を開始します。
4.データアンalysis
- 実験からの生データを取得し、分析のために一度に一つのサンプルを選択します。サンプルスキャンから減算参照スキャン、 すなわちバッファ、。
注:リファレンスの減算は、DSC機器の新しいモデルによって自動的に行われます。 - それはセクション3.1に従って省略された場合、サンプル濃度値を入力します。
- 取り付け、展開時に水に疎水性基の曝露によって引き起こされるタンパク質の折り畳みと展開された状態の熱容量の違いを考慮して、取得したサーモグラムからベースラインを引きます。直鎖状または三次曲線のフィッティングは、試料のDSCプロファイルの形状に応じて適用することができます。一貫性を保つため、フィッティングの同じタイプは、研究、 例えばリアルタイムの安定性試験の間に使用する必要があります。このステップは、遷移のエンタルピーを得るために、ピーク積分の曲線を処理するために必要とされます。
- 非線形最小二乗フィットを用いてピークの統合を実行します。製品に基づいて知識は、二つの状態又は非二状態モデルを適用します。二状態モデルは、単一の協調熱転移のために使用され、さらに製品知識が利用可能になるまで未知のタンパク質のために、非2状態モデルを適用することができます。該当する場合は、 カイ二乗値が一定になるまで機器のソフトウェアの反復曲線フィッティング関数を用いてフィッティングカーブを調整します。
- 得られた結果は、転移温度(Tm)は、熱量測定エンタルピー(ΔH)、およびサンプルのファントホッフのエンタルピー(ΔHVH)の中点の値が表示されます。
結果
熱量計は、実際に試料溶液、バッファ35への熱流量の差を測定するように、ほとんどのDSC実験からの生データは、温度グラフに対する熱流束として提示されます。両方の細胞( すなわち 、サンプルとリファレンスセル)が実験中に同一のソリューションが含まれている場合そのため、スキャンからの生データは、観察されないピークが平坦な線でなければなりません。観察された任意のピークはなぜ分析をサンプリングする前にバッファのスキャンを実行している計装エラー( 例えば 、損傷または汚染された細胞)に帰することができる適切なシステム適合性試験です。 図1は、熱量計分析をサンプリングする前に良好な作動状態にあったことを示す典型的なバッファスキャンの結果を示しています。
図2は、DSC実験の生データは差分に行っ示しています2つのタンパク質試料のerentたくさん。以前に示唆されるように、観察されたピークは、サンプルと、それぞれのバッファの熱流束の差があります。サンプル濃度の差は、熱量計によって記録された熱容量の変化を引き起こす可能性があります。しかし、これらの変化は、手順のセクション4.2に従ってサンプル分析の間に正規化されます。より高い濃度は、より低い濃度での遷移に寄与しない付加的な熱力学的ドメインを明らかにすることができます。また、各遷移は、タンパク質36の一つ以上の構造ドメインを含むことができる熱力学的ドメインを表します。この場合には、タンパク質1は、協働して溶融3つの構造ドメインを有します。
図3は、ベースライン減算および反復曲線Fiの後、タンパク質1及び図2に示す2、 すなわちのための生データの分析から生成された結果を示していますめの設定。得られたサーモグラムは、レート(自動解析ソフトウェアで予め設定されたアルゴリズムによって行わ)及び濃度を走査するための正規化されています。このように、温度グラフ対同等熱容量の実験の結果を提示します。解析ソフトウェアは、タンパク質のアンフォールディングの協同に応じて上に与えられた方程式のバリエーションを使用して他の熱力学的パラメータを導出するために、このようなT mとΔCPとして温度グラフ、対熱容量からのデータを使用しています。
未知のサンプルをテストする場合、適切な温度範囲を設定することは非常に重要です。そうでなければ、不完全なサーモグラムを図4に示すように、生じ得ます。このようなプロファイルのT mを導出することができるが、ΔHを正確に決定することができません。したがって、サンプルは完全に熱転移をキャプチャするために広い温度範囲で再テストする必要があります。いくつかのタンパク質はまた、再adilyフォームが増加移行後の熱容量で、その結果、完全な変性の後に集約します。 図2(b)に示すように 、これは多くの場合、不完全なサーモとして表示されます。しかし、より高い最終温度でテストすることをそこにサーモのその領域における構造遷移の発生であるか、それは、タンパク質凝集体の単なる熱吸収効果であるかどうかを確認することができます。
熱安定性は、業界37におけるタンパク質およびタンパク質ベースの製品の最も重要な物性の一つです。医薬品には、処方緩衝液や、湿度や温度などの環境要因を含む様々な条件下で生物製剤の安定性を決定するために使用されます。また、生産ロット間のコンホメーションの一貫性を確保するために、主要な製造工程( 例えば、精製および解毒)を監視するために使用されます。 >図5及び図6は、2つの異なるタンパク質の安定性および構造的立体配座にそれぞれの化学的解毒および保管条件の影響を調べるために、DSCの使用を示しています。 TmとΔHに有意差はそれぞれ、コンフォメーション変化およびタンパク質分解を示しています。また、 図6の第三の遷移損失はさらにサンプルが(多角度光散乱(SEC-MALS)によるサイズ排除クロマトグラフィーを用いて分析した場合、分子量の減少により確認されたドメインの分解を示しますデータ示さず)。
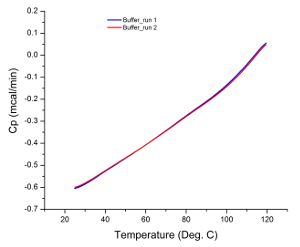
図1:バッファをスキャンします。観察されないピークを持つ各スキャンの勾配の類似性は、楽器が良好な作動状態にあり、再現可能な結果を生成したことを示します。//ecsource.jove.com/files/ftp_upload/55262/55262fig1large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。
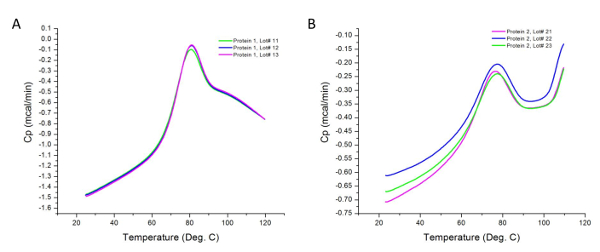
図2:DSC実験から収集された生データ。これらのグラフは、( すなわち、ベースラインの前の減算とカーブフィッティングに)実験ラン以降に取得した未解析(生)データの良い表現です。各行は製造ロットを表します。タンパク質2は、サーモのポスト遷移領域における100℃以上の熱容量の増加、その結果、加熱時より容易に凝集する傾向があります。 この図の拡大版をご覧になるにはこちらをクリックしてください。
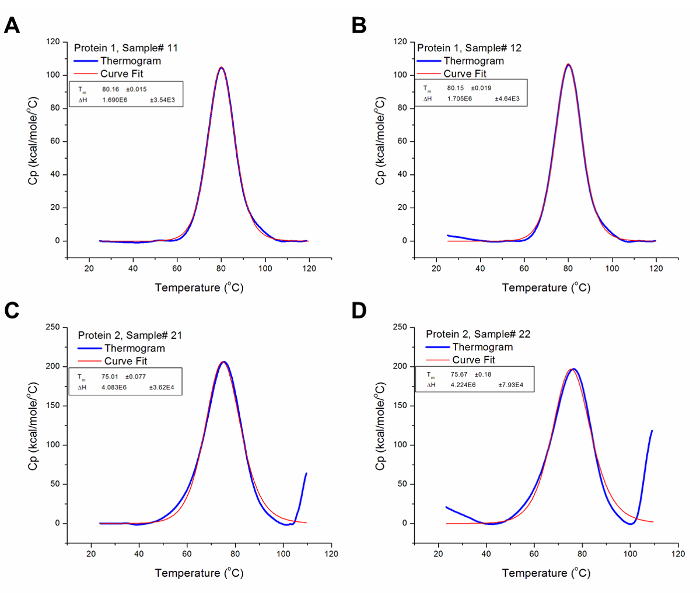
図3:DSCデータ分析。これらのグラフは、( すなわち 、ベースライン減算し、カーブフィッティング後の)分析DSCデータの良好な表現です。赤い線は、サーモにベストフィットの曲線を表す青い線は、ベースラインを引いた後のサーモグラムを表します。タンパク質1サンプル#12(A) の T mおよびΔHは、それぞれ80.16℃、1.69×10 6カロリー/モルです。 (B)タンパク質1サンプル#13のT mおよびΔHは80.15℃であり、それぞれ1.71×10 6カロリー/モルです。 (C)タンパク質2サンプル#21のT mおよびΔHは75.01℃であり、それぞれ4.08×10 6カロリー/モルです。タンパク質2サンプル#22のために(D)T mとΔHはそれぞれ75.67℃、4.22×10 6カロリー/モルです。 にはこちらをクリックしてくださいこの図の拡大版を表示します。
図4:不完全なサーモ。生データは不十分な温度範囲で分析タンパク質1のために収集します。実験の最終温度は120℃に設定した図2Aのための実験と比較して、タンパク質の全体の遷移プロファイルに対応しなかった90°Cに設定しました。 この図の拡大版をご覧になるにはこちらをクリックしてください。
図5:データはプロテイン1(A)の立体構造上の化学解毒の効果を示す分析タンパク質1は、その天然のコンフォメーションとヘクタールで毒素でありますそのT mは 2.57×10 5カロリー/モルで56.84℃、ΔHでね。 (B)タンパク質1( すなわちトキソイド)の無毒化された形は、それぞれの T mと81.01°CのΔH値および1.89×10 6カロリー/モルを持っています。したがって、解毒ステップは、その無毒化形式に大きな安定性(より高いT m)を付与するタンパク質1の構造の立体配座に変化のいくつかのフォームを導入することを結論付けることができます。 この図の拡大版をご覧になるにはこちらをクリックしてください。
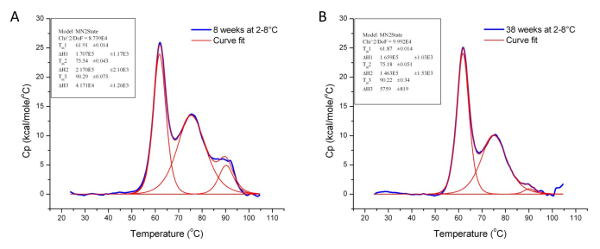
図6:これらのグラフは、保存温度の影響を示すデータは、タンパク質3の立体構造上の保存条件の影響を示す分析 (2から8℃)での安定性とProの三次構造に3 30週間以上TEIN。ストレージの8 番目の (A)及び38週目 (B)におけるタンパク質3のT m及びΔHの値を以下の表1に示します。 この図の拡大版をご覧になるにはこちらをクリックしてください。
| サンプル | Tmの1(°C) | ΔH1(CAL /モル) | Tmの2(°C) | ΔH2(CAL /モル) | Tmの3(°C) | ΔH3(CAL /モル) |
| 8週間、2-8℃で保存されたタンパク質3 | 61.91 | 1.71×10 5 | 75.54 | 2.17×10 5 | 90.29 | 4.17×10 5 |
| 61.87 | 1.66×10 5 | 75.18 | 1.46×10 5 | 90.22 | 5.76×10 5 |
表1:2でのストレージの8 番目と38 番目の週でタンパク質3のTm及びΔH値- 8℃。両方の時点でT m値が類似しているが、ΔH値の差は、タンパク質3の三次構造は、指定された保存条件の下で30週間にわたって低下したことを示しています。
ディスカッション
この手順が正常に安定性と製品の比較研究21を含む様々な特性テストパッケージに組み込まれています。リアルタイム安定性試験では、DSCは、それらの貯蔵寿命を決定するために、T mを監視するだけでなく、時間をかけての生物製剤のFを推定するために使用されます。製品の比較に関しては、プロセス及び設備の変更の影響だけでなく、製造ロットの構造的コンホメーションに重要な製造工程の効果を評価するために使用されます。これは、典型的に理想的な製品として指定された参照製品に製造ロットのΔHを直接比較することを含みます。また、DSCは、製品の処方研究37のために有用な分析ツールであることが証明されています。異なる緩衝液における異なる濃度でのタンパク質のT mは 、に最も安定proffers製剤を決定することができますタンパク質。
この方法とその結果の客観性の信頼性を確保するためには、同一の研究( 例えば 、ワクチン製剤試験)内で実行するために実行から一貫性のあるテスト・パラメータを維持することが重要です。しかしながら、手順は、種々のタンパク質の物理的性質の違いに対応するように変更することができます。することができる修飾の例は、実験38、39の走査速度を変化させるれます。より速い走査速度で試験したときに、加熱成形凝集する傾向があったタンパク質( 例えば、120℃/ h)は熱量計の毛細管を詰まらならびに熱転移プロファイルに凝集体の寄与を回避します。これは、スキャン速度は、DSC実験38の結果に影響を与えることができることは注目に値します。熱転移のピークの広がりは、いくつかのプロの走査速度の増加に伴って観察されていますteins;ただし、T mは 38かなり一定のままでした。また、試料調製のための透析及び脱ガスステップも正確な結果31のために非常に重要です。透析は、試料の組成およびバッファ内の唯一の違いはタンパク質であることを保証します。従って、試料によって吸収すべての過剰な熱は、タンパク質の熱容量に起因し得ます。熱力学的パラメータの外挿が展開イベントが一定の体積と圧力31の下で発生していることを前提としていたよう脱気は、正確な量の分析を保証します。仮定の一定の圧力部分は、手続きのセクション1.1に従ってシステムの窒素加圧により会計処理されます。
このような円偏光二色性(CD)および蛍光分光法のようなタンパク質の立体配座の安定性を決定する他の方法と比較して、DSCは、COMに多くの利点を提供しますコストと時間の節約など、商用の設定。まず、示差走査熱量計の断熱設計は、CDおよび蛍光分光6のための計装と測定値と比較して、より良好な温度精度で熱安定性の測定を可能にします。第二に、CDとは異なり、DSCデータの精度は、タンパク質39、40のヘリシティに依存しません。ただし、CDはDSC 41に相補的であろう二次構造、の展開に関する追加情報を提供します。また、DSCシステムの加圧は、サンプルを沸騰させずに広い温度範囲でのテストを可能にします。従って、タンパク質の広い範囲は、DSCによって試験することができます。
DSCは、生物製剤の熱安定性を決定するために、比較的迅速かつ簡単な方法であるが、それには限界がないわけではありません。まず、ベースライン減算ステップは、生データの分析に人間の矛盾のいくつかのフォームを紹介します。従って、結果のばらつきは、異なるユーザ間で観察され得ます。第二に、示差走査熱量計は、バルク製造規模で達成することは困難かもしれない最低濃度限界を有しています。第三に、不可逆的な熱変性のΔHは絶対的なものではありません。これは同様のシナリオで誘導されたΔG(タンパク質の安定性の指標は)誤解を招くことができることを意味します。さらに、この方法は、精製されたサンプルに最適です。相互作用が存在しない場合は調査中のタンパク質、または新しい熱転移の出現との相互作用がある場合、不純物の存在は、T mのシフトを引き起こす可能性があるのいずれか。いずれにしてもサーモ上でこれらの追加機能は、誤ってこのように、結果の解釈に影響を与え、サンプルに起因することができます。これらの制限にもかかわらず、DSCは番目の詳細な熱力学の情報を提供することができる信頼性の高い方法のまま適切に42実装されていればEタンパク質は、プロセスを展開します。
結論として、DSCは、ワクチン製品およびその中間体のためのコンホメーションの読み出しツールとしてかなりの利点を提供しています。同一の製品の多くのアレイのために収集二つのパラメータ、T mおよびΔHは、タンパク質の三次構造および安定性に対するプロセスの変更、製剤、および貯蔵条件の影響を調べるために使用することができる経験的な基準になることができるとウイルス抗原21、43。
開示事項
すべての著者は、サノフィパスツールの社員です。作業は、サノフィパスツールによって資金を供給し、このビデオの記事のための出版料はサノフィパスツールによって支払われました。著者は、該当所属または主題または原稿で議論の材料と金融の競合を持っているどのような組織や団体と金融の関与を持っていません。これらは、雇用、コンサルタント、株式の所有権やオプション、またはロイヤルティが含まれます。
いいえ書き込み支援は、この原稿の生産に利用されませんでした。
謝辞
著者は、彼らの議論のための示差走査熱量計、SasmitデシュムクとウェブスターMagcalas上のインストールやトレーニングにおけるその役割のために、パヴェルCzudec、トーマス・ケイジ(マルバーン限ら)(旧GEヘルスケア付き)ジョセフ・マンシーニに非常に感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| Differential Scanning Calorimeter | Malvern Instruments Ltd | 28428948 (Via GE Healthcare) | Has an autosampler for automated dispensing of samples into the cell to reduce human effort and errors. |
| Contrad 100 | Decon Laboratories Inc | 1504 | Dilute with water to 20% before use |
| 500 µL Polypropylene round bottom 96 well plate | Canadian Life Science | ML072100 | Equivalent plates from other suppliers (e.g., VW) can also be used |
| MicroCal ThermoVac | Malvern Instruments Ltd | N/Ap | provided with the Cap VP DSC |
| Biosafety cabinet | Labconco | Logic+ - A2 | biocontainment laminar flow cabinet for sample preparation |
| Slide-A-Lyzer dialysis cassette | Thermo Scientific | 66810 or 66380 | to equilibrate the sample and buffer |
参考文献
- Gill, P., Moghadam, T. T., Ranjbar, B. Differential scanning calorimetry techniques: applications in biology and nanoscience. J. Biomol. Tech. 21 (4), 167-193 (2010).
- Watson, E. S., O'Neil, M. J. Differential microcalorimeter. Patent. , (1966).
- O'Neill, M. J. The Analysis of a Temperature-Controlled Scanning Calorimeter. Anal. Chem. 36 (7), 1238-1245 (1964).
- O'Neil, M. J. Measurement of Specific Heat Functions by Differential Scanning Calorimetry. Anal. Chem. 38 (10), 1331-1336 (1966).
- Privalov, P. L., Monaselidze, D. R. . Mol. Biol. 6, 7-33 (1975).
- Privalov, P. L., Plotnikov, V. V. Adiabatic differential microcalorimeter. Адиабатический дифференциальный микрокалориметр. , (1970).
- Andronikashvili, E. L., et al. Calorimetric study of the nature of the intramolecular fusion of collagen, isolated from transplantable tumor. Dokl. Akad. Nauk. 183 (1), 212-214 (1968).
- Andronikashvili, E. L., et al. . Conformational Changes of Biopolymers in Solution. , 171-173 (1973).
- Andronikashvili, E. L. Malignant transformation and changes in various physic-chemical properties of macromolecules and supramolecular structures. Biofizika. 32 (5), 782-799 (1987).
- Velicelebi, G., Sturtevant, J. M. Thermodynamics of the denaturation of lysozyme in alcohol-water mixtures. Biochemistry. 18 (7), 1180-1186 (1979).
- Sturtevant, J. M. Heat capacity and entropy changes in processes involving proteins. Proc. Natl. Acad. Sci. 74 (6), 2236-2240 (1977).
- Sturtevant, J. M. Biochemical applications of differential scanning calorimetry. Annu. Rev. of Phys. Chem. 38, 463-488 (1987).
- Jackson, W. M., Brandts, J. F. Thermodynamics of protein denaturation. A calorimetric study of the reversible denaturation of chymotrypsinogen and conclusions regarding the accuracy of the two-state approximation. Biochem. 9 (11), 2294-2301 (1970).
- Privalov, P. L., Khechinashvili, N. N., Atanasov, B. P. Thermodynamic analysis of thermal transitions in globular proteins. I. Calorimetric study of chymotrypsinogen, ribonuclease and myoglobin. Biopolymers. 10 (10), 1865-1890 (1971).
- Privalov, P. L., Khechinashvili, N. N. A thermodynamic approach to the problem of stabilization of globular protein structure: a calorimetric study. J. Mol. Biol. 86 (3), 665-684 (1974).
- Privalov, P. L., Potekhin, S. A. Scanning microcalorimetry in studying temperature-induced changes in proteins. Methods Enzymol. 131, 4-51 (1986).
- Veprintseva, O. D., Emelyanenko, V. I., Konstantinova, V. V., Shnyrov, V. L. The importance of structural changes in bacteriophage T4 tail proteins. Biofizika. 33, 954-961 (1988).
- Shutilova, N., Semenova, G., Klimov, V., Shnyrov, V. Temperature-induced functional and structural transformations of the photosystem II oxygen-evolving complex in spinach subchloroplast preparations. Biochem. Mol. Biol. Int. 35 (6), 1233-1243 (1995).
- Sanina, N. M., Kostetsky, E. Y. a., Shnyrov, V. L. Calorimetric investigation of phosphatidyl choline from membranes of marine invertebrates. J. Evol. Biokhim. Physiol. 23, 451-460 (1987).
- Oreshkin, E. F., et al. Conformational changes in the muscle proteins of cured beef during heating. Meat Science. 16 (4), 297-305 (1986).
- Kirkitadze, M., Hu, J., Tang, M., Carpick, B. Qualification of a differential scanning calorimetry method for biophysical characterization of monoclonal antibodies and protein vaccine antigens. Pharm. Bioprocess. 2 (6), 491-498 (2014).
- Jiskoot, W., Daan, C. . Methods for structural analysis of protein pharmaceuticals. 3, (2005).
- Plotnikov, V. V., Brandts, M., Lin, L. N., Brandts, J. F. A new ultrasensitive scanning calorimeter. Anal. Biochem. 250 (2), 237-244 (1997).
- Plotnikov, V. V., et al. An autosampling differential scanning calorimeter instrument for studying molecular interactions. Assay Drug Dev. Technol. 1 (1), 83-90 (2002).
- Freire, E. Differential scanning calorimetry. Protein Stability and Folding: Theory and Practice. Method in Molecular Biology. 40, 191-218 (1995).
- Freire, E., van Osdol, W. W., Mayorga, O. L., Sanchez-Ruiz, J. M. Calorimetrically determined dynamics of complex unfolding transitions in proteins. Annu. Rev. Biophys. Biophys. Chem. 19, 159-188 (1990).
- Johnson, C. R., Morin, P. E., Arrowsmith, C. H., Freire, E. Thermodynamic analysis of the structural stability of the tetrameric oligomerization domain of p53 tumor suppressor. Biochemistry. 34 (16), 5309-5316 (1995).
- Kasimova, M. R., Sam, J. M., Freire, E. The conformational equilibrium of human growth hormone. J. Mol. Biol. 277 (2), 409-418 (1998).
- Saboury, A. A., Moosavi-Movahedi, A. A. Clarification of calorimetric and van't hoff enthalpies for evaluation of protein transition states. Biochem Edu. 22 (4), 210-211 (1994).
- Privalov, P. L. Microcalorimetry of proteins and their complexes. Protein Structure, Stability, and Interactions. Method in Molecular Biology. 490, 1-39 (2009).
- Dehghan-Nayeri, N., Rezaei-Tavirani, M. The Interpretation of Protein Structure Through Relationship of Melting Point (Tm) and Enthalpy of Unfolding (ΔHU). Int J Anal Pharma Biomed Sci. 4 (1), 47-50 (2015).
- . Stability testing of new drug substances and products. Guideline, ICH Harmonised Tripartite. 1 (2), (2003).
- Kjeldahl, J. Neue Methode zur Bestimmung des Stickstoffs in organischen Körpern (New method for the determination of nitrogen in organic substances). Zeitschrift für analytische Chemie. 22 (1), 366-383 (1883).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the Folin phenol reagent. J. Biol. Chem. 193 (1), 265-275 (1951).
- HÖhne, G., Hemminger, W., Flammersheim, H. J. . Differential Scanning Calorimetry. , (2003).
- Porter, L. L., George, D. R. A thermodynamic definition of protein domains. Proc. Natl. Acad. Sci. USA. 109 (24), 9420-9425 (2012).
- Frokjaer, S., Daniel, E. O. Protein drug stability: a formulation challenge. Nature Reviews Drug Discovery. 4, 298-306 (2005).
- Johnson, C. M. Differential scanning calorimetry as a tool for protein folding and stability. Arch. Biochem. Biophys. 531, 100-109 (2013).
- Chiu, M. H., Elmar, J. P. Differential scanning calorimetry: an invaluable tool for a detailed thermodynamic characterization of macromolecules and their interactions. J. Pharm. Bioallied Sci. 3 (1), 39-59 (2011).
- Hirst, J. D., Charles, L. B. Helicity, circular dichroism and molecular dynamics of proteins. J. Mol. Biol. 243 (2), 173-178 (1994).
- Kirkitadze, M. D., et al. Central modules of the vaccinia virus complement control protein are not in extensive contact. Biochem. J. 344 (1), 167-175 (1999).
- Freire, E., SchÖn, A., Hutchins, B. M., Brown, R. K. Chemical denaturation as a tool in the formulation optimization of biologics. Drug disc today. 18 (19), 1007-1013 (2013).
- Wen, J., et al. Applications of differential scanning calorimetry for thermal stability analysis of proteins: qualification of DSC. J. Pharm. Sci. 101 (3), 955-964 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved