Method Article
Differential Scanning Calorimetry - Eine Methode zur Beurteilung der thermischen Stabilität und Konformation von Protein-Antigen
In diesem Artikel
Zusammenfassung
Differential-Scanning-Kalorimetrie misst die thermische Übergangstemperatur (en) und die gesamte Wärmeenergie benötigt, um ein Protein zu denaturieren. Die erhaltenen Ergebnisse werden verwendet, um die thermische Stabilität von Proteinantigenen in Vakzin-Formulierungen zu beurteilen.
Zusammenfassung
Differential-Scanning-Kalorimetrie (DSC) ist eine analytische Technik, die die molare Wärmekapazität der Proben als Funktion der Temperatur mißt. Im Falle von Proteinproben, DSC-Profile liefern Informationen über die thermische Stabilität, und in gewissem Maße dient als strukturelle "Fingerabdruck", der verwendet werden kann strukturelle Konformation zu beurteilen. Es wird unter Verwendung eines Differential - Scanning - Kalorimeter durchgeführt, die die Wärmeübergangstemperatur misst (Schmelztemperatur, T m) und die Energie erforderlich , um die Wechselwirkungen zu stören die Tertiärstruktur stabilisierenden (Enthalpie; & Delta; H) von Proteinen. Vergleiche werden zwischen Formulierungen sowie Fertigungslose, und die Unterschiede in abgeleiteten Werte zeigen Unterschiede in der thermischen Stabilität und strukturelle Konformation hergestellt. Die Daten, welche die Verwendung von DSC in einem industriellen Umfeld für Stabilitätsstudien sowie die Überwachung wichtiger Fertigungsschritte werden als Beweis für die Wirksamkeit dieses Pro bereitgestelltkoll. Im Vergleich zu anderen Verfahren zur Bestimmung der thermischen Stabilität von Protein-Konformationen der Beurteilung ist DSC kostengünstig, erfordert nur wenige Probenvorbereitungsschritte und stellt auch eine vollständige thermodynamischen Profil des Proteins Entfaltungsprozess.
Einleitung
Differential - Scanning - Kalorimetrie (DSC) ist ein experimentelles Verfahren , das direkt die Differenz der Wärmeenergieaufnahme misst in einer Probe relativ zu einer Referenz bei einer geregelten Temperaturänderung unter 1, 2, 3, 4, 5, 6, 7, 8, 9 , 10, 11, 12. Durchgeführt in einem Differential - Scanning - Kalorimeter, umfasst das Verfahren die Einführung von Wärmeenergie in eine Probenzelle und eine Referenzzelle während gleichzeitig gleich der Temperatur der beiden Zellen im Laufe der Zeit zunehmende 2, 13,14. Aufgrund des Unterschieds in der Zusammensetzung der Probe und der Referenz, werden unterschiedliche Energiemenge erforderlich 2 , die Temperatur der Zellen zu erhöhen, 12, 13. So kann die Temperaturdifferenz die überschüssige Menge an Energie zwischen den Zellen zu kompensieren , benötigt wird gemessen und direkt in Beziehung zu spezifischen thermodynamischen Eigenschaften der Probe 1, 3.
In den 1960er Jahren entwickelte MJ O'Neil und E. Watson von Perkin Elmer die erste Differential - Scanning - Kalorimeter den Wärmefluss von Feststoffen 2, 3, 4 zu messen. Parallel dazu PL Privalov und DR Monaseldze EL des Instituts für Physik, Republik Georgien (ehemalige UdSSR) schuf eine einzigartige Differential adiabatische Kalorimeter, die verwendet werden können, for biochemische Forschung 5, 6. Anschließend Andronikashvili Team am Institut für Physik, Republik Georgien, berichtete die Wärmekapazität von Biomolekülen wie faserig und globuläre Proteine, DNA und RNA unter Verwendung von DSC 7, 8, 9. Mehrere Teams unter Leitung von 10 Sturtevant, 11, 12, Brandts 13 und 14 Privalov, 15, 16 auf die Entwicklung der Theorie konzentriert und praktische Anwendungen der DSC die thermodynamischen Details der Proteinentfaltung zu untersuchen. Der Wert der DSC in das Studium großen supramolekularen Strukturen wie Phagen, Chloroplasten, Phospholipid Flüssigkristalle und Fleischproteine wurden auch 17 berichtet sup>, 18, 19, 20.
DSC wurde nun alltäglich in der pharmazeutischen Forschung und Entwicklung für die Beurteilung der thermischen Stabilität von Biomolekülen werden, insbesondere Proteine , 1, 21, 22. Dies ist vor allem aufgrund der Fortschritte in Bezug auf die Empfindlichkeit und die Automatisierung der Instrumentierung das Experiment 23, 24 zur Durchführung verwendet. Hier wird das endgültige Ergebnis der DSC-Experiment, nämlich molare Wärmekapazität als Funktion der Temperatur, verwendet wird, die folgenden thermodynamischen Parameter (Änderung der Wärmekapazität (& Delta; Cp) zu schätzen, Enthalpie (& Dgr; H), Entropie (& Delta; S) und Gibbs-Energie (& Delta; G)) unter Verwendung der folgenden Gleichung:
eq1.jpg "/> (1)
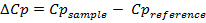 (2)
(2)
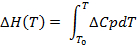 (3)
(3)
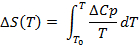 (4)
(4)
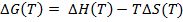 (5)
(5)
Wo Cp Wärmekapazität gemessen; q ist der Wärmestrom in das Testmaterial; T 0 und T sind die Anfangs- und Endtemperaturen des Übergangs bzw. 22, 25. Es ist auch erwähnenswert , dass die Gleichungen , die oben auf Einzeldomänen - Proteine anzuwenden , die thermische Zweizustandsübergang und reversiblen Entfaltung 22 durchlaufen kann. Analyse komplexer Proteine (zB nicht-Zwei-Zustands - Proteine und Oligomeren) have durch Friere et al. 26; Johnson et al. 27; und Kasimova et al. 28.
Um zu bestimmen , ob ein Protein erfährt Zweizustandsübergang oder bildet einen Zwischenprodukte bei der thermischen Denaturierung, die experimentell abgeleiteten Enthalpie (& Dgr; H, auch als kalorimetrische Enthalpie & Dgr; H bezeichnet Cal) an die Enthalpie gegen unten die van't Hoff - Gleichung abgeleitet wird (auch bezeichnet als van't Hoff Enthalpie; & Delta; H VH):
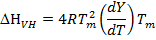 (6)
(6)
Wobei T m die midpoint temperature des Übergangs ist, R die ideale Gaskonstante (1,987 cal mol -1 K -1) ist und Y der Anteil der Proteinpopulation im ausgeklappten Zustand 16, 29. Ob& Dgr; H VH gleich & Delta; H Cal; oder & Delta; H VH / AH Cal ist gleich 1 ist , dann erfährt das Protein eine "Alles-oder-Nichts" Übergang (dh Zweizustandsübergang) 16, 25, 29. Wenn jedoch & Delta; H VH kleiner als & Dgr; H Cal; oder & Dgr; H VH / & Dgr; H Cal kleiner als 1 ist , unterliegt das Protein ein nicht-Zweizustandsübergang 16, 25, 29. Das Verhältnis von & Delta; H VH / & Dgr; H Cal entspricht auch der Anteil der Proteinstruktur , die 26 als thermodynamischen kooperativer Einheit oder Domäne schmilzt.
Die thermodynamischen Parameter, die oben wie & Dgr; G und & Delta; H erwähnt liefern nützliche Informationen über die thermische Stabilität von Proteinen, einschließlich Biologika 30. Allerdings wird der Schwerpunkt auf T m und & Delta; H in dieser Publikation verlegt werden, da sie die angegebenen Werte für dieses Protokoll sind. T m ist die mittlere Temperatur des Übergangs, in dem die gefalteten und der ungefalteten Zustände des Proteins sind im Gleichgewicht ( das heißt & Dgr; G = 0) 25, 31. Je höher die T m eines Proteins, desto höher ist seine thermische Stabilität 31. & Dgr; H entspricht der Fläche unter der Spitze (n) der Wärmekapazität gegenüber Temperaturdiagramm (auch als Thermogramms bekannt) erzeugt am Ende des DSC - Experiment 16, 25. Es ist die Energie , die erforderlich Proteine zu denaturieren und die verwendet werden können , die aktive Fraktion (F a) in einer Proteinformulierung (dh der Anteil der Proteine mit aktiver Konformation in einer Probe) mittels der folgenden Gleichung zu ermitteln:
jove_content ">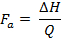 (7)
(7) Wo & Delta; H ist die experimentell ermittelten Enthalpie der Proteinprobe und Q ist die Enthalpie für eine gut charakterisierte Referenz oder standardisierte Protein bestimmt 22. Die Schätzung der F a ist von Bedeutung für die Echtzeit - Stabilität von Produkten Überwachung sowie Durchführung von Stabilitätsstudien unter Stressbedingungen erforderlich , wie ICH - Richtlinien 32. Vergleich von & Delta; H stellt auch Informationen über die Kompaktheit der Tertiärstruktur - Konformation eines Proteins 31.
Dieses Protokoll Details eines Verfahrens für die thermische Stabilität von Proteinen in einer industriellen Umgebung zu bewerten und wurde für die Formulierung von Impfstoffen, umfassend verwendet. Es wurde unter Verwendung eines automatisierten Differentialscanningkalorimeter entwickelt, die reproduzierbare Ergebnisse f erzeugtoder Protein-Konzentrationen so niedrig wie 300 & mgr; g / mL.
Protokoll
1. Instrument Inbetriebnahme
- Einschalten des Differentialabtastkalorimeters und erhöhen den Druck in den Zellen Sieden der Proben zu unterdrücken sowie verhindern die Bildung bei erhöhten Temperaturen Blasen. Dies wird typischerweise durch Zufuhr von Stickstoff in das System erreicht.
- Je nach der konstituierenden Material der Zelle (zB Tantal, Gold, Platin, etc.), stellen Sie den Druck des Stickstoffgases Versorgung gemäß der vom Hersteller empfohlenen Druck zu vermeiden , dass die Zelle zu schädigen. Sie können beispielsweise den Druck des Stickstoffgaszufuhr zu 45 psi für das Instrument verwendet, um dieses Verfahren zu entwickeln, und einem Druck über 80 psi kann die Zelle beschädigen.
- Sicherstellen, dass alle Reinigungsmittelvorratsbehälter auf das erforderliche Volumen aufgefüllt. Reinigungsmittel erforderlich sind Reinigungsmittel und Wasser zu waschen und reinigen Sie die Zelle jeweils nach jeder Probe laufen.
- Stellen Sie die Temperatur des Probenaufnahmefachauf einen geeigneten Wert, vorzugsweise 5 ° C, um die Integrität der Probe vor dem Experiment zu erhalten.
2. Probenvorbereitung
- Dialysieren um die Probe gegen den Puffer, der für das Experiment als Referenz verwendet wird. Alternativ Elutionspuffer im letzten Schritt der Proteinreinigung (dh Säulenelution) gesammelt werden , können verwendet werden.
- Bestimmung der Konzentration der Proteinprobe , die am besten geeignete Proteinkonzentration Bestimmungsverfahren unter Verwendung von beispielsweise Kjeldahl Methode 33 oder Lowry - Verfahren 34. Für einen objektiven Vergleich der Ergebnisse, die gleiche Methode verwenden konsequent innerhalb der gleichen Studie. Die erforderliche Konzentrationsbereich kann je nach Modell des Instruments variieren. Für das Instrument in diesem Protokoll verwendet, liegt der bevorzugte Arbeitsbereich von 0,5 bis 1 mg / mL.
- Degas die Probe und Referenzpuffer im Vakuum befreit von Mikroblasen zu erhalten, das Volumen inaccur verursachen könnenacy. Dieser Schritt kann für neuere Kalorimeter Modelle übersprungen werden.
- Unter Verwendung einer Mikropipette und sterilen Spitzen in einer laminaren Strömung biocontainment Schrank, laden die Proben und ihre entsprechenden Puffer in Paaren in 96-Well-Platten kompatibel mit dem Instrument. Füllen Sie die ersten beiden Paare von Vertiefungen mit Puffer und die letzten zwei Paare mit Wasser für den Puffer-Puffer und dem Wasser Scan sind. Puffer-Puffer Scans die Eignung des Gerätes zu überprüfen , bevor Messung (dh Bewertung der Instrumentenfehler) abzutasten, sowie eine Basis einzurichten; während Wasser-Scans werden ausgeführt, um die Zellen zu reinigen.
- Decken Sie die 96-Well-Platte mit einer Siegelfolie, und stellen Sie sicher, dass die Wells richtig versiegelt werden, bevor die Platte aus dem Biosafety Kabinett unter Probenkontamination zu vermeiden.
- Die Platte wird in der Probenaufnahmefach in der richtigen Ausrichtung.
3. Experimentelle Parameter-Setup
Hinweis: Je nach dem instrumentierung, Proben in die Zelle geladen werden entweder manuell mit einer Spritze oder einer automatischen Probennehmer automatisch verwenden. In diesem Fall (dh einer industriellen Umgebung), wird ein Autosampler verwendet , um Zeit zu sparen.
- Mit Hilfe der Erfassungssoftware, geben Sie den Probeninformationen in der Reihenfolge der Platte gemäß Abschnitt 2.4 geladen wurde. Geben Sie Konzentrationen falls vorhanden, sonst geben Konzentrationswerte in Analysesoftware vor der Datenanalyse (Abschnitt 4.2).
- Wählen Sie die Option, die Reinigung von Zellen, die mit Reinigungsmittel vor jeder Probe Scan gewährleistet, die durch mehrere Wasserspülung Schritte folgen müssen, keine Waschmittelreste zu gewährleisten, die in den Zellen gelassen.
- Stellen Sie die Starttemperatur des Experiments auf 20 ° C, aber je nach Vorwissen der Probe variieren kann. Für bekannte Proteine können vorbestimmte Starttemperatur verwendet werden, während eine niedrigere Starttemperatur für unbekannte Proben eingesetzt werden kann.
- Stellen Sie die Endtemperaturdes Experiments, zB 100 ° C. Die Endtemperatur kann in Abhängigkeit von Vorkenntnissen der Probe variieren.
- Stellen Sie die Abtastrate des Experiments, zB 60 ° C / h, was die typische Abtastrate ist. Jedoch kann Abtastrate abhängig von Vorkenntnissen der Probe variieren, beispielsweise 90 ° C / h oder 120 ° C / h. Es ist ratsam, unbekannte Proben bei verschiedenen Abtastraten zu scannen, um die Kinetik der Entfaltung zu beurteilen.
- Rescan Proben zu untersuchen, um die Reversibilität der thermischen Entfaltung. Das Entfalten eines Proteins wird als reversibel, wenn die Enthalpie für die zweite Abtastung erhalten wird, ist mindestens 80% des Enthalpie-Wert für die erste Abtastung.
- Stellen Sie die post-Experiment Thermostaten auf 10 ° C, um die Integrität des Kalorimeters Zellen zu bewahren.
- Stellen Sie sicher, dass die Test-Setup-Parameter korrekt sind, bevor das Experiment ausgeführt wird. Wenn alles an seinem Platz ist, das Experiment zu starten.
4. Daten einalysis
- Abrufen von Rohdaten aus dem Experiment und wählen Sie eine Probe zu einer Zeit für die Analyse. Subtrahieren Referenz - Scan, dh Puffer, von der Probe - Scan.
HINWEIS: Referenz Subtraktion wird durch automatisch neuere Modelle von DSC-Geräten durchgeführt. - Geben Sie Wert Probenkonzentration, wenn sie gemäß Abschnitt 3.1 weggelassen wurde.
- Passen und subtrahieren Basislinie aus dem erfassten Thermogramms zu berücksichtigen, um Unterschiede in den Wärmekapazitäten der gefalteten und ungefalteten Zuständen des Proteins, die durch die Exposition von hydrophoben Gruppen zu Wasser bei der Entfaltung verursacht wird. Lineare oder kubische Kurvenanpassung kann für die Probe in Abhängigkeit von der Form der DSC-Profil angewendet werden. Aus Gründen der Einheitlichkeit hat die gleiche Art von Fitting während einer Untersuchung, beispielsweise Echtzeit - Stabilitätsstudie verwendet werden. Dieser Schritt ist erforderlich, um die Kurve zu verarbeiten für die Peak-Integration Enthalpie des Übergangs zu erhalten.
- Führen Peak-Integration mit der nichtlinearen kleinsten Quadrate. Basierend auf ProduktWissen anwenden Zwei-Staaten oder nicht-Zwei-Staaten-Modell. Zwei-Staaten-Modell kann für einzelne kooperativen thermischen Übergänge verwendet werden, und für unbekannte Proteine, gelten nicht zwei Zustandsmodell bis auf weiteres Produktwissen zur Verfügung steht. Ggf. anpassen Kurvenanpassung unter Verwendung des iterativen Kurvenanpassungsfunktion der Software-Ausstattung , bis der Chi-Quadrat - Wert konstant bleibt.
- Erhaltenen Ergebnisse werden die Werte für Mittelpunkt der Übergangstemperaturen (Tm) aufweisen, kalorimetrischen Enthalpie (& Delta; H) und van't Hoff Enthalpie (& Dgr; H VH) der Probe.
Ergebnisse
Die Rohdaten von den meisten DSC - Experimente werden als Wärmeflusses gegen die Temperatur zeigt dieses Diagramm, wie das Kalorimeter tatsächlich den Unterschied in der Rate der Wärmestrom in die Probenlösung misst und 35 puffern. Deshalb, wenn beide Zellen (dh Probe und Referenzzellen) identische Lösungen während eines Experiments enthalten, die Rohdaten aus dem Scan sollte eine flache Linie ohne beobachtbare Spitzen sein. Jede beobachtete Peak kann Instrumentierung Fehler zurückgeführt werden (zB beschädigte oder verschmutzte Zellen), die , warum läuft Puffer Scans vor der Probenanalyse ist eine adäquate Systemeignungstest. Abbildung 1 zeigt das Ergebnis eines typischen Puffer Scan anzeigt , dass das Kalorimeter war in gutem Zustand vor Analyse zu probieren.
Abbildung 2 zeigt die Rohdaten für eine DSC - Experiment durchgeführt auf diffErent viele zwei Proteinproben. Wie früher angedeutet, werden die beobachteten Peaks sind die Unterschiede in der Wärmefluss der Proben und ihre jeweiligen Puffer. Unterschiede in der Probenkonzentration kann zu Schwankungen in der Wärmekapazität durch das Kalorimeter aufgezeichnet; jedoch sind diese Variationen normalisiert während der Probenanalyse gemäß Abschnitt 4.2 des Verfahrens. Höhere Konzentrationen können auch zusätzliche thermodynamischen Domänen offenbaren nicht bei niedrigeren Konzentrationen auf den Übergang beitragen. Darüber hinaus stellt jeder Übergang einen thermodynamischen Domäne , die 36 eine oder mehrere strukturelle Domänen des Proteins einschließen kann. In diesem Fall hat das Protein 1 drei strukturelle Domänen, die kooperativ schmelzen.
Abbildung 3 zeigt die aus der Analyse der Rohdaten erzeugten Ergebnisse für Protein 1 und 2 dargestellt in Figur 2, also nach der Baseline - Subtraktion und iterative Kurven fitting. Die resultierenden Thermogramme wurden zum Abtasten Rate (automatisch durchgeführt von einem voreingestellten Algorithmus in der Analysesoftware) und Konzentration normalisiert worden ist; Somit stellt die Ergebnisse des Experiments in vergleichbaren Wärmekapazität gegen die Temperatur Graphen. Die Analyse - Software verwendet , um Daten von der Wärmekapazität gegenüber Temperatur - Diagramme, wie T m und & Delta; Cp, andere thermodynamischen Parameter abzuleiten , indem Variationen der Gleichungen oben in Abhängigkeit von der Kooperativität der Proteinentfaltung.
Bei unbekannten Proben zu testen, das Einstellen der richtigen Temperaturbereich ist von entscheidender Bedeutung. Andernfalls kann unvollständig Thermogrammen führen, wie in Abbildung 4 dargestellt. Obwohl T m von solchen Profilen abgeleitet werden können, werden & Dgr; H kann nicht genau bestimmt werden . Daher muss die Probe mit einem größeren Temperaturbereich erneut getestet werden, um vollständig den Wärmeübergang zu erfassen. Einige Proteine auch wiederadily Form aggregiert nach vollständiger Denaturierung, was zu einer Erhöhung der Zeit nach dem Übergang Wärmekapazität: Dies erscheint oft als unvollständig Thermogramms , wie in 2B dargestellt. Jedoch kann mit einer höheren Endtemperatur Nachtestung helfen, zu bestätigen, ob ein Auftreten einer Konformationsänderung ist in diesem Bereich des Thermogramms, oder es ist nur die wärmeabsorbierende Wirkung von Proteinaggregaten.
Thermische Stabilität ist eine der wichtigsten physikalischen Eigenschaften von Proteinen und proteinbasierte Produkte in der Industrie 37. In der Division Pharmaceuticals wird es verwendet, um die Stabilität der Biologika unter verschiedenen Bedingungen zu bestimmen, einschließlich der Formulierung Puffer und Umweltfaktoren wie Feuchtigkeit und Temperatur. Es wird auch zur Überwachung wichtiger Fertigungsschritt (zB Reinigung und Entgiftung) , um sicherzustellen , Konformationsänderungen Konsistenz zwischen Produktionschargen verwendet. > 5 und 6 die Verwendung von DSC veranschaulichen die Auswirkungen der chemischen Entgiftung und Lagerungsbedingungen jeweils auf die Stabilität und strukturelle Konformation von zwei verschiedenen Proteinen zu untersuchen. Die signifikanten Unterschiede in Tm und & Delta; H zeigen Konformationsänderungen und Proteinabbau verbunden. Darüber hinaus veranschaulicht den Verlust des dritten Übergangs in Figur 6 weiter den Abbau einer Domäne , die durch eine Abnahme des Molekulargewichts wurde bestätigt , als die Proben wurden analysiert mit Grßenausschlußchromatographie unter Verwendung von Mehrfachwinkel - Lichtstreuung (SEC-MALS) ( Daten nicht gezeigt).
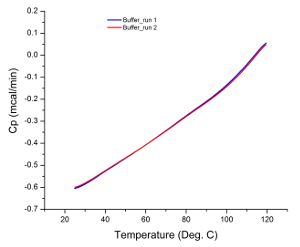
Abbildung 1: Puffer Scans. Die Ähnlichkeit in Gradienten jedes Scans ohne beobachtbare Spitzen zeigt an, dass das Gerät in gutem Zustand ist und reproduzierbare Ergebnisse erzeugt.//ecsource.jove.com/files/ftp_upload/55262/55262fig1large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
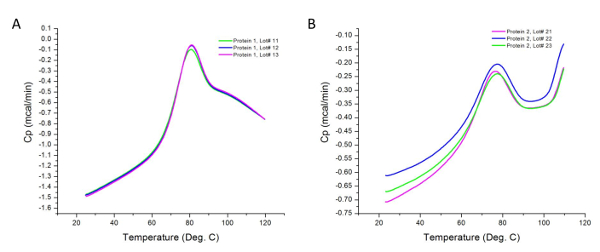
Abbildung 2: Raw gesammelten Daten aus DSC - Experimente. Diese Diagramme sind gute Darstellungen der unanalysierte (raw) Daten nach Versuchsdurchläufe erworben (dh vor der Grundlinie Subtraktion und Kurvenanpassung). Jede Linie steht für eine Produktionscharge. Protein 2 neigt dazu, leichter beim Erhitzen zu aggregieren, was zu einer Erhöhung der Wärmekapazität von über 100 ° C in der Post-Übergangsbereich des Thermogramms. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
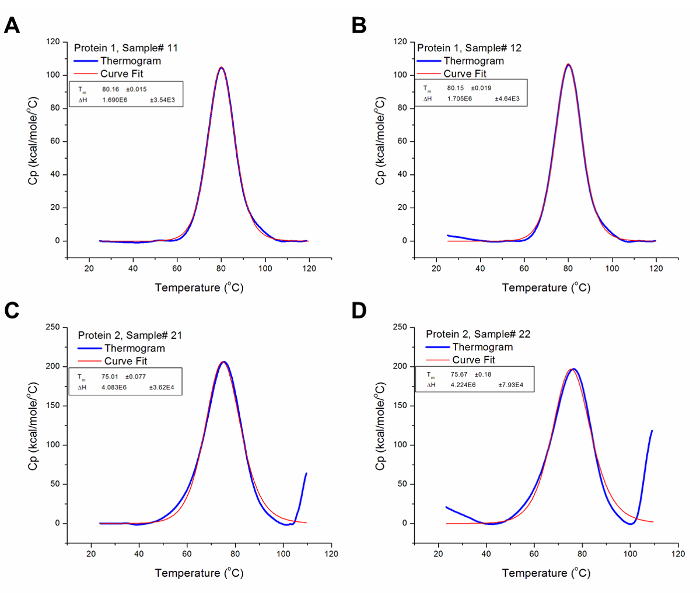
Abbildung 3: Analysierte DSC - Daten. Diese Diagramme sind gute Darstellungen analysiert DSC - Daten (dh nach der Baseline - Subtraktion und Kurvenanpassung). Die blaue Linie stellt die Thermogramms nach Baseline Subtraktion, während die rote Linie die Kurve mit der besten Anpassung an die Thermogramms darstellt. (A) Die T m und & Dgr; H für Protein 1 Probe # 12 80,16 ° C und 1,69 x 10 6 cal / mol auf. (B) Die T m und & Dgr; H für Protein 1 Probe # 13 80,15 ° C und 1,71 x 10 6 cal / mol auf. (C) Die T m und & Dgr; H für Protein 2 Probe # 21 75,01 ° C und 4,08 x 10 6 cal / mol auf. (D) Die T m und & Delta; H für Protein 2 Probe # 22 sind 75,67 ° C und 4,22 x 10 6 cal / mol auf. Bitte klicken Sie hier , um diesehen eine größere Version dieser Figur.
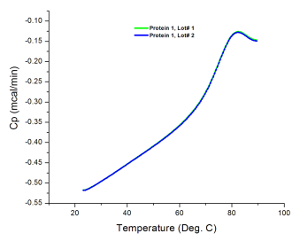
Abbildung 4: Eine unvollständige Thermogramm. Rohdaten zu sammeln für die Protein-1 bei einer unzureichenden Temperaturbereich analysiert. Die Endtemperatur des Experiments wurde auf 90 ° C eingestellt , die nicht den gesamten Übergangsprofil des Proteins zu dem Experiment im Vergleich zu 2A aufzunehmen hat , die auf 120 ° C eingestellt war. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
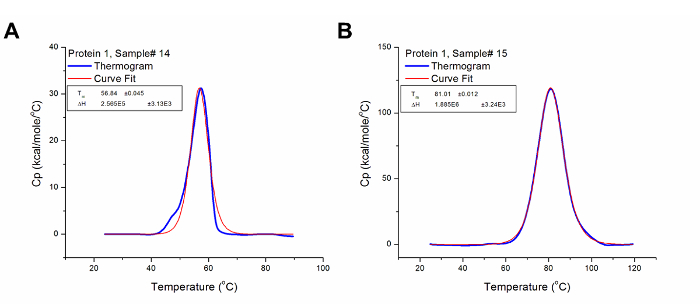
Abbildung 5: Analysierte Daten zeigt die Wirkung chemischer Entgiften auf die Tertiärstruktur des Proteins 1. (A) Protein 1 ist ein Toxin in seiner nativen Konformation und has seine T m bei 56,84 ° C und & Delta; H bei 2,57 x 10 5 cal / mol. (B) Die entgiftete Form von Protein 1 (dh Toxoid) hat T m und & Delta; H - Werte von 81,01 ° C und 1,89 x 10 6 cal / mol auf. Somit kann gefolgert werden , dass die Entgiftungsschritt der strukturellen Konformation des Protein irgendeine Form der Variation 1 eingeführt , die eine höhere Stabilität (höhere T m) in seine entgifteten Form verleiht. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
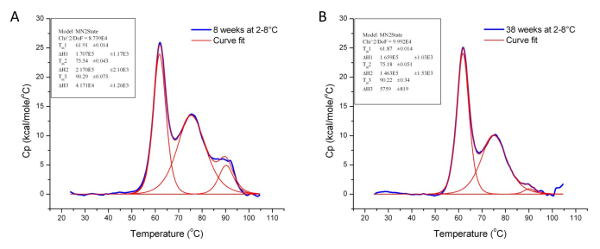
Abbildung 6: werteten Daten die Wirkung von Lagerbedingungen Zeigen auf die Konformation von Protein 3. Diese Graphen , die die Wirkung der Aufbewahrungstemperatur veranschaulichen (2 - 8 ° C) auf die Stabilität und Tertiärstruktur von Protein 3 über 30 Wochen. Die T m und & Delta; H - Werte für Protein 3 auf dem 8. (A) und 38 th Woche (B) der Lagerung sind in Tabelle 1 unten angegeben. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
| Sample | Tm 1 (° C) | & Dgr; H 1 (cal / mol) | Tm 2 (° C) | & Delta; H 2 (cal / mol) | Tm 3 (° C) | & Delta; H 3 (cal / mol) |
| Protein 3 gelagert bei 2-8 ° C für 8 Wochen | 61,91 | 1,71 x 10 & sup5 ; | 75,54 | 2,17 x 10 & sup5 ; | 90,29 | 4,17 x 10 & sup5 ; |
| Protein 3 gelagert bei 2-8 ° C für 38 Wochen | 61,87 | 1,66 x 10 & sup5 ; | 75,18 | 1,46 x 10 & sup5 ; | 90.22 | 5,76 x 10 & sup5 ; |
Tabelle 1: Tm und & Dgr; H Werte für Protein 3 am 8. und 38. Woche der Lagerung bei 2 - 8 ° C. Obwohl die T zu beiden Zeitpunkten m Werte ähnlich sind, zeigt die Differenz der Werte & Delta; H , dass die Tertiärstruktur von Protein 3 über 30 Wochen unter den angegebenen Lagerbedingungen verschlechtert hat.
Diskussion
Dieses Verfahren wurde in verschiedenen Charakterisierung Testpakete, einschließlich Stabilität und Produkt Vergleichbarkeitsstudien 21 erfolgreich integriert. In Echtzeit Stabilitätsstudien, wird DSC verwendet , um die T m zu überwachen, sowie die F a von Biologics im Laufe der Zeit schätzen , um ihre Haltbarkeit zu bestimmen. Im Hinblick auf die Produkt Vergleichbarkeit wird es verwendet, um die Auswirkungen von Prozess- und Facility Änderung sowie die Wirkung der wichtigsten Herstellungsschritte auf die strukturelle Anpassung der erzeugten Partien beurteilen. Dies umfasst in der Regel den direkten Vergleich der & Delta; H der produzierten Menge auf ein Referenzprodukt, das als ideale Produkt bezeichnet wurde. Darüber hinaus hat DSC ein nützliches analytisches Werkzeug für die Produktformulierungsstudien 37 erwiesen. Die T m eines Proteins in verschiedenen Puffern und verschiedenen Konzentrationen können verwendet werden , um die Formulierung zu bestimmen, die am meisten Stabilität vorbringt , umdas Protein.
Um die Zuverlässigkeit dieser Methode und Objektivität ihrer Ergebnisse zu gewährleisten, ist es wichtig , Testparameter konsistent von Lauf zu halten innerhalb der gleichen Studie (zB Impfstoffformulierung Studie) zu laufen. Jedoch kann das Verfahren der physikalischen Eigenschaften verschiedener Proteine, um Unterschiede modifiziert werden. Ein Beispiel für eine Modifikation , die vorgenommen werden kann , ist die Änderung der Abtastgeschwindigkeit des Experiments 38, 39. Proteine , die zur Bildung von Aggregaten neigen waren beim Erhitzen mit einer schnelleren Abtastrate sucht wurden (beispielsweise 120 ° C / h) , um den Beitrag von Aggregaten der thermischen Übergangsprofil zu vermeiden sowie die Kapillaren des Kalorimeters verstopfen. Es ist erwähnenswert, dass Rate Scannen 38 das Ergebnis eines DSC - Experiment beeinflussen können. Eine Verbreiterung des thermischen Übergangs Spitze wurde mit zunehmender Abtastraten in einem gewissen pro beobachtetteine; jedoch blieb T m ziemlich konstant 38. Darüber hinaus sind die Dialyse und Entgasung Schritte zur Probenvorbereitung ist auch sehr wichtig für genaue Ergebnisse 31. Dialyse stellt sicher, dass der einzige Unterschied in der Zusammensetzung der Probe und der Puffer ist das Protein; Somit sind alle überschüssige Wärme von der Probe absorbierte kann der Wärmekapazität des Proteins zugeschrieben werden. Entgasen sorgt für eine präzise Volumenanalyse, da die Extrapolation der thermodynamischen Parameter annimmt , dass die Entfaltungsereignis auftritt unter konstantem Volumen und der Druck 31. Der konstante Druckanteil der Annahme wird durch Stickstoffunterdrucksetzen des Systems gemäss Abschnitt 1.1 des Verfahrens berücksichtigt.
Im Vergleich zu anderen Methoden der Stabilität von Protein-Konformationen wie Zirkulardichroismus (CD) und Fluoreszenz-Spektroskopie zu bestimmen, DSC bietet eine Reihe von Vorteilen in einem comHandelseinstellung einschließlich Kosten- und Zeiteinsparungen. Erstens erlaubt die adiabatische Design eines Differentialscanningkalorimeters zur Messung der thermischen Stabilität mit einer besseren Temperaturgenauigkeit im Vergleich zu Messungen mit Instrumenten für die CD und Fluoreszenzspektroskopie 6. Zweitens, im Gegensatz zu CD, ist die Genauigkeit der DSC - Daten nicht abhängig von der Helizität des Proteins 39, 40; jedoch bietet CD zusätzliche Informationen über die Entfaltung der Sekundärstruktur, die dem DSC 41 kostenlos sein würde. Zusätzlich erlaubt die Druckbeaufschlagung des DSC- System zum Testen mit einem breiten Temperaturbereich, ohne die Probe siedet; Somit kann ein breites Spektrum von Proteinen, die durch DSC getestet werden.
Während DSC eine relativ schnelle und einfache Methode ist die thermische Stabilität von Biologika, um zu bestimmen, ist es nicht ohne Einschränkungen. Zuerst wird die BasisLinie Subtraktion Schritt stellt eine Form der menschlichen Widersprüchlichkeit in den Rohdaten Analyse; Somit Schwankungen Ergebnisse können zwischen verschiedenen Benutzern beobachtet werden. Zweitens haben Differential-Scanning-Kalorimeter minimale Konzentrationsgrenzen, die schwierig sein könnte, bei Massenproduktionsmaßstab zu erreichen. Drittens ist die AH der irreversiblen thermischen Denaturierung nicht absolut; was bedeutet, dass abgeleitete & Delta; G (ein Indikator für die Proteinstabilität) in ähnlichen Szenarien können irreführend sein. Darüber hinaus arbeitet das Verfahren am besten für gereinigten Proben. Anwesenheit von Verunreinigungen kann entweder bewirken eine Verschiebung der T m , wenn es eine Wechselwirkung mit dem Protein untersucht wird, oder das Aussehen des neuen thermischen Übergänge , wenn keine Wechselwirkung auftritt. In jedem Fall sind die zusätzlichen Funktionen auf den Thermogrammen können zu Unrecht zu den Proben zugeschrieben werden, wodurch die Interpretation der Ergebnisse zu beeinträchtigen. Trotz dieser Einschränkungen bleibt, DSC, ein zuverlässiges Verfahren, die detaillierte Informationen über die thermodynamischen th liefern kannwenn sie umgesetzt e Protein Prozess ordnungsgemäß 42 Entfaltung.
Abschließend bietet DSC erheblichen Vorteil als Konformationsänderung Auslese Werkzeug für die Impfstoff-Produkte und deren Vorprodukte. Die beiden Parameter, T m und & Dgr; H kann eine empirische Basislinie werden für eine Reihe von Chargen des gleichen Produkts gesammelt , die verwendet werden können , um die Auswirkungen von Prozessänderungen, Formulierung und Lagerbedingungen auf die Tertiärstruktur und die Stabilität des Proteins zu untersuchen und virale Antigene 21, 43.
Offenlegungen
Alle Autoren sind Mitarbeiter bei Sanofi Pasteur. Die Arbeit wurde gefördert von Sanofi Pasteur, und Veröffentlichungsgebühren für dieses Video-Artikel wurden von Sanofi Pasteur bezahlt. Die Autoren haben keine entsprechenden Zugehörigkeiten oder finanzielle Beteiligung mit keiner Organisation oder Einrichtung, die in dem Manuskript diskutiert einen finanziellen Konflikt mit dem Gegenstand oder Materialien hat. Dazu gehören Beschäftigung, Unternehmensberatungen, Aktienbesitz oder Optionen, oder Lizenzgebühren.
Kein Schreiben Unterstützung wurde bei der Herstellung des Manuskripts verwendet.
Danksagungen
Die Autoren sind sehr dankbar, dass Joseph Mancini (früher mit GE Healthcare), Pawel Czudec, Thomas Cage (Malvern Instruments Limited) für ihre Rolle bei der Installation und Schulung auf dem Differential-Scanning-Kalorimeter, Sasmit Deshmukh und Webster Magcalas für ihre Gespräche.
Materialien
| Name | Company | Catalog Number | Comments |
| Differential Scanning Calorimeter | Malvern Instruments Ltd | 28428948 (Via GE Healthcare) | Has an autosampler for automated dispensing of samples into the cell to reduce human effort and errors. |
| Contrad 100 | Decon Laboratories Inc | 1504 | Dilute with water to 20% before use |
| 500 µL Polypropylene round bottom 96 well plate | Canadian Life Science | ML072100 | Equivalent plates from other suppliers (e.g., VW) can also be used |
| MicroCal ThermoVac | Malvern Instruments Ltd | N/Ap | provided with the Cap VP DSC |
| Biosafety cabinet | Labconco | Logic+ - A2 | biocontainment laminar flow cabinet for sample preparation |
| Slide-A-Lyzer dialysis cassette | Thermo Scientific | 66810 or 66380 | to equilibrate the sample and buffer |
Referenzen
- Gill, P., Moghadam, T. T., Ranjbar, B. Differential scanning calorimetry techniques: applications in biology and nanoscience. J. Biomol. Tech. 21 (4), 167-193 (2010).
- Watson, E. S., O'Neil, M. J. Differential microcalorimeter. Patent. , (1966).
- O'Neill, M. J. The Analysis of a Temperature-Controlled Scanning Calorimeter. Anal. Chem. 36 (7), 1238-1245 (1964).
- O'Neil, M. J. Measurement of Specific Heat Functions by Differential Scanning Calorimetry. Anal. Chem. 38 (10), 1331-1336 (1966).
- Privalov, P. L., Monaselidze, D. R. . Mol. Biol. 6, 7-33 (1975).
- Privalov, P. L., Plotnikov, V. V. Adiabatic differential microcalorimeter. Адиабатический дифференциальный микрокалориметр. , (1970).
- Andronikashvili, E. L., et al. Calorimetric study of the nature of the intramolecular fusion of collagen, isolated from transplantable tumor. Dokl. Akad. Nauk. 183 (1), 212-214 (1968).
- Andronikashvili, E. L., et al. . Conformational Changes of Biopolymers in Solution. , 171-173 (1973).
- Andronikashvili, E. L. Malignant transformation and changes in various physic-chemical properties of macromolecules and supramolecular structures. Biofizika. 32 (5), 782-799 (1987).
- Velicelebi, G., Sturtevant, J. M. Thermodynamics of the denaturation of lysozyme in alcohol-water mixtures. Biochemistry. 18 (7), 1180-1186 (1979).
- Sturtevant, J. M. Heat capacity and entropy changes in processes involving proteins. Proc. Natl. Acad. Sci. 74 (6), 2236-2240 (1977).
- Sturtevant, J. M. Biochemical applications of differential scanning calorimetry. Annu. Rev. of Phys. Chem. 38, 463-488 (1987).
- Jackson, W. M., Brandts, J. F. Thermodynamics of protein denaturation. A calorimetric study of the reversible denaturation of chymotrypsinogen and conclusions regarding the accuracy of the two-state approximation. Biochem. 9 (11), 2294-2301 (1970).
- Privalov, P. L., Khechinashvili, N. N., Atanasov, B. P. Thermodynamic analysis of thermal transitions in globular proteins. I. Calorimetric study of chymotrypsinogen, ribonuclease and myoglobin. Biopolymers. 10 (10), 1865-1890 (1971).
- Privalov, P. L., Khechinashvili, N. N. A thermodynamic approach to the problem of stabilization of globular protein structure: a calorimetric study. J. Mol. Biol. 86 (3), 665-684 (1974).
- Privalov, P. L., Potekhin, S. A. Scanning microcalorimetry in studying temperature-induced changes in proteins. Methods Enzymol. 131, 4-51 (1986).
- Veprintseva, O. D., Emelyanenko, V. I., Konstantinova, V. V., Shnyrov, V. L. The importance of structural changes in bacteriophage T4 tail proteins. Biofizika. 33, 954-961 (1988).
- Shutilova, N., Semenova, G., Klimov, V., Shnyrov, V. Temperature-induced functional and structural transformations of the photosystem II oxygen-evolving complex in spinach subchloroplast preparations. Biochem. Mol. Biol. Int. 35 (6), 1233-1243 (1995).
- Sanina, N. M., Kostetsky, E. Y. a., Shnyrov, V. L. Calorimetric investigation of phosphatidyl choline from membranes of marine invertebrates. J. Evol. Biokhim. Physiol. 23, 451-460 (1987).
- Oreshkin, E. F., et al. Conformational changes in the muscle proteins of cured beef during heating. Meat Science. 16 (4), 297-305 (1986).
- Kirkitadze, M., Hu, J., Tang, M., Carpick, B. Qualification of a differential scanning calorimetry method for biophysical characterization of monoclonal antibodies and protein vaccine antigens. Pharm. Bioprocess. 2 (6), 491-498 (2014).
- Jiskoot, W., Daan, C. . Methods for structural analysis of protein pharmaceuticals. 3, (2005).
- Plotnikov, V. V., Brandts, M., Lin, L. N., Brandts, J. F. A new ultrasensitive scanning calorimeter. Anal. Biochem. 250 (2), 237-244 (1997).
- Plotnikov, V. V., et al. An autosampling differential scanning calorimeter instrument for studying molecular interactions. Assay Drug Dev. Technol. 1 (1), 83-90 (2002).
- Freire, E. Differential scanning calorimetry. Protein Stability and Folding: Theory and Practice. Method in Molecular Biology. 40, 191-218 (1995).
- Freire, E., van Osdol, W. W., Mayorga, O. L., Sanchez-Ruiz, J. M. Calorimetrically determined dynamics of complex unfolding transitions in proteins. Annu. Rev. Biophys. Biophys. Chem. 19, 159-188 (1990).
- Johnson, C. R., Morin, P. E., Arrowsmith, C. H., Freire, E. Thermodynamic analysis of the structural stability of the tetrameric oligomerization domain of p53 tumor suppressor. Biochemistry. 34 (16), 5309-5316 (1995).
- Kasimova, M. R., Sam, J. M., Freire, E. The conformational equilibrium of human growth hormone. J. Mol. Biol. 277 (2), 409-418 (1998).
- Saboury, A. A., Moosavi-Movahedi, A. A. Clarification of calorimetric and van't hoff enthalpies for evaluation of protein transition states. Biochem Edu. 22 (4), 210-211 (1994).
- Privalov, P. L. Microcalorimetry of proteins and their complexes. Protein Structure, Stability, and Interactions. Method in Molecular Biology. 490, 1-39 (2009).
- Dehghan-Nayeri, N., Rezaei-Tavirani, M. The Interpretation of Protein Structure Through Relationship of Melting Point (Tm) and Enthalpy of Unfolding (ΔHU). Int J Anal Pharma Biomed Sci. 4 (1), 47-50 (2015).
- . Stability testing of new drug substances and products. Guideline, ICH Harmonised Tripartite. 1 (2), (2003).
- Kjeldahl, J. Neue Methode zur Bestimmung des Stickstoffs in organischen Körpern (New method for the determination of nitrogen in organic substances). Zeitschrift für analytische Chemie. 22 (1), 366-383 (1883).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the Folin phenol reagent. J. Biol. Chem. 193 (1), 265-275 (1951).
- HÖhne, G., Hemminger, W., Flammersheim, H. J. . Differential Scanning Calorimetry. , (2003).
- Porter, L. L., George, D. R. A thermodynamic definition of protein domains. Proc. Natl. Acad. Sci. USA. 109 (24), 9420-9425 (2012).
- Frokjaer, S., Daniel, E. O. Protein drug stability: a formulation challenge. Nature Reviews Drug Discovery. 4, 298-306 (2005).
- Johnson, C. M. Differential scanning calorimetry as a tool for protein folding and stability. Arch. Biochem. Biophys. 531, 100-109 (2013).
- Chiu, M. H., Elmar, J. P. Differential scanning calorimetry: an invaluable tool for a detailed thermodynamic characterization of macromolecules and their interactions. J. Pharm. Bioallied Sci. 3 (1), 39-59 (2011).
- Hirst, J. D., Charles, L. B. Helicity, circular dichroism and molecular dynamics of proteins. J. Mol. Biol. 243 (2), 173-178 (1994).
- Kirkitadze, M. D., et al. Central modules of the vaccinia virus complement control protein are not in extensive contact. Biochem. J. 344 (1), 167-175 (1999).
- Freire, E., SchÖn, A., Hutchins, B. M., Brown, R. K. Chemical denaturation as a tool in the formulation optimization of biologics. Drug disc today. 18 (19), 1007-1013 (2013).
- Wen, J., et al. Applications of differential scanning calorimetry for thermal stability analysis of proteins: qualification of DSC. J. Pharm. Sci. 101 (3), 955-964 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten