Method Article
共沈降によるF-アクチンへのタンパク質結合の測定
要約
このプロトコールは、糸状アクチン(F-アクチン)と同時沈降するタンパク質の能力を試験し、結合が観察された場合に相互作用の親和性を測定する方法を記載する。
要約
細胞内の糸状アクチン(F-アクチン)の組織化は、アクチン核形成、増殖、架橋および/または分解を制御する多数のアクチン結合タンパク質によって調節される。このプロトコルは、タンパク質またはタンパク質ドメインがF-アクチンに結合するかどうかを決定し、相互作用の親和性( すなわち、解離平衡定数)を測定する技法、すなわちアクチン共沈降、またはペレット化アッセイを記載する。この技術では、目的のタンパク質をまず溶液中のF-アクチンとともにインキュベートする。次いで、分別遠心分離を用いてアクチンフィラメントを沈降させ、ペレット化した物質をSDS-PAGEにより分析する。目的のタンパク質がF-アクチンと結合すると、アクチンフィラメントと一緒に沈降する。結合反応の生成物( すなわち、 F-アクチンおよび目的のタンパク質)を定量化して、相互作用の親和性を決定することができる。アクチンペレット化アッセイは、目的のタンパク質がF-アクチンと結合し、リガンド結合などのそのタンパク質への変化がF-アクチンとのその相互作用にどのように影響するかを評価するために使用される。
概要
アクチンは、運動性、収縮、接着、および形態学を含む、複数の細胞プロセスにおいて重要な役割を果たす必須の細胞骨格タンパク質である1 。アクチンは、単球球状アクチン(G-アクチン)および重合した糸状アクチン(F-アクチン)の2つの形態で存在する。細胞内では、Fアクチンの組織化はアクチンフィラメント2,3,4の核形成、成長、架橋、分解を制御する大量のタンパク質によって制御されています。しかしながら、複数のアクチン結合タンパク質がアクチンネットワークの組織化を調節するためにどのように機能するかは依然としてほとんど不明である。
タンパク質 - タンパク質相互作用の測定は、タンパク質が生化学レベルでどのように細胞行動に影響を及ぼすかを理解するための重要なアプローチである。多くの異なるアッセイを使用して、精製タンパク質間の相互作用を検出することができる。可溶性タンパク質の一般的なアプローチには、プルダウン、蛍光偏光、等温滴定熱量測定、および表面プラズモン共鳴が含まれる。重要なことに、これらのアッセイの全ては、タンパク質が可溶性であることを必要とし、したがって、Fアクチンのような高分子の糸状タンパク質での使用に適応するのが困難である。ここでは、タンパク質またはタンパク質ドメインがF-アクチンに結合するかどうかを決定し、相互作用の親和性を測定するためのテクニック、すなわちアクチン共沈降、またはペレット化アッセイを説明します。
アクチンペレット化アッセイは、超遠心分離機以外の特別な装置を必要としない比較的簡単な技術である。すべての試薬は、基本的な生化学の知識を前提に作成するか、購入することができます。 F-アクチンへの結合が確立されると、このアッセイを使用して見かけの親和性( すなわち、解離平衡定数)を測定することができる5 。また、いったん親和性が確立されると、ペレット化アッセイ目的タンパク質の変化( すなわち 、翻訳後修飾、突然変異、またはリガンド結合)がFアクチンとの相互作用にどのように影響するかを測定するのに有用なツールです。この手法には、アッセイを試みる前に研究者が知っておくべき限界( 議論を参照)があります。
プロトコル
1.材料の準備
- 目的のタンパク質を精製する(セクション2を参照)。
- G-アクチンを準備または購入する。
注:G-アクチンは、複数の供給源1から単離することができます。あるいは、購入することができます。再構築されたG-アクチン(5mM Tris pH8.0,0.2mM CaCl 2、0.2mM ATP(アデノシン三リン酸)、および0.5mMジチオスレイトール(DTT)中)は急速凍結し、-80℃および> 10mg / mL小さな(10〜20μL)アリコートで、そして使用直前に解凍する。 G-アクチンのアリコートは再凍結してはならない。 - BSAなどのコントロールタンパク質を準備または購入する(ステップ4.4を参照)。
- 10倍の重合バッファー(200mMイミダゾールpH7.0,1M KCl、20mM MgCl 2、5mM ATPおよび10mM EGTA(エチレングリコール - ビス(β-アミノエチルエーテル)-N、N、N '四酢酸))。必要に応じて、10倍ストックを調製し、ATP添加後にpHを調整する。アリコート(25μLは有効量)で保存し、-80&#176℃。
- 10倍反応緩衝液(200mMイミダゾールpH7.0,1.5M NaCl、20mM MgCl 2、5mM ATP、および10mM EGTA)を調製する。必要に応じて、10倍ストックを調製し、ATP添加後にpHを調整する。アリコート(50〜100μLは有効量)で保存し、-80℃で保存します。
注:反応バッファーの組成は柔軟性があり、バックグラウンド沈降を減少させ、非特異的結合を制限し、および/または結合を改善するために調整する必要があり得る(ステップ1.5.1〜1.5.3)。- タンパク質の安定性を最適化するために、反応バッファーのpHを6〜8に調整します。より低いpHまたはより高いpHでは、イミダゾールの代わりに適切な緩衝液を使用する。
注:安定性のためにタンパク質がより低いまたは高いpHを必要としない限り、pH 7.0を出発点として使用します。 pHが6.0以下または8.0以上の緩衝液を使用しないでください。アクチンが破壊される可能性があります。推奨緩衝液(最終濃度および記載された最適pH)には、20mM MOPS(3-( N-モルホリノ)プロパンスルホン酸)、pH= 6.5; 20mMイミダゾール、pH = 7.0; 10mM HEPES(4-(2-ヒドロキシエチル)ピペラジン-1-エタンスルホン酸)、pH = 7.5;および20mMのトリス、pH = 8.0を含む。 - アッセイの必要性に応じて、反応緩衝液の塩濃度を変化させる。
注:アクチンは酸性タンパク質であり、ほとんどのアクチン結合タンパク質はアクチンと会合する静電相互作用にある程度依存しています。したがって、塩濃度を増加させると、ほとんどの場合アクチン結合が減少する。反応緩衝液は、生理学的レベルの塩(150mM NaCl、作業濃度)を使用し、これが推奨される出発点である。必要であれば、結合を促進するために塩濃度を低下させる( 例えば、 100mMにする)か、結合を制限するように増加させることができる。 - 特定の理由がない限り、反応バッファー中のMgCl 2 、ATP、またはEGTAの濃度を変更しないでください。
- タンパク質の安定性を最適化するために、反応バッファーのpHを6〜8に調整します。より低いpHまたはより高いpHでは、イミダゾールの代わりに適切な緩衝液を使用する。
2.アッセイのための試験タンパク質の調製
- 準備最良の結果を得るために液体クロマトグラフィーを用いた高純度タンパク質7 。
注:組換えタンパク質を使用する場合、グルタチオン-S-トランスフェラーゼ(GST)などの大きなタンパク質タグは、結合を妨げる可能性があるため、標的タンパク質からのプロテアーゼ切断によって除去する必要があります。 GSTはまた、アクチン結合の親和性を人工的に増加させることができる融合タンパク質のホモダイマー化を引き起こす。 - 280 nmでの吸光度を測定してタンパク質濃度を測定する。消散係数で除算する。消光係数は、配列分析またはオンラインツールを用いてタンパク質配列から計算することができる。あるいは、BradfordまたはBCA(ビシンコニン酸)法を用いてタンパク質濃度を決定する。
注:最初の実験では、通常20〜40μMのタンパク質50〜100μLで十分です。これは、ほとんどのアクチン結合タンパク質にとって有用な出発点である、低いマイクロモル範囲での結合の分析を可能にする。より大きな泉親和性を計算するための結合曲線を作成するためにタンパク質の高濃度が必要となることが多い(セクション5参照)。 - 使用直前に、不溶性タンパク質の凝集物を除去するために、タンパク質(4℃で50,000〜100,000×gで10分間)をハードスピンします。溶解性が懸念される場合は、遠心分離後にタンパク質濃度を再測定する(ステップ2.2)。
3. F-アクチンを調製する。
- -80°Cの冷凍庫からG-アクチンのアリコートを取り出し、迅速に解凍します。
- G-アクチンに10倍の重合バッファーを添加して最終濃度を1倍にします。 1倍の重合バッファー中のG-アクチン濃度が、臨界濃度をはるかに上回る少なくとも10〜20μMであることを確認する。室温(RT)で1時間インキュベートし、アクチンを重合させる。
- 重合後、4℃で溶液中にF-アクチンを保存し、数週間安定させる。保管後に再びF-アクチンを使用する前に、チューブを数回フリックさせて、すべてのアクチンが溶解し、溶液中に均一に分布するようにします。
注:(オプション)ファロイジンを添加して、G-アクチン:ファロイジンのモル比を1:1にする。 RTで30分間インキュベートし、ファロイジンをF-アクチンに結合させる。ファロイジンは、F-アクチンを安定化させ、(i)遠心分離中に沈降しないアクチンの量を減少させ、(ii)F-アクチンを臨界濃度(約0.5μM)以下に希釈することを可能にする結合曲線を生成するためにF-アクチンの量を変化させる場合に必要である(親和性の測定に関するセクション5を参照)。
4.ペレット化アッセイ - 基本プロトコル
注記:セクション4で説明した基本的なプロトコールは、目的のタンパク質がF-アクチンと一緒に沈降するかどうかを決定するために使用されます。 F-アクチンへの結合が確立されると、この相互作用の親和性は、セクション5に記載のプロトコールに従って測定することができる。
- 10xストックを1倍に希釈し、DTTを1mMの最終濃度に加えることにより、使用日に反応緩衝液を調製する。
注:(オプション)ポリドカノールを反応緩衝液中0.02%の最終使用濃度に加える。ポリドカノールは、非特異的バックグラウンド結合を減少させ、疎水性タンパク質が超遠心分離管に付着するのを防ぐのに役立つ界面活性剤である。 - 目的のタンパク質を超遠心チューブ中の1x反応バッファー中の所望の濃度に希釈する。サンプル量を少なく(40〜60μL)、最小量の小さな超遠心管( 例えば 、それぞれ0.2 mLを保持する7 x 20 mmのチューブ)を使用して大量のタンパク質を使用しないようにしてください。
注記:多くのアクチン結合タンパク質は、マイクロモル範囲のF-アクチンに対する親和性を有するため、目的のタンパク質を2および10μMで試験することが推奨される。結合が10μMで観察されない場合、結合がより高濃度で観察されることはありそうもない。もし添加されたタンパク質が最終反応体積の10〜20%を占める場合、実験を行う前にタンパク質を反応緩衝液に透析する必要があり得る。 - F-アクチンを所望の最終濃度に加える。
注:2μMは、臨界濃度をはるかに上回っているため、アクチンは繊維状に維持されているため、最初の実験には有用な濃度です。SDS-PAGE(ステップ4.10)で分析すると目に見えるペレットが生成されます。 - 超遠心チューブで以下のコントロールを準備し、アッセイを参考にしてください。
- F-アクチンなしで目的のタンパク質を含むサンプルを調製する。これらのサンプル中のタンパク質濃度が「プラスF-アクチン」サンプル中の濃度と一致することを確認する。
注:これらのサンプルは、F-アクチンの非存在下で超遠心分離チューブの側面に凝集または付着したタンパク質の量を決定する。 - ネガティブコントロールサンプルを調製する関心対象のタンパク質に使用される同一または類似の濃度で投与される。 F-アクチンの有無にかかわらず、F-アクチンと結合しない対照タンパク質を使用する。
注:これは重要なコントロールです。なぜなら、Fアクチンに結合しないにもかかわらず、タンパク質がアクチンフィラメントとFアクチンのペレットに「閉じ込められる」ようになるからです。トラップの量は、F-アクチン源、緩衝液条件などに依存して変化し得る。したがって、この対照はすべての実験に含まれるべきである。理想的には、対照タンパク質は、目的タンパク質( 例えば 、αE-カテニン(〜100kDa)、BSA(66kDa)が適切な対照である)と同様の分子量を有するべきである。市販のゲル濾過標準は、ある範囲のサイズをカバーし、凝集物を含まない傾向があるので、優れたコントロールタンパク質を作る。 - 必要に応じて、F-アクチンの有無にかかわらず、F-アクチンに結合するタンパク質を含む陽性対照試料を調製する。濃度がthの濃度に類似していることを確認するeタンパク質を含む。
注:このコントロールは、実験条件( 例えば、調製されたF-アクチン、反応緩衝液、および遠心分離)がF-アクチン結合を可能にすることを実証する点で有用である。ペレット化アッセイは弱いF-アクチン相互作用を検出することができないので(ディスカッション参照)、既知のF-アクチン結合タンパク質はF-アクチンに対する中程度〜弱い親和性を有することが推奨される( すなわち、低いマイクロモル範囲)。精製されたF-アクチン結合タンパク質は市販されている。
- F-アクチンなしで目的のタンパク質を含むサンプルを調製する。これらのサンプル中のタンパク質濃度が「プラスF-アクチン」サンプル中の濃度と一致することを確認する。
- すべてのサンプルをRTで30分間インキュベートする。
注:関心のあるタンパク質が安定していると仮定して、インキュベーション時間を長くしても問題はありませんが、おそらく不要です。目的のタンパク質がRTで安定でない場合、サンプルは4℃でインキュベートすることができます。この場合、より長いインキュベーション時間が必要な場合があります。 - 試料を遠心分離機ローターにロードする。遠心分離後にペレットを再懸濁するのを助けるために、チューブをローター内に配置する。このために、すべての遠心チューブ( 例:サンプル番号)に印を付け、ローター内のすべてのチューブを同じ位置( 例えば、外向きの数)に置きます。
- 超遠心分離機で4℃、100,000×gで20分間遠心する。
- 遠心分離後、各チューブから上清の3/4( 例えば 、開始容量が60μLであれば45μL)を除去し、別の微量遠心チューブ中の1/3容量の4×サンプルバッファー(この場合は15μL)と混合する。
- ペレット(ガラスのように見える)を乱さないように注意しながら、ゲルローディングチップで残りの上清を除去する。
注:分離後のタンパク質解離を制限するために遠心分離を完了した後できるだけ早く上清をチューブから除去することが重要です。また、同じ理由でペレットを反応バッファーで洗浄しないでください。
- ペレット(ガラスのように見える)を乱さないように注意しながら、ゲルローディングチップで残りの上清を除去する。
- 各ペレットに1/4倍量の1xサンプルバッファーを加えるt( 例えば 、開始容量が60μLの場合は80μL)。
注:これにより、ペレットと上清サンプルとの直接的な比較およびペレット化されたタンパク質の割合の決定を可能にする上清(ステップ4.8、4倍サンプルバッファーの1/3量が加えられた)と同じ希釈が行われる。- すべてのチューブにサンプルバッファーを添加し、室温で少なくとも5分間インキュベートする。サンプル回収を改善するために、ペレットをサンプル緩衝液中に置く。
- チューブのペレット領域を連続的に洗浄することによりペレットを再懸濁するために、サンプルをp200ピペットチップで8〜10回粉砕する。再懸濁の助けとなるように、粉砕中にペレット上にピペットチップを静かにこすります。
注:粉砕中にサンプルに空気が混入しないように注意してください。これにより、サンプルバッファーが泡立ち、サンプルの回収率が低下します。 - 粉砕後に再懸濁したサンプルをマイクロチューブに移す。
- SDS-PAGEおよびクマシー染色8により上清およびペレット試料を分析する。レーンあたり10-15μLの試料をロードする。これはタンパク質を可視化するのに十分である。
注:F-アクチンと同時沈降するタンパク質は、「F-アクチン」がない「F-アクチン」ペレットサンプル( 図1A )より濃縮されます。タンパク質濃度が0.1〜10μMの範囲であれば、標準的なクマシーブルー染色で検出するのに十分である。高親和性相互作用を測定するためにタンパク質濃度を低くすると、コロイド状クーマシー9またはウェスタンブロッティングを使用して感度を高めることができます。 - スキャナーまたはイメージングシステムを使用して画像クーマシー染色したゲル(ステップ5.12)。
5.ペレット化アッセイ - 定量
注:F-アクチンへの特異的結合が観察される場合、tの親和性を測定することは有用であり得る彼は相互作用する。これは、第4章で概説したプロトコールにいくつかの変更や追加を加えることによって達成されます。結合アッセイの設計と解釈に関する優れたガイドは、Pollard 10を参照してください。分析と定量化を支援するフローチャート( 図2 )が提供されています。
- 試験する濃度範囲を決定する。
注記:濃度範囲はタンパク質に依存し、見掛けのK d ( 例えば、 1μM)未満の濃度から結合を飽和させるのに十分高い濃度に及ぶべきである。正確な結合曲線を生成するためには、濃度範囲の上限で複数のサンプルで結合が飽和に達することが重要です( 図1C )。上記のように、多くのアクチン結合タンパク質は、低マイクロモル範囲(1〜5μM)でF-アクチンに対する親和性を有する。 0.5〜1μMのK dを有するタンパク質の場合、有用な出発濃度範囲は0.1〜10μM。 - 目的のタンパク質を強く回転させ(ステップ2.3)、凝集物を除去する。試験する最終濃度の2倍で7-8サンプルを含む濃度シリーズを作製するためにタンパク質を連続希釈する。例えば、試験する範囲が0.1-8μMである場合、1倍反応緩衝液中で16,8,4,2,1,0.5および0.2μMの以下の希釈液を調製する。
注意:ステップ4.2で述べたように、添加したタンパク質が最初の希釈液(上記の例では16μMサンプル)の10%-20%を超える場合、タンパク質をさらに濃縮するか、タンパク質を1×反応緩衝液に添加する。 「プラスF-アクチン」および「F-アクチンなし」サンプルについては、それぞれの希釈液を十分に調製するようにしてください。 - 超遠心分離チューブ中の1x反応バッファー中で所望の濃度に目的のタンパク質を希釈することにより、サンプルを調製する(セクション4のように)。 ultracentを使用して多量のタンパク質を使用しないように、サンプル量を低く抑えてください(40〜60μL)小さな最小容積( 例えば 、それぞれ0.2mLを保持する7×20mmの管)を備えたリファイ管。
- F-アクチンを目的の最終濃度に適切なサンプルに加え、1倍の反応バッファーを使用して容量を上げます。例えば、2μMのF-アクチンを使用する50μLの反応では、各サンプルに25μLの2倍タンパク質、10μLの10μMF-アクチン、および15μLの1倍反応緩衝液があることを確認します。対照サンプルを含める(ステップ4.4.2および4.4.3)。
注:陰性および陽性対照については、試験する範囲内の1つの濃度(ステップ5.1)、理想的にはその範囲の中央付近( 例えば、濃度範囲が0.1〜10μMの場合は4μM)を使用します。
- F-アクチンを目的の最終濃度に適切なサンプルに加え、1倍の反応バッファーを使用して容量を上げます。例えば、2μMのF-アクチンを使用する50μLの反応では、各サンプルに25μLの2倍タンパク質、10μLの10μMF-アクチン、および15μLの1倍反応緩衝液があることを確認します。対照サンプルを含める(ステップ4.4.2および4.4.3)。
- すべてのサンプルをRTで30分間インキュベートする。
- 30分後、各サンプルの1/5( 例えば、 50μLの反応液10μL)を除去し、20μLの水と10μLの4×サンプルバッファーと混合する。
注:これらは「合計」です標準曲線を生成するために使用されます。 - 超遠心分離機ローターに試料をロードする。 100,000×gおよび4℃で20分間遠心分離する。
- 必要に応じて、遠心分離後、各チューブから3/4の上清( 例えば、遠心分離した容量が40μLであれば30μL)を除去し、4×サンプルバッファー(この場合は10μL)と別の微量遠心管で混合する。ペレットを乱さないように注意しながら、ゲルローディングチップで残りの上清を除去する。
注:結合親和性を測定する場合、上清を流す必要はありません。それにもかかわらず、特に新しいタンパク質を試験する場合には、上清を保存することが有用であり得る。 - 分析しない場合は、上清を除去する(ステップ5.7)。
- ペレットを1倍のサンプルバッファー( 例えば、遠心分離した容量が40μLの場合は40μL)の1倍量に再懸濁する。
- すべてのチューブにサンプルバッファーを添加し、室温で少なくとも5分間インキュベートする。
- Trサンプルをp200ピペットチップで8-10回反復し、チューブのペレット領域を連続的に洗浄する。再懸濁の助けとなるように、粉砕中にペレット上にピペットチップを静かにこすります。
- 再懸濁したタンパク質をマイクロ遠心チューブに移す。
注:これらは「ペレット」サンプルです。 - SDS-PAGEで合計とペレットのサンプルを分析する8 。可能であれば、すべてのサンプルを1つのゲルで実行します。そうでない場合は、1つのゲルでペレットサンプルを実行し、1秒間に全サンプルを実行します。
注:サンプル数を考慮すると、分析には大きなゲルシステムが推奨されます。 2つ以上のゲル上でサンプルを走らせる場合、すべてのゲルが同じように染色されることが重要です( つまり、同じクマシー溶液と染色/デスティネーションで同じ時間)。 - 広範囲( すなわち、 2〜3対数)および直線範囲にわたってタンパク質バンド強度を測定するイメージングシステムを使用したイメージクーマシー染色ゲル。イメージが飽和ピクセルなしで収集されます。
注:レーザーベースのイメージングシステムは、最高の感度と信号対雑音比を提供します。 - ImageJまたは類似の分析プログラムを使用して、タンパク質バンド強度を測定し、結合したタンパク質の量を計算する。
注記:すべてのサンプル測定では、ImageJの選択ツールを使用して、各バンドの周りに関心領域(ROI)を描き、領域と平均グレー値を測定(解析>測定)します。サンプルを含まない領域からの平均グレー値を測定することにより、各ゲルのバックグラウンドを計算する。各ROIの平均グレー値からバックグランド平均グレー値を差し引き、各バンドの積算濃度値を得るために面積を掛けます。- Totalサンプル( 図2A )から目的のバンド強度のタンパク質を測定します。
- バンド強度( すなわち、積分密度測定値)対タンパク質質量( 図4 )をプロットすることによって標準曲線を生成する。2B)。
- F-アクチンと一緒に沈降する目的のタンパク質の量を測定する(共沈降したタンパク質、 図2C )。
- F-アクチンの非存在下で沈降する目的のタンパク質の量を測定する(バックグラウンド沈降、 図2D )。
- 共沈降したタンパク質からバックグランド沈降物を差し引く( すなわち、 5.13.3のステップ5.13.4の値を差し引いて)、F-アクチンに結合するタンパク質の量を決定する。
- 各ペレット中のF-アクチンの量を測定する( 図2E )。サンプル当たりのF-アクチンの平均量を決定し、次いで各サンプルを平均で割って、各サンプル中のF-アクチンの平均に対する比( すなわち、バンドより下の数)を決定する。
- 各サンプルについて、ペレットの相違を調整するために、結合タンパク質(ステップ5.13.5で計算)の量をF-アクチンアクチンペレット比(ステップ5.13.6)で割ります。
NOTE:この値は標準化された結合タンパク質である。 - 標準曲線(ステップ5.13.2)を使用して、各サンプルの標準化結合タンパク質(ステップ5.13.7)の量(質量)を計算する。
注:最初に除去されたタンパク質(「Total」サンプル)、およびロードされた量(ペレット全体が充填されていない限り、ペレットの一部である)は、タンパク質の総量を計算する際に考慮する必要がありますそれはペレット化された。 - ペレット中のタンパク質の全質量(ステップ5.13.8で計算)およびサンプルの容量から、各サンプル中の結合したタンパク質の濃度を決定する。この値を出発濃度から差し引き、遊離タンパク質の量を決定する。結合したタンパク質の濃度をアクチンの濃度(μM/アクチンのμM)とプロットし、遊離タンパク質の濃度で割って結合曲線を生成する( 図1C )。
注:F-アクチンは単一の均一な種ではないので、それは難しいF-アクチンのモル濃度をG-アクチン濃度から外挿することができる。結合したタンパク質の量(アクチンのμM/μM)を決定するために開始G-アクチン濃度を使用し、反応における結合部位の見かけの濃度を推定する。アクチンフィラメント上の単一のアクチン結合タンパク質分子が複数のモノマーと接触することができるため、アクチンのすべてが重合するわけではないので、結合部位の濃度は通常、反応におけるアクチンモノマーの濃度よりも低い。
- 統計的プログラムを使用して、非線形最小二乗回帰を使用して結合曲線から親和性(K d )およびB maxを決定する。
注記:結合データが解析されない場合や、結合が飽和しているかどうかが不明瞭で、実験誤差10を歪ませる可能性があるため、スキャッチャードプロットは推奨されません。
結果
本発明者らは、共沈降アッセイにおいてF-アクチンへのαE-カテニンホモダイマーの結合を調べた。過去の実験から、F-アクチンに対するαE-カテニンホモダイマーの親和性は約1μMであり、 Bmaxは 11に近いことが示されているので、低濃度のF-アクチン(0.2μMではなく2μM;議論)。 0.2μMが臨界濃度未満であるため、ウサギ骨格筋G-アクチンから重合したF-アクチンを安定化するためにファロイジンを添加した(ステップ3.3)。増加する濃度のαE-カテニンホモダイマー(0.125-12.0μM)を、0.2μMのF-アクチンの存在下または非存在下でインキュベートした。試料を遠心分離し、得られたペレットを分析した( 図1A )。予想通り、バックグラウンドより上のF-アクチンと一緒に沈降したαE-カテニンホモダイマー( 図1A 、F-アクチンペレットサンプルを非F-acスズペレットサンプル)。 BSAを陰性対照として用いた( 図1B )。結合したタンパク質を定量し、遊離タンパク質上にプロットして、相互作用の親和性を計算した( 図1C )。プロットされたデータはヒルの方程式に最もよく合います。計算されたK dは2.9μMであり、B maxは0.2であり、ヒル係数(h)は4.8であった。したがって、αE-カテニンホモダイマーは、以前の研究(〜1.0μMに対して2.9μMのK d)と一致して、低いマイクロモル親和性でF-アクチンに協同して結合する11 。
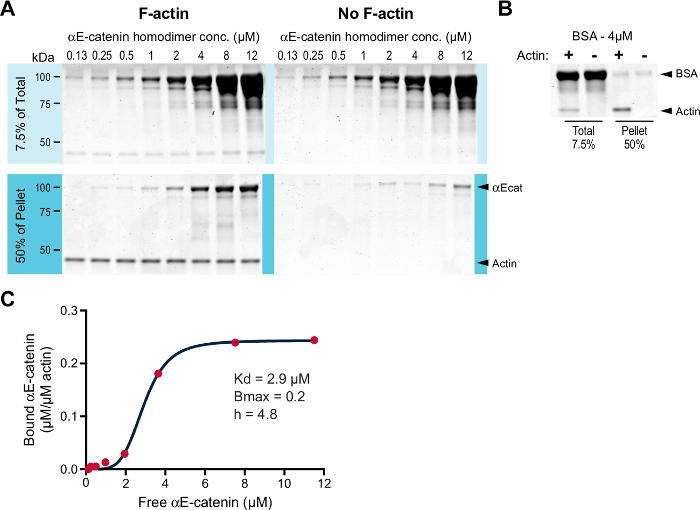
図1: 高速F-アクチン同時沈降アッセイ。 ( A )増加する濃度(0.125-12.0μM)のαE-カテニンホモダイマーを、ファロイドで安定化した0.2μMのF-アクチン(左パネル)または非存在下(右パネル)でインキュベートしたn。それらをRTで30分間インキュベートし、遠心分離した。全部(出発材料の7.5%)およびペレット化した材料(ペレット化した材料の50%)をSDS-PAGEによって分離し、クマシー色素で染色した。 ( B )陰性対照として4μMBSAを流した。 F-アクチンを含む(+)または含まない( - )アクチビンを含む全サンプルおよびペレットサンプルをSDS-PAGEによって分離し、クマシー色素で染色した。 ( C )遊離αE-カテニン(μM)に対して、Aから結合したαE-カテニン(μM/μMアクチン)をプロットし、ヒル式(赤線)に適合した。 K d 、B max 、及びヒル係数(h)が列挙される。 この図の拡大版を見るには、ここをクリックしてください。

図2: アクチンペレット化定量 - フローチャート。この概略図は、定量化に使用されたTotalおよびPelletサンプル( A 、 CE )および標準曲線( B )の例を含む第5章の重要なステップを概説しています。 5.13ステップ: 1 )総サンプル(A)中の目的のタンパク質の量を測定する。 2 )バンド強度対タンパク質質量(B)をプロットして標準曲線を作成する。 3 )F-アクチン( C )と一緒に沈降する目的のタンパク質の量を測定する。 4 )F-アクチン( D )の非存在下でペレット化した目的タンパク質の量を測定する。 5 )Fをアクチンに結合したタンパク質の量を決定するためにCからDを引く。 6 )各ペレット中のF-アクチンの量(E)を測定し、1サンプル当たりのF-アクチンの平均量を計算し、各サンプルを平均で割り出す(以下の数字はその比を示す)。 7 )各サンプルについて、結合タンパク質の量(ステップ5で計算)をF-アクチンペレット比(ステップ6で計算)で割り、ペレットの違いを調整する。 8 )標準曲線( B )を用いて、各試料中の正規化された結合タンパク質の量(質量)を計算する(工程7)。 9 )遊離タンパク質および結合タンパク質の濃度を決定して結合曲線を作成する。 この図の拡大版を見るには、ここをクリックしてください。
ディスカッション
アクチン共沈降アッセイは、タンパク質がF-アクチンに結合するかどうかを迅速に判定することができる簡単な技術である。いくつかの変更を加えて、この技術を用いて相互作用の親和性を測定することもできる。上記のプロトコールで提起された点に加えて、アッセイの設計、実施および解釈の際には、以下の問題を考慮する必要があります。
関心のあるタンパク質
新たに調製または凍結したタンパク質をアッセイに使用することができる。凍結タンパク質が使用される場合、凍結がF-アクチン結合に影響を及ぼさないように、結果を新鮮な(決して凍結されていない)タンパク質と比較することが強く推奨される。
G-アクチン源
多くのペレット化実験は、その豊富な存在のために筋肉から単離されたG-アクチンを使用する。哺乳動物には、α、β、γの3つの主要なアクチンアイソタイプがあり、それらは非常に類似している(> 90%の配列同一性ty)。それにもかかわらず、アイソタイプ12,13の間に機能的な相違がある。可能であれば、結合アッセイに使用されるG-アクチンアイソタイプは、インビボアイソタイプと一致するはずである。例えば、骨格筋で発現されるタンパク質を試験する場合、α-アクチンが最良の選択である。線維芽細胞で発現されるタンパク質を調べる場合は、β-アクチンが推奨される。
ファロイジン使用
ファロイジンはFアクチンに結合するので、Fアクチン結合タンパク質(アクチンフィラメントへの結合からのコフィリンなどのファロイジンブロック)の結合を妨害したり、ブロックすることさえあります14 。従って、ファロイジンは注意して使用すべきであり、可能であれば非ファロイジン処理した試料と比較した。
高い背景
F-アクチンの非存在下でタンパク質が沈降することは珍しいことではない( 図1A 、F-アクチンペレット試料なしs)。しかしながら、高いレベルのバックグラウンド沈降は、真のアクチン共沈降を隠し、不可能ではないにしても、タンパク質がF-アクチンに結合するか、または相互作用の親和性を測定するのを困難にする可能性がある。ポリジカノールを反応緩衝液(工程4.1)に添加することにより、バックグラウンドを有意に減少させることができ、容易な解決策である。それがバックグラウンドを減少させないならば、反応緩衝液、塩濃度、および/またはインキュベーション温度を調整することが役立ち得る。
結合曲線
結合曲線を生成するためには、目的のタンパク質またはF-アクチンの濃度を一連の反応にわたって変化させることが必要である。実際には、固定された濃度でF-アクチンを維持し、目的のタンパク質の濃度を変化させることがより容易で好ましい。ペレット化アッセイにおいて固定濃度( 例えば、 2μM)でF-アクチンを維持することにより、より高い濃度のF-アクチンでの非特異的捕捉が制限され、より低い(<0.5μM)濃度のF-アクチンでの解重合。脱重合はファロイジンを用いて防止することができるが、これは系に潜在的な複雑化因子を導入する(工程3.3以上参照)。固定濃度でF-アクチンを維持することにより、サンプル間でF-アクチンペレットを比較(および標準化)することができ、失敗した実験( すなわち、 F-アクチンペレットが非常に変動し、濃度間の分析を妨げる)を同定することができる。最後に、固定濃度でF-アクチンを維持することにより、アクチンフィラメントへの結合が協同的であるかどうかを決定することができる( 図1C )。
飽和結合
すべての結合実験と同様に、F-アクチンへの結合が飽和し、タンパク質+ F-アクチンの濃度が安定することが重要です( 図1C )。プラトーがなければ、正確な解離平衡定数を計算することはできません。したがって、それ試験すべき希釈シリーズを注意深く計画し、常により高濃度のタンパク質( すなわち、予想されるK dよりも少なくとも5〜10倍高い)を含むことが重要である。
バインディング分析
測定された解離定数が決定的であるためには、目的タンパク質に対するF-アクチン上の結合部位の濃度が親和性よりもはるかに低くなるようにするF-アクチン濃度を用いてアッセイを実施すべきである。この基準が満たされたかどうかを確認するために、B maxから結合部位の濃度を推定する。例えば、[F-アクチン]が2μMでBmax = 0.5である場合、[結合部位]は約1μMである。 K dは[結合部位]よりも少なくとも5〜10倍大きくなければならない。測定されたK dが[結合部位]と同じオーダーの大きさである場合、観察された結合曲線は高親和性結合siの滴定を表す可能性がある真の結合等温線ではなく、これが観察される場合は、正確な親和性を測定するために、10倍低いF-アクチン濃度を用いてアッセイを繰り返す。高親和性相互作用のために、親和性を正確に測定するのに十分低いF-アクチン濃度を達成するために、ファロイジン安定化(ステップ3.3)が必要であるかもしれない。
最後に、アッセイを実施し、評価する際に研究者が認識すべき共沈降アッセイに関する根本的な制限がある。最も重要なことに、共沈降アッセイは真の平衡定数を生成しない。結合生成物( すなわち、タンパク質+ F-アクチン)は、遠心分離の間に反応物から分離され、その後、生成物は解離して新たな平衡を作り出すことができる。その結果、共沈降アッセイは、誤った親和性の相互作用を誤って計算したり、検出しなかったりする可能性があります。多くのアクチン結合タンパク質は、Fアクチンに対して低い( すなわち、マイクロモル)親和性を有するので、陰性の結果( 15,16を参照)。これらの制限にもかかわらず、ペレット化アッセイは、ほとんどの研究者の手段の範囲内であり、タンパク質がF-アクチンに結合するかどうかを決定し、相互作用の親和性を測定するための有効なツールである。
開示事項
著者らは、競合する金銭的利益がないと宣言している。
謝辞
この研究は、国立衛生研究所認可HL127711のAVKに支持された。
資料
| Name | Company | Catalog Number | Comments |
| Sorvall MTX 150 Micro-Ultracentrifuge | ThermoFisher Scientific | 46960 | |
| S100-AT3 rotor | ThermoFisher Scientific | 45585 | |
| Ultracentrifuge tubes - 0.2 mL | ThermoFisher Scientific | 45233 | |
| Actin, rabbit skeletal muscle | Cytoskeleton | AKL99 | |
| Bovine Serum Albumin | Sigma | A8531 | |
| Polidicanol (Thesit) | Sigma | 88315 | |
| Phalloidin | ThermoFisher Scientific | P3457 | |
| Dithiothreitol (DTT) | ThermoFisher Scientific | R0862 | |
| Adenosine triphosphate (ATP) | Sigma | A2383 | |
| Imidazole | Fisher Scientific | O3196 | |
| Sodium Chloride (NaCl) | Fisher Scientific | BP358 | |
| Magnesium Chloride (MgCl2) | Fisher Scientific | M33 | |
| Potassium Chloride (KCl) | Fisher Scientific | P217 | |
| Ethylene glycol-bis(β-aminoethyl ether)-N,N,N',N'-tetraacetic acid (EGTA) | Sigma | 3779 | |
| Odyssey CLx Imaging System | LI-COR | ||
| Coomassie Brilliant Blue R-250 Dye | ThermoFisher Scientific | 20278 | |
| Colloidal Blue Staining Kit | ThermoFisher Scientific | LC6025 |
参考文献
- Pollard, T. D. Actin and Actin-Binding Proteins. Cold Spring Harb Perspect Biol. 8 (8), (2016).
- Hansen, M. D., Kwiatkowski, A. V. Control of actin dynamics by allosteric regulation of actin binding proteins. Int Rev Cell Mol Biol. 303, 1-25 (2013).
- Lappalainen, P. Actin-binding proteins: the long road to understanding the dynamic landscape of cellular actin networks. Mol Biol Cell. 27 (16), 2519-2522 (2016).
- Mullins, R. D., Hansen, S. D. In vitro studies of actin filament and network dynamics. Curr Opin Cell Biol. 25 (1), 6-13 (2013).
- Miller, P. W., et al. Danio rerio alphaE-catenin is a monomeric F-actin binding protein with distinct properties from Mus musculus alphaE-catenin. J Biol Chem. 288 (31), 22324-22332 (2013).
- Wickline, E. D., et al. alphaT-Catenin Is a Constitutive Actin-binding alpha-Catenin That Directly Couples the Cadherin.Catenin Complex to Actin Filaments. J Biol Chem. 291 (30), 15687-15699 (2016).
- Simpson, R. J., Adams, P. D., Golemis, E. . Basic methods in protein purification and analysis : a laboratory manual. , (2009).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Dyballa, N., Metzger, S. Fast and sensitive colloidal coomassie G-250 staining for proteins in polyacrylamide gels. J Vis Exp. (30), (2009).
- Pollard, T. D. A guide to simple and informative binding assays. Mol Biol Cell. 21 (23), 4061-4067 (2010).
- Hansen, S. D., et al. alphaE-catenin actin-binding domain alters actin filament conformation and regulates binding of nucleation and disassembly factors. Mol Biol Cell. 24 (23), 3710-3720 (2013).
- Perrin, B. J., Ervasti, J. M. The actin gene family: function follows isoform. Cytoskeleton (Hoboken). 67 (10), 630-634 (2010).
- Tondeleir, D., Vandamme, D., Vandekerckhove, J., Ampe, C., Lambrechts, A. Actin isoform expression patterns during mammalian development and in pathology: insights from mouse models. Cell Motil Cytoskeleton. 66 (10), 798-815 (2009).
- Prochniewicz, E., Janson, N., Thomas, D. D., Dela Cruz, E. M. Cofilin increases the torsional flexibility and dynamics of actin filaments. J Mol Biol. 353 (5), 990-1000 (2005).
- Kuhn, J. R., Pollard, T. D. Real-time measurements of actin filament polymerization by total internal reflection fluorescence microscopy. Biophys J. 88 (2), 1387-1402 (2005).
- Hansen, S. D., Zuchero, J. B., Mullins, R. D. Cytoplasmic actin: purification and single molecule assembly assays. Methods Mol Biol. 1046, 145-170 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved