Method Article
Измерение связывания белка с F-актином путем совместного осаждения
В этой статье
Резюме
Этот протокол описывает метод для проверки способности белка к совместному осаждению с нитчатым актином (F-actin) и, если связывание наблюдается, для измерения аффинности взаимодействия.
Аннотация
Организация нитчатого актина (F-actin) внутри клеток регулируется большим количеством актин-связывающих белков, которые контролируют зарождение актина, рост, сшивание и / или разборку. В этом протоколе описывается методика - совместное осаждение актина или гранулирование - определение того, связывает ли белковый или белковый домен F-актин и измеряет аффинность взаимодействия ( т.е. константу равновесия диссоциации). В этом методе интересующий белок сначала инкубируют с F-актином в растворе. Затем для осаждения актиновых филаментов используют дифференциальное центрифугирование, и осажденный материал анализируют с помощью SDS-PAGE. Если интересующий белок связывается с F-актином, он будет осаждаться вместе с актиновыми филаментами. Продукты реакции связывания ( т.е. F-актин и представляющий интерес белок) могут быть количественно определены для определения аффинности взаимодействия. Актин гранулирующий анализ является прямым методом определенияЕсли интересующий белок связывает F-актин и для оценки того, как изменения этого белка, такие как связывание лиганда, влияют на его взаимодействие с F-актином.
Введение
Афин является важным белком цитоскелета, который играет критическую роль в множественных клеточных процессах, включая подвижность, сокращение, адгезию и морфологию 1 . Актин существует в двух формах: мономерный глобулярный актин (G-actin) и полимеризованный нитчатый актин (F-актин). Внутри клеток F-актиновая организация контролируется большим набором белков, которые регулируют зарождение, рост, сшивание и разборку актиновых филаментов 2 , 3 , 4 . Однако, как несколько актин-связывающих белков функционируют согласованно, чтобы регулировать организацию сети актина, все еще в значительной степени неясно.
Измерение белково-белковых взаимодействий является важным подходом для понимания того, как белки оказывают влияние на клеточное поведение на биохимическом уровне. Для определения взаимодействия между очищенными белками можно использовать множество различных анализов.Общие подходы к растворимым белкам включают в себя срывы, поляризацию флуоресценции, изотермическую титровальную калориметрию и поверхностный плазмонный резонанс. Важно отметить, что для всех этих анализов требуется, чтобы белки были растворимыми и, таким образом, их трудно адаптировать для использования с полимерным волокнистым белком, таким как F-актин. Здесь мы описываем методику - коэдиентацию актина или гранулирование - анализ, чтобы определить, связывает ли белковый или белковый домен F-актин и измеряет сродство взаимодействия.
Актин гранулирующий анализ является относительно простой техникой, которая не требует специального оборудования, кроме ультрацентрифуги. Все реагенты могут быть изготовлены, исходя из знания базовой биохимии или приобретены. После установления связывания с F-актином анализ можно использовать для измерения кажущейся аффинности ( т.е. константы равновесия диссоциации) 5 . Кроме того, после установления сродства, гранулирующий анализЯвляется полезным инструментом для измерения того, как изменения интересующего белка ( т.е. пост-трансляционные модификации, мутации или связывание лигандов) влияют на его взаимодействие с F-актином 6 . Метод имеет ограничения (см. Обсуждение ), о которых исследователь должен знать перед попыткой анализа.
протокол
1. Подготовить материалы
- Очистите интересующий белок (см. Раздел 2).
- Подготовьте или купите G-actin.
ПРИМЕЧАНИЕ: G-actin может быть выделен из нескольких источников 1 ; Альтернативно, его можно приобрести. Восстановленный G-актин (в 5 мМ Tris pH 8,0, 0,2 мМ CaCl 2 , 0,2 мМ АТФ (аденозинтрифосфат) и 0,5 мМ дитиотреитол (ДТТ) следует заморозить, хранить при -80 ° C и> 10 мг / мл В небольших (10-20 мкл) аликвотах и оттаивают непосредственно перед использованием. Аликвоты G-actin не следует замораживать. - Подготовьте или купите контрольный белок, такой как BSA (см. Шаг 4.4).
- Приготовьте 10-кратный буфер для полимеризации (200 мМ имидазола с pH 7,0, 1 М KCl, 20 мМ MgCl 2 , 5 мМ АТФ и 10 мМ ЭГТА (этиленгликоль-бис (β-аминоэтиловый эфир) -N, N, N ', N'- Тетрауксусна кислота)). Сделайте 10-кратный запас и отрегулируйте рН после добавления АТФ, если необходимо. Алиготе (25 мкл полезный объем) и хранить при -80 и #176; С.
- Готовят 10-кратный реакционный буфер (200 мМ имидазола, рН 7,0, 1,5 М NaCl, 20 мМ MgCl 2 , 5 мМ АТФ и 10 мМ EGTA). Сделайте 10-кратный запас и отрегулируйте рН после добавления АТФ, если необходимо. Аликвоту (50-100 мкл полезный объем) и хранить при -80 ° C.
ПРИМЕЧАНИЕ. Состав реакционного буфера является гибким и может потребоваться корректировка для уменьшения фонового осаждения, ограничения неспецифического связывания и / или улучшения связывания (этапы 1.5.1-1.5.3).- Отрегулируйте рН буфера реакции между 6 и 8 для оптимизации стабильности белка. При более низком или более высоком рН замените соответствующий буфер для имидазола.
ПРИМЕЧАНИЕ. Используйте рН 7,0 в качестве отправной точки, если для стабильности стабильность белка не требует более низкого или более высокого рН. Не используйте буфер с рН ниже 6,0 или выше 8,0, так как это может нарушить актин. Рекомендуемые буферы (конечная концентрация и оптимальные значения рН) включают: 20 мМ MOPS (3- ( N- морфолино) пропансульфоновая кислота), pH= 6,5; 20 мМ имидазола, pH 7,0; 10 мМ HEPES (4- (2-гидроксиэтил) пиперазин-1-этансульфокислота), pH 7,5; И 20 мМ Трис, рН = 8,0. - Варьируйте концентрацию соли в буфере реакции, в зависимости от потребностей анализа.
ПРИМЕЧАНИЕ. Актин является кислотным белком, и почти все связывающие актин белки в некоторой степени зависят от электростатических взаимодействий с ассоциацией с актином. Поэтому увеличение концентрации соли в большинстве случаев приводит к уменьшению связывания актина. Буфер для реакции использует физиологический уровень соли (150 мМ NaCl, рабочая концентрация), и это рекомендуемая исходная точка. Если необходимо, концентрация соли может быть снижена ( например, до 100 мМ) для содействия связыванию или увеличения с целью ограничения связывания. - Не изменяйте концентрации MgCl 2 , ATP или EGTA в буфере для реакции, если нет особых причин для этого.
- Отрегулируйте рН буфера реакции между 6 и 8 для оптимизации стабильности белка. При более низком или более высоком рН замените соответствующий буфер для имидазола.
2. Подготовьте тестовый белок к анализу.
- ДГОБелок высокой чистоты с использованием жидкостной хроматографии для достижения наилучших результатов 7 .
ПРИМЕЧАНИЕ. При использовании рекомбинантного белка следует удалить крупные белковые метки, такие как глутатион-S-трансфераза (GST), путем расщепления протеазой из целевого белка, поскольку они могут препятствовать связыванию. GST также вызывает гомодимеризацию слитых белков, которые могут искусственно увеличить сродство связывания актина. - Определить концентрацию белка путем измерения поглощения при 280 нм. Разделите по коэффициенту экстинкции; Коэффициент экстинкции можно вычислить из последовательности белка, используя анализ последовательностей или онлайн-инструменты. В качестве альтернативы, определите концентрацию белка с использованием методов Брэдфорд или BCA (бицинхониновая кислота).
ПРИМЕЧАНИЕ. Для начальных экспериментов обычно достаточно 50-100 мкл белка при 20-40 мкМ. Это позволит проанализировать связывание в области низких микромолей, что является хорошей отправной точкой для большинства актин-связывающих белков. Больший квантИ часто требуется более высокая концентрация белка для создания кривой связывания для расчета сродства (см. Раздел 5). - Незадолго до употребления тщательно перемешайте белок (50000-100000 мкг в течение 10 мин при 4 ° С), чтобы удалить агрегаты нерастворимого белка. Если имеет значение растворимость, повторно измерьте концентрацию белка (шаг 2.2) после центрифугирования.
3. Подготовьте F-актин
- Удалите аликвоту G-actin из морозильника -80 ° C и быстро разморозьте.
- Добавить 10x полимеризационный буфер к G-актину до конечной концентрации 1x. Убедитесь, что концентрация G-актина в 1х полимеризационном буфере составляет по меньшей мере 10-20 мкМ, значительно выше критической концентрации. Инкубируйте в течение 1 ч при комнатной температуре (RT), чтобы актин смог полимеризоваться.
- После полимеризации хранить F-актин в растворе при 4 ° C, где он будет стабильным в течение нескольких недель. Перед повторным использованием F-actin после хранения аккуратно инвертируйтеИли несколько раз пролистайте пробирку, чтобы убедиться, что весь актин растворен и равномерно распределен в растворе.
ПРИМЕЧАНИЕ: (Необязательно) Добавить фаллоидин для достижения молярного соотношения G-актин 1: 1: фаллоидин. Инкубируйте 30 минут при комнатной температуре, чтобы фаллоидин мог связываться с F-актином. Фаллоидин стабилизирует F-актин и выполняет две задачи: (i) он уменьшает количество актина, которое не осаждается во время центрифугирования, и (ii) оно позволяет разбавлять F-актин ниже критической концентрации (~ 0,5 мкМ), что часто Необходимо, если изменяют количество F-актина для создания кривой связывания (см. Раздел 5 по измерению сродства).
4. Анализ гранулирования - основной протокол
ПРИМЕЧАНИЕ. Основной протокол, описанный в разделе 4, используется для определения того, является ли представляющий интерес белок содовым осаждением с F-актином. Как только связывание с F-актином установлено, аффинность этого взаимодействия может быть измерена по протоколу, описанному в разделе 5.
- Готовят реакционный буфер в день использования, разбавляя запас 10х до 1х и добавляя DTT до конечной концентрации 1 мМ.
ПРИМЕЧАНИЕ: (Необязательно) Добавить полидоканол до конечной рабочей концентрации 0,02% в реакционном буфере. Полидоканол является поверхностно-активным веществом, которое снижает неспецифическое связывание фона и помогает предотвратить прилипание гидрофобных белков к ультрацентрифужной пробирке. - Разбавьте интересующий белок до желаемых концентраций в 1х реакционном буфере в ультрацентрифужных пробирках. Следите за низким объемом образца (40-60 мкл), чтобы избежать использования больших количеств белка, используя ультрацентрифужные пробирки с небольшими минимальными объемами ( например , 7 x 20 мм пробирки, каждая из которых содержит по 0,2 мл).
ПРИМЕЧАНИЕ. Поскольку многие актин-связывающие белки имеют сродство к F-актину в микромолярном диапазоне, рекомендуется тестировать интересующий белок при 2 и 10 мкМ. Если связывание не наблюдается при 10 мкМ, маловероятно, что связывание будет наблюдаться при более высоких концентрациях. ЕслиДобавленный белок составляет более 10-20% от конечного реакционного объема, может потребоваться диализ белка в реакционный буфер перед проведением эксперимента. - Добавить F-actin в желаемую конечную концентрацию.
ПРИМЕЧАНИЕ: 2 мкМ является полезной концентрацией для начальных экспериментов, потому что она значительно выше критической концентрации, таким образом поддерживая актин в нитевидном состоянии. Он будет производить видимый осадок при анализе с помощью SDS-PAGE (стадия 4.10). - Подготовьте следующие контроли в ультрацентрифужных пробирках, чтобы сделать анализ информативным.
- Подготовьте образец (ы), содержащий представляющий интерес белок, без F-актина. Убедитесь, что концентрация белка в этих образцах соответствует концентрации в образцах «плюс F-актин».
ПРИМЕЧАНИЕ: Эти образцы будут определять количество белка, который агрегируется или прилипает к краям трубки ультрацентрифуги в отсутствие F-актина. - Подготовка образцов отрицательного контроляПри той же или сходной концентрации (концентрациях), используемой для представляющего интерес белка. Используйте контрольный белок, который не связывается с F-актином, с F-актином и без него.
ПРИМЕЧАНИЕ. Это важный контроль, поскольку белки могут попасть в ловушку в филаментах актина и грануле с F-актином, даже если они не связывают F-актин. Количество захвата может варьироваться в зависимости от источника F-актина, условий буфера и т. Д. Таким образом, этот контроль должен быть включен во все эксперименты. В идеале контрольный белок должен иметь молекулярную массу, близкую к интересующему белку ( например , для αE-катенина (~ 100 кДа), BSA (66 кДа) является подходящим контролем). Коммерчески доступные стандарты гель-фильтрации обеспечивают превосходные контрольные белки, поскольку они охватывают диапазон размеров и, как правило, не содержат агрегатов. - Необязательно, готовят образцы положительного контроля, содержащие белок, который связывается с F-актином, с F-актином и без него. Убедитесь, что концентрация (концентрации) аналогична концентрацииЕ белка, представляющего интерес.
ПРИМЕЧАНИЕ. Этот контроль полезен тем, что он демонстрирует, что экспериментальные условия ( например, приготовленный F-актин, буфер для реакции и центрифугирование) позволяют связывание F-актина. Поскольку анализ на гранулирование может не выявить слабые взаимодействия F-актина (см. Обсуждение), рекомендуется, чтобы известный F-актин-связывающий белок имел умеренно-слабую аффинность к F-актину ( то есть в области низких микромолей ). Очищенные F-актин-связывающие белки являются коммерчески доступными.
- Подготовьте образец (ы), содержащий представляющий интерес белок, без F-актина. Убедитесь, что концентрация белка в этих образцах соответствует концентрации в образцах «плюс F-актин».
- Инкубируйте все образцы в течение 30 мин при комнатной температуре.
ПРИМЕЧАНИЕ. Более длительные сроки инкубации являются точными, предполагая, что представляющий интерес белок является стабильным, хотя, вероятно, и не нужен. Если интересующий белок не устойчив при RT, образцы можно инкубировать при 4 ° C. В этом случае может потребоваться более длительное время инкубации. - Загрузите образцы в ротор центрифуги. Расположите трубы внутри ротора, чтобы помочь в ресуспендировании осадка после центрифугирования.Для этого отметьте все пробирки центрифуги ( например, с номером образца) и поместите все трубы в роторе в одно и то же положение ( например, номер обращен наружу).
- Центрифуга при 100000 мкг в течение 20 мин при 4 ° С в ультрацентрифуге.
- После центрифугирования удаляют 3/4 надосадочной жидкости ( например , 45 мкл, если начальный объем составляет 60 мкл) из каждой пробирки и смешивают с 1/3 объема 4х буфера для образца (15 мкл в данном случае) в отдельной микроцентрифужной пробирке.
- Удалите оставшийся супернатант с наконечником для загрузки геля, стараясь не нарушать гранулу (которая может быть видна как стеклянное пятно).
ПРИМЕЧАНИЕ. Важно удалить супернатант из пробирок как можно скорее после завершения центрифугирования, чтобы ограничить диссоциацию белка после разделения. Кроме того, не мойте гранулы буфером для реагентов по той же причине.
- Удалите оставшийся супернатант с наконечником для загрузки геля, стараясь не нарушать гранулу (которая может быть видна как стеклянное пятно).
- Добавьте 4/3 тома 1x буфера выборки для каждого pelleТ ( например , 80 мкл, если начальный объем составлял 60 мкл).
ПРИМЕЧАНИЕ. Это делает разбавление таким же, как и для надосадочной жидкости (стадия 4.8, добавляли 1/3 объема 4х буфера для образцов), что позволяет прямое сравнение между образцами осадка и супернатанта и определение процента белка, который был осажден.- Добавить буфер для образца во все пробирки и инкубировать в течение не менее 5 мин при комнатной температуре. Позвольте грану сидеть в буфере для образцов, чтобы улучшить восстановление образца.
- Растирайте образец 8-10 раз с помощью наконечника пипетки p200 для ресуспендирования осадка путем непрерывной промывки области таблетки в пробирке. Аккуратно очистите наконечник пипетки от гранул во время растирания, чтобы помочь при ресуспензии.
ПРИМЕЧАНИЕ. Будьте осторожны, чтобы не вводить воздух в пробу во время растирания, так как это приведет к образованию пузырьков проб и уменьшению восстановления образца. - Перенесите ресуспендированные образцы в микроцентрифужные пробирки после растирания.
- Анализ супернатантов и образцов гранул с помощью SDS-PAGE и окрашивания Кумасси 8 путем загрузки 10-15 мкл образца на дорожку; Этого достаточно для визуализации белков.
ПРИМЕЧАНИЕ: Белки, которые осаждаются совместно с F-актином, будут обогащаться в образцах гранул «плюс F-актин» над образцами гранул «без F-актина» ( рисунок 1A ). Стандартное окрашивание кумасси синим является достаточным для обнаружения, если концентрации белка находятся в диапазоне 0,1-10 мкМ. Коллоидная кумасси 9 или вестерн-блоттинга могут быть использованы для повышения чувствительности, если концентрации более низких белков используются для измерения взаимодействий с большей аффинностью. - Изображение Гели, окрашенные кумасси, с использованием сканера или системы визуализации (шаг 5.12).
5. Анализ гранулирования - количественная оценка
Примечание: если наблюдается специфическое связывание с F-актином, может быть полезно измерить сродство tВзаимодействия. Это достигается путем внесения нескольких изменений и дополнений в протокол, описанный в разделе 4. За отличным руководством по проектированию и интерпретации тестов на связывание см. Pollard 10 . Для помощи в анализе и количественном анализе приводится блок-схема ( рисунок 2 ).
- Определите диапазон концентраций для проверки.
ПРИМЕЧАНИЕ: Диапазон концентраций будет зависеть от белка и должен простираться от концентрации ниже кажущегося K d ( например, 1 мкМ) до концентраций, достаточно высоких, чтобы насытить связывание. Очень важно, чтобы связывание достигало насыщения в нескольких образцах в верхнем пределе диапазона концентраций, чтобы сформировать точную кривую связывания ( рис. 1С ). Как отмечено выше, многие актин-связывающие белки имеют сродство к F-актину в низкомикромолярном диапазоне (1-5 мкМ). Для белка с K d 0,5-1 мкМ полезный начальный диапазон концентраций должен составлять 0,1-10 мкМ. - Жесткий отжиг (шаг 2.3) представляющий интерес белок для удаления агрегатов. Серийно разбавляют белок, чтобы получить концентрационный ряд, содержащий 7-8 образцов при 2х конечной концентрации, подлежащей тестированию. Например, если диапазон для тестирования составляет 0,1-8 мкМ, подготовьте следующие разведения в 1х реакционном буфере: 16, 8, 4, 2, 1, 0,5 и 0,2 мкМ.
ПРИМЕЧАНИЕ. Как упомянуто на этапе 4.2, если добавленный белок составляет более 10-20% от первого разведения (образец 16 мкМ в примере выше), может потребоваться либо концентрировать белок дальше, либо диализировать Белка в 1х реакционный буфер. Обязательно подготовьте достаточное количество каждого разведения для образцов «плюс F-actin» и «no F-actin». - Подготовьте образцы (как в разделе 4), разбавив интересующий белок до желаемых концентраций в 1х буфере для реакции в ультрацентрифужных пробирках. Следите за тем, чтобы объем образца не был низким (40-60 мкл), чтобы избежать использования больших количеств белка с использованием ультрацентраПробирки с небольшими минимальными объемами ( например , 7 x 20-миллиметровые пробирки, каждая из которых содержит по 0,2 мл).
- Добавить F-actin в желаемую конечную концентрацию к соответствующим образцам и поднять объем, используя 1x реакционный буфер. Например, для 50 мкл реакций с использованием 2 мкМ F-актина убедитесь, что каждый образец имеет 25 мкл 2х белков, 10 мкл 10 мкМ F-актина и 15 мкл 1х реакционного буфера. Включите контрольные образцы (шаги 4.4.2 и 4.4.3).
ПРИМЕЧАНИЕ. Для отрицательных и положительных контролей используйте одну концентрацию в пределах проверяемого диапазона (шаг 5.1), идеально около середины до верхней границы диапазона ( например, 4 мкМ, если диапазон концентраций составляет 0,1-10 мкМ).
- Добавить F-actin в желаемую конечную концентрацию к соответствующим образцам и поднять объем, используя 1x реакционный буфер. Например, для 50 мкл реакций с использованием 2 мкМ F-актина убедитесь, что каждый образец имеет 25 мкл 2х белков, 10 мкл 10 мкМ F-актина и 15 мкл 1х реакционного буфера. Включите контрольные образцы (шаги 4.4.2 и 4.4.3).
- Инкубируйте все образцы в течение 30 мин при комнатной температуре.
- Через 30 мин удаляют 1/5 каждого образца ( например, 10 мкл 50 мкл реакции) и смешивают с 20 мкл воды и 10 мкл 4х буфера для образцов.
ПРИМЕЧАНИЕ. Это «Total»Amples и будет использоваться для создания стандартной кривой. - Загрузите образцы в ротор ультрацентрифуги. Центрифуга в течение 20 мин при 100000 xg и 4 ° C.
- По желанию после центрифугирования удаляют 3/4 надосадочной жидкости ( например, 30 мкл, если центрифугированный объем составляет 40 мкл) из каждой пробирки и смешивают с 4х буфером для проб (в данном случае 10 мкл) в отдельной микроцентрифужной пробирке. Удалите оставшийся супернатант с наконечником для загрузки геля, стараясь не мешать грануле.
ПРИМЕЧАНИЕ. При измерении аффинности связывания нет необходимости запускать супернатант. Тем не менее, может быть полезно сохранить супернатант, особенно при тестировании нового белка. - Удалите супернатант, если не анализируете (шаг 5.7).
- Ресуспендируют осадок в 1 объем 1х буфера для образца ( например, 40 мкл, если объем центрифугирования составляет 40 мкл).
- Добавить буфер для образца во все пробирки и инкубировать в течение не менее 5 мин при комнатной температуре.
- TrПовторяют образец 8-10 раз с наконечником пипетки p200, непрерывно промывая область шарика трубки. Аккуратно очистите наконечник пипетки от гранул во время растирания, чтобы помочь при ресуспензии.
- Перенесите ресуспендированный белок в микроцентрифужную пробирку.
ПРИМЕЧАНИЕ. Это образцы «Пелле». - Проанализируйте образцы Total и Pellet с помощью SDS-PAGE 8 . Запускайте все образцы на один гель, если это возможно; Если нет, запустите образцы гранул на один гель и на второй образец.
ПРИМЕЧАНИЕ: Учитывая количество образцов, рекомендуется большая система геля для анализа. При работе с образцами на двух или более гелях важно, чтобы все гели окрашивались одинаково ( то есть, тот же раствор Кумасси и то же время , что и для окрашивания / удаления). - Изображение Кумасси-окрашенные гели с использованием системы формирования изображений, которая измеряет интенсивности белковых полос в широком ( т. Е. В два-три логарифма) и линейном диапазоне. Убедитесь, что изображенияСобранные без насыщенных пикселей.
ПРИМЕЧАНИЕ. Системы формирования изображений на основе лазера обеспечивают наилучшую чувствительность и отношение сигнал / шум. - Используя ImageJ или аналогичную программу анализа, измерьте интенсивности полосы белка и вычислите количество связанного белка.
ПРИМЕЧАНИЕ. Для всех измерений образца используйте инструмент выбора в ImageJ, чтобы нарисовать область интереса (ROI) вокруг каждой полосы и измерить (проанализировать> измерить) область и среднее значение серого. Вычислите фон для каждого геля, измеряя среднее значение серого из области без образца. Вычтите среднее значение среднего значения серого из каждого значения ROI, обозначающее значение серого, а затем умножьте на площадь, чтобы получить интегрированное значение плотности для каждой полосы.- Измерьте интенсивность протеинового белка по процентам от Всего образцов ( Рисунок 2A ).
- Создайте стандартную кривую, построив график интенсивности полосы ( т. Е. Интегральных измерений плотности) по сравнению с массой белка ( рис.2В).
- Измерьте количество представляющего интерес белка, который был осажден с помощью F-actin (соосажденный белок, рисунок 2C ).
- Измерьте количество интересующего белка, осаждаемого в отсутствие F-актина (фоновая седиментация, рисунок 2D ).
- Вычтите фон седиментации из co-sedimented белка ( т. Е. Вычесть значения из шага 5.13.4 из шага 5.13.3), чтобы определить количество белка, который связан с F-актин.
- Измерьте количество F-актина в каждой таблетке ( рисунок 2E ). Определите среднее количество F-актина на образец, а затем разделите каждую выборку на среднее значение, чтобы определить отношение F-актина в каждой выборке относительно среднего ( т. Е. Числа под полосами).
- Для каждого образца разделите количество связанного белка (рассчитанное на этапе 5.13.5) с отношением гранул актина в отношении F-актина (шаг 5.13.6), чтобы скорректировать различия в таблетке.
NОТЕ: Это значение является нормированным связанным белком. - Используйте стандартную кривую (шаг 5.13.2), чтобы вычислить количество (массу) нормированного связанного белка (шаг 5.13.7) в каждом образце.
ПРИМЕЧАНИЕ: первоначально удаленный белок (образец «Всего»), а также загруженное количество (которое, если только весь осадок не был загружен, будет составлять некоторую долю осадка), должно учитываться при расчете общего количества белка Что гранулированный. - Определите концентрацию связанного белка в каждом образце из общей массы белка в грануле (рассчитанной на этапе 5.13.8) и объема образца. Вычтите это значение из начальной концентрации для определения количества свободного белка. Разделите концентрацию связанного белка на концентрацию актина (мкМ / мкМ актина) и постройте график зависимости от концентрации свободного белка для получения кривой связывания ( рис. 1С ).
ПРИМЕЧАНИЕ: Так как F-актин не является единым, однородным видом, он является труднымКульт для экстраполяции молярной концентрации F-актина из концентрации G-актина. Используйте начальную концентрацию G-актина для определения количества связанного белка (мкМ / мкМ актина) и оценки кажущейся концентрации сайтов связывания в реакции. Концентрация сайтов связывания обычно меньше, чем концентрация актиновых мономеров в реакции, потому что не все актины полимеризуются и потому, что одна молекула связывающего актин белка может контактировать с несколькими мономерами на актиновой нити.
- Используя статистическую программу, определите сродство (K d ) и B max по кривой связывания с использованием нелинейной регрессии по методу наименьших квадратов.
ПРИМЕЧАНИЕ. Участки Scatchard не рекомендуется анализировать данные привязки, отчасти потому, что они могут затуманить, насколько насыщен связывание, и потому, что они могут искажать экспериментальную ошибку 10 .
Результаты
Мы исследовали связывание гомодимера αE-катенина с F-актином в анализе ко-седиментации. Поскольку в прошлых экспериментах было показано, что сродство гомодимера αE-катенина для F-актина составляет около 1 мкМ, а B max около 11 , мы провели анализ с низкой концентрацией F-актина (0,2 мкМ, а не 2 мкМ, см. Дискуссия). Поскольку 0,2 мкМ ниже критической концентрации, для стабилизации F-актина, полимеризованного из G-актина скелетной мышцы кролика (шаг 3.3), добавляют фаллоидин. Увеличение концентрации гомодимера αE-катенина (0,125-12,0 мкМ) инкубировали в присутствии или в отсутствие 0,2 мкМ F-актина. Образцы центрифугировали и полученные гранулы анализировали ( фиг.1А ). Как и ожидалось, гомодимер αE-catenin, осажденный с F-актином выше фона ( рисунок 1A , сравните образцы гранул F-актина с no-F-acОбразцы олова). BSA был запущен как отрицательный контроль ( Рисунок 1B ). Связанный белок определяли количественно и наносили на график над свободным белком для расчета аффинности взаимодействия ( фиг.1С ). Построенные данные лучше всего соответствуют уравнению Хилла. Рассчитанный K d составлял 2,9 мкМ, B max - 0,2, а коэффициент Хилла (h) - 4,8. Таким образом, гомодимер αE-катенина связывает F-актин совместно с низкой микромолярной аффинностью, что согласуется с предыдущей работой (K d 2,9 μM против ~ 1,0 μM) 11 .
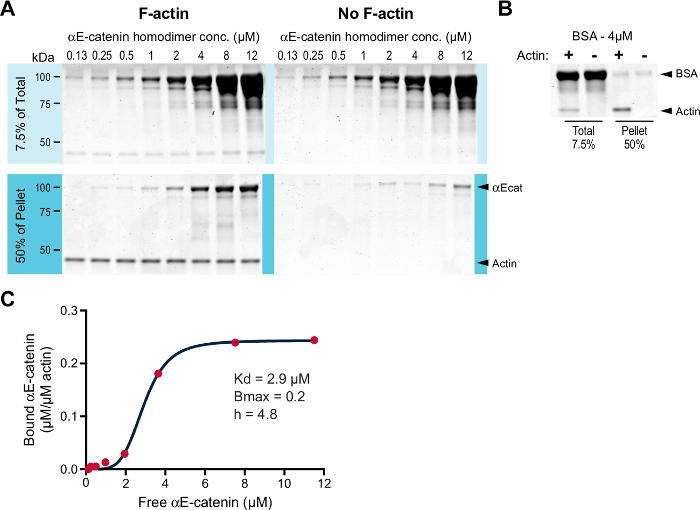
Рисунок 1: Высокоскоростное F-actin co-седиментационное исследование. ( A ) Увеличение концентрации (0,125-12,0 мкМ) гомодимера αE-катенина инкубировали с (левые панели) или без (правые панели) 0,2 мкМ F-актин, стабилизированный фаллоидип. Их инкубировали в течение 30 мин при комнатной температуре и центрифугировали. Общее количество (7,5% исходного материала) и гранулированный материал (50% гранулированного материала) разделяли электрофорезом в ДСН-ПААГ и окрашивали красителем Кумасси. ( B ) В качестве отрицательного контроля использовали 4 мкМ BSA. Всего и образцы гранул с (+) или без (-) F-актина разделяли электрофорезом в ДСН-ПААГ и окрашивали красителем Кумасси. ( C ) Связанный αE-catenin (мкМ / мкМ актин) от A был нанесен на график против свободного αE-catenin (μM), и данные соответствовали уравнению Хилла (красная линия). Указаны коэффициенты K d , B max и Hill (h). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: количественная оценка гранулирования актина - блок-схема. Эта схема описывает основные этапы в разделе 5 с примерами образцов Total и Pellet ( A , CE ) и стандартной кривой ( B ), используемой для количественной оценки. 5.13 этапов: 1 ) Измерьте количество белка, представляющего интерес, в Всего образцов (A). 2 ) Создать стандартную кривую путем построения зависимости интенсивности полосы от массы белка (В). 3 ) Измерьте количество представляющего интерес белка, который был осажден с F-актином ( C ). 4 ) Измерьте количество представляющего интерес белка, который осаждали в отсутствие F-актина ( D ). 5 ) Вычтите D из C, чтобы определить количество белка, связанного с F-актином. 6 ) Измерьте количество F-актина в каждой таблетке (E), вычислите среднее количество F-актина на образец и разделите каждую пробу на среднее значение (числа ниже показывают отношение). 7 )Для каждого образца разделить количество связанного белка (рассчитанного на этапе 5) с отношением гранул F-актина (рассчитанное на этапе 6), чтобы скорректировать различия в осадке. 8 ) Используйте стандартную кривую ( B ) для расчета количества (массы) нормированного связанного белка в каждом образце (шаг 7). 9 ) Определите концентрацию свободного белка и связанного белка для создания кривой связывания. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Анализ соосаждения актина является прямым методом, который позволяет быстро определить, связывает ли белок F-актин. С некоторыми модификациями методику можно также использовать для измерения аффинности взаимодействия. Помимо вопросов, затронутых в вышеуказанном протоколе, при проектировании, проведении и интерпретации анализа следует учитывать следующие вопросы.
Интересующий белок
Свежеприготовленный или замороженный белок может быть использован в анализе. Если используется замороженный белок, рекомендуется сравнить результаты с новым (никогда не замороженным) белком, чтобы гарантировать, что замораживание не влияет на связывание F-актина.
Источник G-actin
Во многих экспериментах с гранулированием G-актин изолирован от мышцы из-за ее относительного содержания. Существуют три главных изотипа актина у млекопитающих - альфа, бета и гамма - которые удивительно похожи (> 90% идентичности последовательностити). Тем не менее, существуют функциональные различия между изотипами 12 , 13 . Если возможно, изотип G-актина, используемый в анализе связывания, должен соответствовать изотипу in vivo . Например, при тестировании белка, выраженного в скелетных мышцах, альфа-актин является лучшим выбором; Если исследуется белок, экспрессируемый в фибробластах, рекомендуется использовать бета-актин.
Использование Phalloidin
Поскольку фаллоидин связывает F-актин, он может мешать или даже блокировать связывание некоторых F-актин-связывающих белков ( например, блокирование фактоидином кофилина от связывания с актиновыми филаментами) 14 . Таким образом, фаллоидин следует использовать с осторожностью и результаты по сравнению с образцами, обработанными нефаллоидином, когда это возможно.
Высокий фон
Нередко белки осаждаются в отсутствие F-актина ( рис. 1А , без образца F-актина в таблеткахс). Однако высокие уровни фонового осаждения могут маскировать истинное соосаждение актина и затруднять, если не невозможно, определение того, связывает ли белок F-актин или измеряет аффинность взаимодействия. Добавление полидиканола в реакционный буфер (шаг 4.1) может значительно уменьшить фон и является простым решением. Если это не уменьшает фона, то может помочь корректировка реакционного буфера, концентрации соли и / или температуры инкубации.
Кривая привязки
Для создания кривой связывания необходимо варьировать концентрацию либо представляющего интерес белка, либо F-актина в течение ряда реакций. На практике легче и предпочтительнее поддерживать F-актин в фиксированной концентрации и варьировать концентрацию интересующего белка. Поддержание F-актина при фиксированной концентрации ( например, 2 мкМ) в анализе гранулирования ограничивает неспецифическое улавливание при более высоких концентрациях F-актина и предотвращаетДеполимеризации при более низких (<0,5 мкМ) концентрациях F-актина. Деполимеризацию можно предотвратить с помощью фаллоидина, хотя это вводит потенциальный усложняющий фактор в систему (см. Шаг 3.3 и выше). Поддержание F-актина при фиксированной концентрации также позволяет сравнить (и нормализовать) гранулу F-актина по образцам и идентифицировать неудавшиеся эксперименты ( т.е. где осадок F-актина сильно варьирует, предотвращая анализ по концентрациям). Наконец, поддержание F-актина при фиксированной концентрации позволяет определить, является ли связывание с актиновой нитью кооперативной ( рис. 1С ).
Насыщенный переплет
Как и во всех экспериментах на связывание, очень важно, чтобы связывание с F-актином было насыщенным и что концентрация белков плюс F-актиновые плато ( рис. 1C ). Без плато невозможно вычислить точную константу равновесия диссоциации. Таким образом, онВажно тщательно планировать анализируемую серию разбавлений и всегда включать более высокие концентрации белка ( т. Е. По крайней мере в 5-10 раз выше, чем ожидаемый K d ).
Анализ связывания
Для того, чтобы измеренные константы диссоциации были окончательными, анализ следует проводить с использованием концентрации F-актина, которая позволяет концентрации сайтов связывания на F-актине для представляющего интерес белка быть значительно ниже, чем сродство. Чтобы проверить, был ли соблюден этот критерий, оцените концентрацию сайтов связывания от B max . Например, если [F-actin] составляет 2 мкМ и B max = 0,5, то [сайты связывания] ≈ 1 мкМ. K d должен быть по крайней мере в 5-10 раз больше, чем [места связывания]. Если измеренный K d имеет тот же порядок величины, что и [участки связывания], то возможно, что наблюдаемая кривая связывания представляет собой титрование связывания с высоким сродством siСкорее, чем истинная изотерма связывания. Если это наблюдается, повторите анализ, используя концентрацию F-актина в 10 раз ниже, чтобы измерить точную аффинность. Для высокоаффинных взаимодействий стабилизация фаллоидина (шаг 3.3) может быть необходима для достижения концентрации F-актина, достаточно низкой для точного измерения сродства.
Наконец, существуют фундаментальные ограничения в методе совместного осаждения, которые должны быть известны исследователям при выполнении и оценке анализа. Самое главное, что анализ соосаждения не дает истинной константы равновесия. Продукты связывания ( т.е. белок плюс F-актин) отделяют от реагентов во время центрифугирования, после чего продукты могут диссоциировать для создания нового равновесия. В результате анализ совместного осаждения может ошибочно вычислять или не обнаруживать взаимодействия с низкой аффинностью. Поскольку многие актин-связывающие белки имеют низкое ( т.е. микромолярное) сродство к F-актину, отрицательный результат ( т.е. не обнаруживается связывание) в анализе необязательно означает, что белок не связывает F-актин. В качестве альтернативы, исследования на основе микроскопии на основе TIRF с одной нитью более чувствительны и более точны для определения константы диссоциации (для обзоров по этой методике см. Ссылки 15,16 ). Несмотря на эти ограничения, метод грануляции находится в пределах возможностей большинства исследователей и является эффективным инструментом для определения, связывает ли белок F-актин и измеряет сродство взаимодействия.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Эта работа была поддержана Национальным институтом здравоохранения Грант HL127711 AVK.
Материалы
| Name | Company | Catalog Number | Comments |
| Sorvall MTX 150 Micro-Ultracentrifuge | ThermoFisher Scientific | 46960 | |
| S100-AT3 rotor | ThermoFisher Scientific | 45585 | |
| Ultracentrifuge tubes - 0.2 mL | ThermoFisher Scientific | 45233 | |
| Actin, rabbit skeletal muscle | Cytoskeleton | AKL99 | |
| Bovine Serum Albumin | Sigma | A8531 | |
| Polidicanol (Thesit) | Sigma | 88315 | |
| Phalloidin | ThermoFisher Scientific | P3457 | |
| Dithiothreitol (DTT) | ThermoFisher Scientific | R0862 | |
| Adenosine triphosphate (ATP) | Sigma | A2383 | |
| Imidazole | Fisher Scientific | O3196 | |
| Sodium Chloride (NaCl) | Fisher Scientific | BP358 | |
| Magnesium Chloride (MgCl2) | Fisher Scientific | M33 | |
| Potassium Chloride (KCl) | Fisher Scientific | P217 | |
| Ethylene glycol-bis(β-aminoethyl ether)-N,N,N',N'-tetraacetic acid (EGTA) | Sigma | 3779 | |
| Odyssey CLx Imaging System | LI-COR | ||
| Coomassie Brilliant Blue R-250 Dye | ThermoFisher Scientific | 20278 | |
| Colloidal Blue Staining Kit | ThermoFisher Scientific | LC6025 |
Ссылки
- Pollard, T. D. Actin and Actin-Binding Proteins. Cold Spring Harb Perspect Biol. 8 (8), (2016).
- Hansen, M. D., Kwiatkowski, A. V. Control of actin dynamics by allosteric regulation of actin binding proteins. Int Rev Cell Mol Biol. 303, 1-25 (2013).
- Lappalainen, P. Actin-binding proteins: the long road to understanding the dynamic landscape of cellular actin networks. Mol Biol Cell. 27 (16), 2519-2522 (2016).
- Mullins, R. D., Hansen, S. D. In vitro studies of actin filament and network dynamics. Curr Opin Cell Biol. 25 (1), 6-13 (2013).
- Miller, P. W., et al. Danio rerio alphaE-catenin is a monomeric F-actin binding protein with distinct properties from Mus musculus alphaE-catenin. J Biol Chem. 288 (31), 22324-22332 (2013).
- Wickline, E. D., et al. alphaT-Catenin Is a Constitutive Actin-binding alpha-Catenin That Directly Couples the Cadherin.Catenin Complex to Actin Filaments. J Biol Chem. 291 (30), 15687-15699 (2016).
- Simpson, R. J., Adams, P. D., Golemis, E. Basic methods in protein purification and analysis : a laboratory manual. , Cold Spring Harbor Laboratory Press. (2009).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Dyballa, N., Metzger, S. Fast and sensitive colloidal coomassie G-250 staining for proteins in polyacrylamide gels. J Vis Exp. (30), (2009).
- Pollard, T. D. A guide to simple and informative binding assays. Mol Biol Cell. 21 (23), 4061-4067 (2010).
- Hansen, S. D., et al. alphaE-catenin actin-binding domain alters actin filament conformation and regulates binding of nucleation and disassembly factors. Mol Biol Cell. 24 (23), 3710-3720 (2013).
- Perrin, B. J., Ervasti, J. M. The actin gene family: function follows isoform. Cytoskeleton (Hoboken). 67 (10), 630-634 (2010).
- Tondeleir, D., Vandamme, D., Vandekerckhove, J., Ampe, C., Lambrechts, A. Actin isoform expression patterns during mammalian development and in pathology: insights from mouse models. Cell Motil Cytoskeleton. 66 (10), 798-815 (2009).
- Prochniewicz, E., Janson, N., Thomas, D. D., Dela Cruz, E. M. Cofilin increases the torsional flexibility and dynamics of actin filaments. J Mol Biol. 353 (5), 990-1000 (2005).
- Kuhn, J. R., Pollard, T. D. Real-time measurements of actin filament polymerization by total internal reflection fluorescence microscopy. Biophys J. 88 (2), 1387-1402 (2005).
- Hansen, S. D., Zuchero, J. B., Mullins, R. D. Cytoplasmic actin: purification and single molecule assembly assays. Methods Mol Biol. 1046, 145-170 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены