Method Article
ゼブラフィッシュの網膜におけるタンパク質局在を解決する相関超解像および電子顕微鏡観察
要約
このプロトコルでは、相関超解像光学顕微鏡および走査型電子顕微鏡像によるゼブラフィッシュの網膜の細胞内タンパク質局在結果を取得する必要な手順について説明します。
要約
超解像光学顕微鏡を組み合わせると、走査電子顕微鏡幼虫ゼブラフィッシュの網膜の細胞内蛋白質のローカリゼーションを調査する手法を提案します。超解像光顕微鏡のサブ回折限界の解像度機能により、相関データの精度を向上させます。簡単に、110 ナノメートル、分厚い低温部分はシリコン ・ ウエハに転送され、蛍光染色後の超解像光学顕微鏡検査によってされます。その後、セクションは、セルロースとプラチナの走査型電子顕微鏡 (SEM) でのイメージングの前にシャドウに保持されます。これらの 2 つの顕微鏡のモダリティから画像は、組織のランドマークを用いたオープン ソース ソフトウェアを簡単にマージされます。ここで幼虫のゼブラフィッシュの網膜の適応方法をについて説明します。ただし、このメソッドはティッシュおよび有機体の他のタイプに適用も。この相関関係によって得られる補足情報が膜とミトコンドリア蛋白質の発現と細胞の他のコンパートメントとしてもミトコンドリアのクリステを解決することができることを示します。
概要
タンパク質と細胞の別のコンパートメントの関係の細胞レベル下の局在を決定する方法は、機能や相互作用の可能性を理解するための不可欠なツールです。超解像顕微鏡電子顕微鏡との組み合わせでは、このような情報の1を提供します。個々 の分子のリターン (GSDIM) 地上州枯渇顕微鏡超解像顕微鏡技術の有機性および遺伝的コード化の同時2の広い範囲と互換性があるは、最大 20 の横方向分解能を実現 nm3。 標準的な回折限界の顕微鏡より高い解像度を持つメソッド定款相関4,5,6の精度が向上します。蛋白発現の特定の細胞内コンパートメントの一番良い相関を達成するために、不確実性7同じ超薄切片の光顕および電顕の使用の量を減らすことをお勧めします。セクショニングのさまざまな方法、徳安クライオ セクション プロトコル脱水や樹脂埋め込みを必要としない、さらに、多くの抗原の抗原性を保持し、良い組織の微細構造の8を説明します。いくつかのメソッドは、相関光・電子顕微鏡 (クレム)4,5,9,10セクションのこれらの適用性を実証しています。
ゼブラフィッシュの網膜は、ビジュアル開発と脊椎動物の間でその非常に節約された構造と機能を与えられた人間の病気のメカニズムを検討する貴重なモデルです。膜特定、網膜視細胞表示で基底シナプス、切端基肥細長い核をもつ哺乳類の光受容体として同じアーキテクチャ内部セグメントをより根尖部と外側セグメントにおけるミトコンドリアのクラスタ リング構成最も根尖の位置11ディスク。多様な細胞コンパートメントに蛋白質のローカリゼーションはゼブラフィッシュの節約され、人間、ひと疾患関連タンパク質12,13の生物学的機能の調査を許可します。
ここで網膜サンプル相関超解像光および電子顕微鏡による Tom20 ミトコンドリア外膜タンパク質の局在を解決するゼブラフィッシュ稚魚を準備するためのプロトコルを提案する.シリコン基板上低温セクションを収集に基づくし、プラチナの薄層を適用した後生成される地形的情報によってコントラストを得るします。これらの手順は、使用、再現性、および実験を完了する時間の使いやすさの面で明確な技術的な改善です。我々 は最近、マウス組織14核孔とミトコンドリア蛋白質の検出手法の適用性を実証しました。
プロトコル
すべての実験 ARVO ステートメントに従って眼科と視覚に関する研究における動物の使用を行ったし、地元当局によって承認されたします
。1 シリコンウェハー上超薄切片の作製
- サンプル固定
- 0.1% グルタルアルデヒド、4% のホルムアルデヒド 0.1 M cacodylate バッファーを含む固定液を準備します。
。 注: 注意!グルタルアルデヒド、ホルムアルデヒド、cacodylate バッファーを操作するときに注意を使用して、適切な個人用保護具を着用、発煙のフードで動作します 。
- 上記 15 (5 dpf) ゼブラフィッシュ幼虫 (エチル 3-アミノ安息香酸メタンスルホン酸、PBS (リン酸バッファー生理食塩水、pH 7) で 0.4 %w/v) tricaine 安楽死させる 5 日後に受精します 。
- は、氷の上あらかじめ冷やして固定液に浸漬して幼虫を修正します。ヘッドを外すし、穏やかな揺動 4 ° C で一晩インキュベートします 。
- は、1% のアガロース層状の板に冷固定液で微細鉗子と (双眼鏡) の下で顕微解剖メスを使用して目の周りの組織をトリミングすることによって目を解剖します。新鮮な中古冷蔵定着剤を管に目を転送します 。
- 室温 (RT) で洗うたび PBS (リン酸バッファー生理食塩水、pH 7.4) 5 分で 2 回洗う 。
- 0.1% グルタルアルデヒド、4% のホルムアルデヒド 0.1 M cacodylate バッファーを含む固定液を準備します。
- ゼラチン浸潤およびマウント
- ウォーム アップ 15 mL 食ブランド ゼラチン 12 %w/v PB (リン酸バッファー, 0.1 M pH 7.4) で 40 ° C、PBS を削除し、目を含むチューブにゼラチン溶液を追加。サンプル ゼラチン浸潤を確認し穏やかな揺れでサーモや水浴の 40 ° C で 10-30 分間インキュベート優しくチューブをタップします 。
- を埋める 12 mm × 5 × 3 mm のシリコンやポリエチレン 40 ° C の水浴中温かいゼラチンと金型を埋め込みフラット。ピペットを使用して金型ごと 2 つ目を追加、解剖針を用いた両眼の下でそれらを正しく整列させるし、1 分間室温でクールダウンし、4 ° C、20 分で硬化ゼラチン
- ゼラチン ブロックのかみそりの刃を使用してブロックごとの 1 つの目に合わせて両眼下を再トリムします 。
- は、氷の上 PB で 2.3 M ショ糖に埋め込まれたゼラチン目を転送します。4 ° C で一晩インキュベートします 。
- 新しい 2.3 M ショ糖液と 4 ° C または-20 ° C で保存場所に Exchange この手順の後のサンプルは区分のため準備ができているまたはヶ月に数週間の-20 ° C で保存することができます 。
- は再クライオ端子に転送する前にゼラチン ブロック目のほとんどのサイズをトリミングします。液体窒素で低温ウルトラミクロトームに乗り換えで凍結します 。
- Cryosectioning
- カット 110 nm 厚いセクション-120 ° c 低温ウルトラミクロトームでダイヤモンド ナイフを使用します 。
- (水) で 2% セルロースと 2.3 M ショ糖液 (1:1) の液滴を含む有線ループ セクションを選ぶ。7 mm × 7 mm シリコン ・ ウエハにセクションを転送します。さらに処理まで 4 ° c のセクションを格納します 。
2。Immunolabelling
- 4 滴滴に逆さまでウエハを置くことによって 20 分の 0 の ° C で PBS で洗浄ウェーハ。PBS 2 x 2 分間室温で洗って 。 1 分の pbs は、0.15% で 3 回
- 加温グリシン。1 分の 3 x を洗う/PBS で洗浄します。5 分前 incubate PBG (0.5% ウシ血清アルブミン BSA と 0.2% ゼラチン タイプ B PBS) と
- ウサギ抗 Tom20 と加温 (材料表 参照) PBG の (4 μ g/mL) 室温で 30 分間 。
- は、PBG で 6 x 1 分/洗浄を洗浄します。あらかじめ抗家兎 Alexa 647 F(ab') 2 とした加温で 5 分間 PBG を incubate (材料の表 を参照してください) PBG の (7.5 μ g/mL) 30 分
- は、PBG で 6 x 1 分/洗浄を洗浄します。3 x 2 分を PBS で洗浄します。DAPI を孵化させなさい (4 μ g/mL) 10 の PBS で s 洗浄の PBS で 2 x 2 分 。
3。超解像顕微鏡
- 加温簡潔にウェハ (10 s) グリセロール (80%) の 1:1 溶液液滴上に配置し、清掃システム (200 mM リン酸緩衝 10% ブドウ糖、0.5 mg/mL を含む酸素を格納するバッファーを画像でglucoseoxidase、40 μ g/mL カタラーゼ、15 mM ベータ-mercaptoethylamine 塩酸塩 (MEA HCL)、pH 8.0).
- グリセロール (80%) の 1:1 混合物の新鮮なドロップにガラス下部 (厚さ 170 ± 5 μ m) シャーレにウエハース (下向きのセクション) を転送し、(ステップ 3.1) のようにバッファーをイメージングします 。
- は、ピペットで、すべての側面からウェハの下に液体のほとんどを削除します。シリコーンのストライプを使用してペトリ皿の底にウェーハを修正します
。 注: シリコン ストライプ 2 成分シリコーン接着剤 (3 mm × 12 mm) から作られています 。
高い開口数を使用して倒立顕微鏡上の - イメージ セクション (例: 160 X/NA 1.43; 材料表 を参照ください) 油浸超解像専用対物レンズ。イメージング、前に横方向と軸のドリフトを最小限に抑える/減らすために顕微鏡の温度に釣り合うサンプルができます 。
- センターの関心のある分野、最初広視野落射蛍光画像を取得します。超解像の操作モードに変更します。15 ms にカメラの露光時間を調整し、(EM) 300 の最大利得を掛けて電子を設定します 。
- 点灯サンプル、642 nm 連続波レーザー落射蛍光モードで最大のレーザー パワー (~2.8 kW/cm 2 に対応)。よく、確率が低い場合の個々 の信号が重なって、レーザー パワーを ~0.7 kW/cm 2 にセットして、単一分子が点滅するとすぐに、各フレームで区切られます。30,000 フレームの最小値を取得することにより、落射蛍光モードで raw 画像を記録します
。 注: すべてのこれらのパラメーターことができますのによって異なる異なる標本密度をラベリングします 。
- Raw データから復興イベント リスト (raw イメージで各単一分子の点滅のローカライゼーション) を生成する] をクリックして 30 光子 (サンプルに応じて調整する必要がある) の検出閾値を使用して " 評価 " で、' t シリーズ解析 ' 下 ' ツール '.
- ガウシアンフィッティング 16 4 の描画ピクセル サイズを適用することによって超解像画像を視覚化するをクリックして nm " イメージの作成 " の ' イベント リスト処理パネル ' 下 ' ツール '
。 注: 超解決イメージを生成するため本研究で使用されるシステムの統合ソフトウェア ・ ツールが採用されました。しかし、他の単一分子局在ベース システムで記述されている超解像イメージングを実行でした、雷雨 17 としてオープン ソース ソフトウェア ツールでデータを処理する可能性があります 。
4。プラチナ シャドーイング
- シリコン ストライプを削除し、ウェハの縁近くにシャーレからそれを持ち上げるの PBS のドロップを追加します。5 分 2 分の 2 倍を洗う/PBS で洗浄ポストは、PBS で 0.1% グルタルアルデヒドでそれを修正し、ウェハの pbs は、2 x 2 分を洗うです 。
- では、5 分/インキュベーション セルロース 2% 氷の上の水の 1 滴のために二度ウェーハを孵化させなさい。遠心管のウェハを挿入し、遠心分離機 14,100 x g で 90 s. マウントそれカーボン セメントの実施と SEM アルミ スタブにします 。
- 2 から 10 までのレイヤーを追加するプラチナ/電子 8 ° 回転シャド ウイングによる試料の炭素の nm ビーム蒸発デバイス設定: 1.55 kV、55 mA、0.3 nm/秒、8 °、回転レベル 4 の角度 。
5。走査電子顕微鏡観察
- スキャン イメージ セクション電子 m1.5 icroscope kV、2 mm 作業距離し、二次電子検出器のレンズと共にします 。
6。光および電子顕微鏡画像の配置
フィジー 18 をクリックして画像の- 両方オープン タイプ " ファイル |オープン "。クリックしてキャンバスのサイズを調整する " 画像 |調整 |キャンバス サイズ " をクリックしてスタックに両方の画像をもたらすと " の画像 |スタック |画像のスタックを "。Tiff ファイル タイプとしてスタックを保存します 。
- 、フィジーをクリックして新しい TrackEM2 19 インターフェイスを開く " ファイル | 新規 |TrackEM2 (新) "。黒のウィンドウを右クリックしを選択することによって両方の画像とスタックをインポート " インポート スタック ". 画像をマウスの右クリックを使用して選択しランドマークと手動で電子顕微鏡画像に
- 配置光顕微鏡画像 " 配置 |ランドマークと手動でレイヤーを揃える "。
ランドマークを追加する
- ピック選択ツール (黒矢印)。(補足図 1) 両方の画像で同じエッジを選択するのに参照として核の形状を使用します。(最低限 3 つのポイントは選択する必要があります) いくつかのポイントを追加します。クリックすると、選択するマウスの右でアフィン モデルの位置合わせを適用 " 変換を適用する |アフィン モデル ".
- レイヤーの透明度を変更 (補足図 1 を参照)、配置の品質を評価する
結果
Tom20 translocase ミトコンドリア外膜複雑な20のサブユニット蛋白の発現はゼブラフィッシュ稚魚網膜の薄い部分で超解像光学顕微鏡検査 (図 1) によって決定された、この情報は同じセクションのプラチナ シャドウ後走査電子顕微鏡観察によって得られた地形の信号を補完します。これらの相関データ ミトコンドリア膜の特定区画との関連付けの蛋白質の局在を確認し、さらにセルの他の細胞器官とタンパク質の関係についての情報を提供します。
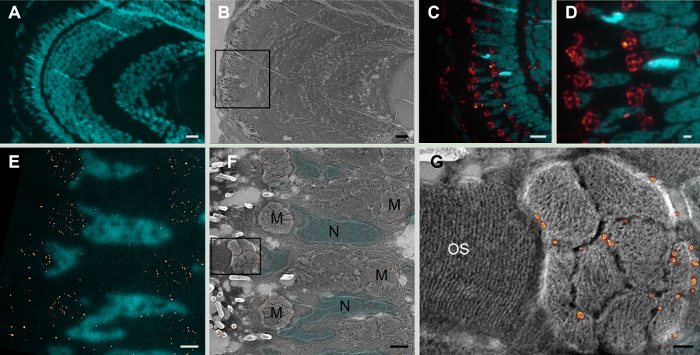
図 1: ゼブラフィッシュの網膜にクレム。A.低倍率広視野画像 5 dpf ゼブラフィッシュ網膜セクション、核染色 DAPI (シアン) の。B.は、同じ領域の電子顕微鏡。C. B. 核内のフレームの高倍率広視野画像染色 DAPI (シアン) と Tom20 ミトコンドリア染色が赤で表示されます。D.高倍率で同じセクションの広視野画像。Tom20 式のパターンは、ミトコンドリアのクラスターです。E.式の Tom20 (赤い点) GSDIM 顕微鏡による検出します。核染色 DAPI (水色)。F.電子相関の超解像を組み合わせると、走査電子顕微鏡と同じセクション。Tom20 染色 (赤い点) は、ミトコンドリアの外膜で、ミトコンドリアのクラスター (M) に表示されます。(N) の核の蛍光 DAPI 信号は、SEM 像の地形に対応します。G. f. でフレームの高倍率画像スキャンの電子顕微鏡画像は、GSDIM イメージ (赤い点) にコンテキストを提供します。ミトコンドリアのクリステがはっきり見えると Tom20 の染色は、ミトコンドリア外膜にローカライズします。外側のセグメントの膜光受容体 (OS) は、明確に解決されます。イメージのピクセル サイズは 5 海里にあります。スケール バー: A、B、および c: 10 μ mD: 2 μ m;E と f: 1 μ m と g: 0.2 μ mこの図の拡大版を表示するのにはここをクリックしてください。
補足図 1: 光顕および電顕画像の配置。A. SEM 像と異なる核に沿って番号ランドマーク (黄色) TrackEM2 インタ フェースのスクリーン ショット。B. 蛍光画像と異なる DAPI に沿って番号ランドマーク (イエロー) TrackEM2 インターフェイスからのスクリーン ショットが核を染色します。レイヤーの透明度を変更するには、メニューの左上の部分のスライダーを使用できます。スケール バー: 1 μ m.ファイルのダウンロードは、こちらをご覧ください。
ディスカッション
このメソッドは、蛋白質の細胞小器官内の正確な位置を決定する文脈情報を持つ超解決蛋白質のローカリゼーションを組み合わせたものです。核のような他の細胞器官とミトコンドリアの外膜または幼虫ゼブラフィッシュの網膜の視細胞の外側セグメント単位で Tom20 の発現を可視化する実験の完了を示すここで.
徳安クライオ断面と、手入れが行き届いたセクションを取得するいくつかのトレーニングが必要です。ただし、これは成功を示した21多くの所に採用されている方法です。Si ウェハへのセクションの転送は非常に単純な特別な配慮は必要ありません。画像バッファーでグリセリンの使用はセクションの乾燥を避けるために非常に重要なステップです。超解像イメージング ウェハがペトリ皿のガラス底に近づくと非常に最良の結果が取得されます。シリコーン ストライプこの位置にウェーハを管理するのに役立ちます。特別な注意は、セクションの損傷を防ぐために縞を除去しながらする必要があります。
低温セクション、約 100 の厚さ nm、Z 次元光学解像度より薄くはさらにこの薄い層からのみ超解像顕微鏡の信号が来ているようこの相関法の精度を容易と信号の走査型電子顕微鏡は、サンプルの地形を表示されています。このメソッドは、マルチカラー イメージングとも組み合わせることができます。ただし、特別な注意が必要、同じ条件 (例えば画像バッファー) の下でイメージを作成することができますサンプルとクロストークを防止する必要があります。
メソッドの 1 つの制限は、2 次元のアプローチは、連続切片 (約 3 に 7 ウェハあたり) の限られた数だけを集めることができます。したがって、ボリュームの分析を扱うプロジェクトは理想的ではないでしょう。しかし、組織のあらゆるタイプのサンプルの単純な区分でタンパク質の発現を検出に適用できるメソッドです。ウラニルの酢酸または鉛のクエン酸のような古典的な造影剤を使用しないメソッドを提供します。プラチナ シャドウによってコントラスト非常に有益な地形のコントラストを提供していますがいくつかのケースで膜は解決することは困難。これは、たとえば、小さい小胞蛋白質の発現を決定する必要があるプロジェクトの問題が生じる。
徳安クライオ-セクション、に基づいて、我々 のプロトコルは、標準装備を使って超解像と走査型電子顕微鏡から相関結果を取得します。シリコン基板上のセクションのコレクション、プラチナのコントラスト用試料調製に安定性を提供するために簡単な手順。
開示事項
著者が明らかに何もありません。
謝辞
資金調達のイオンおよび RGB: Ambizione スコア スイス国立科学財団 PZ00P3 142404/1 と PZ00P3 163979 を与えます。
資料
| Name | Company | Catalog Number | Comments |
| Paraformaldehyde | Sigma-Aldrich | #158127 | |
| Glutaraldehyde EM Grade | EMS, USA | #16220 | |
| Cacodylate | Merck | #8.20670 | |
| Tricaine | Sigma-Aldrich | #886-86-2 | |
| Agarose, peqGOLD Universal | VWR International GmbH | 35-1020 | |
| Flat embedding molds | BEEM Flat | ||
| Local food brand gelatin | Dr.Oetker | Extra Gold | |
| Sucrose | Merck | #1.07687 | |
| Methylcellulose | Sigma | #M-6385 | |
| Glycine | Sigma | #G-7126 | |
| Gelatin type B | Sigma | #G-6650 | |
| BSA | Applichem | #A6588.0050 | |
| Silicon wafer | Si-Mat Silicon Materials | Type: P/Boron; Orientation <111> ON; Growth method: CZ; Resistivity:1-30 ohm/cm; Surface: polished; Laser cut at 7 x7 mm | |
| Cryo-pin | Baltic Preparation | #16701950 | |
| Wired loop "Perfect loop" | |||
| Silicone stripes | Picodent | Twinsil 22 | |
| Glucose | Sigma-Aldrich | #G8270 | |
| glucoseoxidase | Sigma-Aldrich | #G7141 | |
| catalase | Sigma-Aldrich | #C40 | |
| beta-Mercaptoethylamine hydrochloride | Sigma-Aldrich | #M6500 | |
| anti-Tom20 | Santa Cruz Biotechnology | #sc - 11415 | |
| AlexaFluor 647 AffiniPure F(ab')2 fragment donkey anti rabbit IgG | Jackson Immuno-Research | #711-606-152 | |
| DAPI | ROCHE, Switzerland | #10236276001 | |
| Glycerol solution | Sigma-Aldrich | #49782 | |
| Glass bottom petri dish | Ibidi, Germany | u-Dish 35mm, high glass bottom, #81158 | |
| SEM aluminium stub | Agar Scientific | #G301F | |
| Conducting carbon cement Leit-C | Plano, Germany | AG3300 | |
| Name | Company | Catalog Number | Comments |
| Instruments | |||
| Diamond Knife (Cryo Immuno) | Diatome | DCIMM3520 | |
| Cryo-ultramicrotome | Leica Microsystems | Leica EM FCS | |
| Widefield-TIRF microscope GSD Leica SR GSD 3D | Leica Microsystems | ||
| 160x 1.43 TIRF objective | Leica Microsystems | 11523048 | |
| SEM - Zeiss Supra 50 VP | Zeiss | Supra 50 VP | |
| FIB-SEM - Zeiss Auriga 40 | Zeiss | Auriga 40 |
参考文献
- Hauser, M., Wojcik, M., Kim, D., Mahmoudi, M., Li, W., Xu, K. Correlative Super-Resolution Microscopy: New Dimensions and New Opportunities. Chem Rev. , (2017).
- Dempsey, G. T., Vaughan, J. C., Chen, K. H., Bates, M., Zhuang, X. Evaluation of fluorophores for optimal performance in localization-based super-resolution imaging. Nat Methods. 8 (12), 1027-1036 (2011).
- Fölling, J., Bossi, M., et al. Fluorescence nanoscopy by ground-state depletion and single-molecule return. Nat Methods. 5 (11), 943-945 (2008).
- Betzig, E., Patterson, G. H., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science (New York, N.Y.). 313 (5793), 1642-1645 (2006).
- Kopek, B. G., Shtengel, G., Grimm, J. B., Clayton, D. A., Hess, H. F. Correlative photoactivated localization and scanning electron microscopy. PLOS one. 8 (10), e77209 (2013).
- Paez-Segala, M. G., Sun, M. G., et al. Fixation-resistant photoactivatable fluorescent proteins for CLEM. Nat Methods. 12 (3), 215-218 (2015).
- Narayan, K., Subramaniam, S. Focused ion beams in biology. Nat Methods. 12 (11), 1021-1031 (2015).
- Tokuyasu, K. T. Immunochemistry on ultrathin frozen sections. Histochem J. 12 (4), 381-403 (1980).
- Suleiman, H., Zhang, L., et al. Nanoscale protein architecture of the kidney glomerular basement membrane. eLife. 2, e01149 (2013).
- Kopek, B. G., Shtengel, G., Xu, C. S., Clayton, D. A., Hess, H. F. Correlative 3D superresolution fluorescence and electron microscopy reveal the relationship of mitochondrial nucleoids to membranes. Proc Nat Acad Sci U S A. 109 (16), 6136-6141 (2012).
- Avanesov, A., Malicki, J. Analysis of the retina in the zebrafish model. Methods Cell Biol. 100, 153-204 (2010).
- Bachmann-Gagescu, R., Phelps, I. G., et al. The ciliopathy gene cc2d2a controls zebrafish photoreceptor outer segment development through a role in Rab8-dependent vesicle trafficking. Hum Mol Gen. 20 (20), 4041-4055 (2011).
- Bachmann-Gagescu, R., Dona, M., et al. The Ciliopathy Protein CC2D2A Associates with NINL and Functions in RAB8-MICAL3-Regulated Vesicle Trafficking. PLOS Gen. 11 (10), e1005575 (2015).
- Mateos, J. M., Guhl, B., et al. Topographic contrast of ultrathin cryo-sections for correlative super-resolution light and electron microscopy. Sci Rep. 6, 34062 (2016).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Thompson, R. E., Larson, D. R., Webb, W. W. Precise nanometer localization analysis for individual fluorescent probes. Biophys J. 82 (5), 2775-2783 (2002).
- Ovesný, M., Křížek, P., Borkovec, J., Svindrych, Z., Hagen, G. M. ThunderSTORM: a comprehensive ImageJ plug-in for PALM and STORM data analysis and super-resolution imaging. Bioinformatics. 30 (16), 2389-2390 (2014).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Cardona, A., Saalfeld, S., et al. TrakEM2 software for neural circuit reconstruction. PLOS one. 7 (6), e38011 (2012).
- Wurm, C. A., Neumann, D., et al. Nanoscale distribution of mitochondrial import receptor Tom20 is adjusted to cellular conditions and exhibits an inner-cellular gradient. Proc Nat Acad Sci U S A. 108 (33), 13546-13551 (2011).
- Slot, J. W., Geuze, H. J. Cryosectioning and immunolabeling. Nat Prot. 2 (10), 2480-2491 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved