Method Article
Корреляционные суперразрешением и электронной микроскопии решить локализация белка в Zebrafish сетчатки
В этой статье
Резюме
Этот протокол описывает необходимые шаги для получения результатов локализация внутриклеточных белков на сетчатке данио рерио, соотнося суперразрешением светлую микроскопию и сканирование электронной микроскопии изображений.
Аннотация
Мы представляем метод расследовать локализация внутриклеточных белков в сетчатке личиночной данио рерио, комбинируя суперразрешением светлую микроскопию и растровая электронная микроскопия. Суб дифракционный предел резолюции возможности суперразрешением света Микроскопы позволяют улучшение точности коррелированных данных. Вкратце 110 Нм толщиной крио секции передаются кремниевой пластины и, после окрашивания иммунофлюоресценции, отражаются с суперразрешением световой микроскопии. Впоследствии разделы сохраняются в метилцеллюлоза и платины, затененных до изображений в сканирующий электронный микроскоп (SEM). Изображения из этих двух способов микроскопии легко объединяются с помощью ткани достопримечательности с открытым исходным кодом. Здесь мы описываем метод адаптированы для личинок данио рерио сетчатки. Однако этот метод применяется также для других видов организмов и тканей. Мы демонстрируем, что дополнительную информацию, полученные от этой корреляции способен решить выражение митохондриальных протеинов в связи с мембраны и макул митохондрий, а также относительно других отсеков ячейки.
Введение
Методы определения субцеллюлярные Локализация белков и их связь с различных отсеков ячейки являются важнейшими инструментами для понимания их функции и возможности взаимодействия. Супер-резолюции микроскопии в сочетании с электронной микроскопии предоставляет такие сведения1. Микроскопия истощение земли государства следуют отдельные молекулы возвращение (GSDIM) представляет собой технологию микроскопии суперразрешением, совместим с широким спектром органических и генетически закодированный флуорофоров2 и достигает латеральное разрешение до 20 Нм 3. Включение методов с высоким разрешением, чем стандартные дифракционный микроскопии улучшает точность корреляции4,5,6. Рекомендуется для достижения наилучшего соотношения белков с конкретным субцеллюлярные отсека и уменьшить объем неопределенности7 использование того же раздела ультратонких для света и электронной микроскопии. Среди различных методов, резания Tokuyasu крио раздел протокол не требует обезвоживания или встраивание смолы и, Кроме того, сохраняет антигенностью многих эпитопов и обеспечивает хорошие ткани Ультраструктура8. Несколько методов продемонстрировали применимость этих разделов в коррелятивном света и электронной микроскопии (Клем)4,5,9,10.
Данио рерио сетчатки является полезной моделью для изучения визуальной разработки и механизмов болезней человека, учитывая его высоко сохраняется структура и функции различных позвоночных. В частности, сетчатки фоторецепторов отображения той же архитектуры как млекопитающих фоторецепторов, с базальной синапса, apico-basally удлиненные ядра, кластеризация митохондрий в сегменте более апикальной внутренний и наружный сегмент состоит из мембраны диски в наиболее апикальной позиция11. Локализация белков различных сотовых отделений, сохраняемой между данио рерио и человека, позволяя исследование биологической функции человека болезни соответствующих белков12,13.
Здесь мы представляем протокол подготовить личиночной данио рерио сетчатки образцы для устранения Локализация белков митохондриальных внешней мембраны Tom20 коррелятивных суперразрешением света и электронной микроскопии. Метод основан на сборе крио разделы на кремниевых пластин и получение контраст по топографической информации производится после нанесения тонкого слоя платины. Эти шаги являются четкие технические усовершенствования с точки зрения удобства использования, воспроизводимость и время выполнения экспериментов. Недавно мы продемонстрировали применимость метода для обнаружения ядерной поры и митохондриальных протеинов в мыши ткани14.
протокол
все эксперименты были проведены в соответствии с заявлением Арво для использования животных в глазной и видение исследования и были утверждены местными властями.
1. Подготовка ультратонких разделы на кремниевых пластин
фиксации образцов- подготовить фиксирующие раствор, содержащий 0.1% глютаральдегид, 4% формальдегида в буфер cacodylate 0,1 М.
Примечание: осторожно! Соблюдайте осторожность при работе с буфером глютаральдегид, формальдегид и cacodylate, носить надлежащие средства личной защиты и работают в зонта. - Усыпить 5 дней после оплодотворения личинки данио рерио (5 dpf) с tricaine (этиловый метансульфонат 3-аминобензоат, 0,4% w/v в PBS (фосфат буфер солевой, рН 7)) как описано 15.
- Исправить личинки, погружение в предварительно охлажденные фиксирующие решения на льду. Удалите головы и инкубировать на ночь при 4 ° C с плавное покачивание.
- Вскрыть глаз путем обрезки ткани вокруг глаз с помощью тонкой щипцы и microdissection скальпель (под бинокль) охлажденные фиксирующие решения на пластине местная агарозы 1%. Передать трубку с свежими предварительно охлажденные фиксатором глаза.
- Мыть дважды в PBS (фосфат буфер солевой, рН 7,4) за 5 мин каждый мыть при комнатной температуре (RT).
- подготовить фиксирующие раствор, содержащий 0.1% глютаральдегид, 4% формальдегида в буфер cacodylate 0,1 М.
- Желатин инфильтрации и монтажа
- теплой до 15 мл местные продукты бренда желатина 12% w/v в PB (фосфатного буфера, 0,1 М рН 7,4) на 40 ° C. Удалите PBS и добавить желатин решение в пробирки, содержащие глаз. Нажмите трубка мягко для обеспечения желатин инфильтраты образца и проинкубируйте 10-30 мин при 40 ° C в thermoblock с нежным встряхивания или на водяной бане.
- Заполнить 12 мм x 5 мм x 3 мм кремния или полиэтилена плоский встраивание формы с теплой желатин в водяной бане 40 ° C. Добавьте два глаза за плесень с помощью пипетки, выровнять их должным образом под бинокль с помощью иглы рассечение и пусть желатин остыть при комнатной температуре в течение 1 мин и затвердевают при 4 ° C на 20 мин
- Повторно отделка блок желатина под бинокль, чтобы соответствовать один глаз на блок с помощью лезвия бритвы.
- Передавать 2,3 М сахарозы в PB желатин встроенных глаза на льду. Инкубируйте на 4 ° C на ночь.
- Обмен новым 2,3 М раствора сахарозы и хранить при 4 ° С или 20 ° C; после этого шага, образцы готовы для разрезания или могут храниться при температуре-20 ° C в течение нескольких недель до месяцев.
- Повторно отделка блок желатина почти размер глаза перед передачей крио контактный. Замораживание в жидком азоте и передачи криоультрамикротом.
- Cryosectioning
- Вырезать 110 Нм толщиной секций при-120 ° C с алмазным ножом в криоультрамикротом.
- Выбрать разделы с проводной цикл, содержащий капельку метилцеллюлоза 2% (в воде) и 2,3 М раствора сахарозы (1:1). Перенести разделы кремниевой пластины 7 x 7 мм. Хранить разделы на 4 ° C до дальнейшей обработки.
2. Immunolabelling
- мыть пластин с PBS при 0 ° С 20 мин на четыре капли, поместив пластин вниз на капли. Мыть в PBS 2 x 2 мин при комнатной температуре. Глицин
- Инкубировать 3 раза в 0,15% в PBS, за 1 мин. Вымойте 3 x 1 мин/мыть с PBS. Предварительно incubate с PBG (PBS с BSA бычий сывороточный альбумин 0,5% и 0,2% желатина типа B) для 5 минут
- Инкубировать с кролик анти Tom20 (см. Таблицу материалов) в PBG (4 мкг/мл) за 30 мин при комнатной температуре.
- Мыть 6 x за 1 мин/мыть в PBG. Предварительно incubate с PBG на 5 мин на RT. инкубировать с анти кролик Alexa 647 F(ab') 2 (см. Таблицу материалов) в PBG (7.5 мкг/мл) за 30 мин
- Мыть 6 x за 1 мин/мыть в PBG. Вымойте 3 x 2 мин в PBS. Проинкубируйте с DAPI (4 мкг/мл) в PBS для 10 s. мыть 2 x 2 мин в PBS.
3. Супер-резолюции микроскопии
- инкубировать вафельные кратко (10 s), поместив ее на капли раствора 1:1 глицерина (80%) и визуализации буфера, содержащий кислорода, очистки системы (200 мм фосфатного буфера, содержащий 10% глюкозы, 0.5 мг/мл glucoseoxidase, 40 мкг/мл каталазы, 15 мм бета mercaptoethylamine гидрохлорид (MEA HCL), рН 8,0).
- Передача пластин (раздел вниз) Петри стекла (толщиной 170 ± 5 μm) снизу на свежие капли 1:1 смесь глицерина (80%) и визуализации буфера (как шаг 3.1).
- Удалить со всех сторон, с пипеткой, большая часть жидкости под пластины. Использование полосы силиконовые исправить пластины на нижней части Петри.
Примечание: Силиконовые полосы сделаны из двухкомпонентный клей силиконовый (3 x 12 мм).
Разделы - изображения на инвертированного микроскопа с помощью высокая числовая апертура (например 160 X / NA 1,43; см. Таблицу материалов) масло погружения супер резолюции выделенный цели. До обработки изображений, позволяют сбалансировать Микроскоп температуры для того, чтобы свести к минимуму и уменьшить боковые и осевого смещения выборки.
- Центр области интересов и приобрести первые widefield эпифлуоресцентного ссылкой изображения. Изменить режим работы супер резолюции. Отрегулируйте время экспозиции камеры до 15 мс и установите электрон умножения (EM) получить максимум 300.
- Освещения образца с 642 Нм непрерывная волна лазера на мощность максимальная лазера (соответствующий ~2.8 кВт/см 2) в режиме эпифлуоресцентного. Как только одной молекулы мигает хорошо отделены в каждом кадре, так что вероятность низка, что отдельные сигналы пересекаются, установите мощность лазера до ~0.7 кВт/см 2. Запись изображений в формате raw в режиме эпифлуоресцентного путем приобретения минимум 30 000 кадров.
Примечание: Все эти параметра может изменяться в зависимости от различных образцов и маркировки плотностями. - От исходных данных, создать список событий реконструкции (локализации каждого одной молекулы скачок в raw изображений) с помощью обнаружения порога 30 фотонов (должен корректироваться по образцу), нажав " вычислить " в ' t серии анализ ' под ' инструменты '.
- Визуализировать изображения супер резолюции Гаусса фитинга 16 применения рендеринга пикселей размером 4 Нм, нажав " создать образ " в ' Группа обработки списка событий ' под ' инструменты. '
Примечание: Для создания супер решена изображения интегрированные программные инструменты системы, используемые в данном исследовании были заняты. Однако, описанные супер резолюции изображений может быть выполнена на любой другой системе локализации на основе одной молекулы, и данные могут обрабатываться с открытым исходным кодом программного обеспечения инструменты как гроза 17.
4. Платиновый затенение
- удаления кремния полосы и добавить каплю PBS недалеко от края пластины поднять его вверх от Петри. Промойте пластины 2 x 2 мин в PBS, то пост исправить ее с 0.1% глютаральдегид в PBS для 5 минут промыть 2 x 2 мин/мыть в PBS.
- Инкубировать вафельные дважды за 5 мин/инкубации в 1 капле метилцеллюлоза 2% в воде на льду. Вставьте вафля в пластиковых пробирок и центрифуги на 14 100 x g для 90 s. горе его на заготовка SEM алюминия с проведением углерода цемента.
- Добавить слой от 2 до 10 Нм платины/углерода на образце, роторный затенение на 8° с помощью электрона луча параметры устройства испарения: 1.55 кв, 55 мА, 0,3 Нм/s и угол 8°, вращение уровень 4.
5. Сканирующая электронная микроскопия
- изображения секций с сканирование электрона мicroscope на 1,5 кв, 2 мм рабочих расстояние и с в объектив детектор средних электронов.
6. Выравнивание света и электронной микроскопии изображений
- Открыть обоих типов изображений с 18 Фиджи, нажав " файл | Открытые ". Отрегулируйте размер холста, нажав " изображение | Отрегулируйте | Размер холста " и принести оба изображения в стек, нажав " изображение | Стеки | Изображения в стек ". Сохранить как тип файла tiff стек.
- В Фиджи, откройте новый интерфейс TrackEM2 19, нажав " файл | новый | TrackEM2 (новый) ". Импорт стек с оба изображения, щелкнув правой кнопкой мыши на окне черный и выбрав " импорта стека ".
- Выравнивание свет микроскопия image для электронной микроскопии изображений вручную с ориентиров, с помощью щелчка правой кнопкой мыши на изображении и выбрав " выровнять | Выровнять слой вручную с достопримечательностями ".
- Выбрать выберите инструмент (черная стрелка) для добавления достопримечательностей. Используйте форму ядер как ссылку для выбора же края в обоих изображений (дополнительный рис. 1). Добавьте несколько пунктов (минимум три точки должны быть выбраны). Применить выравнивание с Аффинная модель правой мышью, нажав кнопку и выбрав " применить преобразование | Аффинная модель ".
- Изменить прозрачность слоя (см. дополнительный рис. 1), для оценки качества выравнивания.
Результаты
Выражение протеина Tom20, субъединицы ацилкарнитин митохондриальных внешней мембраны комплекс20, определяется, в шлифов личиночной данио рерио сетчатки, супер резолюции световой микроскопии (рис. 1) и эта информация была дополнена топографических сигнала, полученные путем сканирования электронной микроскопии после Платиновый затенение те же разделы. Эти корреляционные данные подтверждают локализация протеина в ассоциации с конкретного отсека, внешней митохондриальной мембраны и, также представить информацию о соотношении белка с другие органеллы клетки.
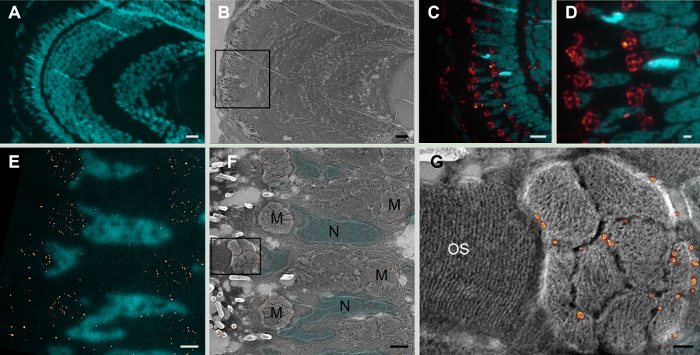
Рисунок 1: Клем на сетчатке данио рерио. А. малое увеличение widefield образ раздела 5 dpf данио рерио сетчатки, ядер, окрашенных с DAPI (голубой). Б. сканирующая электронная микроскопия того же района. C. выше увеличение widefield изображение кадра в ядрах б. витражи с DAPI (голубой) и Tom20 митохондриальных пятнать отображается красным цветом. D. Widefield изображение же секции на увеличение. Шаблон Tom20 выражение находится в кластеры митохондрий. E. выражение из Tom20 (красные точки) определяется GSDIM микроскопии. Ядер окрашенных DAPI (голубой). F. же раздел как E объединение коррелятивных суперразрешением и растровая электронная микроскопия. Tom20 окрашивание (красные точки) появляется в митохондриальной кластера (M) в наружной мембраны митохондрий. Флуоресценции DAPI сигнала в ядрах (N) соответствует топографии SEM изображения. Г. высокое увеличение изображения кадра в F. Сканирования электронная микроскопия image предоставляет контекст для GSDIM изображения (красные точки). Митохондриальной макул ясно видны и Tom20 окрашивание локализован для наружной мембраны митохондрий. Мембраны внешнего сегмента фоторецепторов (OS) ясно разрешаются. Размер 5 пикселей изображения Нм. Масштаб бары: A, B и C: 10 мкм; D: 2 мкм; E и F: 1 мкм и G: 0,2 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Дополнительный рисунок 1: выравнивание изображения света и электронной микроскопии. A. скриншот из интерфейса TrackEM2 с изображением SEM и пронумерованных достопримечательности (желтый) вдоль различных ядер. Б. скриншот из интерфейса TrackEM2 с изображением флуоресценции и пронумерованных достопримечательности (желтый) вдоль различных DAPI окрашенных ядер. Чтобы изменить прозрачность слоя может использоваться ползунков на левой верхней части меню. Линейки: 1 µm. пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Этот метод сочетает в себе супер решена белка локализации с сведения о контексте, чтобы определить точное положение белков в органеллы. Мы здесь продемонстрировать завершения эксперимента, чтобы визуализировать выражение Tom20 в наружной мембраны митохондрий, и ее связь с другими органеллы как ядра или внешних сегментов фоторецепторных в личиночной данио рерио сетчатки.
Tokuyasu крио резании требует определенной подготовки приобрести хорошо сохранившиеся разделы. Однако это метод, работающих во многих лабораториях с продемонстрировали успех21. Передача секций кремниевой пластины очень проста, и никаких особых действий предпринимать не требуется. Использование глицерина в буфере визуализации является весьма критический шаг, чтобы избежать высыхания секций. Для супер-резолюции изображений наилучшие результаты получаются при Вафля находится очень близко к стекло нижней части Петри. Полосы силиконовые помочь поддержание пластин в этом положении. Особое внимание должно быть принято при удалении полосы для того, чтобы избежать повреждения разделов.
Толщина крио секций, около 100 Нм, тоньше, чем оптическое разрешение в Z-измерение, дополнительно облегчает точность этого метода соотносится как суперразрешением микроскопии сигнал идет только от этого тонкого слоя и Сканирующий электронный микроскоп сигнал отображается топографии образца. Этот метод может также сочетаться с многоцветной изображений. Однако особое внимание необходимо принять что образец может быть imaged тех же условиях (например визуализации буфера) и кросс talk должны быть предотвращены.
Одним из недостатков метода является его двумерный подход, поскольку лишь ограниченное количество последовательных секций (около 3 до 7 в вафельных) могут быть собраны. Таким образом проекты, касающиеся анализа тома не будет идеальным. Однако это метод, который может быть применен для определения выражения протеина в любом типе ткани путем простой секционирование в образце. Мы предоставляем метод без использования агентов Классический контраст как уранила ацетат или свинца цитрата. Контраст, Платиновый затенение обеспечивает очень информативный топографических контраст, но в некоторых случаях мембраны трудно решить. Это может создать проблемы для проектов, которые, например, необходимо определить выражение белков в небольших пузырьков.
Наш протокол, основанный на Tokuyasu крио секции, использует стандартное оборудование для получения результатов коррелятивных суперразрешением и сканирующих электронных микроскопов. Простые шаги, чтобы обеспечить стабильность и воспроизводимость в подготовке образца коллекцию секций на кремниевых пластин и использование платины для контраста.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Финансирование Ион и RGB: Швейцарской национальной науки фонд Ambizione-Оценка Грант PZ00P3 142404/1 и PZ00P3 163979.
Материалы
| Name | Company | Catalog Number | Comments |
| Paraformaldehyde | Sigma-Aldrich | #158127 | |
| Glutaraldehyde EM Grade | EMS, USA | #16220 | |
| Cacodylate | Merck | #8.20670 | |
| Tricaine | Sigma-Aldrich | #886-86-2 | |
| Agarose, peqGOLD Universal | VWR International GmbH | 35-1020 | |
| Flat embedding molds | BEEM Flat | ||
| Local food brand gelatin | Dr.Oetker | Extra Gold | |
| Sucrose | Merck | #1.07687 | |
| Methylcellulose | Sigma | #M-6385 | |
| Glycine | Sigma | #G-7126 | |
| Gelatin type B | Sigma | #G-6650 | |
| BSA | Applichem | #A6588.0050 | |
| Silicon wafer | Si-Mat Silicon Materials | Type: P/Boron; Orientation <111> ON; Growth method: CZ; Resistivity:1-30 ohm/cm; Surface: polished; Laser cut at 7 x7 mm | |
| Cryo-pin | Baltic Preparation | #16701950 | |
| Wired loop "Perfect loop" | |||
| Silicone stripes | Picodent | Twinsil 22 | |
| Glucose | Sigma-Aldrich | #G8270 | |
| glucoseoxidase | Sigma-Aldrich | #G7141 | |
| catalase | Sigma-Aldrich | #C40 | |
| beta-Mercaptoethylamine hydrochloride | Sigma-Aldrich | #M6500 | |
| anti-Tom20 | Santa Cruz Biotechnology | #sc - 11415 | |
| AlexaFluor 647 AffiniPure F(ab')2 fragment donkey anti rabbit IgG | Jackson Immuno-Research | #711-606-152 | |
| DAPI | ROCHE, Switzerland | #10236276001 | |
| Glycerol solution | Sigma-Aldrich | #49782 | |
| Glass bottom petri dish | Ibidi, Germany | u-Dish 35mm, high glass bottom, #81158 | |
| SEM aluminium stub | Agar Scientific | #G301F | |
| Conducting carbon cement Leit-C | Plano, Germany | AG3300 | |
| Name | Company | Catalog Number | Comments |
| Instruments | |||
| Diamond Knife (Cryo Immuno) | Diatome | DCIMM3520 | |
| Cryo-ultramicrotome | Leica Microsystems | Leica EM FCS | |
| Widefield-TIRF microscope GSD Leica SR GSD 3D | Leica Microsystems | ||
| 160x 1.43 TIRF objective | Leica Microsystems | 11523048 | |
| SEM - Zeiss Supra 50 VP | Zeiss | Supra 50 VP | |
| FIB-SEM - Zeiss Auriga 40 | Zeiss | Auriga 40 |
Ссылки
- Hauser, M., Wojcik, M., Kim, D., Mahmoudi, M., Li, W., Xu, K. Correlative Super-Resolution Microscopy: New Dimensions and New Opportunities. Chem Rev. , (2017).
- Dempsey, G. T., Vaughan, J. C., Chen, K. H., Bates, M., Zhuang, X. Evaluation of fluorophores for optimal performance in localization-based super-resolution imaging. Nat Methods. 8 (12), 1027-1036 (2011).
- Fölling, J., Bossi, M., et al. Fluorescence nanoscopy by ground-state depletion and single-molecule return. Nat Methods. 5 (11), 943-945 (2008).
- Betzig, E., Patterson, G. H., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science (New York, N.Y.). 313 (5793), 1642-1645 (2006).
- Kopek, B. G., Shtengel, G., Grimm, J. B., Clayton, D. A., Hess, H. F. Correlative photoactivated localization and scanning electron microscopy. PLOS one. 8 (10), e77209 (2013).
- Paez-Segala, M. G., Sun, M. G., et al. Fixation-resistant photoactivatable fluorescent proteins for CLEM. Nat Methods. 12 (3), 215-218 (2015).
- Narayan, K., Subramaniam, S. Focused ion beams in biology. Nat Methods. 12 (11), 1021-1031 (2015).
- Tokuyasu, K. T. Immunochemistry on ultrathin frozen sections. Histochem J. 12 (4), 381-403 (1980).
- Suleiman, H., Zhang, L., et al. Nanoscale protein architecture of the kidney glomerular basement membrane. eLife. 2, e01149 (2013).
- Kopek, B. G., Shtengel, G., Xu, C. S., Clayton, D. A., Hess, H. F. Correlative 3D superresolution fluorescence and electron microscopy reveal the relationship of mitochondrial nucleoids to membranes. Proc Nat Acad Sci U S A. 109 (16), 6136-6141 (2012).
- Avanesov, A., Malicki, J. Analysis of the retina in the zebrafish model. Methods Cell Biol. 100, 153-204 (2010).
- Bachmann-Gagescu, R., Phelps, I. G., et al. The ciliopathy gene cc2d2a controls zebrafish photoreceptor outer segment development through a role in Rab8-dependent vesicle trafficking. Hum Mol Gen. 20 (20), 4041-4055 (2011).
- Bachmann-Gagescu, R., Dona, M., et al. The Ciliopathy Protein CC2D2A Associates with NINL and Functions in RAB8-MICAL3-Regulated Vesicle Trafficking. PLOS Gen. 11 (10), e1005575 (2015).
- Mateos, J. M., Guhl, B., et al. Topographic contrast of ultrathin cryo-sections for correlative super-resolution light and electron microscopy. Sci Rep. 6, 34062 (2016).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Thompson, R. E., Larson, D. R., Webb, W. W. Precise nanometer localization analysis for individual fluorescent probes. Biophys J. 82 (5), 2775-2783 (2002).
- Ovesný, M., Křížek, P., Borkovec, J., Svindrych, Z., Hagen, G. M. ThunderSTORM: a comprehensive ImageJ plug-in for PALM and STORM data analysis and super-resolution imaging. Bioinformatics. 30 (16), 2389-2390 (2014).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Cardona, A., Saalfeld, S., et al. TrakEM2 software for neural circuit reconstruction. PLOS one. 7 (6), e38011 (2012).
- Wurm, C. A., Neumann, D., et al. Nanoscale distribution of mitochondrial import receptor Tom20 is adjusted to cellular conditions and exhibits an inner-cellular gradient. Proc Nat Acad Sci U S A. 108 (33), 13546-13551 (2011).
- Slot, J. W., Geuze, H. J. Cryosectioning and immunolabeling. Nat Prot. 2 (10), 2480-2491 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены