Method Article
ラットの視神経の部分断裂: 網膜神経節細胞の二次変性を評価する新しい手術アプローチとの確立モデル
要約
網膜神経節細胞 (Rgc) の二次変性は、緑内障の一般的発生します。本研究では、部分的な視神経断裂に対する革新的な手術アプローチについて説明します。この省スペースの手術アプローチの使用は、モデルの適用範囲を拡張し、新しい方法で Rgc の二次傷害メカニズムの探索をできます。
要約
以前の研究では、網膜神経節細胞 (Rgc) の二次変性が緑内障で一般的に発生することを示しています。断裂部分の視神経は、有用かつ再現可能なモデルと見なされます。二次変性、例えば完全な視神経断裂、視神経のクラッシュ モデルを評価するために一般的に使用される他の視神経損傷モデルと比較して、部分の視神経断裂モデルは、優れたそれを区別する主ですその場で二次変性。したがって、それは二次変性を評価するための優れたツールとして機能します。本研究では、眼球の眼窩外側壁を球後視神経の領域に直接アクセスして視神経の部分断裂の新手術アプローチについて説明します。また、断裂を支援する新設計、低コストの手術器具を提案します。プライマリおよびセカンダリの損傷領域の境界を区別するに代表的な結果によって示されているように新しいアプローチと器により高効率と安定性モデルの手術の十分なスペースを提供します。順番わかりやすく硬膜鞘と眼血管断裂前に視神経から分離します。追加の利点は、この省スペースの手術アプローチの背後にあるメカニズムの探索を許可する部分的に切断の視神経の切り株に薬、キャリア、または選択の RGC トレーサーを管理する捜査官の能力を向上させることは新しい方法で、二次障害。
概要
二次変性は外傷、前後以下の急性および慢性神経変性疾患中枢神経系 (CNS) に一般的に発生します。1,2,3,4,5主要な病理学的イベントの初期の帰結としてのニューロンとグリア細胞死と呼ばれている主な変性二次変性とニューロンとグリア細胞、または部分的にしか影響を受けないプライマリでの死は、中損傷。Rgc の二次変性も、緑内障が発生すると考えられています。6 Yoles et al.7は、Rgc の二次損傷が視神経損傷モデルで発生することを確認しました。彼らは、これらの軸索を取り巻く損傷によってニューロンが軸索に変性環境により最終的に退化する急性損傷後負傷されていないが生成されることを示した。この二次変性進歩的なファッション関連の被害の深刻さのニューロンに影響を与えます。これまでのところ、緑内障で RGC 損傷のメカニズムはいまだに不明特に不十分な臨床治療の結果二次傷害に関連。8,9,10したがって、それは緑内障の開発の間に Rgc の二次変性のメカニズムを探索する必要です。11サイズ、分布、Rgc の二次変性のメカニズムを定量的に評価することができます二次傷害の動物モデルの確立は、Rgc の二次損傷を研究する科学者から注目を集めています。
Levkovitch 動詞らによって設立されたポン ラットモデルをこの問題を明確にします。 には、12軸索損傷を評価するためには、Rgc の退化そして死が誘導されます。このモデルは、二次変性のメカニズムを探ると、潜在的な神経保護エージェントを識別するための良いツールを構成すると考えられています。二次傷害のこのモデルを生成するために使用する楽器は、視神経の定量的な切除を完了するためにダイヤルつまみを離の深さを設定することにより定量的トランセクト尺度とダイヤモンド ナイフです。手術パスの眼球上向きまたは一時的な結膜からアプローチします。手術の過程では、鉗子の主要な傷害を引き起こす可能性がありますの力によって網膜、視神経を影響を受ける可能性があります。もっと重要なは、露出の視神経の限られたスペースのため、切開前に、硬膜鞘を分離することは困難です。したがって、網膜虚血およびモデルの失敗で起因する視神経の部分断裂の中に眼の血管を損傷することが可能です。さらに、ダイヤモンド ナイフは高価で、各使用先端の鋭さが減少します。ターンでは、深さと.のモデリングの効果に影響する可能性
Rgc 本の二次変性のモデルは、眼球の外側眼窩壁から新しい手術アプローチを通じて得られました。この新しい手術アプローチは、下向き、または眼球の鼻側に向かって引っぱったら眼球と視神経の主な損傷を避ける軌道筋円錐に囲まれた球後視神経を直接アクセスします。これはまたモデルの確立中に手術の空間を増加し、硬膜鞘視神経を部分的に transecting する前に分離を有効に。不注意による関与と眼の血管の損傷がモデルの失敗につながることができますに注意してくださいすることが重要です。また、モデルは transfected セル、薬および部分的に切断の視神経の切り株に試薬のフォロー アップ評価できます。自己設計されていた手術器具は安いし使用される複数回、モデリングのコストを軽減することができます。良い再現性と安定性を持っているこのメソッドによって確立された Rgc の二次損傷モデルを示した。
プロトコル
含む動物科目が制度上の動物によって承認された手続きケアおよび使用委員会 (IACUC) 首都医科大学の。手術器具およびソリューションはすべて微生物の感染を制限するために手術前に加熱滅菌処理します
。注: 手術のプロトコルには、麻酔、外科的アプローチ、視神経の評価、終了、および回復の 5 つの部分が含まれています。視神経の定量的な断裂部分を支援するために、低コストで新しい手術器具が設計されました。すべての手順は、次の倫理的なルールと手術手技を行った
。1 です手術手技
- 無菌技術を使用して実験を行う; 動物の使用のためのプロトコルは特定の機関をする必要があります。 。
- 定置滅菌器具材料 (ソリューション、テスト物質、トレーサー、針、等) 感染症と動物福祉への悪影響だけでなく、研究の潜在的な負の影響を防ぐために生体組織に接触.
2。麻酔
- 動物用イソフルラン気化器システムを用いた麻酔 SD ラット。イソフルラン麻酔ガスを蒸発させるため、1 L/分の速度で医療用酸素を使用します。添付麻酔ボックスに動物を置き、遅い呼吸と動物の鎮静まで 4.5% の濃度イソフルランを実行します 。
- 防毒マスク添付ファイルにガスの流れを切り替えるし、操作テーブルの上に動物を配置します。2% とモニター麻酔にイソフルラン麻酔濃度を下げます。大きい動物 (> 300 g) イソフルランの高濃度を必要とする場合があります。イソフルラン投与量調整で、手術中に麻酔を監視します。常に深さと呼吸の率を評価し、深い痛みのないことを保証するつま先ピンチ評価 5 分ごとを実行します 。 手術が完了すると、
- は、イソフルランを切り操作テーブルから削除する前に数分間呼吸酸素を動物を許可します。手術の毛布で動物をカバーおよび/または手術中に毛布を規制を使用体温を維持します 。
3。自己設計され、手術アシスタント楽器 (SSAI)
- 、SSAI 製ステンレス鋼と主に使用装備手棒 (長さ、100 mm; 直径 9 mm) と溝付き頭部 ( 図 1)。溝の頭の表面に溝はそれぞれ半円形、垂直方向の深さ、幅、および 1,000 μ m、500 μ m、200 μ m の長さを持つ。2 つの部分の間は、長さ 50 mm のジョイント セクションがあります。溝の頭 ' s エッジは 300 μ m 広い
。 注: 表面に溝の断裂の腹側の視神経の安定化が可能にします。視神経の腹側を中に産むときに溝の外面に背側の視神経を公開します。一方、垂直方向の切断が実行されたとき背側の視神経溝の端に露出を離断することができます。溝の頭部によって表面に溝内腹側の視神経を保護 ' s エッジ 。
- セカンダリ定量的切断視神経の軸索 (背側) に対応する Rgc の主要な傷害を実現けが直接的な被害なし untransected 視神経の軸索 (腹側) に対応する Rgc で行われます 。
4。外科的アプローチ
- ラット、外科医が直面している頭を手術台の上の右側の場所。手術視野の中心部に右の軌道を調整します。75% エタノール 0.5% クロルヘキシジンの適用、右眼窩皮膚の外部音響孔眼に沿って数回切開面積をきれい。アイリスのはさみを使用して外部の音響孔眼間毛皮を削除します 。
- では、0.5 から 1 センチメートルの長さの外部音響孔眼に沿ってアイリスはさみを使って皮膚切開を確認します。筋膜と 0.12 mm 歯付き鉗子で三角形のくさびを作成する上向きに引っ張り、ピンチします。切開領域に Vannas 春はさみの下刃を挿入し、同じのせん断方向に筋膜を切開します 。
- カット筋 Vannas とは春のはさみ、眼窩静脈を公開します。眼窩静脈の側面をクランプし、鈍らせる鋭い鋸歯鉗子を使用は、切開部の両側を開きます。フォロー アップ操作を容易にするために配置されている軌道筋表面の手術の方向に軌道の静脈を置き、手術を避けるためには、眼窩静脈の出血関連します 。
- アイリス間違いなく右眼眼窩筋の鈍的切離の視野を完全に公開する切開線に沿って離れて以下をカットするはさみを使ってください。
- 離眼窩筋のフォルダーをクランプし、鈍らせる続行を皮膚と筋膜の切開の方向で垂直方向に分離します。眼窩の脂肪組織の外観まで軌道の深さに達する徐々 に側面に沿って別々 。
- 眼窩の脂肪組織の暴露の後外科医は外科医の右側に垂直方向に直面してからラット頭部方向を変更します。一方、常に湿ったによる手術や綿棒滅菌 PBS を含むを保管します。しっとりと柔らかい組織を維持しながらの外科分野の明確なビジョンをによりします 。
5。視神経にアクセスする
- 眼窩に視神経乳頭周囲軌道筋円錐を覆う眼窩の脂肪組織を切断します。これは適切な手術アプローチのよりよい露出を保証します。避けるために限られた脂肪質のティッシュの切除を維持持続出血します 。
- は、外直筋を公開する脂肪質のティッシュをカットしました。外直筋、外側をクランプ、Vannas 春ハサミでカットします。0.12 mm を使用して視神経を覆う脂肪プルアップ鉗子を歯し、Vannas 春ハサミで切って外直筋下脂肪組織が残っている場合
。 注: この時点で光神経周囲組織の鞘ができる 。
- 視神経の総暴露量までの軌道の深さでは、視神経の方向に沿って組織鞘を分離する続行します。きれいなきれいな少量の血液組織の除去に起因する手術の綿棒を使用して領域を維持します
。 注: 視神経が表示されます 。
- 、それをアクセスするためには、眼動脈を損傷することがなく神経を取り囲む硬膜鞘を削除します。手術顕微鏡下で高倍率で硬膜の血管のパターンを調べるシースを軽く回転します。
- 血管に欠けている領域を識別し、硬膜に縦カットを実行します 。13 をリッピング鞘 26 G 針の先端またはサファイア手術プローブの knifepoint で視神経の方向に平行、慎重に水平カットと血管への損傷を避けて
。 注: だけ残った神経を覆うくも膜耐性膜をする必要があります。ネ、非常に薄く、透明である 。
- 血管に欠けている領域を識別し、硬膜に縦カットを実行します 。13 をリッピング鞘 26 G 針の先端またはサファイア手術プローブの knifepoint で視神経の方向に平行、慎重に水平カットと血管への損傷を避けて
- ステップ 5.2、26 G 針の先端またはサファイア手術プローブの knifepoint で軽くクモ膜を視神経の方向に平行にリッピングに似ています 。13
- 背側の視神経溝のヘッドの端よりわずかに高いが、そっとそして慎重に、楽器 groove 内で視神経を横たわっていた。この時、26 G 針の先端と溝付き頭部プラットフォームのエッジまたは部分的な視神経断裂を完了するサファイア手術プローブの knifepoint 上記背側の視神経をトランセクトします 。
6。閉じると回復
後者を解放する視神経の- 垂直方向に少し深い楽器の移動方向。その後、優しく楽器の溝の頭を削除します。眼の筋肉や余分な損傷を避けるために他の組織を傷つけるしないでください。断裂部分の視神経の断端を観察できます 。
- は、外直筋、筋膜、元の位置に目の他の周囲のティッシュを取り付けます。その後、シーケンスの筋肉と軌道のスキン層を縫合します。出血が続く場合優しく、傷を閉じる前に医療コットン ボールと記入し、時間の期間、この維持します。感染を防ぐために傷に抗生物質軟膏を適用します 。
- ターンをイソフルラン ソースを切り、数分間呼吸酸素を動物を許可します。ラット蘇生の過程で断熱温水マットを準備または乾燥パディングでケージ表面を覆います。回復処理中にラット気道の開存性を確保するための毛布を持つ動物をカバーします 。
- 手術後個別に家動物。制度上のアニマル ・ ケアの当局によって提供されるガイドラインによると手術後の鎮痛薬を管理します。手術後の動物を注意深く監視します 。
結果
SSAI (図 2 a)を使用して新しい手術アプローチと二次障害モデルの確立に関する成功の確認するには、Rgc はモデルの確立の直後に逆行性標識しました。この手順の目的は、 (図 2 b)の上の丘に神経トレーサー染料 (3% 蛍光体 (例えばFluorogold) 滅菌リン酸バッファー生理食塩水) を注入して逆行性ラベル Rgc をだった。このアプローチは、少しの変化で実行可能な Rgc の再現可能なラベルを生成します。14,15,16,17,18染料逆行性網膜で Rgc によってとられるが、右目で離断しない軸索ライブ Rgc のマーカーを構成します。一方、Rgc は右目の軸索はトレーサー染料(図 2)でラベル付けされませんが部分的に切断の視神経に対応します。コントロールの目として左目網膜の視神経に沿って Rgc 操作なしすべてで標識した金色素(図 2 D)の上の丘から逆行性に。
視神経の部分断裂の逆行性標識後 7 日網膜が収穫、固定、平らに、マウントします。ラベル付きの Rgc は、網膜の定義された領域の蛍光顕微鏡下でイメージしました。Rgc の蛍光標識部分の視神経断裂の有無の結果は、図 3のとおりです。視神経の神経の untransected 部分に対応する右網膜で Rgc 蛍光ゴールド ラベル付けされた、ラベルとラベルの付いた Rgc の明確な境界ができるだけ(図 3 a図 3 b)、可視化視神経の部分的なトランザクションを示します。(図 3、図 3 D)左目の網膜を示した蛍光のすべて Rgc コントロールの目として
評価するには、視神経の頭部や眼動脈、entoretina に血液を供給する血管が負傷して、右目眼底操作中に影響を受けるかどうかは、手術の前後をイメージしました。画像は、右目 (手術目) 前に、術後後 1 時間への血液供給を示した。動脈の血液は、十分だった。静脈の閉塞が認められなかった。(図 4 a、 4 b を図)の操作中に血液供給システムへの損傷がなかったことが示唆されました。したがって、Rgc の二次変性モデルは正常に確立されました。
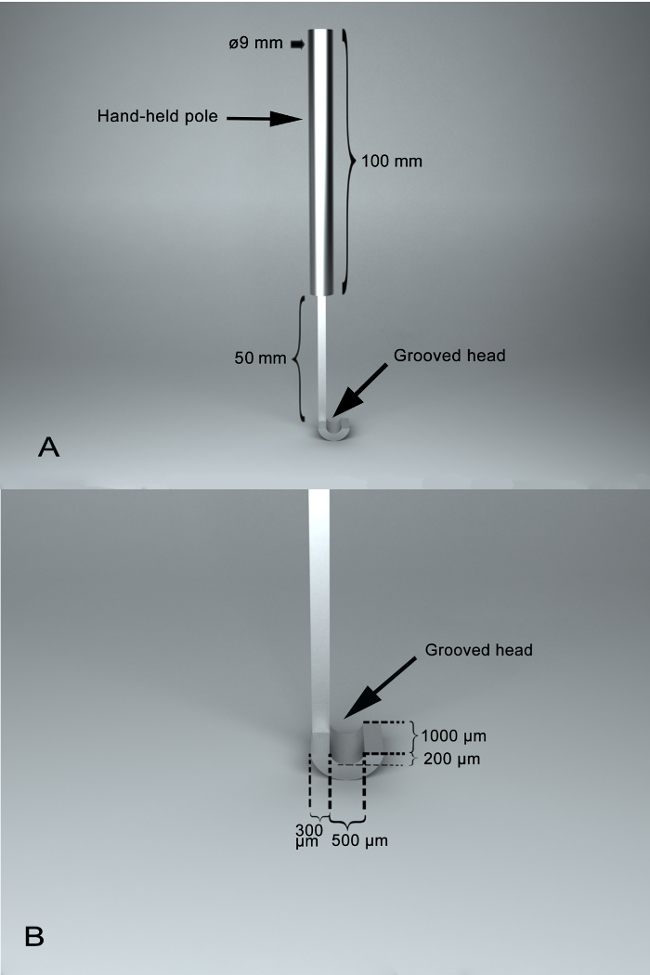
図 1: 自己設計されていた外科助手楽器、SSAI の写真です。(A)ハンドヘルド ポールと溝付き頭部を含む 2 つの主要部分で、手術器具のパノラマ ビュー。、それらの間には、長さ 50 mm の共同セクションがあります。手持ちのポールの長さが 100 mm、手持ちのポールの直径は 9 mm (B) A の特徴 SSAI 溝。溝の頭の表面に溝が半円形、断裂のため安定している内に、レイアウトに視神経を可能にします。この表面に溝は、200 μ m の垂直方向の深さと 500 μ m の幅で 1,000 μ m の長さです。溝のヘッドのエッジの幅は 300 μ mこの図の拡大版を表示するのにはここをクリックしてください。
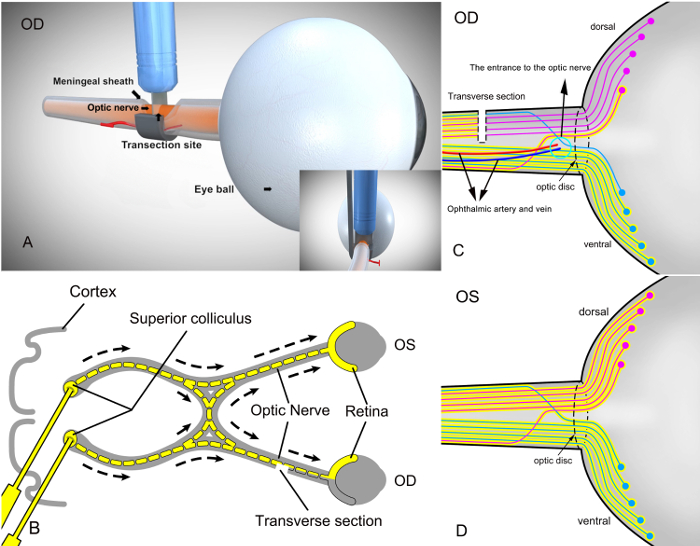
図 2: RGC 自己設計されていた外科助手楽器 (SSAI) と右の視神経の部分切除後の網膜のラベリングと逆行性標識蛍光体と丘の模式図.(A)自己設計されていた外科助手楽器 (SSAI) とラットの部分的な右視神経断裂の外科的ビュー。(B)モデリングした後 Rgc でラベル付けされた逆行性脳の丘に神経トレーサー染料 (黄色、3 %fluorophore 滅菌リン酸バッファー生理食塩水) を注入すること。Rgc の軸索は、上丘に存在するので、トレーサー染料は逆行性 Rgc によってとられる、生きた細胞のマーカーを構成します。横断図には、視神経の断面を表します。OD、運営の目OS、操作することがなくコントロール目。(C)、視神経の untransected 部分に対応する Rgc だけは蛍光で標識しました。青地は区切りのない腹側の視神経と網膜に対応する Rgc赤では、部分的に切断の背部の視神経と網膜に対応する Rgc を反映しています。(D) 、網膜手術せず左眼 (目) の Rgc すべてでラベル付けされた染料。背側と腹側の視神経は、すべての同様の色素で標識しました。この図の拡大版を表示するのにはここをクリックしてください。
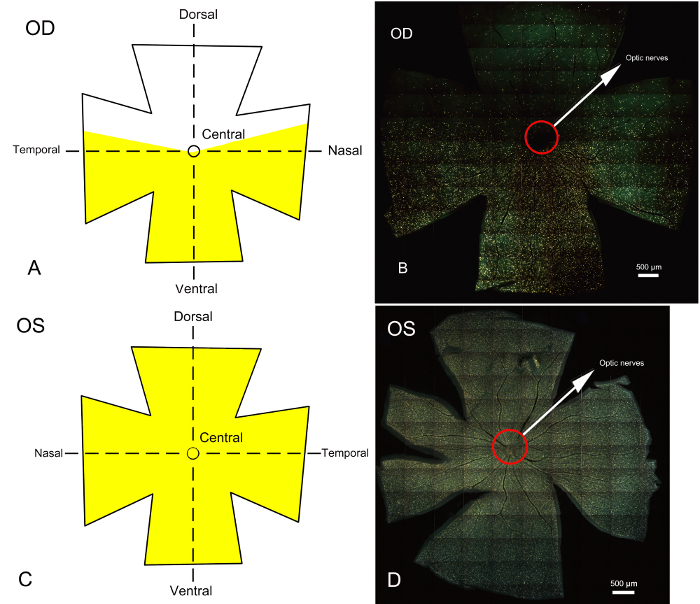
図 3: 蛍光ラベル Rgc 視神経部分断裂を確立した後 7 日間の網膜全体落射蛍光顕微鏡と逆行性標識丘のモデルします。Fluorogold 網膜上の RGC 領域を染色の対応する回路図は掲載されてもいます。( A) と(C)はそれぞれの fluorophore にラベリングした後右 (手術) の網膜左 (コントロール) 目で Rgc のスケマティック ダイアグラムを表します。イエローはゴールド色素の付いた領域を示します。網膜は、背側、腹側と中央部分に分かれています。(B)と(D)を表す全体網膜落射蛍光顕微鏡、蛍光顕微鏡下で得られました。黄色は蛍光ラベルの付いた Rgc の領域を表します。手術の目 (右目) Bに示すように、ラベルのない地域は視神経、網膜の背側を中心に、部分的に離断に対応する Rgc の領域を表します。金色素でラベル付けされた領域は、視神経が切断され、網膜の中央部と腹側の側面に主に集中しているに対応する Rgc の領域です。バウンドさせるラベルとラベルの付いた Rgc の領域間機は明らかです。RGC の体の主な変性は背側網膜に限定されるだろうし、二次変性する RGC 体中央部と腹側の網膜ですべての損失が考えられます。(D)全体の網膜は、Rgc fluorophore にラベリングした後左目の顕微鏡写真。左目手術なしの Rgc 全く蛍光で染色。スケール バー = 500 μ m.この図の拡大版を表示するのにはここをクリックしてください。
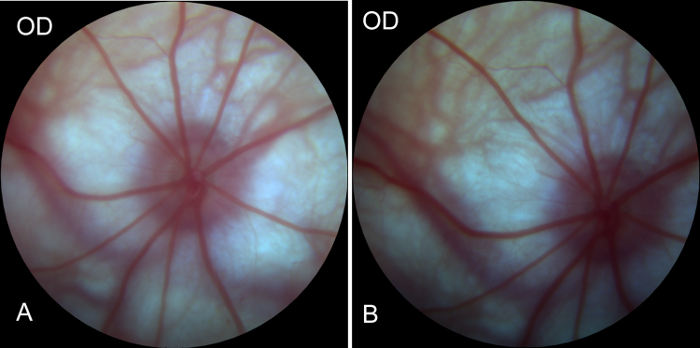
図 4: 眼底カメラによる右眼の眼底の術前・術後の画像が得られる。(A) 、眼底、動脈の充填と静脈還流や閉塞の良い血液供給を示すラットでは, 右目手術前に眼底の画像を示す良い網膜の血液供給システム。(B)右目手術後 1 時間の眼底像眼底の術前の画像と比べると、大幅な変更は認められなかった網膜の血液供給、眼球の血液供給システムはモデリングのプロセス中に影響されないことを示します。この図の拡大版を表示するのにはここをクリックしてください。
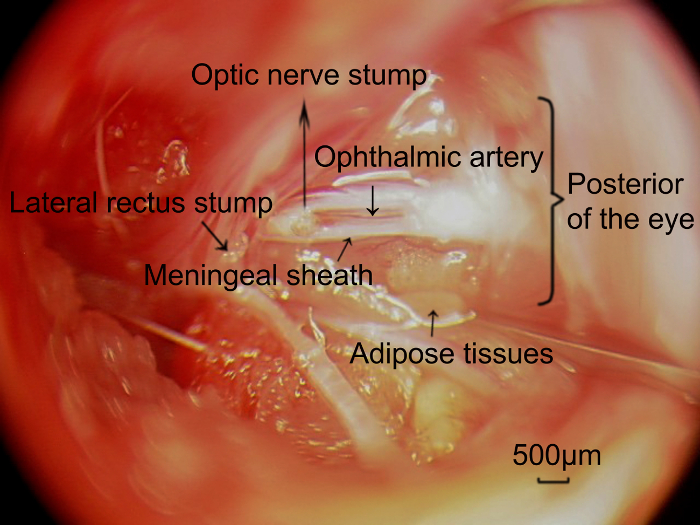
図 5: 外科的アプローチによってキャプチャ硬膜の鞘に位置する球後視神経と眼動脈の写真。視神経のターゲットの長さを完全に除去した後眼動脈 (矢印) 視神経の硬膜の鞘と併用され、露出、視神経に平行。スケール バー = 500 μ m.この図の拡大版を表示するのにはここをクリックしてください。
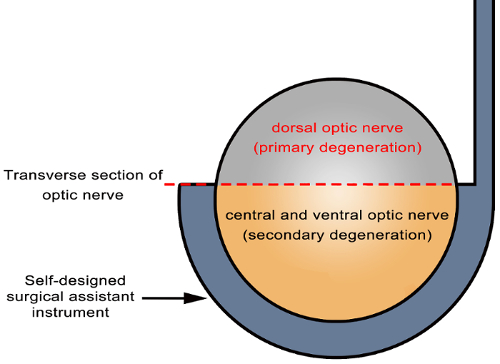
図 6: 第一次および二次変性視神経内の模式図.視神経の部分切開は、自己設計されていた外科助手器具 (矢印) を使用して達成されました。直接破損したサイト (灰色の横断面の視神経の背側切断サイト) の軸索を受ける間接的破損したサイト (黄色の横断面の視神経の中央部と腹側領域) の間の主な変性二次変性を受けること。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
運用手順
モデル構築の過程で注意の価値があるいくつかのポイントがあります。4.2 の手順で手術の動きを原因筋肉の上の血管の損傷を避けるために慎重に行う必要があります。特に、目尻側の皮下筋膜を切断、鋭い鋸歯鉗子に使用する引き上げて皮下筋膜筋膜面垂直方向に筋膜は過度の出血によってモデルが失敗になることができます外眼角で眼窩静脈への損傷を避けるために春はさみ Vannas でカットする必要があります。4.3 のステップ可能性があります血管から直接削除するときの出血を防止する利点があります。4.5 の手順、ピッキング鋭い鋸歯鉗子しますが、ない Vannas の理由で軌道の筋肉の分離に春はさみは連続的な出血や出血を避けるためにです。筋肉は筋膜切開; に垂直方向の両側にぶっきらぼう区切ら一方、軌道の深い筋肉は、外側と末梢に引き伸ばされます。この手順には、眼窩、大きな手術のウィンドウを提供し、視神経を覆う組織へのスムースなアクセスを許可するのより深い部分が明らかになります。上記の手順で出血が発生した場合圧力を使用して適用する無菌手術または綿棒。少量の出血は、この手順でいくつか秒後停止します。ステップ 4.6 の目的軌道筋円錐軌道の深さで視神経の方向に沿って視神経を公開するためのいくつかの脂肪と別の筋肉を簡単に削除するフォロー アップ操作を容易にすることです。
現在のプロトコルの最も重要な部分は、手順 5.1 5.6 です。視神経乳頭周囲の血管系に損傷を与えることが重要です。視神経は、部分的に神経目から 1 mm 以内に浸透し、内部の網膜に血液を供給する眼動脈への損傷を避けるために、目の後ろから少なくとも 1.5 2.0 mm 切断する必要があります。外直筋を切断の目的は外直筋幅は明らかに視神経のビューをブロックと視神経の良い露出を達成するためにです。一方、眼動脈硬膜鞘(図 5)に関連付けられているを削除されないように、分離し視神経乳頭周囲の硬膜を切り離して、硬膜鞘の血管のパターンを調べるべきです。鉗子を使用して、優しく鞘を回転します。さらに、硬膜の鞘で縦カットを許可する血管に欠けている領域が識別される必要があります。眼動脈に密接に関連付けられている硬膜の部分を避けるために、目の後ろから小さな作動距離を維持するために必要です。網膜は通常透明で、血管を明確に区画することができます。破損した網膜の血液の供給の場合乳白色凝集外観につながる網膜は退化しました。時間をかけて減少目サイズと同様、曇りに目とレンズのガラス室通常なります。本研究では、眼底の術前・術後の画像に上記の手順を適用した後モデルで、眼底の血液の供給への損傷は確認されていません。
さらに、このモデルのいくつかの手順に特別な注意が必要。視神経を公開する鋭い曲線鋸歯鉗子または他の手術器具を使用して、外科医は避けてください無理、視神経、眼球や眼動脈を損傷する可能性があります主な損傷と網膜虚血の結果します。さらに、目を囲む血管の必要がありますが破損していない、持続的な出血を避けるためにモデリングの失敗につながる可能性があります。この実験で使用されている SSAI には、繊細な使用が必要です。視神経が楽器溝内に置くは、視神経と表面に溝が良い一貫性と各動物モデルの再現性を確保するためしっかりと装着する必要があります。練習では、最初のエントリのカットが行われた後の目あたり 15 〜 20 分以内完全手術を完了できます。
王ら19は、視神経定量的 amputator を使用して確立される部分的な視神経断裂のような動物モデルを発表しました。手術の手順が含まれています: 1) 中断と眼瞼のスーペリアー; を固定、目尻を離れて切断2) 視神経などを探索し、amputator; を使用して視神経の優れた部分を transecting・ 3) 結膜や皮膚を縫合します。手術は比較的単純な操作中に次の問題が発生しました。外眼角切開は、操作の特定のスペースを公開可能性があります、常に長い球を公開する外科医が必要な場合は特に、球後視神経鞘を公開するために眼球をストレッチする必然的な必要性があった視神経鞘鞘分離; さらに容易にするために眼球ストレッチ力が大きかった、眼球と視神経の直接牽引損傷が発生する可能性があります。視神経鞘とカットが血管に特別な注意を払いましたないと血管損傷は失敗したモデルの確立につながる可能性があります。このペーパーで説明した二次損傷モデルのプリンシパルのプロシージャ: 新しい手術からアプローチ眼球の外側眼窩壁に直接アクセス眼窩筋円錐に囲まれた球後視神経への主要な損傷を回避する、眼球と視神経、下向き、または眼球の鼻側に向かって引っぱったら。この新しい手術アプローチのモデリングでは、手術空間を向上し、視神経の部分断裂の前に眼動脈に密接に関連付けられている硬膜の鞘を簡単に分離。視神経の部分断裂はコスト効果的かつ再利用可能なモデルの全体的なコストを削減、自己設計されていた手術の器具を行った。ラットの軌道構造は、外眼角と骨構造に最も近い軌道の他の哺乳類のものとは異なる筋肉で覆われています。外科的アプローチは、眼窩骨と骨膜の破壊を必要とせず眼球の後部に達する可能性があります。厳密な術前消毒と術後の抗菌薬予防投与、感染症、炎症、浮腫が大幅削減。
自己設計されていた手術補助器
その主な機能は次のとおり自己設計されていた外科助手器具を使用して断裂部分の視神経のラットモデルを設立されました。それは異なる動物間で断裂を一貫性も溝のエッジにさらされる視神経の定量的な断裂部分に役立ちます。我々 はテストし、SSAI とモデルの構築の再現性を確認します。最大変動率は 1.85%、平均値 0.67% ± 0。 44%。20これらの結果を示す、SSAI を使用して良好な再現性と国連と部分的な視神経断裂モデルを確立できます。iformity。
表面に溝の幅と溝の内面の半円形のデザインが視神経に与える影響をより固定し表面に溝を作るし、視神経を実験誤差と副作用の減少も添付より緊密。溝のエッジは、カッターの切れ味に関係なく、溝に視神経を損傷しない操作中に溝に視神経の保護を強化することができます。溝のエッジの別の利点は、視神経断裂中クラッシュ傷害予防です。
深くて狭い空間での動作に適しています。新しい手術アプローチを展開すると、経路のまま、深い、ハンドヘルド ポールと共同セクションを簡単にフォロー アップ操作を実行する視神経鞘下溝ヘッドを配置する使用ことができます。操作の計測器を使用する場合、断裂、例えば26 G 針の先端のカッターの広い範囲を使用できます。挫傷を避けるために、はさみによって引き起こされる傷害をつぶすもサファイア手術プローブ ナイフを選択できます。溝は視神経切断のさまざまなレベルを完了する別の垂直深さで可能です。
らSSAI 王の amputator と比較してシンプルな構造を持ちます。さらに、切削手順はより一貫性の向上と動物モデルの再現性と、SSAI を使用して便利です。最後に、SSAI による切削に使用可能なツールの範囲が広いまたです。結論としては、神経の定量的および制服の切開になります、SSAI はラット視神経断裂の評価モデルを確立するための効果的な道具として役立つかもしれない。
ラット視神経部分断裂モデルの特性
部分的な視神経断裂モデルは Rgc の二次変性を評価するために役立ちます。このモデルの潜在的なメリットは正確に二次変性から主を区別する能力はその場で視神経と網膜の両方。中央部と腹側の視神経が背側の視神経(図 6)の部分的な断裂 (約 1/3、1/2) 後の二次損傷を受けやすくなります。網膜に、Rgc のプライマリとセカンダリの傷害の地域は部分断裂後網膜 Rgc に対応する視神経の地形に基づくべき。ラットの全体の網膜は、背側 (スーペリアー)、腹 (下) の部分に分割され、セカンダリとプライマリの傷害が両方の部分に存在します。ただし、網膜上 Rgc と視神経の軸索との関係に基づいて、RGC 死腹側網膜に主に起因する二次傷害(図 3)。12,22,このモデルの23の利点: 標準的な手順と機器はシンプル、簡単操作眼の血管に影響しません。良い再現性と安定性。短い干渉 Rna (Sirna)、プラスミドを適用することによって、この省スペースの手術アプローチから Rgc を使ってこの手法を使用した部分の視神経にウイルスのベクトルの切り株。また、試薬は選択的治療または Rgc のラベリングのため部分的な視神経断端に配置でした。
Rgc の全体的なプライマリおよびセカンダリの傷害は網膜傷害の 2 つの型の間に明確な境界を持つこの動物モデルで部分的な視神経断裂後共存。視神経の軸索と網膜上の RGC の場所の協会より正確な区別のためさらに調査が必要、この省スペースの手術アプローチ モデルのアプリケーションの範囲を拡張する、研究者を探索することができます、新しい方法で Rgc の二次傷害のメカニズム。
開示事項
すべての著者は、ない任意の利害の衝突があることを宣言します。
謝辞
この作品は、北京自然科学基金 (7152038)、中央南大学 (2016zzts162) の中央大学と科学研究財団の空気目病院グループの (グラント号基礎的研究資金によって支えられました。AF156D11)。最後に、樊城のヤンは、長年にわたって非常に貴重なサポートを Yiping 徐をありがちましょう。
資料
| Name | Company | Catalog Number | Comments |
| Animal Aneathesia Ventilator System | MIDMARK | Matrx VMR | |
| Isoflurane | RWD Life Science Co. | R510-22 | |
| Surgical Microscope | Leica AG, Heerbrugg, Switzerland | M620 F20 | |
| Tobramycin Eye ointment | Alcon | H20110312 | |
| Fluorogold | Biotium | 80014 | |
| Iris scissors | 66vision Co. | 54026 | |
| Vannas spring scissor | 66vision Co. | 54137B | |
| Sharp-serrated forceps/0.12mm toothed forceps | 66vision Co. | 53329A | |
| Sharp-curved forceps | 66vision Co. | 53324A | |
| Sapphire surgical probe | 66vision Co. | 50205TA | |
| 26G needle tip | Shandong Weigao Group Medical Polymer Co. | 3151474 | |
| 10 μl Hamilton Syringe | Hamilton Co. | 80030 | |
| 5-0 non-absorbable suture | Johnson & Johnson International Co. | W580 | |
| Chlorhexidine | Sigma-Aldrich | 282227 | |
| Stereotaxie apparatus | RWD Life Science Co. | 68026 | |
| Retinal Imaging System | OptoProbe Ltd. | OPTO-RIS | |
| RetCamII wide field imaging system | Clarity Medical Systems,Inc. | RetCamII | |
| Fluorescence microscope | Leica Microsystems Inc. | DM6000 |
参考文献
- Stoica, B. A., Faden, A. I. Cell death mechanisms and modulation in traumatic brain injury. Neurotherapeutics. 7 (1), 3-12 (2010).
- Hausmann, O. N. Post-traumatic inflammation following spinal cord injury. Spinal Cord. 41 (7), 369-378 (2003).
- Oyinbo, C. A. Secondary injury mechanisms in traumatic spinal cord injury: a nugget of this multiply cascade. Acta Neurobiol Exp (Wars). 71 (2), 281-299 (2011).
- Guimaraes, J. S., et al. Mechanisms of secondary degeneration in the central nervous system during acute neural disorders and white matter damage. Rev Neurol. 48 (6), 304-310 (2009).
- Stewart, S. S., Appel, S. H. Trophic factors in neurologic disease. Annu Rev Med. 39, 193-201 (1988).
- Brubaker, R. F. Delayed functional loss in glaucoma. LII Edward Jackson Memorial Lecture. Am J Ophthalmol. 121 (5), 473-483 (1996).
- Yoles, E., Schwartz, M. Degeneration of spared axons following partial white matter lesion: implications for optic nerve neuropathies. Exp Neurol. 153 (1), 1-7 (1998).
- Nickells, R. W. From ocular hypertension to ganglion cell death: a theoretical sequence of events leading to glaucoma. Can J Ophthalmol. 42 (2), 278-287 (2007).
- Doucette, L. P., Rasnitsyn, A., Seifi, M., Walter, M. A. The interactions of genes, age, and environment in glaucoma pathogenesis. Surv Ophthalmol. 60 (4), 310-326 (2015).
- Osborne, N. N., Melena, J., Chidlow, G., Wood, J. P. A hypothesis to explain ganglion cell death caused by vascular insults at the optic nerve head: possible implication for the treatment of glaucoma. Br J Ophthalmol. 85 (10), 1252-1259 (2001).
- Rokicki, W., Dorecka, M., Romaniuk, W. Retinal ganglion cells death in glaucoma--mechanism and potential treatment. Part II. Klin Oczna. 109 (7-9), 353-355 (2007).
- Levkovitch-Verbin, H., et al. A model to study differences between primary and secondary degeneration of retinal ganglion cells in rats by partial optic nerve transection. Invest Ophthalmol Vis Sci. 44 (8), 3388-3393 (2003).
- Magharious, M. M., D'Onofrio, P. M., Koeberle, P. D. Optic nerve transection: a model of adult neuron apoptosis in the central nervous system. J Vis Exp. (51), (2011).
- Yoles, E., et al. GM1 reduces injury-induced metabolic deficits and degeneration in the rat optic nerve. Invest Ophthalmol Vis Sci. 33 (13), 3586-3591 (1992).
- Fisher, J., et al. Vaccination for neuroprotection in the mouse optic nerve: implications for optic neuropathies. J Neurosci. 21 (1), 136-142 (2001).
- Levkovitch-Verbin, H., et al. RGC death in mice after optic nerve crush injury: oxidative stress and neuroprotection. Invest Ophthalmol Vis Sci. 41 (13), 4169-4174 (2000).
- Li, Y., et al. VEGF-B inhibits apoptosis via VEGFR-1-mediated suppression of the expression of BH3-only protein genes in mice and rats. J Clin Invest. 118 (3), 913-923 (2008).
- Tang, Z., et al. Survival effect of PDGF-CC rescues neurons from apoptosis in both brain and retina by regulating GSK3beta phosphorylation. J Exp Med. 207 (4), 867-880 (2010).
- Wang, X., Li, Y., He, Y., Liang, H. S., Liu, E. Z. A novel animal model of partial optic nerve transection established using an optic nerve quantitative amputator. PLoS One. 7 (9), e44360 (2012).
- Yan, F. C., Li, S. N., Liu, K. G., Lu, Q. J., Wang, N. L. The establishment of a rat partial optic nerve transection model and assessment of its reproducibility. Ophthalmology in China. 22 (1), 34-37 (2013).
- Fitzgerald, M., et al. Secondary degeneration of the optic nerve following partial transection: the benefits of lomerizine. Exp Neurol. 216 (1), 219-230 (2009).
- Fitzgerald, M., et al. Near infrared light reduces oxidative stress and preserves function in CNS tissue vulnerable to secondary degeneration following partial transection of the optic nerve. J Neurotrauma. 27 (11), 2107-2119 (2010).
- Li, H., et al. Lycium barbarum (wolfberry) reduces secondary degeneration and oxidative stress, and inhibits JNK pathway in retina after partial optic nerve transection. PLoS One. 8 (7), 68881 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved