Method Article
ライブ イメージング モニター細胞生物学および複数の神経集団の血統で、進行を追跡 1 つのセルに続いて
* これらの著者は同等に貢献しました
要約
ソフトウェア ベースの後処理に続いてタイムラプス ビデオ顕微鏡による神経の人口を監視するための堅牢なプロトコルを説明します。このメソッドは、ライブ イメージング実験中に選択した人口の生物学イベントを識別するために強力なツールを表します。
要約
細胞の運命決定や分化、増殖などの神経細胞集団の重要な生命現象を制御するメカニズムを理解することは、神経系に影響を与える多くの病気のためデザイン治療戦略に重要になります。静止画で彼らの最終的な成果に依存して細胞集団を追跡する現在の方法と、彼らは通常単一細胞における行動特性を識別するために十分な時間分解能を提供するために失敗します。また、細胞死における変化、細胞集団、希釈、拡散、または細胞を分析するために使用するマーカーの効率が低い内行動の多様性の結果の不完全か不正確な読み出しにつながるすべての重要なハンディキャップであります。逆に、ライブ イメージングおよび単一細胞を適切な条件の下で追跡を実行する各イベントを監視するための強力なツールを表します。ここでは、後処理、続いてタイムラプス ビデオ顕微鏡検査プロトコルは、単一セルの解像度、特定のソフトウェアを用いた神経集団の追跡に記載されます。説明されている方法では、異なる神経集団の細胞生物学と系統の進行に関する本質的な質問に対処するための研究を有効にします。
概要
神経集団を再生成する新しいより効果的な治療戦略を開発するために我々 は最初再生神経の細胞を維持する基本的なメカニズムを理解する必要があります。この目標を追求して、静穏化、増殖・分化、モード部門、細胞周期の長さ、移動能力、生存率などのタイミングとバランスを調節する因子の包括的な知識が必要です。それは多くの年1に採用されている技術的なアプローチが、イメージングのライブし、直接観察のまま上記イベントを監視する最良の選択肢。終点の読み出しを中心とした多くの他のアプローチに反対のライブ ・ イメージングと単一細胞を追跡、実験2,3,4,5,の長さ全体にわたって情報を提供6。 したがって、と同様、多くの重要なイベントを識別するそれ以外の場合に渡すことがあります一時的な解像度の追加により、細胞死、異種細胞動作、または細胞運命決定、見過ごされました。理想的には、細胞のこれらの機能は最高で、単一細胞レベルで生体内では、監視する必要が場所両方組み込み (細胞自律的に) と外因性 (細胞ニッチ) キューが考慮されます。
ただし、体外のの状況は自然の環境を再現できない環境で生じるが、通常これらのプロトコルで使用される低密度の培養条件はの本質的な特性を明らかにするより適している、セルです。また、成長媒体を変更するだけで、周囲の環境のより単純なコントロールは、それぞれの神経のニッチを定義する外的要因だけでなく、可能性があります環境の要因の個々 の役割を調査するための貴重なツールを構成するかもしれない病理学的シナリオ7,8,9,10、11,12,13で誘導します。したがって、ここで、提案されたプロトコルのように正しく構成されているライブ イメージングは先に挙げた質問のほとんどに対応する実行可能な体外ソリューションを提供します。
簡単に言えば、このプロトコルでは、ハードウェア、ソフトウェア、培養条件および追跡 1 つのセルに続いてライブ イメージング実験を正常に実行するために必要な主な手順について説明します。このアプローチでは、生物学と複数の神経集団の系統進行の基本的な側面を明らかにするために役立つ貴重な情報を提供しています。
プロトコル
複数神経集団 (図 1) の単一細胞追跡続いてライブ イメージングを実行に必要な手順について説明します。含む動物このプロトコルで記述されている必要がありますすべてのプロシージャは、実験動物科学 (ICLAS) の国際評議会のガイドラインに従って実施。
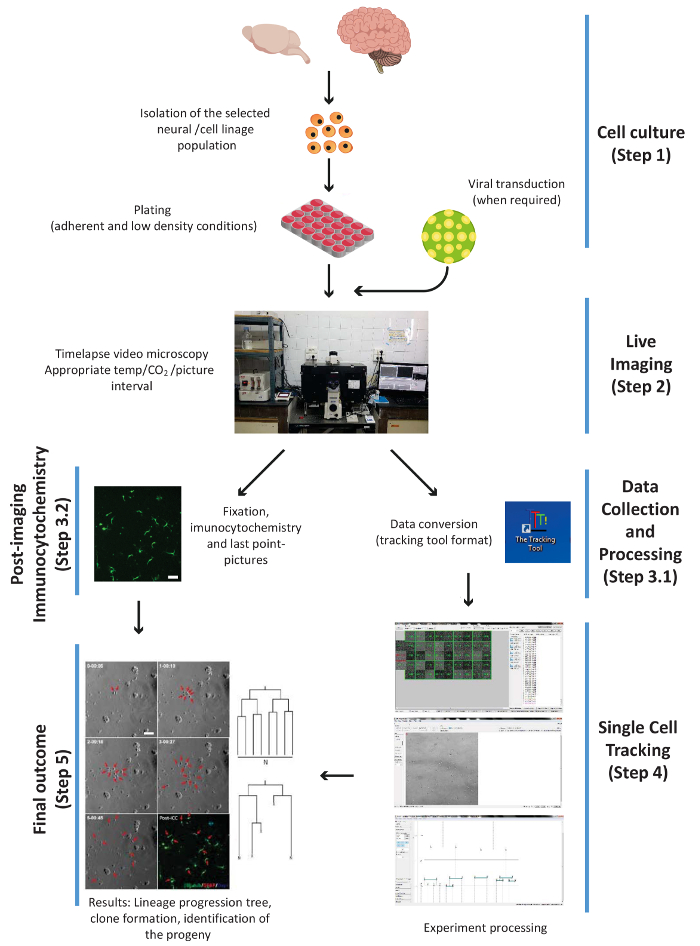
図 1.すなわちプロシージャの主な実験手順を示すスキーム: 細胞培養、ライブ イメージング、PICC とデータ収集、追跡、1 つのセルと最終的な結果。手順は、プロトコルの作業フローに従って番号が付けられます。この図の拡大版を表示するのにはここをクリックしてください。
1. 細胞培養: 分離と神経集団または細胞系譜選択しためっき
注: このプロトコルと連携して、神経細胞の生物学を分析するその有用性を検証するための異なる細胞集団への応用の例が与えられます。これらが含まれます: (詳細な分離のプロトコルを参照してください14); の上衣ゾーン (SEZ) マウス由来成体神経幹細胞 (aNSCs)(詳細な分離のプロトコルを参照してください15); の神経細胞リプログラミング研究する皮質アストロ サイト生後(詳細な分離法を参照してください16); の小脳アストロ サイト生後マウス神経 2 a 神経芽細胞腫細胞株 (N2a)。
- ポリ-D-リジン コーティング 24 ウェル プレートに直接細胞を播きます。ウェルあたり 1 mL の培地を使用します。プレート 37 ° C で 8% CO2 aNSCs、またはライブ イメージングの前に 2 h のアストロ サイト/セル行の CO2を 37 ° C、5% で孵化させなさい。単一細胞を追跡が不可能となる coverslips 電動顕微鏡ステージを転置した不必要な動きを防ぐために使用しないでください。
注: セル密度と培地、実験で用いられた、: 30-40,000 細胞/ウェル ダルベッコの aNSCs のためのイーグル培地 (DMEM:F12 栄養混合物媒体) を更新N2a DMEM 高グルコース培地で細胞の 20,000 細胞/ウェル、80,000 細胞/ウェル DMEM 高グルコース培地; で小脳のアストロ サイトの55 65,000 細胞/ウェル DMEM:F12 栄養混合物中で生後アストロ サイトの。 - 実行可能なセルの最低数に文化の細胞密度を調整することによって文化プロトコルを標準化します。それにもかかわらず、細胞密度は、文化の生存を維持するために十分に高い必要があります。
注: セル密度が高すぎる場合、余分な破片や貧しい解離 (塊) を妨げる単一細胞の追跡。
2. ライブ タイムラプス ビデオ顕微鏡によるイメージング
- 顕微鏡、カメラ、ハードウェア、およびインキュベーション システムをオンにします。温度を設定し、空気圧 aNSCs のための 37 ° C と 8% の CO2アストロ サイト/セルラインの 37 ° C および 5% の CO2 。温度と CO2のレベル 1-2 h を安定させるために許可します。
メモ: 特定の機器が時間経過のビデオ分析を実行する必要を含む: 電動コンポーネントと明るいフィールド/位相差/蛍光顕微鏡温度、CO2と湿度の制御培養装置そして最後に、信頼性が高く、十分に強力なハードウェアとソフトウェアを取得して写真のボリュームを処理できるライブ イメージング実験 (材料の表をご確認ください) の間に得られました。 - セルはしっかり、プレート (めっき後 2 h) に取り付けられている、一度は、追跡、すなわち細胞が含まれていない井戸は使用されません 1 つの井戸の底に小さなマークを作成するのに永久的なマーカー ペンを使用します。
注: このマークとして使用されます参照 xyz 座標をゼロと中に実験の後またはゼロの位置に戻るには、媒体の変化の間、いつでも使用できます。 - 顕微鏡の培養室内プレートを置き、変位顕微鏡の電動ステージの中にすべての不必要な動きを避けるためにステージにプレートにしっかりと取り付けます。
- 約 20 分の商工会議所で平衡に細胞培養液の温度を許可します。この手順はコンポーネントの拡張によって録音中の焦点の損失を避けます。
- ライブ イメージング ソフトウェアを起動し、実験を設定するタイムラプス モジュールを選択します。
- 「タイム スケジュール タブ メニュー」で実験と画像取得サイクルの合計時間を設定します。送信された固有の毒性または使用される蛍光ライトのため、解析の時間分解能と潜在的な細胞死のバランスを十分な間隔を定義します。
注: たとえば、120 h の合計が aNSC 文化、明視野画像 5 分毎にこの構成では 1 つのムービーの 120 h の買収が 120-150 ギガバイトのコンピューター デバイスの空き領域を要求する検討を取得しました。 - X と y 座標、および「xyz ポイント タブ メニュー」で焦点距離 (z 座標) によって定義される画像位置を選択します。いつでも、座標を取得するために初期位置として基準点 (xyz 0 座標) を含めます。
- または必要なとき落射蛍光励起との組み合わせでのみ「波長選択タブ メニュー」、明視野での取得資産種類を選択します。露光時間を選択します。念頭に送信、露出と (前述)、特に蛍光灯の光はセル実行可能性を損ないます。
- ANSCs、小脳のアストロ サイトおよび N2a セル、明視野 (10-50 ms 露光時間) を選択します。
- 赤/緑の蛍光で導入された皮質アストロ サイトが組み合わせで明視野 (10-50 ms 露光時間) を選択するの実験用の記者によって (赤色励起波長: 550 nm、400 ms 露出時間; 緑励起波長: 460-500 nm と 100 ms 露光時間)。
- 実験と画像を保存するフォルダーの名前を定義します。いつでも実験をリロードする位置のリストを保存し、すべての条件を設定すると、「今すぐ実行」ボタンをクリックしてしてテストを実行します。
- 実験を一時停止し、再実験が完了するまでは 1 日 1 回「z ボタンを上書きする」をクリックするとフォーカス条件を調整します。ライブ イメージング中に媒体の変更が必要な場合は、実験を一時停止し、時間経過室からプレートを取得します。
注: を細胞死や過剰増殖培地の pH の変化だけでなく、部屋の温度の変化細胞の顕微鏡の正しい焦点を当ててあります。(ANSCs) などの重要な文化は、4-(2-hydroxyethyl)-1-piperazineethanesulfonic 酸 (HEPES) を添加した培地の使用をお勧めします (最終濃度: 1 mM)。
3. ポスト画像各種 (PICC)、データの収集と処理
- 実験が完了すると、ソフトウェアを一時停止し、次の手順で説明するように、PICC と固定用プレートを取得します。
- セル固定を実行: 1 mL リン酸緩衝生理食塩水 (PBS) で細胞を洗浄し、パラホルムアルデヒド (PFA) (PBS の 4%) を 500 μ l 添加室温 (RT) で 10 分間インキュベートします。
注意: パラホルムアルデヒド強い定着剤は、皮膚や目に触れないように慎重に処理する必要があります。ヒューム フードの内部でのみ操作する必要があります。 - 3 回で 1 mL の PBS セルを洗ってブロッキング液 (PBS ウシ血清アルブミン (BSA) の 2% (重量/巻) および非イオン性界面活性剤の 0.2% (巻/巻) を含む) を 500 μ l 添加します。室温 1 時間インキュベートします。
- ブロックのソリューションを削除し、一次抗体溶液 250-400 μ L を追加します。室温 2 時間インキュベートします。一次抗体のソリューションには、BSA の 2% (重量/巻) および非イオン性界面活性剤の 0.2% (巻/巻) を含む PBS で希釈した一次抗体が含まれています。ここで説明した実験で使用される抗体: GFAP (1: 500) βIII-チューブリン (1:1, 000) と α-チューブリン (1:1, 000)。井戸に直接実施しています、大量のソリューションが必要とされるすべてのセルをカバーするため (250-400 μ L)。
- 3 回 1 mL の PBS で洗浄し、(手順 3.4 に記載された希釈) 二次抗体溶液 250-400 μ L を追加します。ここで説明した実験で使用される二次抗体: 抗マウス フルオレセイン (FITC) (1:800)、抗家兎 Cy3 (1: 500)。暗闇の中で常温 1 時間孵化させなさい。
- 3 回 1 mL の PBS で洗浄します。セルを 1 mL の PBS、プロトコルの後のステップにしてください。
- 顕微鏡ステージに戻ったプレートを置き、しっかりと電動顕微鏡ステージの変位の間に不必要な動きを避けるためにステージに結び付けます。
- 手順 2.2 で作成したマークを使用してゼロ位置 xyz を取得し、「すべての X、Y、Z オフセット」ボタンを押すことによってこの基準点に位置を再設定します。各位置のための焦点距離を再設定します。
- 「波長選択タブ メニュー」の蛍光性放出に必要な条件を構成する画像の最終ラウンドを取得以前 PICC の標的抗原を検出するために。
- 簡単に言えば、明視野、に加えて FITC をアクティブ (励起: 495 nm)、Cy3 (励起: 550 nm) ソフトウェアの取得オプション。明視野 400 ms 露出のための 10-50 ms を使用して、フルオロを検出および写真の最終ラウンドを取得する、「1 時間ループ」ボタンを押します。
注: 蛍光性の強度は PICC 結果に応じて異なる場合があります。最適な画質を得るために露光時間を調整します。
- 簡単に言えば、明視野、に加えて FITC をアクティブ (励起: 495 nm)、Cy3 (励起: 550 nm) ソフトウェアの取得オプション。明視野 400 ms 露出のための 10-50 ms を使用して、フルオロを検出および写真の最終ラウンドを取得する、「1 時間ループ」ボタンを押します。
- ソフトウェアのファイル/エクスポート オプションを選択し、タグ付きイメージ ファイルの形式 (Tiff) または共同写真専門家グループ (Jpeg) 形式の画像を事前に定義された保存先のフォルダーにエクスポートします。
- トラッキング ソフトウェアで必要な形式にエクスポートする画像変換: 追跡ツールは、17 (tTt)。これを達成するため、入力を定義、出力位置 (xy)、チャンネル (c) 時点 (t) に使用されるマーカーと同様に、ウィンドウの動作「tTt コンバーター ツール」のフォルダーと「画像に変換」ボタンを押します。
注: 特定の設定に従って画像の名前を変更する必要があります、これらの実験で使用される各位置の個々 のフォルダーに格納する必要があります。要件、インストールについてはダウンロード可能、ポジション/イメージ、および追跡ツールの使用の名前を変更する: https://www.bsse.ethz.ch/csd/software/tTt-and-qtfy.html。
4. 単一セルのトラッキング
- データの名前を変更後、tTt ソフトウェアを実行します。ユーザー名と tTt 作業用のフォルダーを選択します。
注: 追跡分析されたすべてのデータとエクスポートされた結果、ツール作業フォルダーが格納されます。作業フォルダーは、tTtexport、「AVIexport」、「構成」、"TreeExport"、"tTtfiles"という名前サブフォルダーを含む名前必要があります。 - 実験が格納されているフォルダーのパスを示す「選択実験フォルダー ウィンドウ」で読み込まれる実験を選択し、「実験をロード」ボタンをクリックしますします。
- 読み込まれているイメージをトラッキング ソフトウェアで読むことができる形式に変換するログ ファイル コンバーターを実行 (実験が最初に読み込まれる、ためこれから要求される自動的にソフトウェア)。
- (後に変換、実験中に記録された位置の概要は、「位置レイアウト ウィンドウ」に表示されます)、そのシンボルをクリックしてして追跡するための位置を選択します。各位置、位置と対応する番号の画像で構成されるシンボルによって表されます (図 1参照)。
- 位置が選択されているし、「位置レイアウト ウィンドウ」の右側に利用可能なイメージの一覧を表示、選択し、「画像を読み込む」ボタンをクリックして。
- 読み込みが完了し、「セルのエディター ウィンドウ」が表示されます波長と「セル エディター ウィンドウ」内で追跡するイメージ間隔を選択します。明視野観察に対応する波長 0、1 は FITC、Cy3 に 2 に対応、DAPI を 3。ここで説明する実験、インターバル 1 が使用された、すなわち、すべての画像が読み込まれます。明確にするには、は、間隔 2 は、すべての 2 番目のイメージの読み込みを意味します。
- 画像が読み込まれると、「位置レイアウト ウィンドウ」に戻るし、以前に読み込まれた位置を表すアイコンをダブルクリックします。実行する単一セルのトラッキングを可能にする「映画の窓」が表示されます。
- 追跡ツールの指示に従って、追跡に進みます。(明視野観察に対応する) 0 チャンネルを選択し、明るさとコントラスト (「調整ガンマ ボタン」) を調整します。追跡を起動するには、F2 キーを押します。
注: 追跡、時に追跡対象のセルが続きますにマウス ポインターを置くと、「0」キーを押します。細胞分裂、細胞のアポトーシスおよび失われたセルのボタンはこれらの特定のセルのイベントを監視することがあります。
5. 最終的な結果
- 単一細胞トラッキングが完了すると、識別、子孫保存実験 (セル エディター ウィンドウ/ファイル] タブ/として現在のツリーを保存) し、結果をエクスポートするのに進みます。
- 系統樹と「セル エディター ウィンドウ」にある「エクスポート メニュー」内のセル データをエクスポートします。同様に、エクスポート セル画像と「エクスポート メニュー」を介して映画を「映画の窓」からアクセスできます。画像、リネージュの木、データ、および映画は、tTt の作業フォルダーにエクスポートされます。
結果
説明した方法により解決する複数の神経集団の細胞生物学に関する重要な質問です。例えば、神経因性と oligodendrogliogenic aNSCs7,8,14,18系統の進行をモニターすることが可能だった。追跡する単一 aNSCs と彼らの子孫 (図 2 a, B)、その aNSCs を示すことは可能だった分離体外分裂をほとんど生成する彼らの神経因性の性質を維持しでを提案するシーケンスに従うというvivo19単一セルのレベルで実証されていません。また、この培養システムは、NSC の自己更新8,14を勉強するユニークなモデルを提供する非対称細胞分裂 (図 2 b)、SEZ から aNSC 系列で初めて可視化することを許可しました。同様に、分析、系列に関係なく、細胞の成長、事業部、細胞生存率、細胞周期の長さのラウンドに関する貴重なデータを入手することが可能だった。
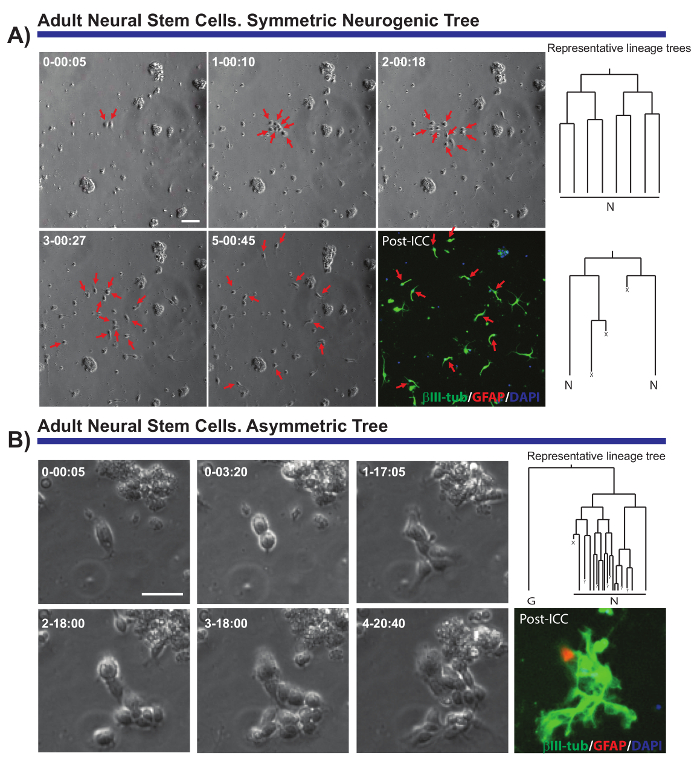
図 2 。ANSCs の例は経済特区から分離したし、ライブ イメージングと単一細胞を追跡しました。位相コントラストの画像には、異なる時点 (日 h: 分) で複製の進行が描かれています。ΒIII-チューブリン (緑) と 4', 6-diamidino-2-phenylindole (DAPI、青)、最終的なイメージはグリア線維性酸性蛋白 (GFAP、赤) のイメージ作成後の免疫細胞化学 (PICC) に対応します。(A) 解析部門を増幅の別のラウンドを対称神経因性木後分裂神経芽細胞を生成します。赤い矢印は、対称の木に含まれるセルをポイントします。右側に、tTt ソフトウェアによって生成されたクローンに対応する系列木が表示されます。(B) 潜在的な自己複製イベントを通じて静止 GFAP 陽性細胞を他の生じながら神経芽細胞を生成する増幅部門を受ける 1 つの分岐と非対称神経因性ツリーを生成前駆の例です。右側に、tTt ソフトウェアによって生成された系列ツリーが表示されます。すべての系統樹:"N"を示しています後分裂神経芽細胞;"G"は、静止の GFAP 陽性細胞;"X"、細胞死;"?"失われた細胞。スケール バーを表します 50 μ m.この図の拡大版を表示するのにはここをクリックしてください。
ライブ イメージング、追跡の分析も単一のセルは神経集団の渡り鳥の容量の正確な読み出しを提供しています。このような情報は、スクラッチ傷の試金20, 傷 (図 3) を閉じるときはアストロ サイト平均距離に関する情報の生成に送信された生後小脳アストロ サイトから取得されました。また、他の人が実験を通じて変更できないままアストロ サイトのいくつかが治癒過程中に分割されていることを確認することが可能だった。驚くほど、分かれているようだ (倍まで平均旅行) の非分裂の同等よりより多作の回遊行動を展示します。この現象は、古典的なエンドポイント解析実験の読み出しでうちに希釈されて、傷害時に瘢痕を形成するアストロ サイト容量の非常に興味深いの不均一性を示唆しています。
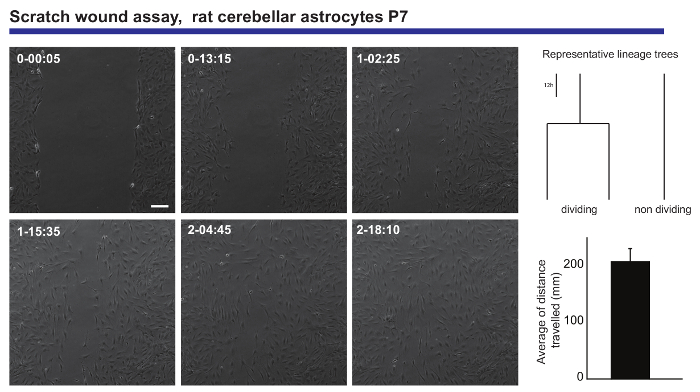
図 3.傷生後小脳アストロ サイトの回遊行動の分析は、アッセイを傷しました。位相コントラストの画像には、異なる時点 (日 h: 分) で傷が描かれています。TTt ソフトウェアによって生成された系統樹は、傷口を閉じながらアストロ サイトの細胞分裂の面で、代表的な動作を示します。ヒストグラムは、単一細胞を追跡したアストロ サイトによる走行平均距離 (平均 ± S.E.M.) を示しています。スケール バーを表します 50 μ m.この図の拡大版を表示するのにはここをクリックしてください。
タイムラプス ビデオ顕微鏡実験のもう一つの興味深い機能は、増殖・分化細胞集団を比較するための容量です。N2a セル (10% 牛胎児血清 (FBS)) の存在下で増殖や (0.5 %fbs + 10 μ M アラキドン酸) 存在下で分化を促進する条件の下でめっきをテストしました。一方、細胞が増殖しない (図 4 b) 神経突起を形成する (図 4 a)、増殖の条件の下でこれらの細胞の血統の進行に従うことだった。驚くことに、単一細胞トラッキング許可と異なる増殖区別する能力と神経突起伸長 (撤回) 評価されるエクスポート後ことができます正確で定量的なデータを提供する植民地です。
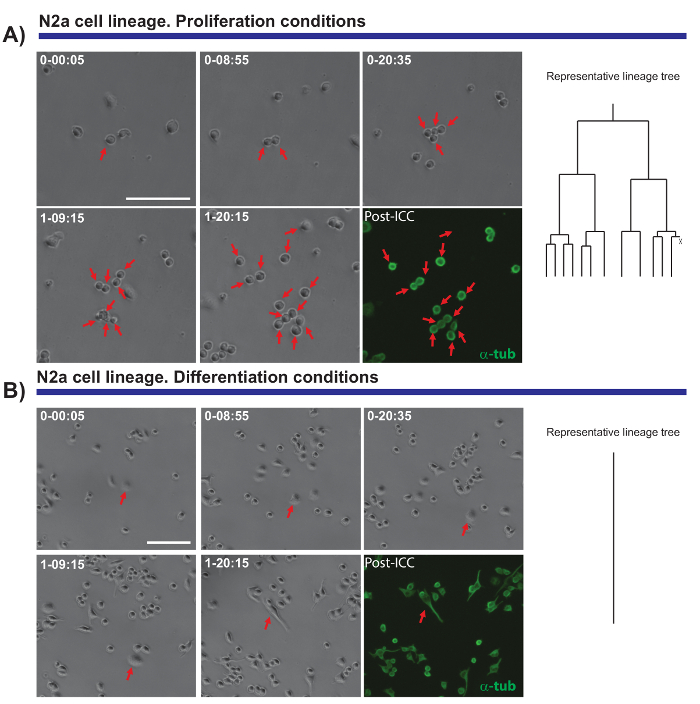
図 4 。N2a 細胞生物学 (A) の増殖または分化条件 (B) を監視します。位相コントラストの画像が異なる時点 (日 h: 分) でクローンの進行を描いたします。最終的なイメージは、α-チューブリン (緑) のイメージ作成後の免疫細胞化学 (PICC) に対応します。追跡 (A) 単一のセルにより、異なる細胞の増殖反応の不均一性と同様、監視する部門のラウンド。右側は、tTt のソフトウェアによって生成された系列ツリーは、N2a 細胞の増殖挙動を示しています。(B) 細胞分化の条件下では細胞周期を終了し、突起、後画像解析によって効果的に測定することができますプロセスを生成します。単一のセルのトラッキング、右側の系列ツリーによって表される、N2a 細胞が細胞周期を終了し、分化条件下で細胞分裂を停止方法を示しています。スケール バーは、50 μ m を表します。この図の拡大版を表示するのには、ここをクリックしてください。
最後に、ライブ イメージングと追跡 1 つのセル、セル、リプログラミングに送信される形態と分子の変化を監視する非常に便利です。Achaete うろこ状のものの相同物 1 (Ascl1) で導入した産後のアストロ サイトのライブ イメージングは、アストロ サイトがプログラムし直された (見なさいをされているときにリプログラミングや細胞分裂の閉塞時に発生する形態学的変化に関する貴重なデータを提供します図 5)。また、Ascl1 伝達をダブル Cortin (DCX) プロモーターの制御下で緑色蛍光タンパク質 (GFP) のエンコーディング構成要素の伝達と組み合わせれば、それは時神経のポイントは正確な時間を定義することが可能特定のマーカープログラムし直された細胞 (図 5) で表される開始します。タイムラプス ビデオ顕微鏡には、定量化し、このプロセスの間に死ぬ細胞と比較して書き換えが正常に完了するセルの数ができます。このようなイベントの監視が正常にプログラムし直された9セルに重要な「チェックポイント」同定につながった。
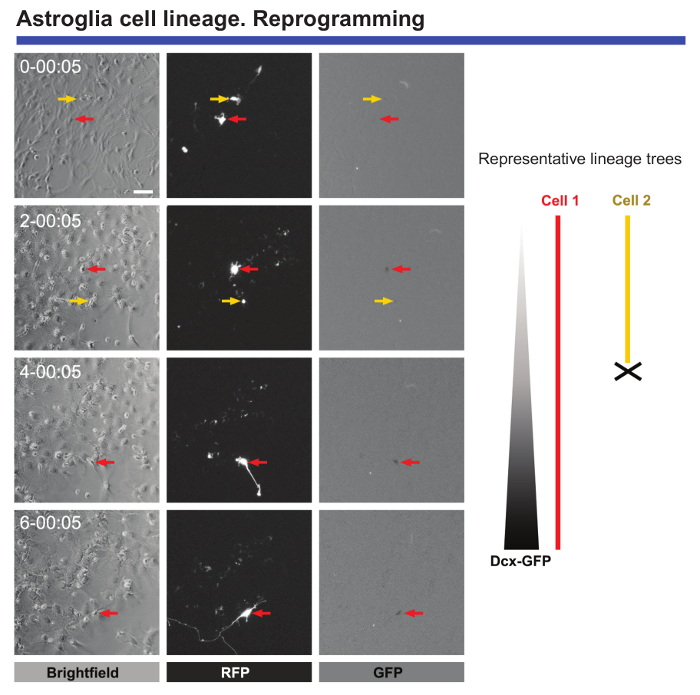
図 5 。神経細胞のリプログラミングを受ける生後皮質アストロ サイトの分析。リプログラミングによるプロ神経因性 Ascl1、赤色蛍光タンパク質 (RFP) ベクトルを伝達。神経の変換は、DCX プロモーターの制御下に GFP をエンコード ベクトルと共同伝達によって監視だった。位相コントラストの画像は、異なる時点 (日 h: 分) でリプログラミングの進行を示します。RFP と GFP 発現の蛍光画像それぞれ。ライブ イメージングと単一細胞トラッキング許可に従う、形態学的変化、リプログラミング、細胞死は、細胞分裂の有無など重要なイベントとプログラムし直された細胞が神経細胞マーカーを表現し始めるとき正確な時間を定義することができます。.スケール バーを表す 80 μ m.この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
ライブ イメージングの最も重要な値の 1 つは、ニューロン集団の系統進行の重要な側面を解明、正確な血統で、トレースを実行する可能性です。トレースする血統は id として定義され、それ以降のクローンにクローンの創始者から21を形成する 1 つの祖先のすべての子孫の監視します。驚くことに、トレース (例えば、ウイルス伝達または多色記者構造21) 系統の代替手法があるという最終的な結果はまだ写真に基づいており、それは必ずしも重大な問題点シーケンス全体を構成します。つまり、その細胞死、細胞集団、希釈、拡散または貧しいマーカーは、一緒に他の重要なハンディキャップの効率の動作における不均一性、結果2の不完全か不正確な読み出しに 。さらに、ライブ イメージングにより、モードや細胞分裂、細胞の成長、移行、増殖と分化、細胞周期の長さ、神経突起のタイミングなどの神経集団の生物学の重要な機能を分析する研究者形成、複雑さと長さ、細胞運命の選択 (差別化)、または変換 (初期化)。
さらに、ライブ イメージングが簡単に他の分析などのように単一のセルからデータを取得するためのもので補完できる RNA シーケンス。ただし、複合ライブ イメージングおよび他の技術の恩恵を達成するために以前に映画で監視されてそれらの細胞が後で再度識別されるされ、個別に収集し、二次分析が必要です。これは、特定のセルの蛍光レポーターを適用または参照としてセルのグループの分布を解析して位置座標を含める顕微鏡を使用して実現できます。実際には、トランスクリプトームのプロファイルの組み合わせと個々 の細胞の挙動細胞の生物学に関与する新しい分子手掛かりを解明するための有力な道筋があります。
ライブ イメージング実験を危険にさらすことができる主要な問題の 1 つは、不十分なセル文化です。前述のように、高密度で破片や貧しい解離 (塊形成) の過剰があります品質と単一細胞を追跡を不可能に作る画像の空間分解能。したがって、調査の下で異なる細胞集団の条件は、培養細胞の生存率を損なうことがなく可能なセルの最小数に調整必要があります。
画像取得の頻度はまた重要調整してください慎重に、特に蛍光照明を使用する場合。とびに送信および、特に蛍光光細胞生存率が低下する可能性があります。また、解析の時間分解能画像のキャプチャ間隔の過剰があります。
ライブ イメージング実験中にもう一つの重要なステップは、焦点の定期的な調整です。正しい設定/再-設定焦点距離の障害は、単一セルの追跡を妨げる可能性があります。また、培養室を維持適切な温度・湿度・ CO2レベル、細胞死を誘導することが望ましくない変化を改正することを慎重に確認する必要です。
最後に、PICC を実行すると、画像取得の最後のラウンドの前に xyz ゼロ位置を正しく取得することが重要です。不適切な再設定、xyz のゼロの位置と、細胞の子孫の識別を妨げる、位相差顕微鏡および蛍光画像と一致することは困難になるそれがあります。
このアプローチには、多くの肯定的な面がありますが、神経集団のライブ イメージングにいくつかの制限はまだ保持されます。例えば、aNSCs の成功した単一細胞追跡を実行するために必要な低細胞密度の場合、ウエスタンブロット14などの生化学的アッセイを採用することは不可能になります。また、小脳アストロ サイトのような高速集団に分割を監視したり N2a 細胞は一時的制限、それはしばしば合流点近く文化として細胞を追跡するは難しい。さらに、細胞の分離に関連付けられている固有の生物学的制限と同様、多くの培養法はしばしば妥協して細胞長期間にわたってライブ イメージング実験の期間を制限すること。最後に、正と負の効果を持って、自然の環境から細胞を分離します。細胞の生理学的なニッチから分離されたが、彼らの行動を調節する重要な信号を受信する失敗する一方、同時に、特定の神経の系統の進行で個別にそれらの信号の効果をテストする強力な手段を表す集団。
上述の制限を考えると、完璧な方法論的シナリオが通常の生理学的な条件の vivoの下ライブ イメージングおよび単一の細胞追跡実験を行うことが明らかです。ただし、現在の技術は2脳の深い地域で時間の長い期間の単一のセルに従うことができません。したがって、ライブ イメージングの未来生理環境3のほとんどのマイナーな干渉可能な限り単一細胞体内の細胞生物学を完全に分析することを目指して、このような制限を克服するのに焦点を当てる必要があります。
開示事項
著者が明らかに何もありません。
謝辞
図 1の彼女の援助と芸術作品ありがとうベアトリス「ガスコン」。また、博士 C. ノリスは彼の援助に感謝我々。ここで紹介する作業は研究助成金、「赤デ excelencia Consolider インジェニオ スペイン語イオン チャンネル ・ イニシアチブ」によって支えられた (BFU2015 70067REDC)、フンダシオン ラモン UCM-サンタンデール (PR26/16-18 b とウォールストリート-3)、スムーザー CM (S2013/氷-2958) メック (BFU2014 53654 P)Areces 助成プログラム (PR2018/16-02)。フェリペ ・ オルテガは Ramon y カハール スペイン経済省と競争力のプログラムを認めている (MEC: RYC 2013 13290)。
資料
| Name | Company | Catalog Number | Comments |
| Poly-D-lysine | Sigma | P0899 | Working solution 0.02 mg mL-1 |
| 24 wells plate | Falcon | 352047 | |
| Dulbecco’s modified Eagle’s medium (DMEM): F12 Nutrient Mixture medium (-L Glutamine) | Invitrogen | 21331-020 | |
| DMEM High Glucose medium | Sigma | D6546 | |
| Bovine Serum Albumin | Sigma | A6003 | |
| Triton X-100 | Merck | 11869 | non-ionic surfactant |
| Mouse anti-β III Tubulin | Sigma | T8660 | |
| Rabbit anti-GFAP | DakoCytomation | Z0334 | |
| Mouse anti-α Tubulin | Sigma | T5168 | |
| Anti-Mouse FITC | Jackson Laboratories | 715-095-150 | |
| Anti-Rabbit Cy3 | Jackson Laboratories | 711-165-152 | |
| Brightfield/Phase contrast/fluoresence microscope | Nikon | TE-2000-E | |
| CFI PLAN FLUOR DLLL 10X objetives | Nikon | Ref 280MRH10101 | |
| CFI SUPER PLAN FLUOR ELWD AMD 20X objetives | Nikon | Ref 280MRH48230 | |
| pE-300 LED fluorescence | Cool LED | Ref Number 1981 | |
| 310M-201 Incubation system (temperature) | OKO-Lab | Serial Nº VOF007307 | |
| Pro-ScanII Motorized stage system | Prior | Serial Nº 60018 | |
| High precision microscope camera version 4.2 | ANDOR Zyla | VSC-03650 | |
| Specifc software for live imaging with timelapse module: NIS-Elements AR4.5 | Nikon | NIS-Elements AR4.5 -Hasp ID: 13CE819E | |
| OKO touch Incubation system (CO2) | OKO-lab | Serial number 1716 | |
| Murine Neuro-2a Neuroblastoma Cell line | ATCC | ATCCCCL131 | |
| HEPES buffer solution 1 M | Invitrogen | 15630-056 |
参考文献
- Conklin, E. G. The Mutation Theory From the Standpoint of Cytology. Science. 21 (536), 525-529 (1905).
- Ortega, F., Costa, M. R. Live Imaging of Adult Neural Stem Cells in Rodents. Front Neurosci. 10, 78 (2016).
- Skylaki, S., Hilsenbeck, O., Schroeder, T. Challenges in long-term imaging and quantification of single-cell dynamics. Nat Biotechnol. 34 (11), 1137-1144 (2016).
- Schroeder, T. Tracking hematopoiesis at the single cell level. Ann N Y Acad Sci. 1044, 201-209 (2005).
- Schroeder, T. Imaging stem-cell-driven regeneration in mammals. Nature. 453 (7193), 345-351 (2008).
- Etzrodt, M., Endele, M., Schroeder, T. Quantitative single-cell approaches to stem cell research. Cell Stem Cell. 15 (5), 546-558 (2014).
- Ortega, F., et al. Oligodendrogliogenic and neurogenic adult subependymal zone neural stem cells constitute distinct lineages and exhibit differential responsiveness to Wnt signalling. Nat Cell Biol. 15 (6), 602-613 (2013).
- Costa, M. R., et al. Continuous live imaging of adult neural stem cell division and lineage progression in vitro. Development. 138 (6), 1057-1068 (2011).
- Gascon, S., et al. Identification and Successful Negotiation of a Metabolic Checkpoint in Direct Neuronal Reprogramming. Cell Stem Cell. 18 (3), 396-409 (2016).
- Karow, M., et al. Reprogramming of pericyte-derived cells of the adult human brain into induced neuronal cells. Cell Stem Cell. 11 (4), 471-476 (2012).
- Kleiderman, S., et al. Conversion of Nonproliferating Astrocytes into Neurogenic Neural Stem Cells: Control by FGF2 and Interferon-gamma. Stem Cells. 34 (12), 2861-2874 (2016).
- Bunk, E. C., et al. Prox1 Is Required for Oligodendrocyte Cell Identity in Adult Neural Stem Cells of the Subventricular Zone. Stem Cells. 34 (8), 2115-2129 (2016).
- Aravantinou-Fatorou, K., et al. CEND1 and NEUROGENIN2 Reprogram Mouse Astrocytes and Embryonic Fibroblasts to Induced Neural Precursors and Differentiated Neurons. Stem Cell Reports. 5 (3), 405-418 (2015).
- Ortega, F., et al. Using an adherent cell culture of the mouse subependymal zone to study the behavior of adult neural stem cells on a single-cell level. Nat Protoc. 6 (12), 1847-1859 (2011).
- Heinrich, C., et al. Generation of subtype-specific neurons from postnatal astroglia of the mouse cerebral cortex. Nat Protoc. 6 (2), 214-228 (2011).
- Jimenez, A. I., et al. Potentiation of ATP calcium responses by A2B receptor stimulation and other signals coupled to Gs proteins in type-1 cerebellar astrocytes. Glia. 26 (2), 119-128 (1999).
- Hilsenbeck, O., et al. Software tools for single-cell tracking and quantification of cellular and molecular properties. Nat Biotechnol. 34 (7), 703-706 (2016).
- Ortega, F., Berninger, B., Costa, M. R. Primary culture and live imaging of adult neural stem cells and their progeny. Methods Mol Biol. 1052, 1-11 (2013).
- Kriegstein, A., Alvarez-Buylla, A. The glial nature of embryonic and adult neural stem cells. Annu Rev Neurosci. 32, 149-184 (2009).
- Yu, A. C., Lee, Y. L., Eng, L. F. Astrogliosis in culture: I. The model and the effect of antisense oligonucleotides on glial fibrillary acidic protein synthesis. J Neurosci Res. 34 (3), 295-303 (1993).
- Kretzschmar, K., Watt, F. M. Lineage tracing. Cell. 148 (1-2), 33-45 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved