Method Article
高速液体クロマトグラフィー ESI Q TOF MS と光誘起分解によるエリスロマイシンの除去を使用して水生環境における医薬品の識別
要約
水で医薬品を識別するために最適なツールとして時間の飛行質量分析装置を用いた非対象と分析のためのプロトコルを提案します。その除去における紫外光照射の応用を示す.照射、化合物の分離, 同定と劣化プロファイルのキネティック モデルを含む分析が示されています。
要約
水環境のため、最終的に人間の健康の重要性が増して水サイクル全体を通じて医薬品を監視します。対象し、非対象と解析が選ぶ今日の手段。助けを借りて、通常分析対象とトリプル四重極の質量分析計はより敏感であることが、以前に選択した唯一の化合物を識別できます。本研究で使用される最も強力な非ターゲット分析は時間の飛行質量分析計 (TOF-MS) 拡張を四重極質量アナライザー (Q) によって実行されます。非ターゲットを絞ったアプローチの前に固相抽出法と高速液体クロマトグラフィー (HPLC)、高い感度と選択性をすべてイオン化可能な物質を検出することができます。Q TOF MS 機器をフルに活用タンデム質量分析 (MS/MS) 実験は加速し、識別を容易にする対象となる MS 法感度を高めるが、識別のための基準に依存しています。ライン川の水から 4 医薬品の同定が示されています。ライン川トーマ湖、スイスのグラウビュンデン州と南湾、オランダの近く、北の海への流れに由来します。その長さは 1232.7 km になります。水循環から医薬品を効果的に除去するために主な興味だから効果 UV-C 照射は実験室規模で示されています。このメソッドは、マクロライド系抗生物質のエリスロマイシンの exemplarily 示されている医薬品の高速分解できます。上記の高速液体クロマトグラフィー Q-TOF MS メソッドを使用して、親の薬物およびその分解生成物の濃度-時間図が得られます。一階を逐次反応のための方程式を確立した後計算継ぎ手により照射時間および条件内で第 4 段階として可能性があると考えられる場合を予測するのに役立つ可能性があります速度論的パラメーターの決定排水処理。
概要
医薬品は、水生環境1,2,3,4,5で定期的に発見されます。重要な情報源は、廃液排水処理植物 (WWTP)6,7,8,9です。医薬品の発生、水のサイクル全体を通じて検討されています exemplarily トゥリア川流域10。とりわけ、抗生物質を表す彼らはしばしばきれないの生物学的段階を通るので、薬の特定の危険等級は変更されず、環境11,報12,13 で細菌の抵抗を引き起こす可能性があります。.マクロライド系は、人間および獣医学の両方に適用される抗生物質のクラスを構成します。その代表は、1 μ g/L の排水14,15,16,17,18,19の最大濃度で発見されました。それらの 1 つはエリスロマイシン (Ery)20,21です。海域では、エリスロマイシンは、しばしば伴って anhydroerythromycin Ery A (- H2O)、dehydrate22,23で。エリスロマイシンからの水の除去は、酸に不安定なためです。Anhydroerythromycin 対エリスロマイシンの比率は、pH24,25,26,27に依存します。
化学的に、マクロライド系を含む macrocylic ラクトンは様々 な糖鎖が接続されている、例えば。、desosamine、cladinose、または mycaminose。マクロライドは、発酵プロセスから天然物を化学的に変更が、彼ら多くの場合混合物として存在しています。種と呼ぶ A、B、C、等。、砂糖の置換基が異なります。糖鎖と、ラクトンで自分の位置、マクロライド28,29の作用のモードを担います。環境に害を最小限に抑える、水生環境27,30,31,32に入る前に医薬品を完全に石化することが望ましいです。
この研究の最初の部分を扱う表面海水は、医薬品の検出排水と公海の監視のために重要であります。さまざまな種類の行列のマイクログラム範囲で正体不明の物質を検索するため非ターゲット分析、選択20,33,34,35の方法です。特に、高速液体クロマトグラフィー (HPLC) エレクトロ スプレー イオン化四重極でその特異性と感度のための特別な値の飛行質量分析法 (高速液体クロマトグラフィー-ESI-Q-TOF-MS) の時間を証明されています。感度がさらに物質の同定が拡張する対象となる MS を用いた四極子による選択モードで運営し、衝突セル内衝突エネルギーは 0 に設定。したがって、イオンに到着する断片化されていない TOF 検出器。
この作品の第二の重点は、エリスロマイシンの除去です。いわゆる高度な酸化プロセス (AOPs) は使用される医薬品の除去、 e.g。、UV ライト36,37,38照射による開始。分解に不可欠な真空紫外光による水からヒドロキシルラジカルの形成である UVC 照射次の式 1/。
H2O + hν(< 200 nm) → H2O * → H. + .ああ (1)
水酸基ラジカル物質36,37の劣化に積極的に貢献する 2.8 V、高い酸化電位を持っています。
ここでは、真空 UV/紫外線照射水を用いたエリスロマイシンの劣化は pH の影響を考慮して説明されています。さらにもっと危険な製品の形成は、AOPs39,40を使用しての欠点と思われます。したがって、医薬品の完全な鉱化作用まで照射することが重要です。照射時間を反応の速度論的モデルを適切に推定するには、反応速度定数と半減は、初期の薬物とその紫外線の両方に決定されます。この目的のため濃度-時間 (c t) プロットは HPLC ESI Q TOF MS 測定から派生し、MATLAB を用いた化学反応速度論モデルと比較していた。劣化の速度が優先順に従って進むし、紫外線は、連続またはそれ以降のフォロー アップ反応27,41の中間生成物として記述されていた。
プロトコル
1. 前処理: 固相抽出
- 約 1 リットルのサンプルの準備のための水を収集します。
- 粗粒子を除去する 2 μ m の孔径のブルー ・ バンド フィルターの上、サンプルをフィルター処理します。
- メタノールと純水 3 mL 3 mL を使用して SPE カートリッジを平衡します。
- SPE カートリッジに濾液 (1 L) を適用し、適度な真空、例えばを使用して流速を高める。、ダイヤフラム ポンプ。
注: 複数の SPE カートリッジは、並列に実行できます。 - 3 ml の超純水水サンプルを洗います。
- 3 ml のメタノール カートリッジ ソルビン酸から検体を溶出します。
- 3 mL の溶出液をロータリーエバポレーターを使用して乾燥を集中します。
- 1 mL の純水に溶解します。
- シリンジ フィルターを通してソリューションをフィルター、高速液体クロマトグラフィー ESI Q TOF MS による非対象と解析のための瓶で保管します。
2. 高速液体クロマトグラフィー-ESI-Q-TOF-質量分析法、非ターゲット、ターゲットを絞った分析、および MS/MS
- 高速液体クロマトグラフィー ESI Q TOF MS オートサンプラー バイアルを転送します。
- 高速液体クロマトグラフィー-ESI-Q-TOF-MS のすべての関連するパラメーター (表 1) を設定します。
注: 有限の衝突エネルギーが使用されている場合すなわち。、衝突エネルギー (CE) ≠ 0、イオンが断片化されます。このモードは、ターゲットを絞った MS/MS 法に対応します。 - 測定を開始します。
- 結果として得られるクロマト グラムとマススペクトルを分析します。
3. 紫外線照射実験
- 抗生物質の化合物は、例えばエリスロマイシン (750 mg/L)、20 mg/L の最終濃度で純水を溶解します。
- ソリューションの 750 ml のアルミ箔に包まれて、1 L 触媒反応管を埋めます。
- 原子炉に 15 W の電力を提供するランプをご紹介します。
- 500 rpm でマグネチックスターラーを適用します。
- 3-4、6-7 または 8-9 HCl (0.1 M) の NH3 (0.1 M) 必要な場合を滴下することによって目的の値に pH 値を調整します。pH 6-7 は例として使用されます。
- 注射器を使用して 0 時にサンプルとして反応溶液 2 mL を取るし、2 mL バイアルに転送。
- UV ランプのスイッチし、の経過時間を追跡します。
注: 10 分の照射時間が十分多い。光化学反応の完全性が必要な場合 2 番目の実験シリーズは最初のシリーズの結果を使用して記録する必要があります。
注意: 紫外線照射は、失明につながることがあります。 - すべての 30 のソリューションから 2 mL サンプルを描く s 最初の 5 分間。その後、すべての 60 のサンプルを取る実験終了時まで s。2 mL バイアルにサンプルを転送します。
- -4 ° C で高速液体クロマトグラフィー ESI Q TOF 質量分析までバイアルを保存します。
- 手順 2 で説明した方法と高速液体クロマトグラフィー ESI Q TOF MS を使用して 16 のサンプルを分析します。
4. カイネティクス解析
- MATLAB R2016b のカーブ フィット ツールボックスなど適切なソフトウェアを準備します。
- 親抗生物質の最初順序の動力学に従って化合物の光誘起劣化の時間データ対質量領域に収まるよう、参照してください 2 の eq42,43
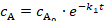 (2)
(2)
濃度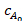 B に最初の反応ステップ A から educt A、速度定数k1と反応時間tの実際の濃度cの初期濃度を参照
B に最初の反応ステップ A から educt A、速度定数k1と反応時間tの実際の濃度cの初期濃度を参照 - 対時間のカーブ質量領域に収まるよう、3 と 4 の eq を使用して分解、すなわち連続またはそれに続くフォロー アップ反応の中間体として記述することができます、製品 B または C 反応によるとモデル →B → C → d。
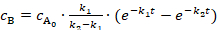 (3)
(3)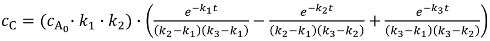 (4)
(4)
濃度cBおよびcC中間体 B および C を参照してくださいk、2k3 C、D に C に対応する速度定数 B - 照射時間は写真製品の劣化を観察するのに十分ではなかった場合、データに合うように式 5 を使用します。この degradate は、濃度CD速度定数を取得する最終的な製品開発として扱うことができます。
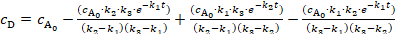 (5)
(5)- B 式 3 ではなく 6 の eq を使用して反応が B で終了した場合の濃度を計算します。C が最終的な製品の場合は、式 4 ではなく 7 の eq によると C の濃度を計算します。
 (6)
(6) (7)
(7)
- B 式 3 ではなく 6 の eq を使用して反応が B で終了した場合の濃度を計算します。C が最終的な製品の場合は、式 4 ではなく 7 の eq によると C の濃度を計算します。
- 半減期t1/2の 8 の eq を使用します。
 (8)
(8)
結果
固相抽出の結果として暗い緑のソリューションに黄色がクロロフィルを含むの存在を示されているすべてのケースで得られた物質 (図 1)。この水のサンプルに含まれる医薬品がその濃度から目に見える着色につながるだろうし、その吸光度は、一般的に低すぎるでしょう。医薬品の発生では、高速液体クロマトグラフィーと高分解能質量分析法を使用して分析する必要があります。
非ターゲット分析、高速液体クロマトグラフィー-ESI-Q-TOF-MS が各化合物のイオンのための正確な質量を取得することができますその卓越した質量精度のため使用されました。実行される分析の質量検出クロマト グラムは、クロマト グラフの分離のコースに記録されている各質量スペクトルの最も強烈なピークを表示する基本ピーク クロマト グラム (BPC)、表されました。図 2に示す例では、ライン川から水のサンプルの BPC を示します。
売り込みには、異なる m/z 値、7 件は、BPC でマークされた、それ故にさまざまな化合物を反映して 25 歳以上ピークが含まれています。物質が不明な先験的頃、分子式を導出する通常識別する最初のステップで構成されます。同位体パターンは環境試料中濃度を低いサンプルのためのすべてのケースでは観測されないことが、これは正確な質量と TOF 検出によって提供される同位体パターンによって実現されます。ドイツ環境庁 (姥) 約 630 化合物を含む環境で医薬品などの公共データベースの助けを借りて、候補者の小さなグループの予備 id が成功した多くの場合。最終的な証拠のためか、市販の基準との比較を行うことができるまたは MS/MS の断片化パターンは、考慮されるかもしれない (図 3)。
この作品は、保存期間に関する基準との比較は非常に多くドイツの地表水は、医薬品の同定を占めています。これらの物質は、メトプロ ロール、β ブロッカー、カルバマゼピン、鎮痛薬、マクロライド系抗生物質のエリスロマイシン A A. エリスロマイシンは、さらに本研究で検討した例として機能の派生物 anhydroerythromycin に含まれます。研究のライン川サンプルいた 7.6 の pH および 16.5 ° c. の平均温度この pH では、試料水に存在する anhydroerythromycin を予想でしょう。詳細な分析のための試料水抽出イオン クロマト グラム (Eic) は基準 (図 4) と比較しました。
比較は、メトプロ ロール、カルバマゼピン、anhydroerythromycin の保持時間と観測の analytes の良い一致を示しています。参照の標準的な anhydroerythromycin の EIC には、2 つのピーク、脱水がエリスロマイシンの 2 つの異なるサイトで起きた 2 種類の化合物が表示されます。しかし、1 つだけ anhydroerythromycin の異性体はライン川のサンプルで確認されました。エリスロマイシン自体のみトレースに存在していた。したがって、MS/MS スペクトルを取得できませんでした。抗生物質とその dehydrate の正確な質量は、表 2に与えられています。EIC、従って m/z 値と保持時間、メトプロ ロール、carbamazepin を使用してライン川サンプルではエリスロマイシンと anhydroerythromycin を識別できます。
水生環境について、下水処理場を通過し、地表水に入るから医薬品を防ぐために重要です。効果的な除去のための探求、異なる pH 値で紫外線照射実験を行ったエリスロマイシンの例として。濃度-時間 (t c) 図は対時間質量領域を使用して記録された Eic に由来するプロット。劣化は、式 2 によって記述されていた。エリスロマイシンは、エリスロマイシン A および B および anhydroerythromycin A の後者の 2 つの異性体で構成されます。エリスロマイシン A の計算適合c t曲線は図 5のとおりです。PH 7 で加速の低下が観察されました。これは、すべて 4 つの化合物を学び、示されていないデータに適用されます。結果として、エリスロマイシンの光誘起劣化は、中性 pH の周り実施されなければなりません。ライン川のサンプルの場合、pH 調整は必要でした。
医薬品の紫外線も特定されたすべての 3 つの pH 値であった。彼らの対応する構造の提案と紫外線の概要については、表 3 で与えられます。紫外線、m/z 製品の速度論的解析の例として 720 サーブを =。紫外線は、反応中間体としてよく記述できます。したがって、紫外線は、aconsecutive とそれに続くフォロー アップの反応の面で記述されていた。中間体の結果の種類の決定は、適切なソフトウェア、(2R) の係数と残差平均二乗誤差 (RMSE) が基準として撮影された計算適合に基づいています。エリスロマイシンは、酸不安定、という事実のために分解される照射時に照射する前にプレゼントをされました。方程式 3 と 4 の結果は、有限の開始濃度だった。したがって、要因は、方程式に追加されました。図 6に示す実験データとフィットは、3 と 4 式に従って計算されます。
中間のこの例は、指数関数的減衰が続く s 字の上昇と集中の増加を示した。これはそれに続くフォロー アップの反応中間体の指標です。連続反応中間体では、s 字状の増加は表示されません。統計品質パラメーターはまたそれに続くフォロー アップ反応モデルによるとフィットの若干優れた契約を示されます。連続反応の定量 R2の係数 0.9898、0.9976 をされているそれに続くフォロー アップの反応のそれより低く、従って。したがって、検査された紫外線は、その後フォロー アップの反応の中間体として解釈されました。K 値に起因する計算のフィットと同様、半減期が計算される次の方程式 5。すべての関連する速度論的パラメーターは表 3に収集されます。
最速の劣化は、pH 7、pH 3 (図 5) の遅い低下を認め、pH 9、続いてで観察されました。この発見は、形成と観測の劣化にも適用されます。3 紫外線が観察されました。M/z 値が 750.46 Ery F、Ery c 720.45 ・ DPEry192、エリスロマイシンの構造 (図 7) の glycosidically バインドされた砂糖に 192.12 に対応します。紫外線の劣化でなかった DPEry192 の pH で 3 と 9 と Ery f pH 9 で。これらの場合、照射時間は長く、中間製品の総低下を観察するのに十分でした。それにもかかわらず、生成速度定数は、式 5、最終製品に対応するを使用して判断でした。

図 1.SPE (左) 後ライン川からのサンプルの比較と超純水 water(right) 治療。緑の着色はの示しているクロロフィル含有物質。この図の拡大版を表示するのにはここをクリックしてください。

図 2.SPE 測定高速液体クロマトグラフィー ESI Q TOF さん後水サンプルの BPCすべてのクロマト グラムは、最高峰に正規化されました。説明 m/z の値は対応する MS スペクトルから得られるマークされます。この図の拡大版を表示するのにはここをクリックしてください。
図 3.エリスロマイシン A の Q TOF MS スペクトル (下) とイオン m/z MS/MS スペクトル 734.4689 (トップ) を =。スペクトルは 30 eV 適用衝突エネルギーでエリスロマイシン A その同位体パターンとフラグメントの擬分子イオンを示します。この図の拡大版を表示するのにはここをクリックしてください。
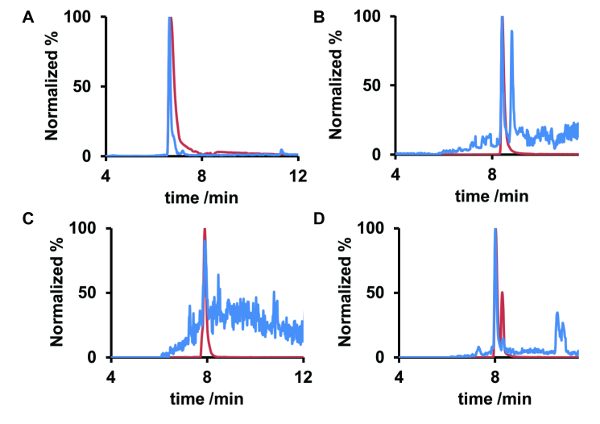
図 4.(A) メトプロ ロール、カルバマゼピン (B)、(C) エリスロマイシン A および (D) anhydroerythromycin A ライン川サンプル (青) では、参照化合物 (赤) から純水の Eic を正規化します。参照化合物と水サンプルにおける医薬品のものの保持時間は、同じです。メトプロ ロール (A) と anhydroerythromycin (D) の信号対雑音比は、カルバマゼピン (B)、後者の跡でだけ存在していたことを示しますエリスロマイシン (C) のものよりも高くなっています。この図の拡大版を表示するのにはここをクリックしてください。
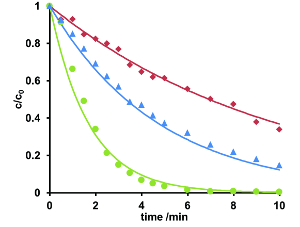
図 5.エリスロマイシン A 3 (赤)、pH 7 (緑) と pH 9 (青) での光分解におよぼす濃度-時間曲線を正規化します。ソリューションは、10 分間照射しました。Ph 7、エリスロマイシンは、サンプルから完全に削除されました。一次運動方程式を用いた濃度-時間曲線を記述する可能性があります。反応速度定数が 0.10 (pH 3) 0.59 (pH 7) = 0.21 (pH 9)。この図の拡大版を表示するのにはここをクリックしてください。

図 6.エリスロマイシン m/z の photoprodegradates の濃度-時間曲線のフィットの比較 = ph 9 720 次方程式 (A) と (B) 4 3 。連続反応 (A) 適合の: R2 = 0.9898、RMSE = 4.645E + 04 とその後のフォロー アップの反応 (B): R2 09976、RMSE を = = 2.366E + 04。この図の拡大版を表示するのにはここをクリックしてください。
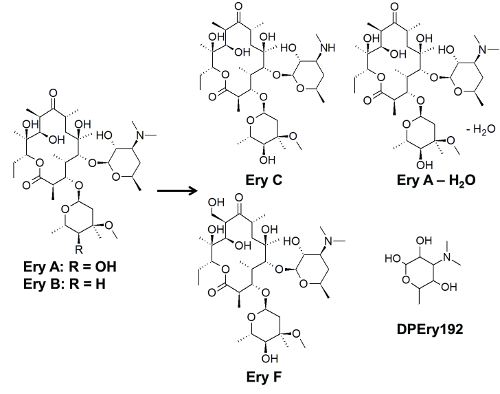
図 7.自社 photdegradation 製品と anhydroerythromycin B エリスロマイシン エリスロマイシン A の構造します。この図は、フォークトらから変更されています。27. 製品の UVC 照射 10 分後形成され、HPLC Q-TOF MS、MS さんを使用して識別されますこの図の拡大版を表示するのにはここをクリックしてください。
| 液体クロマトグラフィー | ||||||
| 列: | 逆相 C-18 | |||||
| 列: | CoreShell 列; | |||||
| 列: | 2.6 μ m 粒子径 50 mm x 2.1 mm 寸法 | |||||
| カラム温度 | 40 ° C | |||||
| 注入量: | 5 Μ L | |||||
| フロー: | 0.3 mL/min | |||||
| 移動相: | 溶剤 a: 水含む 0.1% ギ酸 | |||||
| 0.1% ギ酸を含む溶剤 b: メタノール | ||||||
| グラデーションのプログラム: | ||||||
| 時間最低 | 0 | 1 | 10 | 11.1 | 11.2 | 12 |
| A:B 溶媒の比 | 性ストリーマ | 70: 30 | 25: 75 | 1:99 | 1:99 | 性ストリーマ |
| 質量分析法 | ||||||
| ソース: | デュアルの AJS ESI (肯定的なモード) | |||||
| ガスとソース | ||||||
| ガス温度 | 300 ° C | |||||
| 乾燥ガス: | 8.0 L/分 | |||||
| ネブライザー: | 14 psig | |||||
| シース ガス温度: | 300 ° C | |||||
| シースフロー ガス: | 8 L/分 | |||||
| 質量範囲: | 100 - 1000 m/z | |||||
| アクイジション ・ レート: | 1 スペクトル/s | |||||
| 取得時間: | 1000 ms/スペクトル | |||||
| 過渡/スペクトル | 10014 | |||||
| 対象となる MS 法の | ||||||
| 衝突エネルギー (CE): | 0 eV | |||||
| 質量 - テーブルを優先 | 734.4685 | |||||
| MS/MS (通常自動 MS/MS モード) の | ||||||
| 衝突エネルギー (CE): | 30 eV | |||||
| 絶対しきい値 | 3000 カウント | |||||
| 相対しきい値 | 0.01% | |||||
| 質量範囲: | 100 - 100 m/z | |||||
| アクイジション ・ レート: | 1 スペクトル/s | |||||
| 取得時間: | 1000 ms/スペクトル | |||||
| 過渡/スペクトル | 9964 | |||||
| ターゲットを絞った MS/MS 法の | ||||||
| 質量 - テーブルを優先 | 734.4685 | |||||
テーブル 1。条件と水行列における医薬品の HPLC ESI Q TOF 質量分析のために使用するパラメーターです。2 つの分析間純粋な超純水のサンプルを実行する、またはすべての物質を溶出するためにガスクロマト グラフ法の実行時間を拡張を通じてガスクロマト グラフ実行の間洗浄のステップを導入することをお勧めします。
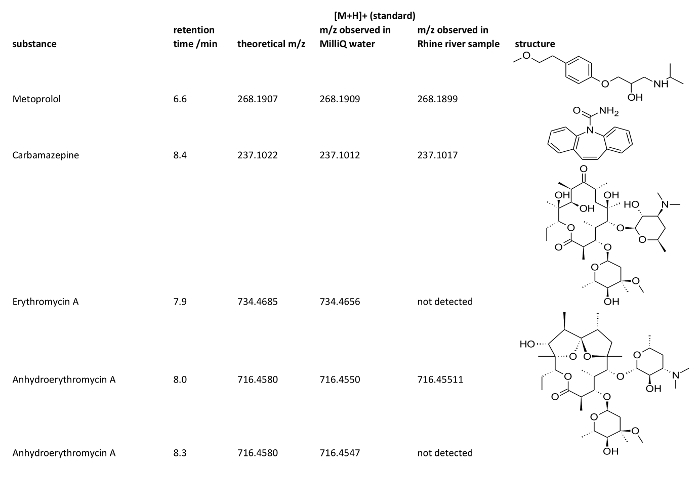
表 2。医薬品の保持時間は、理論的にライン川のサンプルで発見され、[M + H] を観察+ とその構造.ESI モードは陽性に設定されていたので、[M + H]+-イオンが検出されました。保持時間は、通常実験的知られている理由のため最小限に異なる場合があります。
| pH 3 | pH 3 | pH 7 | pH 7 | pH 7 | pH 7 | pH 7 | pH 7 | pH 9 | pH 9 | pH 9 | pH 9 | |
| 製品 | k1 [min-1] | t1/2 【 分 】 (1) | k1 [min-1] | k2 [min-1] | k3 [min-1] | t1/2 【 分 】 (1) | t1/2 【 分 】 (k2) | t1/2 【 分 】 (3k) | k1 [min-1] | k2 [min-1] | t1/2 【 分 】 (1) | t1/2 【 分 】 (k2) |
| Ery A | 0.1 | 6.81 | 0.59 | - | - | 1.18 | - | - | 0.21 | - | 3.37 | - |
| Ery B | 0.05 | 14.23 | 0.66 | - | - | 1.04 | - | - | 0.22 | - | 3.21 | - |
| Ery-H2Oa | 0.11 | 6.53 | 0.59 | - | - | 1.17 | - | - | 0.19 | - | 3.72 | - |
| Ery-H2Ob | 0.15 | 4.76 | 1.11 | - | - | 0.63 | - | - | 0.21 | - | 3.35 | - |
| Ery F | 認められなかった | - | 0.89 | 0.35 | - | 0.78 | 1.98 | - | 1.09* | - | 0.64 | - |
| Ery C | 未定 | - | 0.74 | 5.27 | 0.78 | 0.94 | 0.13 | 0.89 | 0.17 | 0.18 | 4.04 | 3.92 |
| DPEry192 | 0.35* | 1.97 | 認められなかった | - | - | - | - | - | 0.30* | - | 2.34 | - |
| * 以上の劣化観察 | ||||||||||||
表 3。反応速度定数とエリスロマイシンとフォークトから適応その紫外線の分解半減期対応する et al.27. エリスロマイシンは、エリスロマイシン A、エリスロマイシン B および anhydroerythromycin の 2 つのフォームで構成されます。3 紫外線が観察されました。そこ Ery F, Ery C DEry192 とに呼ばれます。
ディスカッション
このレポートで示した非ターゲット分析の例を示した HPLC ESI Q TOF MS、MS を使用して表面水における医薬品の識別/MS との比較は、最終的な証拠として基準を参照します。非対象と用いた TOF MS の強さは、特定の保持時間と予定の分子式の予測につながる高質量精度で全てのイオンの検出に基づいています。TOF 質量分析計の代わりに、水44汚染物質分析のため軌道イオン トラップのアプリケーションをされていた。分子式の予測は、基準をすばやく選択する開始点として使用されました。Q TOF MS 機器の対象となる MS 法の適用は、事前に選択されたイオンだけが四重極フィルターを通るので特定の化合物の検出を許可しました。一般にまた水分析45にトリプル四重極質量分析計を使用して解析が実行されます。機器の欠陥による理論的質量からの偏差を補うために標準の参照とガスクロマト グラフの比較が実行されます。ターゲットを絞った MS/MS 法は、同定解析で選択されるかもしれない。ここでは、イオンが選択されている断片化しているし、その断片が検出されました。MS/MS は MS よりも敏感なので, 水試料中医薬品の濃度が断片を生成する低すぎます。ただし、断片が検出された場合、化合物はより確実に識別できます。十分な感度は、初期の水サンプルの大量集中することで問題に対処できます。さらに、測定実施されなければならないサンプリング後できるだけ早く潜在的な分解46,47,48,49のため。それ以外の場合、サンプルは、化合物の分解や反応を除外する-20 ° C で格納する必要があります。
時々 同じ m/z 値は、別の保存時に表示されます。これは、そのため異性体はさまざまな分析技術を必要とする可能性があります。それは、化合物検出される可能性がないすべてでは、これは必ずしも彼らの不在を証明しないこともあります。彼らはフォーム イオンだけではない可能性があります。 または検出限界以下が発生します。水の種類は、医薬品の存在に影響を行使します。医薬品はほとんど排水処理植物48,50,51,52,53からの源水と下水処理水および廃水と比べて地下水を入力します。
光束またはランプのフルエンス率の光子は劣化と劣化のメカニズムに大きく貢献して以来劣化実験のため照射ソース、事前に特徴する必要があります。おそらく、真空紫外光/紫外線ランプの初期の試みでは、低圧水銀ランプで十分です。一般的には、過酸化水素、H2O2添加は劣化27,36,37,54を加速します。別のランプ、例えばとき UVA ランプを使用すると、ヒドロキシラジカルの形成を確保する、例えば、。、二酸化チタン23,24,30,の添加で。31. 医薬品自体の反応性の写真ではなく、エリスロマイシン、OH ラジカルなど多くの化合物のも劣化を誘発する種27です。
カイネティック ・ パラメーターの測定、照射時間と濃度を表す質量検出クロマト グラム信号の領域がプロットされます。データに合わせて、適切なソフトウェアを使用することをお勧めします。ここでは、MATLAB の曲線のフィッティング ツールに使用された、できる迅速に計算し、正しい方程式データに適合。中間体の運動より複雑な数式によって決定されます。フィット感、すなわち品質パラメーター。、R2および RMSE、同様得られたすぐに。
この研究では、検出して医薬品の汚染物質と純水のエリスロマイシンの光分解を識別する河川水の分析を示した。地表水などの環境水の異なる劣化速度と速度定数は humins などの物質を吸収する光のためなります。著者の経験によると劣化は、しばしば起こるよりゆっくりと、しかし時々 同等の料金41,56。
水生環境の結果の危険性、特に抗生物質医薬品の世界的な問題は、1の成長を続けています。多様化や化学物質、代謝産物の多様性と分解等をターゲットとした解析環境57年の発見の最も重要な解析の武器になります。効果的な除去、下水処理場における新しい段階は高度な酸化プロセスに基づいて設計する必要があります、UV を照射する部分があります。
開示事項
著者は競合する金銭的な利益を宣言しません。
謝辞
メラニー フォークトは Niederrhein 大学の応用科学の Promotionskolleg から奨学金に感謝しています。著者らは、さらに支援のための機関をありがとうございます。
資料
| Name | Company | Catalog Number | Comments |
| Methanol for liquid chromatography LiChrosolv | Merck | 1060181000 | |
| formic acid | Fluka | 94318 | |
| HCl | Riedel-de Haen | ||
| NH3 | Riedel-de Haen | ||
| Simplicity 185 Water Purification System | EMD Millipore | for producing MilliQ-water | |
| Erythromycin | BioChemica AppliChem | A2275,0005 | |
| Filter Rotilabo-filter, Typ 113A | Roth | AP78.1 | |
| SPE-Cartridges Oasis HLB 3cc (60mg) | Waters | WAT094226 | |
| BAKER SPE-12G | J.T. Baker | ||
| membrane pump PC3001 VarioPro | Vacuubrand | ||
| rotary evaporator; Laborota 4000 efficient | Heidolph Instruments | ||
| syringe, 2 mL | Terumo | ||
| Nylon Syringe Filters Target2 | Thermo Scientific | 10301345 | |
| C-18 CoreShell column 50 mm x 2.1 mm dimensions, 2.6 μm particle size | Thermo Scientific | ||
| HPLC 1200 | Agilent | ||
| ESI-Q-ToF-MS 6530 | Agilent | ||
| photoreactor, UV Labor Reactor System 3 | Peschl Utraviolet GmbH | ||
| VUV/UVC-lamp, TNN 15/32, 15 W | Heraeus | ||
| pH-meter, pHenomenal pH 1100L | vwr | 662-1657 | |
| magnetic stirrer | Heidolph Instruments | ||
| MassHunter Workstation B.06.00 | Agilent | ||
| MATLAB R2016b | Mathworks |
参考文献
- Kümmerer, K. Antibiotics in the aquatic environment - a review - part I. Chemosphere. 75 (4), 417-434 (2009).
- Tijani, J. O., Fatoba, O. O., Petrik, L. F. A review of pharmaceuticals and endocrine-disrupting compounds: Sources, effects, removal, and detections. Water, Air, and Soil Pollution. 224 (11), (2013).
- Li, W. C. Occurrence, sources, and fate of pharmaceuticals in aquatic environment and soil. Environmental Pollution. 187, 193-201 (2014).
- Jones, O., Voulvoulis, N., Lester, J. N. Human pharmaceuticals in the aquatic environment a review. Environmental technology. 22 (12), 1383-1394 (2001).
- Carmona, E., Andreu, V., Picó, Y. Multi-residue determination of 47 organic compounds in water, soil, sediment and fish-Turia River as case study. Journal of Pharmaceutical and Biomedical Analysis. 146, 117-125 (2017).
- Kostich, M. S., Batt, A. L., Lazorchak, J. M. Concentrations of prioritized pharmaceuticals in effluents from 50 large wastewater treatment plants in the US and implications for risk estimation. Environmental Pollution. 184, 354-359 (2014).
- Chiffre, A., Degiorgi, F., Buleté, A., Spinner, L., Badot, P. -. M. Occurrence of pharmaceuticals in WWTP effluents and their impact in a karstic rural catchment of Eastern France. Environmental Science and Pollution Research. 23 (24), 25427-25441 (2016).
- Gros, M., Petrovic, M., Barceló, D. Wastewater treatment plants as a pathway for aquatic contamination by pharmaceuticals in the Ebro river basin (northeast spain). Environmental Toxicology and Chemistry. 26 (8), 1553-1562 (2007).
- Ibáñez, M., Borova, V., et al. UHPLC-QTOF MS screening of pharmaceuticals and their metabolites in treated wastewater samples from Athens. Journal of Hazardous Materials. 323, 26-35 (2017).
- Carmona, E., Andreu, V., Picó, Y. Occurrence of acidic pharmaceuticals and personal care products in Turia River Basin: From waste to drinking water. Science of the Total Environment. 484 (1), 53-63 (2014).
- Martínez, J. L. Antibiotics and Antibiotic Resistance Genes in Natural Environments. Science Mag. 321, 365-368 (2008).
- . World Health Organization Antimicrobial resistance - Global Report on Surveillance. Bulletin of the World Health Organization. World Health Organization. 61 (3), 383-394 (2014).
- Proia, L., Von Schiller, D., Alexandre, S., Balc, L. Occurrence and persistence of antibiotic resistance genes in river bio fi lms after wastewater inputs in small rivers. Environmental Pollution. 210, 121-128 (2016).
- Karthikeyan, K. G., Meyer, M. T. Occurrence of antibiotics in wastewater treatment facilities in Wisconsin, USA. Science of the Total Environment. 361 (1-3), 196-207 (2006).
- Prieto-Rodriguez, L., Miralles-Cuevas, S., Oller, I., Agüera, A., Puma, G. L., Malato, S. Treatment of emerging contaminants in wastewater treatment plants (WWTP) effluents by solar photocatalysis using low TiO2 concentrations. Journal of Hazardous Materials. 211, 131-137 (2012).
- Dela Cruz, N., Giménez, J., Esplugas, S., Grandjean, D., de Alencastro, L. F., Pulgarín, C. Degradation of 32 emergent contaminants by UV and neutral photo-fenton in domestic wastewater effluent previously treated by activated sludge. Water research. 46 (6), 1947-1957 (2012).
- Zuccato, E., Castiglioni, S., Bagnati, R., Melis, M., Fanelli, R. Source, occurrence and fate of antibiotics in the Italian aquatic environment. Journal of Hazardous Materials. 179 (1-3), 1042-1048 (2010).
- Castiglioni, S., Bagnati, R., Fanelli, R., Pomati, F., Calamari, D. Removal of Pharmaceuticals in Sewage Treatment Plants in Italy. Environmental Science and Technology. 40 (1), 357-363 (2006).
- Watkinson, J., Murby, E. J., Costanzo, S. D. Removal of antibiotics in conventional and advanced wastewater treatment: implications for environmental discharge and wastewater recycling. Water research. 41 (18), 4164-4176 (2007).
- López-Serna, R., Petrović, M., Barceló, D. Development of a fast instrumental method for the analysis of pharmaceuticals in environmental and wastewaters based on ultra high performance liquid chromatography (UHPLC)-tandem mass spectrometry (MS/MS). Chemosphere. 85 (8), 1390-1399 (2011).
- Christian, T., Schneider, R. J., Färber, H. A., Skutlarek, D., Meyer, M. T., Goldbach, H. E. Determination of Antibiotic Residues in Manure, Soil, and Surface Waters. Acta hydrochimica et hydrobiologica. 31, 36-44 (2003).
- Sacher, F., Thomas, F. Pharmaceuticals in groundwaters Analytical methods and results of a monitoring program in Baden-Württemberg, Germany. Journal of Chromatography. 938, 199-210 (2001).
- Kasprzyk-Hordern, B., Dinsdale, R. M., Guwy, J. Multi-residue method for the determination of basic/neutral pharmaceuticals and illicit drugs in surface water by solid-phase extraction and ultra performance liquid chromatography-positive electrospray ionisation tandem mass spectrometry. Journal of chromatography. A. 1161 (1-2), 132-145 (2007).
- Zuckerman, J. M. Macrolides and ketolides: azithromycin, clarithromycin, telithromycin. Infectious Disease Clinics of North America. 18 (3), 621-649 (2004).
- Hassanzadeh, A., Helliwell, M., Barber, J. Determination of the stereochemistry of anhydroerythromycin A, the principal degradation product of the antibiotic erythromycin A. Organic & biomolecular chemistry. 4 (6), 1014-1019 (2006).
- Hassanzadeh, A., Barber, J., Morris, G., Gorry, P. Mechanism for the degradation of erythromycin A and erythromycin A 2'-ethyl succinate in acidic aqueous solution. Journal of Physical Chemistry A. 111 (4), 10098-10104 (2007).
- Voigt, M., Jaeger, M. On the photodegradation of azithromycin, erythromycin and tylosin and their transformation products - A kinetic study. Sustainable Chemistry and Pharmacy. 5, 131-140 (2017).
- Delaforge, M., Jaouen, M., Mansuy, D. Dual effects of macrolide antibiotics on rat liver cytochrome P-450. Biochemical Pharmacology. 32 (15), 2309-2318 (1983).
- Hansen, J. L., Ippolito, J., Ban, N., Nissen, P., Moore, P. B., Steitz, T. The structures of four macrolide antibiotics bound to the large ribosomal subunit. Molecular Cell. 10 (1), 117-128 (2002).
- Xekoukoulotakis, N. P., Xinidis, N., et al. UV-A/TiO2 photocatalytic decomposition of erythromycin in water: Factors affecting mineralization and antibiotic activity. Catalysis Today. 151 (1-2), 29-33 (2010).
- Yuan, F., Hu, C., Hu, X., Wei, D., Chen, Y., Qu, J. Photodegradation and toxicity changes of antibiotics in UV and UV/H(2)O(2) process. Journal of hazardous materials. 185 (2-3), 1256-1263 (2011).
- Monteagudo, J. M., Durán, A., San Martín, I. Mineralization of wastewater from the pharmaceutical industry containing chloride ions by UV photolysis of H2O2/Fe(II) and ultrasonic irradiation. Journal of Environmental Management. 141, 61-69 (2014).
- Malik, A. K., Blasco, C., Picó, Y. Liquid chromatography-mass spectrometry in food safety. Journal of chromatography. A. 1217 (25), 4018-4040 (2010).
- Hu, C., Xu, G. Mass-spectrometry-based metabolomics analysis for foodomics. TrAC Trends in Analytical Chemistry. 52, 36-46 (2013).
- Castro-Puyana, M., Herrero, M. Metabolomics approaches based on mass spectrometry for food safety, quality and traceability. TrAC Trends in Analytical Chemistry. 52, 74-87 (2013).
- Parsons, S. . Advanced Oxidation Processes for Water and Wastewater Treatment. , (2004).
- Oppenländer, T. . Photochemical Purification of Water and Air: Advanced Oxidation Processes (AOPs): Principles, Reaction Mechanisms, Reactor Concepts (Chemistry). , (2003).
- Giannakis, S., Gamarra Vives, F. A., Grandjean, D., Magnet, A., De Alencastro, L. F., Pulgarin, C. Effect of advanced oxidation processes on the micropollutants and the effluent organic matter contained in municipal wastewater previously treated by three different secondary methods. Water Research. 84, 295-306 (2015).
- Fatta-Kassinos, D., Vasquez, M. I., Kümmerer, K. Transformation products of pharmaceuticals in surface waters and wastewater formed during photolysis and advanced oxidation processes - degradation, elucidation of byproducts and assessment of their biological potency. Chemosphere. 85 (5), 693-709 (2011).
- Vasconcelos, T. G., Henriques, D. M., König, A., Martins, A. F., Kümmerer, K. Photo-degradation of the antimicrobial ciprofloxacin at high pH: Identification and biodegradability assessment of the primary by-products. Chemosphere. 76 (4), 487-493 (2009).
- Voigt, M., Savelsberg, C., Jaeger, M. Photodegradation of the antibiotic spiramycin studied by high-performance liquid chromatography-electrospray ionization-quadrupole time-of-flight mass spectrometry. Toxicological & Environmental Chemistry. 99 (4), 624-640 (2017).
- Mauser, H. . Formale Kinetik. Experimentelle Methoden der Physik und der Chemie. , (1974).
- Connors, K. A. . Chemical Kinetics The Study of Reaction Rates in Solution. , (1990).
- Comtois-Marotte, S., Chappuis, T., et al. Analysis of emerging contaminants in water and solid samples using high resolution mass spectrometry with a Q Exactive orbital ion trap and estrogenic activity with YES-assay. Chemosphere. 166, 400-411 (2017).
- Gago-Ferrero, P., Borova, V., Dasenaki, M. E., Thomaidis, N. S. Simultaneous determination of 148 pharmaceuticals and illicit drugs in sewage sludge based on ultrasound-assisted extraction and liquid chromatography-tandem mass spectrometry. Analytical and bioanalytical chemistry. 407 (15), 4287-4297 (2015).
- Yang, C., Hsiao, W., Chang, B. Chemosphere Biodegradation of sulfonamide antibiotics in sludge. Chemosphere. 150, 559-565 (2016).
- Gartiser, S., Urich, E., Alexy, R., Kümmerer, K. Ultimate biodegradation and elimination of antibiotics in inherent tests. Chemosphere. 67 (3), 604-613 (2007).
- Guerra, P., Kim, M., Shah, a., Alaee, M., Smyth, S. Occurrence and fate of antibiotic, analgesic/anti-inflammatory, and antifungal compounds in five wastewater treatment processes. The Science of the total environment. 473, 235-243 (2014).
- Jelic, A., Gros, M., et al. Occurrence, partition and removal of pharmaceuticals in sewage water and sludge during wastewater treatment. Water Research. 45 (3), 1165-1176 (2011).
- Lin, A. Y. -. C., Tsai, Y. -. T. Occurrence of pharmaceuticals in Taiwan's surface waters: Impact of waste streams from hospitals and pharmaceutical production facilities. Science of The Total Environment. 407 (12), 3793-3802 (2009).
- Sun, J., Luo, Q., Wang, D., Wang, Z. Occurrences of pharmaceuticals in drinking water sources of major river watersheds, China. Ecotoxicology and Environmental Safety. 117, 132-140 (2015).
- Nikolaou, A., Meric, S., Fatta, D. Occurrence patterns of pharmaceuticals in water and wastewater environments. Analytical and Bioanalytical Chemistry. 387 (4), 1225-1234 (2007).
- Gao, P., Ding, Y., Li, H., Xagoraraki, I. Occurrence of pharmaceuticals in a municipal wastewater treatment plant: Mass balance and removal processes. Chemosphere. 88 (1), 17-24 (2012).
- Andreozzi, R., Caprio, V., Insola, A., Marotta, R. Advanced oxidation processes (AOP) for water purification and recovery. Catalysis Today. 53, 51-59 (1999).
- Fernández, C., Callao, M. P., Larrechi, M. S. Kinetic analysis of C.I. Acid Yellow 9 photooxidative decolorization by UV-visible and chemometrics. Journal of hazardous materials. 190 (1-3), 986-992 (2011).
- Voigt, M., Bartels, I., Nickisch-Hartfiel, A., Jaeger, M. Photoinduced degradation of sulfonamides, kinetic, and structural characterization of transformation products and assessment of environmental toxicity. Toxicological & Environmental Chemistry. 99 (9-10), 1304-1327 (2017).
- Hoff, R., Mara, T., Diaz-Cruz, M. Trends in Environmental Analytical Chemistry Trends in sulfonamides and their by-products analysis in environmental samples using mass spectrometry techniques. Trends in Environmental Analytical Chemistry. 9, 24-36 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved