Method Article
バイオ エンジニア リング アプリケーション用先端材料の抗菌特性
要約
先端材料の抗菌性の特性のためのプロトコルを提案します。お互いを補完する 2 つの方法によって材料表面に抗菌活性を測定するここでは、: 1 つは寒天ディスク拡散テストに基づいており、他の ISO 22196:2007 ノルムに基づく標準的な手順です。
要約
強化されたプロパティを持つ新しい材料の開発バイオ エンジニア リング アプリケーションの広い範囲で重要となっています。したがって、医用生体組織工学、ドラッグデリバリー制御などに必要な特定の環境を模倣する多くの新規の生体材料をデザインされています。細胞や酵素の固定化のための改良された特性を持つ素材の開発は、バイオ プロセス工学の現在の研究テーマもです。ただし、これらのアプリケーションで材料の最も望ましい特性の 1 つは任意の望ましくない感染症を避けるために抗菌薬の容量です。これは、(i) 寒天ディスク拡散テスト (拡散法)、(ii) (接触部材表面の抗菌活性を測定する ISO 22196:2007 ノルムに基づく材料の抗菌性の特性の容易に続くプロトコルを提案します。メソッド)。このプロトコルは、微生物の広い範囲をカバーするグラム陽性およびグラム陰性の細菌と酵母を使用して実行する必要があります。例として 4 材料別の化学的性質は、カンジダ大腸菌、黄色ブドウ球菌に対してこのプロトコルを次テストされます。これらのテストの結果は、最初の材料と他の 3 材料のグラム陽性およびグラム陰性菌に対して抗菌活性を増加のため非抗菌活動を展示します。ただし、4 の材料のどれもカンジダの成長を阻害することができます。
概要
インプラントの失敗はしばしば抗菌薬の予防投与と無菌作業条件にもかかわらず発生する微生物の感染症の結果です。この問題は非常に高い医療費を引き起こして、患者1の間で悲惨です。黄色ブドウ球菌などの細菌現在カテーテルと他の医療用インプラントに関連する院内感染に非常に危険な病原体と見なされると、医療機器2の主な汚染物質が重要。したがって、新規抗菌戦略の開発は、毎日、医療用途のため緊急必要です。
抗生物質3、4アンモニウム化合物、酸化物5、抗菌ペプチド (アンペア)6などの抗菌剤。抗生物質は、細菌の抵抗7、抗生物質の過剰使用8上昇上にあるために効率が徐々 に。第四級アンモニウムは、ため微生物抵抗9のみ短期使用のため非常に効率的です。金属イオン ・酸化は非常に効果的な抗菌剤として長い間利用されてきた、包帯、水フィルター、塗料など10、11,12を含む多くの一般的な商用製品で使用されます。ただし、これらの種類の化合物が哺乳類細胞13のいくつかのタイプに有毒であることが実証されています。
アンプは、優れた抗菌、免疫調節特性14,15, を示し細菌16それらに対して抵抗を開発する非常に困難に見つけるように見えます。ただし、純粋なアンプを生成するプロセスは高価です;そのため、大量生産ではありません。このように、アンプの生産に問題がされているカウンターに戦略開発 (例えば、小さな分子抗菌 peptoid 模倣17、ペプチド18α-ペプチド19および β-ペプチド20)。メタクリル酸終わったポリペプチドおよび polypeptoids は、抗菌、防汚のコーティングのための21の合成されています。
純粋に材料などの新規抗菌薬の開発やハイブリッド フォーム、予防し、多剤耐性感染症を治療することがますます必要です。組織やバイオ エンジニア リングなど多くの工学分野のための新しい先端材料の広い範囲は、いくつかの方法を通じて最後の十年に化学と物理性の向上と開発されている: プラズマ重合の接ぎ木疎水性基材22,23,24、架橋密度25,26の仕立て、ソリューション27,28,29の重合,30、ポロジェン解散31,32, グラフェン酸化物 (GO)33,34,35,36などのナノ材料の採用によって、炭素ナノファイバー (Cnf)37。
これらの新しい材料の抗菌能力の研究の潜在的なバイオ エンジニア リングの適用性を高めることができる指数関数的に不可欠となっています、したがって、.このような新しい材料の抗菌性を定量化する容易に続くプロトコルを提案します。ここでは、サンプル準備の後 2 つの相補的な方法を続いている: 最初は寒天ディスク拡散テスト38 (拡散法) に基づいて、2 番目の抗菌活性を測定する ISO 22196:2007 ノルム39に基づいて材料表面 (連絡方法)。
プロトコル
1. サンプル準備
- 円筒パンチ直径 10 mm の 10 mm 径ディスクに物質的なサンプルをカットします。
注: 脆性材料することができます 1 時間適切な無菌溶剤で軟化し、ディスクにカットします。たとえば、亜鉛アルギン酸など親水性材料はこのプロトコルを次にテストされた、サンプルの破壊を避けるためにそれらを切断する前にオートクレーブ処理した水で潤った。ただし、poly(3-hydroxybutyrate-co-3-hydroxyvalerate) など他の疎水性材料には正しくカットするために以前腫れの任意の種類の必要はありません。 - 真空オーブンで 60 ° C でサンプル素材ディスクを乾燥 (< 10-2 Torr) 24 時間。
注: いくつかの材料は、高い乾燥温度を必要があります。ただし、材料が低下する可能性があります熱温度に達することが重要です。 - デジタル ノギスで基材フィルムの厚さを測定します。
メモ: 異なる材料の抗菌活性を比較するとき、このプロトコルは定数と同様の厚みをもつ膜の利用を推奨します。 - 各試験片をエタノール 10 分 70%、その後紫外線 (UV) 各側面ごとに 1 時間の浸漬で滅菌します。
注: 紫外線は UV-C 放射の 12.0 W ランプと層流フードの内部の滅菌シャーレに各試験片を置く実行できます。
注意: 研究者公開しないでください彼ら自身、紫外線に変異原性です。 - 1.1、1.2、1.3 と 1.4 の手順に従います。制御材料ディスク。
注: ポリエチレンテレフタル酸塩 (ペット) または代わりとなる非抗菌材料は、拡散や接点方式で制御ディスクとして使用することができます。さらに、ナノ複合体または扱われた材料を特性評価する際、基材は制御材料として使用ください。
2. 推奨微生物
注: 幅広い微生物に対してテスト済みの素材の抗菌能力を研究する 3 の異なる微生物の使用をお勧めします。
- 3 微生物の純粋培養を使用: グラム陽性菌の黄色ブドウ球菌、大腸菌、グラム陰性の細菌、カンジダ酵母。
注: 他の微生物種もテストできますこのプロトコルで必要に応じて培養条件を変更することによって。
注意: このプロトコルで採用されている微生物の種類によって必要なバイオ計測を従う必要があります。 - あらかじめ滅菌またはオートクレーブ材料と無菌条件を確保する (必要に応じて) 微生物操作または生物学的安全キャビネットの全体のプロセスの中にはブンゼン バーナーの使用します。
注: 推奨されるオートクレーブ条件働き材料および生物学的残基の 20 分間文化媒体の 121 ° C 15 分間 121 ° C をします。
3. 寒天ディスク拡散試験 (拡散法)
注: 抗菌化合物の液相拡散は、先端材料の主要な抗菌メカニズムかもしれない場合は、これらの材料の抗菌能力について非常に有用な情報が拡散法で提供できます。寒天プレートの中央にある材料のディスクは、微生物に対する増殖阻害が文化の 24 h 後発生します透明リング ゾーン (ハロー) を形作ることができる (図 1参照)。
-
拡散テストの手順
- 準備とオートクレーブ トリプシン大豆寒天 (TSA) を製造元の指示に従って。
- TSA をブンゼン バーナーまたは層流フードを用いた無菌条件下で滅菌シャーレに注ぎ。
注: TSA プレートは 4-6 mm の厚さである必要があります。 - 37 ° C でインキュベーターで TSA ペトリ皿で 18-24 h 好をテストする別の微生物を文化します。
- 準備とオートクレーブ トリプシン大豆スープ (TSB) 製造元の指示に従います。
- TSB をブンゼン バーナーまたは層流フードを用いた無菌条件下で殺菌済み血清ピペット 50 mL 殺菌済みの遠心管に注ぐ。
- 滅菌綿棒と渦を使用して滅菌遠心管に含まれる TSB の 3.1.3 で 25 mL のステップからの少数のコロニーを再停止しなさい均一な混合を達成するために 1 分のためにそれら。
- 吸光度を調整 (540 nm) mL あたり単位 (CFU) を形成するコロニーの適切な数を分光光度計と文化の: 約 1.5 × 108 CFU/mL の細菌と 1 x 106 5 × 106 CFU/mL 酵母から。
注: 吸光度を測定する文化とキュベット ボリュームは、分光光度計活用の種類に応じて選択する必要があります。 - 渦を 5 秒間微生物分散を改善し、簡単にこの菌懸濁液の滅菌綿棒を水没微生物のスープ。綿棒の文化を含む管壁に対してそれを押すことによって液体の超過分を削除します。
- 微生物と彼らの全体の表面をカバーし、接種後 5 分で乾燥させる 3 平面で TSA プレートの表面に滅菌綿棒で微生物液懸濁液を均等に連勝します。
注: する水分を除去する、TSA プレート必要があります配置するオープン接種前に 10-15 分の 37 ° C で逆位置に。 - 96% のエタノールをビーカーでそれらを浸すと、ブンゼン バーナー、アルコール バーナーとそれらを燃えるようなピンセットのペアを滅菌します。
- テストを行い、滅菌ピンセットのペアを使用して TSA プレートの中央にディスクを制御するサンプル ディスクを配置します。
- 24 h の 37 ° C で倒立位置で TSA プレート好孵化させなさい。
注: 任意の汚染のリスクを避けるためにお勧め倒立位置で TSA プレートをインキュベートします。ただし、サンプル ディスク TSA プレートから切り離すと場合、この手順を逆位置に実行しないでください。この場合、層流フードの版を乾燥することをお勧めします。この抗菌性試験は再現性を確保するため別の日に quadriplicate で少なくとも実行する必要があります。
-
菌懸濁液濃度・純度の確認
注: 次の手順がステップ 3.1.7 に分光光度計での微生物濃度が正しいことを確認し、微生物汚染がないことを確認するために必要です。文化の 24 h 後各種微生物コロニーの出現によって、微生物汚染を簡単に検出できます。さらに、否定的な TSB コントロール プレート シリアル希釈操作中に TSB 培地の微生物汚染を保障されなければなりません。- 無菌条件で適したオートクレーブ ヒントにマイクロ ピペットを使用して滅菌マイクロ遠心チューブ用に滅菌 TSB (3.1.4 の手順で準備) を調剤します。それらの 1 つは否定的な TSB コントロールとして使用されます。
- TSB を含む滅菌マイクロ遠心チューブ用のステップ 3.1.9 利用微生物スープ サスペンションを 10 進数のシリアル希薄を実行します。
- TSA プレート殺菌済み発病ヘラまたは代替手段を使用して各希釈の 100 μ L を広めます。また否定的な TSB コントロール プレートとして TSA 皿の上 (3.2.1 の手順で準備) 微生物なし TSB 培地の 100 μ L を広げます。
- 24 h の 37 ° C で好気的 TSA プレート好孵化させなさい。
- CFU/mL が類似 3.1.7 の手順で決定することを確認するコロニーの数をカウントします。
- コロニーの 1 種類のみで TSA プレートの微生物汚染がないことを確認してください。
- コロニーを示さない TSB ネガティブ コントロール プレートの微生物汚染がないことを確認します。
4. 部材表面 (連絡方法) の抗菌活性の測定
注: いくつかの材料の主要な抗菌メカニズム面接触かもしれないが場合、は、これらの材料の抗菌能力について非常に有用な情報が連絡方法で提供できます。この方法では微生物は材料の表面に直接配置され、一定の時間後、成長阻害を定めることができます。
-
最初の手順
- 準備とオートクレーブ TSB の製造元の指示に従います。
- TSB をブンゼン バーナーまたは層流フードを用いた無菌条件下で殺菌済み血清ピペット 50 mL 殺菌済みの遠心管に注ぐ。
- 好気的テストに異なる微生物が 37 ° C で軌道シェーカー (140 rpm) で TSB のチューブで一晩文化
- 希釈濃度約 10 の 50 mL 殺菌済み遠心管で TSB の 20 mL で一晩かけて培養6 CFU/mL (540 で分光光度計で nm)。
注: 吸光度を測定する文化とキュベット ボリュームは、分光光度計活用の種類に応じて選択する必要があります。 - TSB を含む滅菌マイクロ遠心チューブ用のこの文化の 10 進数のシリアル希薄を実行します。TSA プレート上のカルチャの 100 μ L を広がり、24 h の 37 ° C 好気的でそれを孵化させなさい。
- 約 1 × 106 CFU/mL の初期細胞濃度を確保するためコロニー数をカウントします。
- 24 h、24 h 滅菌 48 ウェル プレートの井戸を分離後、生菌数計測のためのテスト材料の種類ごとの 4 つのサンプル ディスク後生菌数計測の場所 4 コントロール ディスク。
- 各ディスクの表面に菌懸濁液の 150 μ L をピペットします。
-
微生物制御と供試材料を頼り (24 h) 後
- 4.1.6 のステップの後 24 h 37 ° C で 48 ウェル プレートで残り 4 のサンプル ディスク孵化させなさい好気性。
注: この 24 時間の培養時間は、短いまたは長い時間に成長阻害を研究するために変更できます。 - 培養 24 時間後 4 のサンプル ディスクの表面に滅菌 PBS の 850 μ L をピペットし、菌懸濁液の 150 μ L でそれをミックスします。
- 48 ウェル プレートから PBS/微生物懸濁液の混合物と各ディスクを収集し、10 mL 滅菌済みチューブにそれらを転送します。
- 渦 PBS/微生物懸濁液の混合物および 1 分の各ディスク超音波それ 50 hz 5 分と 1 分実行可能な微生物が残っていないか確認するために再度それは材料の表面に付着する渦。
- TSB を含む滅菌マイクロ遠心チューブ用の熱量の各カルチャの 10 進数のシリアル希薄を実行し TSA プレート上のカルチャの 100 μ L を広げるし、24 h の 37 ° C 好気的でそれを孵化させなさい。
- 各サンプルとコントロール ディスク表面に実行可能な微生物の数のコロニーの数を数えます。この数 (CFU/mL) 中の生菌数を表現します。
- サンプルやコントロール ディスクの最終的な微生物文化の写真を撮る。
- 4.1.6 のステップの後 24 h 37 ° C で 48 ウェル プレートで残り 4 のサンプル ディスク孵化させなさい好気性。
5. 抗菌結果分析
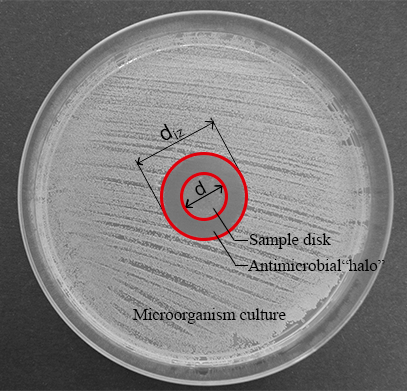
図 1: 抗菌"halo"の正規化された幅の値。このパネルには、抑制帯 (diz) の直径とディスク直径 (d) が表示されます。この図の拡大版を表示するのにはここをクリックしてください。
-
拡散解析の結果
- 抑制帯 (diz) の直径とディスク直径 (d) を測定 (図 1参照) デジタル ノギスで。
注: 抑制ゾーンまたは抗菌「ハロー」が抗菌素材ディスクによって生成される微生物の増殖抑制の結果として形成される (図 1参照)。それは、微生物が正常に成長しているプレートの残りの部分と比較してサンプルに近い透明リング ゾーンがあることを観察することが可能 (不透明帯)。 - 式 (1) を適用することによって抗菌各ディスクの"halo"(nwhalo) の正規化された幅を決定します。
(1)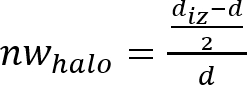
- 各サンプルの抗菌"halo"4 決定nwハロー値の正規化された幅の標準偏差と平均を決定します。
- 材料のディスクと最終的な微生物文化の写真を撮る。
注記: 抑制ゾーン (diz) の直径とディスク直径 (d) も測定できます 5.1.4 の手順で適切な画像処理ソフトウェアを使用して撮影した写真から。
- 抑制帯 (diz) の直径とディスク直径 (d) を測定 (図 1参照) デジタル ノギスで。
-
接触解析結果
- 式 (2) によると回復可能な微生物の数を決定します。
(2)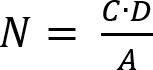
メモ: ここでは、 Nは試料; あたり cm2あたり回復可能な微生物の数Cはプレート カウント;Dは希釈係数;サンプル ディスク径決定 cm2で試験片の表面積です。 - 式 (3) を適用することによって細胞の成長の抑制を反映するように生存 (LV) の損失を決定します。
(3)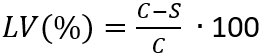
注: ここでは、C 実行可能な微生物 (N) の数の平均値にある CFU/mL•cm2、24 h; 後コントロール標本から回復S は、CFU/mL•cm2, 24 時間後に試験片から回復可能な微生物 (N) の数です。 - 平均値と標準偏差の各サンプルの 4 決定LV(%)値を持つ実行可能性の損失を決定します。
- 式 (2) によると回復可能な微生物の数を決定します。
結果
例として、このプロトコルを用いて、微生物を推奨、3 に対して異なる化学的性質を持つ 4 材料の抗菌能力をテストするため:黄色ブドウ球菌大腸菌カンジダ ・ アルビカンス.それはコントロール ディスク (C、イメージ表示されません) で発生した、寒天ディスク拡散実験 (拡散法) の結果展示 (M1) の最初の物質の非抗菌活性とグラム陽性およびグラム陰性菌に対して抗菌活性を増加M2、M3 および M4 (図 2参照) 他の 3 材料の細菌。
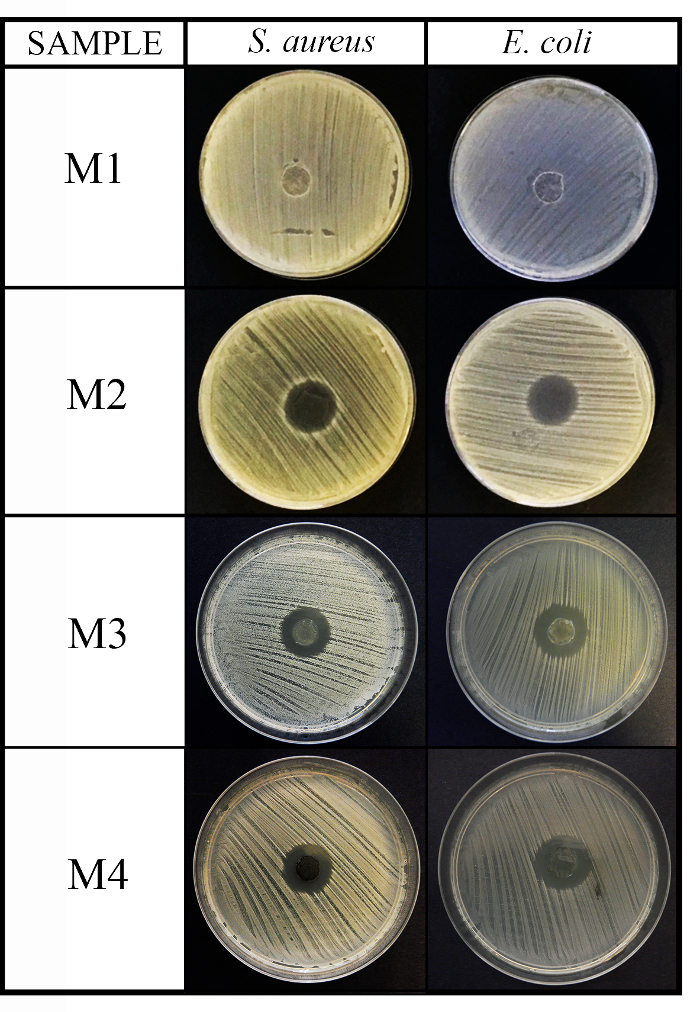
図 2: 抗菌拡散メソッドの結果。このパネルは培養 24 時間後 4 材料 (M1、M2、M3、および M4) ディスクの (x 1 mm 厚さ 10 mm 径) S の黄色ブドウ球菌と大腸菌に対して抗菌拡散メソッドを示しています。この図の拡大版を表示するのにはここをクリックしてください。
図 3では、正規化された幅が異なる抗菌"halo"(nwハロー) 材料のため別の例 M1、M2、M3、および M4 グラム陽性およびグラム陰性菌に対して式 (1) で計算を示しています。ただし、4 の材料のどれもは酵母カンジダ(画像表示されません) の成長を阻害することができた。
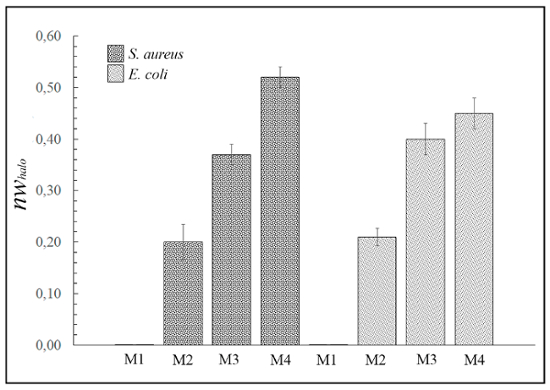
図 3: 抗菌拡散"halo"結果。このパネルは培養 24 時間後ディスクごとに材料 (M1、M2、M3、および M4) (厚さ 1 mm x 直径 10 mm) S の黄色ブドウ球菌と大腸菌に対して正規化された"halo"(nwhalo) を示しています。違いが統計的に有意 (p < 0.01)。しかし、M1 のサンプルは、抗菌活性を起こしません。この図の拡大版を表示するのにはここをクリックしてください。
連絡方法の結果はまた、コントロール ディスク (C) で陽性や他の 3 材料 (参照のグラム陰性菌に対する抗菌活性の増加に発生した (M1) の最初の物質の非抗菌活動を展示図 4)。

図 4: 抗菌メソッドの結果を連絡します。このパネルでは、黄色ブドウ球菌と大腸菌(希釈率 10-4) 培養 24 時間後 4 材料 (M1、M2、M3、および M4) 表面の抗菌活性アッセイの ISO 22196:2007 によるとそれぞれ 90 mm 平板を示しています。Cは培養 24 時間後コントロール ディスクからリカバリを実行可能な細菌です。この図の拡大版を表示するのにはここをクリックしてください。
このプロトコルで示されているように、生存率 (%) の損失は式 (2) と (3) によって決定された (図 5参照)。
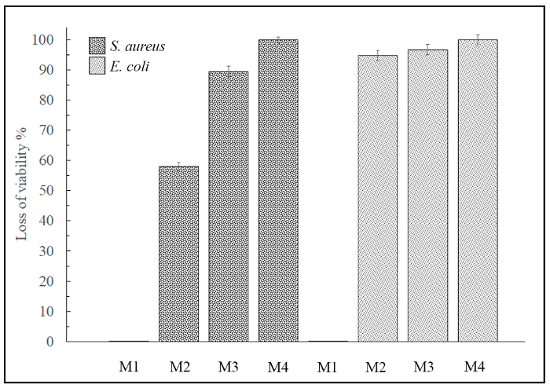
図 5: 接触法による生存率の損失。このパネルは、材料の表面に、M1、M2、M3、および M4黄色ブドウ球菌と大腸菌に対しての生存率 (%) の損失を示しています。サンプルの M1 は、抗菌活性を起こしません。この図の拡大版を表示するのにはここをクリックしてください。
ただし、4 材料のどれもはどちらか (画像表示されません) 接触法による酵母カンジダの成長を抑制することができた。したがって、これらの 4 材料の 3 グラム陽性およびグラム陰性菌に対して抗菌陽性を示した、従って非常に高い抗菌活性要件を持つ多くのバイオ エンジニア リング アプリケーションの役に立つかもしれない。ただし、4 材料のどれもは、酵母の成長を阻害することができた。
ディスカッション
2 既存手法に基づく 2 補足のプロシージャから成るこの容易に続くプロトコルによって分析できる新しい材料の抗菌性: 寒天ディスク拡散テスト38と抗菌活性測定ISO 22196:2007 ノルム39によると材料の表面。
この研究分野の文献で報告されている抗菌テストの多くは試金に強く依存しています。したがって、それは非常に詳細を持っていることが重要と一貫性のあるプロトコルが研究室。この記事は、その方向にステップです。さらに、多くの研究者がこの分野で経験の少ない、正確な結果を得るのために詳細なステップバイ ステップの手順を必要とするため非常に参考になるかも。
このプロトコルは、10 mm 径のディスク形状に切断材料の多くの種類で使用できます。脆性材料は、1 h 切削加工を容易にするための適当な溶剤で腫れすることができます。したがって、アルギン酸など親水性材料をオートクレーブ蒸留水で水和することができます。それらを切断する前に、1 h の疎水性材料をうねりにエタノール、ケトン、ジクロロ メタンなどの他の溶媒を用いることができます。ただし、poly(3-hydroxybutyrate-co-3-hydroxyvalerate) などのいくつかの材料を必要はありません、彼らは直接切ることができます。その後、真空オーブンでサンプル素材ディスクを乾燥し、エタノールと紫外線 1 h 汚染危険を避けるために各試料を滅菌することが重要です。
このプロトコルでは、微生物の広い範囲に到達する 3 微生物の純粋培養の培地使いとして TSA と TSB をお勧めします: グラム陽性菌の黄色ブドウ球菌、大腸菌、グラム陰性の細菌カンジダ酵母。ただし、代替文化メディアと異なる培養条件を必要と他の微生物もこのプロトコルで使用する。時に、新素材の抗菌活性の最初のアイデアを持っているだけ 1 微生物がテストされます。
微生物の種類は、メチシリン耐性表皮ブドウ球菌(MRSE) などの抗生物質耐性病原体に対してテストすべき異なる推奨 3 に対して強い抗菌活性を示す物質をこのプロトコルで正常に利用されています。多くの懸念を引き起こしている他の重要な耐性菌、グラム陰性菌のとバンコマイシン耐性腸球菌(VRE)、グラム陽性のメチシリン耐性黄色ブドウ球菌(MRSA)緑膿菌40,41。
このプロトコルでは、バイオ フィルム抑制と他の種類のウイルスや寄生虫などの微生物に対する材料の抗菌性をテストできません。ただし、このプロトコルは、先端材料の新しい抗菌薬の研究のための非常に有用な出発点を提供します。
抗菌寒天ディスク拡散テストの重要なステップは、サンプル ディスクが寒天メディアとの接触を得るとすぐいくつかの材料を折るためにプレートのセンターに配置する必要がある場合に発生します。この場合、慎重にこのサンプルを展開する滅菌ピンセットのペアを使用することをお勧めします。その一方で、連絡方法コントロールを洗浄することが重要、サンプル ディスク非常によく続いて活発なボルテックスと超音波がない実行可能な微生物を確保するために 4 回それらをピペッティングで PBS で残ります材料に付着表面。
このビデオのプロトコルは、バイオ プロセス工学、組織工学、ドラッグデリバリー制御、包装材、排水処理、農業、生体材料を使用するなど、多くの工学アプリケーションで活用できる、高望ましいの抗菌能力。
このプロトコルにより得られた結果は定性的な (画像) ・定量 (抗菌「ハロー」と実行可能性の損失の正規化された幅) (平均 ± 標準偏差) の再現性の良い分析。異なる材料を比較すると、拡散と接触解析結果で得られたこれらの平均値は続いてトルコのホックの記事の分析、場合は、統計学的に有意を検討するために一方向の分散分析によって分析されなければなりません。異なる (p < 0.01)。
開示事項
著者が明らかに何もありません。
謝辞
作者はバレンシア ・ カトリカ大学サン ビセンテ サンペドロマルティル山脈 2017 231 001UCV を通じてこの仕事のための金融支援を認識したいし、2018-231-001UCV を与えます。
資料
| Name | Company | Catalog Number | Comments |
| Cylindrical punch | 10 mm diameter | ||
| Petri dishes | soria genlab | P101 | 90 mm diameter, sterile |
| Tryptic soy agar (TSA) | Liofilchem | 610052 | Dehydrated medium 500 g (powder) |
| Tryptic soy broth (TSB) | Liofilchem | 610053 | Dehydrated medium 500 g (powder) |
| Sterile cotton swab | EUTOTUBO | 300200 | |
| Centrifuge tubes | VIDRA FOC, SA | 429900 | 50 mL, sterile |
| Ethanol | VWR | 83813360 | Absolute ethanol |
| Sterile 48-wells plate | COSTAR | 3548 | Flat bottom with lid, tissue culture treated, non-pyrogenic, polystyrene |
| A pair of tweezers | BRAUN | 24612036 | Toothless |
| Sterile phosphate buffered saline (PBS). | VWR | E404-100TAPBS | |
| Vaccum oven with a connected vacuum pump | JP Selecta, SA | 5900620 | |
| Laminar flow hood | TELSTAR Technologies, SL | TELSTAR AH-100 | 12.0 W lamp of UV-C radiation |
| Class II Biological safety cabinet | LABOGENE | MARS 1200 | |
| Incubator | ASTEC CO, LTD | SCA-165DR | |
| Vortex mixer | Biosan | V-1 Plus | |
| Spectrophotometer | Macherey-Nagel, Germany | Nanocolor UV/VIS II | |
| Bunsen burner | JP Selecta, SA | 7001539 | |
| Alcohol burner | VIDRA FOC, SA | 1658/20 | In case sterilisation is necessary to be performed inside class II biological safety cabinet |
| Orbital shaker | sartorius stedim | 8864845 | |
| Sonicator | SELECTA | 3000617 | 50/60 Hz |
| Digital calliper | ACHA | 17-260 | 0-150 mm |
| Serological pipette | Fisherbrand | 13-678-11 | 25 mL, sterile |
| Serological pipette | VWR | 612-4950 | 5 mL, sterile |
| Serological pipette | VWR | 612-5541 | 10 mL, sterile |
| Micropipette | GILSON | FA10005P | Pipetman L P200L, plastic 20-200 µL |
| Micropipette | GILSON | F123602 | Pipetman P1000, 200-1000 µL |
| Micropipette | GILSON | FA10016 | Pipetman L P12X300L, 20-300 µL |
| Micropipette tips | LABBOX | TIBP-200-960 | 2-200 µL |
| Micropipette tips | LABBOX | TIBP-1K0-480 | 100-1000 µL |
| Pre-sterilized tube | INSULAB | 301402 | 10 mL |
| Photo camera | Canon EOS 5D | Any camera with high resolution can also be utilized | |
| Gram-positive bacteria Staphylococcus aureus | strain V329 | Cucarella et al. J Bacteriol 183 (9), 2888–2896 (2001) | |
| Gram-negative bacteria Escherichia coli | Colección Española de Cultivos Tipo CECT | CECT 101 | |
| Yeast Candida albicans | Colección Española de Cultivos Tipo CECT | CECT 1394 | |
| Microcentrifuge tubes | DASLAB | 175508 | 1,5 mL |
| Autoclave | JP Selecta, SA | 4002136 | |
| Spectrophotometer-cuvettes | UVAT Bio CB | F-0902-02 | 4,5 mL |
| Drigalski spatula | LABBOX | SPRP-L05-1K0 | Sterile, disposable |
| glass balls (2 mm diameter) | Hecht Karl | 1401/2 | Autoclavable, alternative device to the Drigalski spatula |
| Autoclave bags | DELTALAB | 200318 | To sterilize microbiological residues or contaminated material |
| Electronic pipette filling device | JetPip | JET BIOFIL | |
| Laboratory bottle with ISO thread, graduated, borosilicate 3.3 | LABBOX | SBG3-100-010 | 100 mL, for autoclaving culture media |
| Laboratory bottle with ISO thread, graduated, borosilicate 3.3 | LABBOX | SBG3-250-010 | 250 mL, for autoclaving culture media |
| Laboratory bottle with ISO thread, graduated, borosilicate 3.3 | LABBOX | SBG3-500-010 | 500 mL, for autoclaving culture media |
| Laboratory bottle with ISO thread, graduated, borosilicate 3.3 | LABBOX | SBG3-1K0-010 | 1000 mL, for autoclaving culture media |
| Latex gloves | DENIA | 2278000000 | |
| Indicator tape for sterilization | LABBOX | STAP-A55-001 | Self-adhesive tape with impregnated paper turning to colour when exposed to sterilization process. |
| Universal test tube rack | LABBOX | MTSP-001-001 | To hold centrifuge tubes |
| Microcentrifuge tube rack | VWR | 211-0210 | To hold microcentrifuge tubes |
| Sterile loop | ACEFE S.A. | 100140055 | 10 µL of capacity for microbial culture |
| Material M1 | Universidad Católica de Valencia San Vicente Mártir (UCV) | Material type 1 | |
| Material M2 | Universidad Católica de Valencia San Vicente Mártir (UCV) | Material type 2 | |
| Material M3 | Universidad Católica de Valencia San Vicente Mártir (UCV) | Material type3 | |
| Material M4 | Universidad Católica de Valencia San Vicente Mártir (UCV) | Material type 4 | |
| Material C | Universidad Católica de Valencia San Vicente Mártir (UCV) | Control material |
参考文献
- Sydnor, E. R. M., Perl, T. M. Hospital epidemiology and infection control in acute-care settings. Clin Microbiol Rev. 24 (1), 141-173 (2011).
- Chessa, D., et al. Staphylococcus aureus and Staphylococcus epidermidis Virulence Strains as Causative Agents of Persistent Infections in Breast Implants. PLoS One. 11 (1), e0146668 (2016).
- Pandey, H., Parashar, V., Parashar, R., Prakash, R., Ramteke, P. W., Pandey, A. C. Controlled drug release characteristics and enhanced antibacterial effect of graphene nanosheets containing gentamicin sulfate. Nanoscale. 3 (10), 4104 (2011).
- Jia, Z., Shen, D., Xu, W. Synthesis and antibacterial activities of quaternary ammonium salt of chitosan. Carbohydr Res. 333 (1), 1-6 (2001).
- Liu, Y., Wang, X., Yang, F., Yang, X. Excellent antimicrobial properties of mesoporous anatase TiO2 and Ag/TiO2 composite films. Microporous Mesoporous Mater. 114 (1-3), 431-439 (2008).
- Wang, L., Chen, J., Shi, L., Shi, Z., Ren, L., Wang, Y. The promotion of antimicrobial activity on silicon substrates using a "click" immobilized short peptide. Chem Commun (Camb). 50 (8), 975-977 (2014).
- Kümmerer, K. Resistance in the environment. J Antimicrob Chemother. 54 (2), 311-320 (2004).
- Ng, V. W. L., et al. Antimicrobial hydrogels: A new weapon in the arsenal against multidrug-resistant infections. Adv Drug Deliv Rev. 78, 46-62 (2014).
- Hegstad, K., Langsrud, S., Lunestad, B. T., Scheie, A. A., Sunde, M., Yazdankhah, S. P. Does the Wide Use of Quaternary Ammonium Compounds Enhance the Selection and Spread of Antimicrobial Resistance and Thus Threaten Our Health?. Microb Drug Resist. 16 (2), 91-104 (2010).
- Rana, D., Matsuura, T. Surface modifications for antifouling membranes. Chem Rev. 110 (4), 2448-2471 (2010).
- Lok, C. N., et al. Proteomic analysis of the mode of antibacterial action of silver nanoparticles. J Proteome Res. 5 (4), 916-924 (2006).
- Chen, X., Schluesener, H. J. Nanosilver: A nanoproduct in medical application. Toxicol Lett. 176 (1), 1-12 (2008).
- Ahamed, M., AlSalhi, M. S., Siddiqui, M. K. J. Silver nanoparticle applications and human health. Clin Chim Acta. 411 (23-24), 1841-1848 (2010).
- Yeaman, M. R. Mechanisms of Antimicrobial Peptide Action and Resistance. Pharmacol Rev. 55 (1), 27-55 (2003).
- McLean, D. T. F., Lundy, F. T., Timson, D. J. IQ-motif peptides as novel anti-microbial agents. Biochimie. 95 (4), 875-880 (2013).
- Brogden, K. A. Antimicrobial peptides: Pore formers or metabolic inhibitors in bacteria?. Nat Rev Microbiol. 3 (3), 238-250 (2005).
- Ghosh, C., et al. Small molecular antibacterial peptoid mimics: The simpler the better!. J Med Chem. 57 (4), 1428-1436 (2014).
- Chongsiriwatana, N. P., et al. Peptoids that mimic the structure, function, and mechanism of helical antimicrobial peptides. Proc Natl Acad Sci. 105 (8), 2794-2799 (2008).
- Chen, Y., Mant, C. T., Farmer, S. W., Hancock, R. E. W., Vasil, M. L., Hodges, R. S. Rational design of alpha-helical antimicrobial peptides with enhanced activities and specificity/therapeutic index. J Biol Chem. 280 (13), 12316-12329 (2005).
- Porter, E. A., Wang, X., Lee, H. S., Weisblum, B., Gellman, S. H. Non-haemolytic beta-aminoacid oligomers. Nature. 404 (6778), 565 (2000).
- Gao, Q., Li, P., Zhao, H., Chen, Y., Jiang, L., Ma, P. X. Methacrylate-ended Polypeptides and Polypeptoids for Antimicrobial and Antifouling Coatings. Polym Chem. 8 (41), 6386-6397 (2017).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Gómez-Ribelles, J. L., Monleón-Pradas, M., Vidaurre-Garayo, A., Suay-Antón, J. Characterisation of macroporous poly(methyl methacrylate) coated with plasma-polymerised poly(2-hydroxyethyl acrylate). Eur Polym J. 43 (10), 4552-4564 (2007).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Monleón-Pradas, M., Gómez-Ribelles, J. L. Plasma-induced polymerisation of hydrophilic coatings onto macroporous hydrophobic scaffolds. Polymer (Guildf). 48 (7), 2071-2078 (2007).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Monleón-Pradas, M., Gómez-Ribelles, J. L., Rault, J. Thermal analysis of water in reinforced plasma-polymerised poly(2-hydroxyethyl acrylate) hydrogels. Eur Polym J. 72, 523-534 (2015).
- Monleón-Pradas, M., Gómez-Ribelles, J. L., Serrano-Aroca, &. #. 1. 9. 3. ;., Gallego-Ferrer, G., SuayAntón, J., Pissis, P. Interaction between water and polymer chains in poly(hydroxyethyl acrylate) hydrogels. Colloid Polym Sci. 279 (4), 323-330 (2001).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Monleón-Pradas, M., Gómez-Ribelles, J. L. Effect of crosslinking on porous poly(methyl methacrylate) produced by phase separation. Colloid Polym Sci. 286 (2), 209-216 (2008).
- Monleón-Pradas, M., Gómez-Ribelles, J. L., Serrano-Aroca, &. #. 1. 9. 3. ;., Gallego Ferrer, G., Suay Antón, J., Pissis, P. Porous poly (2-hydroxyethyl acrylate) hydrogels. Polymer (Guildf). 42 (10), 4667-4674 (2001).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Monleón-Pradas, M., Gómez-Ribelles, J. L. Macroporous poly(methyl methacrylate) produced by phase separation during polymerisation in solution. Colloid Polym Sci. 285 (7), 753-760 (2007).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Llorens-Gámez, M. Dynamic mechanical analysis and water vapour sorption of highly porous poly(methyl methacrylate). Polymer (Guildf). 125, 58-65 (2017).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Campillo-Fernández, A. J., Gómez-Ribelles, J. L., Monleón-Pradas, M., Gallego-Ferrer, G., Pissis, P. Porous poly(2-hydroxyethyl acrylate) hydrogels prepared by radical polymerisation with methanol as diluent. Polymer (Guildf). 45 (26), 8949-8955 (2004).
- Rodríguez-Hernández, J. C., Serrano-Aroca, &. #. 1. 9. 3. ;., Gómez-Ribelles, J. L., Monleón-Pradas, M. Three-dimensional nanocomposite scaffolds with ordered cylindrical orthogonal pores. J Biomed Mater Res - Part B: Appl Biomater. 84 (2), 541-549 (2008).
- Brígido-Diego, R., et al. Acrylic scaffolds with interconnected spherical pores and controlled hydrophilicity for tissue engineering. J Mater Sci Mater Med. 40 (18), 4881-4887 (2005).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Ruiz-Pividal, J. F., Llorens-Gámez, M. Enhancement of water diffusion and compression performance of crosslinked alginate with a minuscule amount of graphene oxide. Sci Rep. 7, 11684 (2017).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Deb, S. Synthesis of irregular graphene oxide tubes using green chemistry and their potential use as reinforcement materials for biomedical applications. PLoS One. 12 (9), e0185235 (2017).
- Sánchez-Correa, F., Vidaurre-Agut, C., Serrano-Aroca, A., Campillo-Fernández, A. J. Poly(2-hydroxyethyl acrylate) hydrogels reinforced with graphene oxide: Remarkable improvement of water diffusion and mechanical properties. J Appl Polym Sci. , (2018).
- Serrano-Aroc, &. #. 1. 9. 3. ;., Iskandar, L., Deb, S. Green synthetic routes to alginate-graphene oxide composite hydrogels with enhanced physical properties for bioengineering applications. Eur Polym J. 103, 198-206 (2018).
- Llorens-Gámez, M., Serrano-Aroca, &. #. 1. 9. 3. ;. Low-Cost Advanced Hydrogels of Calcium Alginate/Carbon Nanofibers with Enhanced Water Diffusion and Compression Properties. Polymers (Basel). 10 (4), 405 (2018).
- Bauer, A. W., Kirby, W. M. M., Sherris, J. C., Turck, A. M. Antibiotic susceptibility testing by a standardized single disk method. A J Clin Pathol. 45, 493-496 (1966).
- . . ISO Specification 22196: measurement of antibacterial activity on plastics surfaces. , 584 (2007).
- Taubes, G. The bacteria fight back. Science. 321 (5887), 356-361 (2008).
- Boucher, H. W., et al. 10 x '20 progress--development of new drugs active against Gram-negative bacilli: an update from the infectious diseases society of America. Clinical Infectious Diseases. 56 (12), 1685-1694 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved