Method Article
Antimicrobiens caractérisation de matériaux de pointe pour des Applications de bio-ingénierie
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous présentons un protocole pour la caractérisation antimicrobienne des matériaux avancés. Ici, l’activité antimicrobienne sur les surfaces des matériaux est mesurée par deux méthodes qui se complètent mutuellement : une repose sur le test de diffusion sur disque, et l’autre est une procédure standard basée sur la norme de 22196:2007 ISO.
Résumé
Le développement de nouveaux matériaux avancés avec des propriétés améliorées devient de plus en plus important dans un large éventail d’applications de la bio-ingénierie. Ainsi, de nombreux nouveaux biomatériaux est conçus pour imiter les environnements spécifiques requis pour des applications biomédicales telles que l’ingénierie tissulaire et de la livraison de drogue contrôlée. Le développement de matériaux aux propriétés améliorées pour l’immobilisation des cellules ou des enzymes est également un sujet de recherche actuels en génie des bioprocédés. Cependant, une des propriétés plus désirables d’un matériau dans ces applications est la capacité antimicrobienne pour éviter toute infection indésirables. Pour ce faire, nous présentons des protocoles facile à suivre pour la caractérisation antimicrobienne des matériaux à base de (i) le critère de diffusion disque agar (méthode de diffusion) et (ii) la norme de 22196:2007 ISO pour mesurer l’activité antimicrobienne sur les surfaces des matériaux (contact méthode). Ce protocole doit être effectué à l’aide de bactéries Gram-positives et Gram-négatives et la levure pour couvrir un large éventail de microorganismes. À titre d’exemple, 4 des matériaux avec différentes natures chimiques sont testés suivant ce protocole contre Staphylococcus aureus, Escherichia coliet Candida albicans. Les résultats de ces tests montrent une activité non antimicrobiens pour la matière première et en augmentant l’activité antibactérienne contre les bactéries Gram-positives et Gram-négatives pour les 3 autres matériaux. Toutefois, aucun des 4 matières sont capables d’inhiber la croissance de Candida albicans.
Introduction
Échec de l’implant est souvent une conséquence des infections microbiennes qui se produisent en dépit de la prophylaxie antimicrobienne et des conditions de travail aseptique. Ce problème est entraînant des coûts très élevés de soins de santé, est pénible parmi les patients1. Important des bactéries telles que Staphylococcus aureus sont actuellement considérés comme très dangereux agents pathogènes nosocomial infections liées aux cathéters et d’autres implants médicaux et sont les principaux contaminants des instruments médicaux2. Par conséquent, le développement de nouvelles stratégies antimicrobiennes est absolument nécessaire pour les utilisations quotidiennes et médicale.
Agents antimicrobiens incluent antibiotiques3composés d’ammonium quaternaire4, ions/oxydes métalliques5et peptides antimicrobiens (ampères)6. Antibiotiques deviennent progressivement moins efficaces en raison de la résistance bactérienne7, qui est à la hausse en raison de la surutilisation antibiotique8. Composés d’ammonium quaternaire ne sont plus très efficaces pour une utilisation à court terme en raison de la résistance microbienne,9. Les ions/oxydes métalliques ont été longtemps utilisés comme agents antimicrobiens très efficaces et sont utilisés dans nombreux produits commerciaux communs, y compris les pansements, les filtres à eau, peintures, etc.10,11,12. Toutefois, il a été démontré que ces types de composés peuvent être toxiques pour certains types de cellules de mammifères,13.
Ampères excellent antimicrobien et immunomodulatrices propriétés14,15, et bactéries semblent très difficile de développer une résistance contre les16. Cependant, le processus pour produire des amplis purs est cher ; par conséquent, une production à grande échelle n’est pas viable. Ainsi, des stratégies pour contrer les problèmes dans la production d’amplificateurs ont été mis au point (p. ex., petites peptoid antibactérien moléculaire imite17, peptoids18, α-peptides19 et β-peptides20). Polypeptoids et polypeptides méthacrylate à composition non limitée ont été synthétisés pour antimicrobien et antifouling coatings21.
Le développement de nouveaux agents antimicrobiens tels que les matériaux de pointe en pure ou forme hybride, capable de prévenir et traiter les infections pharmaco-résistante, est de plus en plus nécessaire. Une large gamme de nouveaux matériaux avancés pour les nombreux domaines de la bio-ingénierie comme tissu et génie des bioprocédés ont été développés avec des propriétés chimiques et physiques améliorées au cours des dernières décennies via plusieurs méthodes : plasma-polymérisation greffage sur un substrat hydrophobe22,23,24, l’adaptation de la densité de réticulation25,26, la polymérisation en solution27,28,29 , 30, porogen dissolution31,32et par l’incorporation des nanomatériaux comme le graphène oxyde (aller)33,34,35,36 et carbone nanofibres (CNFs)37.
L’étude de la capacité antimicrobienne de ces nouveaux matériaux pourrait augmenter exponentiellement leur applicabilité éventuelle de la bioingénierie et est, par conséquent, devenue indispensable. Nous présentons un protocole facile à suivre afin de quantifier l’activité antimicrobienne de ces nouveaux matériaux avancés. Ici, après la préparation de l’échantillon, deux méthodes complémentaires sont suivies : la première repose sur la gélose disque diffusion test38 (méthode de diffusion) et le second est basé sur la norme de 22196:2007 ISO39 pour mesurer l’activité antimicrobienne sur surfaces des matériaux (méthode de contact).
Protocole
1. préparation de l’échantillon
- Couper les échantillons de matériaux en disques de diamètre 10 mm avec un diamètre de 10 mm poinçon cylindrique.
Remarque : Matériaux fragiles peuvent être ramollies dans les solvants qui conviennent stériles pendant 1 h et ensuite coupés en disques. Par exemple, les matériaux hydrophiles comme alginate de zinc ont été analysés selon ce protocole et ont été imbibés dans l’eau autoclavé avant de les couper afin d’éviter la rupture de l’échantillon. Toutefois, autres matériaux hydrophobes tels que les poly(3-hydroxybutyrate-co-3-hydroxyvalerate) n’ont pas besoin n’importe quel genre de gonflement précédent afin d’être correctement coupé. - Sécher les disques matérielles de l’échantillon à 60 ° C dans une étuve à vide (< 10-2 Torr) pendant 24 h.
Remarque : Certains matériaux peut-être besoin une haute température de séchage. Toutefois, il est important de ne pas atteindre une température qui pourrait dégrader thermiquement le matériel. - Mesurer les épaisseurs de matériel film avec un pied à coulisse numérique.
Remarque : Ce protocole recommande l’utilisation de matériels films avec une épaisseur constante et analogue lors de la comparaison de l’activité antimicrobienne de différents matériaux. - Stériliser à chaque spécimen par immersion dans de l’éthanol 70 % pendant 10 min et les rayons ultraviolets (UV) pendant 1 h par chaque côté.
NOTE : Rayonnement UV peut être effectuée en plaçant chaque spécimen dans une boîte de Petri stérile à l’intérieur d’une hotte à flux laminaire avec une lampe de 12,0 W de rayonnement UV-C.
ATTENTION : Chercheurs ne devraient pas s’exposer aux rayons ultraviolets, parce qu’il est mutagène. - Effectuez les étapes 1.1, 1.2, 1.3 et 1.4. avec les disques de matériel de contrôle.
Remarque : Le polyéthylène téréphtalate (PET) ou des matériaux non antimicrobiens alternatifs pourraient servir comme un disque de contrôle dans la méthode de diffusion et contact. Plus, lorsque la caractérisation nanocomposites ou matériaux traités, le matériau de base devrait être utilisé comme matériel de contrôle.
2. recommandée de micro-organismes
Remarque : Nous recommandons l’utilisation de 3 différents microorganismes pour étudier la capacité antimicrobienne du matériau testé contre un large éventail de microorganismes.
- Utiliser des cultures pures de 3 microorganismes : les bactéries à Gram positif Staphylococcus aureus, Escherichia coliles bactéries à Gram négatif et la levure Candida albicans.
Remarque : Autres espèces de micro-organismes aussi peuvent être testés avec ce protocole en modifiant les conditions d’incubation si nécessaire.
ATTENTION : Les mesures de biosécurité requises doivent être suivies selon le type de micro-organisme employée dans le présent protocole. - Travailler avec du matériel préalablement stérile ou autoclavé et utiliser un brûleur Bunsen pendant tout le processus de la manipulation microbienne ou une enceinte de sécurité biologique (si nécessaire) afin d’assurer des conditions d’asepsie.
Remarque : Des conditions recommandées autoclave sont 121 ° C pendant 15 min pour les milieux de culture et 121 ° C pendant 20 min. pour le matériel de travail et les résidus biologiques.
3. agar disque Diffusion Test (méthode de Diffusion)
Remarque : Lorsqu’une liquide diffusion de composés antimicrobiens pourrait être le principal mécanisme antimicrobien des matériaux avancés, la méthode de diffusion peut fournir des informations très utiles quant à la capacité antimicrobienne de ces matériaux. Le disque de matière situé au centre de la gélose peut former une zone d’anneau transparent (halo) où une inhibition de la croissance de microorganismes se produit après 24 h de culture (voir Figure 1).
-
Procédure d’essai de diffusion
- Préparer et autoclave une gélose trypticase soja (TSA) suivant les instructions du fabricant.
- Versez la TSA dans des plats de Pétri stérile dans des conditions aseptiques à l’aide d’un bec Bunsen ou une hotte à flux laminaire.
Remarque : Les plaques TSA doivent être de 4 à 6 mm d’épaisseur. - La culture de micro-organismes différents à tester en aérobiose pendant 18-24 heures dans les boîtes de Pétri avec TSA dans un incubateur à 37 ° C.
- Préparer et bouillon de trypticase soja autoclave (BST) suivant les instructions du fabricant.
- Versez le BST dans un tube à centrifuger préstérilisé 50 mL avec une pipette sérologique préstérilisé dans des conditions aseptiques à l’aide d’un bec Bunsen ou une hotte à flux laminaire.
- Resuspendre quelques colonies d’étape 3.1.3 dans 25 mL de TSB contenue dans un tube à centrifuger stérile à l’aide d’un coton-tige stériles et vortex eux pendant 1 min obtenir un mélange homogène.
- Ajuster l’absorbance (à 540 nm) de la culture avec un spectrophotomètre pour le nombre approprié de colonies formant des unités (UFC) par mL : environ 1,5 x 108 UFC/mL pour les bactéries et de 1 x 106 à 5 x 106 UFC/mL pour la levure.
Remarque : Les volumes pour mesurer l’absorbance de la culture et de la cuvette doivent être choisies selon le type du spectrophotomètre utilisé. - Vortex le bouillon de culture microbienne pendant 5 secondes pour améliorer la dispersion du micro-organisme et Plongez brièvement un coton-tige stériles dans cette suspension microbienne. Enlever l’excès de liquide de l’écouvillon en le pressant contre la paroi du tube contenant la culture.
- -Ensemencer uniformément la suspension microbienne bouillon avec le coton-tige stériles sur la surface des plaques TSA dans 3 plans pour couvrir leur toute la surface avec le micro-organisme et le laisser sécher pendant 5 min après l’inoculation.
Remarque : Pour supprimer toute trace d’humidité, les plaques TSA doivent être placés ouverts en position inversée à 37 ° C pendant 10 à 15 min avant l’inoculation. - Stériliser une paire de pincettes en immergeant dans un bécher avec de l’éthanol 96 % et ensuite les flammes avec un bec Bunsen ou la lampe à alcool.
- Placer les disques d’échantillon pour tester et contrôler le disque au centre des plaques TSA en utilisant une paire de pinces stériles.
- Incuber en aérobiose la TSA en position inversée à 37 ° C pendant 24 h.
Remarque : Pour éviter tout risque de contamination, il est recommandé à incuber les boîtes de Pétri de TSA. Toutefois, si le disque échantillon se détache des plaques TSA, n’effectuez pas cette étape en position inversée. Dans ce cas, il est recommandé de sécher les plaques dans la hotte à flux laminaire. Ce test antimicrobiens doit être effectué au moins en quadriplicate à des jours différents pour assurer la reproductibilité.
-
Vérification de la pureté et la concentration de la suspension microbienne
Remarque : Les étapes suivantes sont nécessaires afin de vérifier que la concentration microbienne déterminée avec le spectrophotomètre à l’étape 3.1.7 est correcte et s’assurer qu’il n’existait aucune contamination microbienne de l’environnement. Une contamination microbienne de l’environnement peut être facilement détectée par l’apparition de divers types de colonies microbiennes après 24 h de culture. En outre, aucune contamination microbienne du milieu du BST au cours de sa manipulation dans les dilutions décimales en série ne doit être assurée avec une plaque de contrôle négative du BST.- Diluer le TSB stérile (préparé à l’étape 3.1.4) dans des microtubes stériles à l’aide d’une micropipette avec des pointes autoclavés appropriés dans des conditions aseptiques. L’un d’eux sera utilisé comme contrôle négatif du BST.
- Effectuer des dilutions décimales en série avec la suspension microbienne bouillon utilisée à l’étape 3.1.9 dans les tubes de microcentrifuge stérile contenant du BST.
- Propagation de 100 µL de chaque dilution sur des plaques TSA à l’aide d’une spatule de Drigalski préstérilisée ou un autre instrument. Aussi répandu 100 μl de milieu du BST sans micro-organisme (préparé à l’étape 3.2.1) sur une plaque TSA comme une plaque de contrôle négative du BST.
- Incuber en aérobiose la TSA en aérobie à 37 ° C pendant 24 h.
- Compter le nombre de colonies pour vérifier que le CFU/mL sont semblables à celui déterminé à l’étape 3.1.7.
- Vérifier qu’il n’y a aucune contamination microbienne environnementale sur les plaques de la TSA avec qu’un seul type de colonies.
- Vérifier qu’il n’y a aucune contamination microbienne sur la plaque de contrôle négatif du BST ne montrant aucune colonie
4. mesure de l’activité antimicrobienne sur les Surfaces des matériaux (méthode de Contact)
Remarque : Lorsque la surface de contact peut être le mécanisme principal d’antimicrobiens de certains matériaux de pointe, la méthode de contact peut fournir des informations très utiles quant à la capacité antimicrobienne de ces matériaux. Dans cette méthode, les micro-organismes sont placés directement sur la surface du matériau et leur inhibition de la croissance peut être déterminée après un certain laps de temps.
-
Procédure initiale
- Préparer et stériliser du BST en suivant les instructions du fabricant.
- Versez le BST dans un tube à centrifuger préstérilisé 50 mL avec une pipette sérologique préstérilisé dans des conditions aseptiques à l’aide d’un bec Bunsen ou une hotte à flux laminaire.
- Culture les différents microorganismes à tester en aérobiose, du jour au lendemain dans le tube avec le BST dans un agitateur orbital (140 tr/min) à 37 ° C.
- Diluer la culture nuitée dans 20 mL du BST dans un tube à centrifuger préstérilisé 50 mL à une concentration d’environ 106 UFC/mL (déterminé avec un spectrophotomètre à 540 nm).
Remarque : Les volumes pour mesurer l’absorbance de la culture et de la cuvette doivent être choisies selon le type du spectrophotomètre utilisé. - Effectuer des dilutions décimales en série de cette culture en tubes de microcentrifuge stérile contenant du BST. Répandre 100µl de la culture sur des plaques TSA et il incuber en aérobie à 37 ° C pendant 24 h.
- Dénombrer les colonies afin d’assurer une concentration cellulaire initial d’environ 1 x 106 UFC/mL
- 4 place les disques de contrôle pour le comptage microbienne après 24h et 4 disques d’échantillon de chaque type des matériaux testés pour le comptage microbienne après que 24h en sépare les puits d’une plaque de 48 puits stérile.
- Distribuer 150 µL de la suspension microbienne sur chaque surface de disque.
-
Microbienne de comptage sur le contrôle et les matériaux testés (après 24 h)
- Après l’étape 4.1.6, en aérobiose Incuber les 4 disques échantillon restant dans la plaque de 48 puits à 37 ° C pendant 24 h.
Remarque : Ce temps d’incubation de 24 heures peuvent être modifié afin d’étudier l’inhibition de la croissance à des moments plus ou moins longues. - Après 24 h d’incubation, distribuer 850 µL de PBS stérile sur la surface des 4 disques échantillon et mélangez-le avec les 150 µL de la suspension microbienne.
- Percevoir le mélange de suspension microbienne/PBS et chaque disque de la plaque 48 puits et transférez-les sur un tube de 10 mL pré-stérilisés.
- Vortex le mélange de suspension microbienne/PBS et chaque disque pendant 1 min, ultrasons il à 50 Hz pendant 5 min et vortex il à nouveau pendant 1 min pour s’assurer qu’aucun des microorganismes viables ne restent ont adhéré à la surface du matériau.
- Effectuer des dilutions décimales en série de chaque culture aux ultrasons dans des tubes de microcentrifuge stérile contenant du BST et répandre 100µl de la culture sur des plaques TSA et il incuber en aérobie à 37 ° C pendant 24 h.
- Compter le nombre de colonies, qui sont le nombre de micro-organismes viables sur chaque surface de disque échantillon et témoin. Exprimer ce nombre de cellules viables dans (UFC/mL).
- Prenez une photo de la culture microbienne finale pour les disques de l’échantillon et témoin.
- Après l’étape 4.1.6, en aérobiose Incuber les 4 disques échantillon restant dans la plaque de 48 puits à 37 ° C pendant 24 h.
5. analyse des résultats antimicrobiens
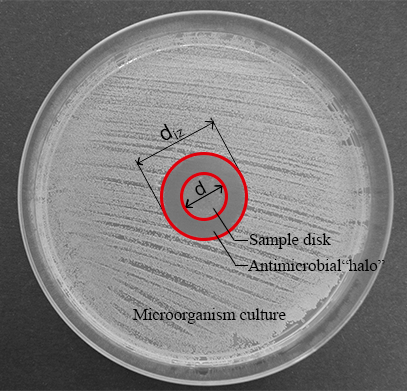
Figure 1 : mesures pour la largeur normalisée de l’antimicrobien « halo ». Ce panneau indique le diamètre de la zone d’inhibition (diz) et le diamètre du disque (d). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
-
Analyse des résultats méthode diffusion
- Mesurer le diamètre de la zone d’inhibition (diz) et le diamètre du disque (d) (voir la Figure 1) avec un pied à coulisse numérique.
Remarque : L’inhibition zone ou antimicrobien « halo » est formé par suite de l’inhibition de la croissance microbienne produite par le disque de matière antimicrobien (voir Figure 1). Il est possible d’observer qu’il y a une zone transparente anneau proche de l’échantillon par rapport au reste de la plaque où les micro-organismes sont développées correctement (zone opaque). - Déterminer la largeur normalisée de l’antimicrobien « halo » (nwhalo) de chaque disque en appliquant l’équation (1).
(1)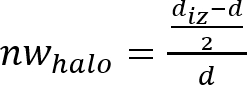
- Déterminer la moyenne et l’écart de la largeur normalisée des valeurs nwhalo antimicrobien « halo » avec 4 déterminé de chaque échantillon.
- Prenez une photo de la culture microbienne finale avec le disque de matière.
Remarque : Le diamètre de la zone d’inhibition (diz) et le diamètre du disque (d) peuvent être mesurées aussi de la photo prise à l’étape 5.1.4 en utilisant une logiciel de traitement d’image adaptée.
- Mesurer le diamètre de la zone d’inhibition (diz) et le diamètre du disque (d) (voir la Figure 1) avec un pied à coulisse numérique.
-
Méthode de contact résultats analyse
- Déterminer le nombre de micro-organismes viables récupérés selon l’équation (2).
(2)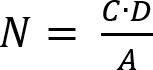
NOTE : Ici, N est le nombre de micro-organismes viables récupérés par cm2 par éprouvette ; C est la teneur en germes ; D est le facteur de dilution ; A est la surface de l’éprouvette en cm2 déterminé par le diamètre du disque échantillon. - Déterminer la perte de viabilité (LV) pour tenir compte de l’inhibition de la croissance cellulaire en appliquant l’équation (3).
(3)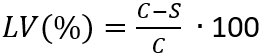
NOTE : Ici, C est le nombre moyen de micro-organismes viables (N) en UFC/mL•cm2, prélevés les échantillons de contrôle après 24 h ; S est le nombre de micro-organismes viables (N) en UFC/mL•cm2, extraite des éprouvettes après 24h. - Déterminer la moyenne et l’écart type de la perte de viabilité avec les 4 valeurs déterminées de LV(%) de chaque échantillon.
- Déterminer le nombre de micro-organismes viables récupérés selon l’équation (2).
Résultats
Ce protocole a été employé, à titre d’exemple, pour tester la capacité antimicrobienne de 4 matériaux avec différentes natures chimiques contre les 3 recommandé microorganismes : Staphylococcus aureus, Escherichia coliet Candida albicans . Les résultats des tests agar disque diffusion (méthode de diffusion) a présenté une activité non antimicrobiens pour la matière première (M1) car elle a eu lieu dans le disque de contrôle (C, image ne pas montrée) et en augmentant l’activité antibactérienne contre les bactéries Gram-positives et Gram-négatives bactéries pour les 3 autres matériaux M2, M3 et M4 (voir Figure 2).
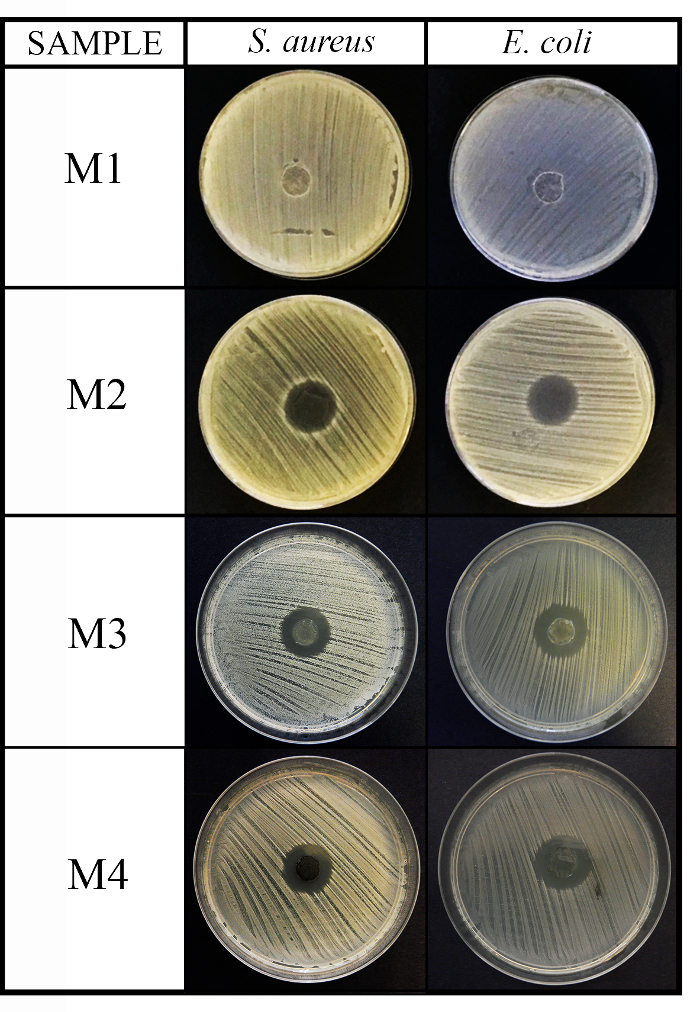
Figure 2 : résultats de méthode de diffusion antimicrobiens. Ce panneau indique la méthode de diffusion aux antimicrobiens pour les 4 matières (M1, M2, M3 et M4) disques (diamètre 10 mm x 1 mm d’épaisseur) contre s. aureus et Escherichia coli après 24 h d’incubation. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
La figure 3 montre les différentes largeurs normalisées de l’antimicrobien « halo » (nwhalo), pour les matériaux différents exemple M1, M2, M3 et M4 contre les bactéries Gram-positives et Gram-négatives, calculé avec l’équation (1). Cependant, aucun des 4 matières étaient capables d’inhiber la croissance de la levure Candida albicans (images non illustrés).
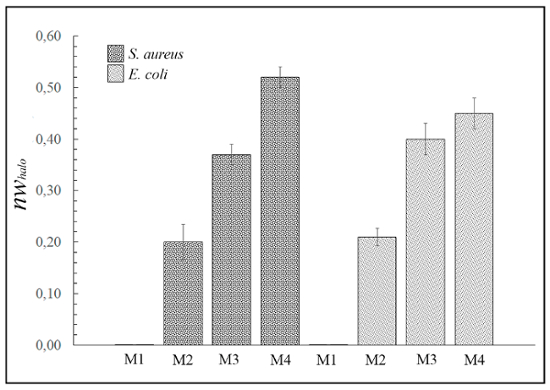
Figure 3 : résultats de diffusion aux antimicrobiens « halo ». Ce panneau montre le normalisée « halo » (nwhalo) pour chaque disque (M1, M2, M3 et M4) matérielle (diamètre 10 mm x 1 mm d’épaisseur) contre s. aureus et Escherichia coli après 24 h d’incubation. Les différences sont statistiquement significatives (p < 0,01). Cependant, l’échantillon M1 ne présentait aucune activité antimicrobienne. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Les résultats de la méthode de contact a également une activité non antimicrobiens pour la matière première (M1) car elle a eu lieu dans le disque de contrôle (C) et la croissante activité antibactérienne contre Grampositive et bactéries à Gram négatif pour les 3 autres matériaux (voir La figure 4).

Figure 4 : antimicrobienne contacter les résultats de la méthode. Ce panneau montre les plaques respectives de 90 mm du 4 matière (M1, M2, M3 et M4) surface activité antimicrobienne dosage selon l’ISO 22196:2007 après 24 h d’incubation pour Staphylococcus aureus et Escherichia coli (facteur de dilution de 10-4). C est la bactérie viable, récupérée à partir du disque de contrôle après 24 h d’incubation. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
La perte de viabilité (%) a été déterminée par l’équation (2) et (3) comme indiqué dans le présent protocole (voir Figure 5).
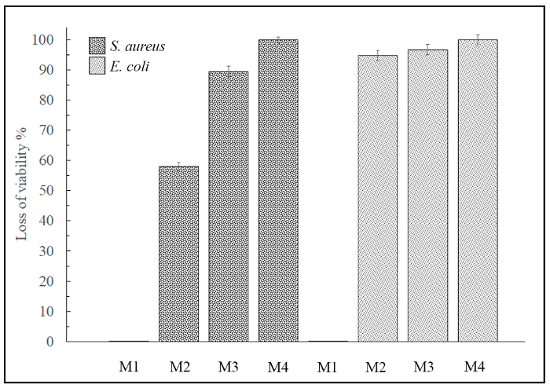
Figure 5 : perte de viabilité par la méthode de contact. Ce panneau montre la perte de viabilité (%) pour le M1, M2, M3 et M4 contre Staphylococcus aureus et Escherichia coli sur les surfaces des matériaux. M1 de l’échantillon n’exposé aucune activité antimicrobienne. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Cependant, aucun des 4 matières étaient capables d’inhiber la croissance de la levure Candida albicans par la méthode de contact soit (non illustrés d’images). Par conséquent, 3 de ces 4 matériaux avancés a montré des résultats positifs antimicrobiens contre les bactéries Gram-positives et Gram-négatives et donc pourrait être très utile pour de nombreuses applications de la bio-ingénierie avec les exigences de haute activité antibactérienne. Cependant, aucun des 4 matières étaient capables d’inhiber la croissance de levure.
Discussion
L’activité antimicrobienne de nouveaux matériaux avancés peut être analysée par le présent protocole facile à suivre, consistant en 2 procédures complémentaires basées sur 2 méthodes existantes : la méthode de diffusion sur gélose test38 et mesuré l’activité antimicrobienne surfaces de matériaux selon la norme ISO 22196:200739.
Dans ce domaine de recherche, nombreux tests antimicrobiens rapportées dans la littérature sont très dépendants de l’essai. Il est donc très important d’avoir des détaillées et cohérente des protocoles en place dans les laboratoires. Cet article est une étape dans cette direction. En outre, il pourrait être très utile pour de nombreux chercheurs qui sont moins expérimentés dans ce domaine et qui doivent être approfondie, étape par étape à suivre pour des résultats précis.
Ce protocole peut être utilisé avec plusieurs types de matériaux découpés en formes de disque de 10 mm de diamètre. Les matériaux fragiles peuvent être gonflées dans un solvant approprié pendant 1 h rendre le processus de découpe plus facile. Ainsi, des matériaux hydrophiles comme les alginates peuvent être hydratés dans l’eau distillée autoclavé. Autres solvants, comme l’éthanol, cétone et le dichlorométhane, peuvent servir à gonfler des matières hydrophobes pendant 1 h avant de les couper. Cependant, certains matériaux tels que le poly(3-hydroxybutyrate-co-3-hydroxyvalerate) n’avez pas besoin d’être gonflé, et ils peuvent être coupés directement. Après cela, il est très important de sécher les disques matérielles de l’échantillon dans une étuve à vide et stériliser chaque échantillon avec l’éthanol et le rayonnement UV pendant 1 h pour éviter tout risque de contamination.
Ce protocole recommande TSA et BST comme milieux de culture et de l’utilisation des cultures pures de 3 microorganismes pour atteindre un large éventail de microorganismes : les bactéries à Gram positif Staphylococcus aureus, Escherichia coli, les bactéries à Gram négatif et la levure Candida albicans. Cependant, les milieux de culture alternative et d’autres microorganismes qui ont besoin de conditions différentes d’incubation pourraient également être utilisés avec ce protocole. Parfois, 1 seul micro-organisme est testé pour avoir une première idée de l’activité antimicrobienne d’un nouveau matériau.
Les matériaux à forte activité antimicrobienne contre les 3 recommandés montrant différents types de microorganismes doivent également être testés contre les agents pathogènes résistants aux antibiotiques comme la méthicilline-résistant Staphylococcus epidermidis (MRSE), qui ont été utilisés avec succès avec ce protocole. Autres micro-organismes résistants aux médicaments importants qui causent beaucoup de soucis sont le Gram positif méthicilline-résistant Staphylococcus aureus (SARM) et vancomycin-resistant Enterococci (ERV) et le Gram-négatif Pseudomonas aeruginosa40,41.
Inhibition de biofilm et l’activité antimicrobienne des matériaux contre d’autres types de micro-organismes tels que les virus et les parasites ne peuvent être testés avec ce protocole. Toutefois, ce protocole prévoit un très bon point de départ pour une étude d’antimicrobiens d’un nouveau matériel de pointe.
Dans le test de diffusion de disque antimicrobien agar, une étape cruciale se produit lorsque le disque de l’échantillon doit être placé dans le centre de la plaque car certains matériaux plier dès qu’ils obtiennent en contact avec les milieux gélosés. Dans ce cas, il est recommandé d’utiliser une paire stérile de pincettes pour Dépliez délicatement l’échantillon. En revanche, dans la méthode de contact, il est essentiel de laver le contrôle et disques d’échantillon très bien avec du PBS de pipetage eux quatre fois suivie d’une agitation vigoureuse et la sonication afin de ne garantir qu’aucun des microorganismes viables restent collés à la matière surface.
Ce protocole vidéo peut être utilisé dans de nombreuses applications de la bio-ingénierie, tels que le génie des bioprocédés, génie tissulaire, livraison de drogue contrôlée, matériaux d’emballage, traitement des eaux usées et l’agriculture, qui utilisent des biomatériaux avec une très capacité antimicrobienne souhaitable.
Les résultats obtenus avec ce protocole sont qualitatives (les images) et quantitative (la largeur normalisée de l’antibactérien « halo » et la perte de viabilité) avec une bonne analyse de sa reproductibilité (moyenne ± écart-type). Lorsque l'on compare les différents matériaux, ces valeurs moyennes obtenues avec l’analyse de résultats de méthode diffusion et contact doivent être analysés par ANOVA, suivie de l’analyse post hoc de la Turquie, afin d’étudier si elles sont, statistiquement, significativement à différents (p < 0,01).
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs aimerait remercier la Universidad Católica de Valencia San Vicente Mártir pour le soutien financier pour ce travail à travers le 001UCV-231-2017 et 2018-231-001UCV subventions.
matériels
| Name | Company | Catalog Number | Comments |
| Cylindrical punch | 10 mm diameter | ||
| Petri dishes | soria genlab | P101 | 90 mm diameter, sterile |
| Tryptic soy agar (TSA) | Liofilchem | 610052 | Dehydrated medium 500 g (powder) |
| Tryptic soy broth (TSB) | Liofilchem | 610053 | Dehydrated medium 500 g (powder) |
| Sterile cotton swab | EUTOTUBO | 300200 | |
| Centrifuge tubes | VIDRA FOC, SA | 429900 | 50 mL, sterile |
| Ethanol | VWR | 83813360 | Absolute ethanol |
| Sterile 48-wells plate | COSTAR | 3548 | Flat bottom with lid, tissue culture treated, non-pyrogenic, polystyrene |
| A pair of tweezers | BRAUN | 24612036 | Toothless |
| Sterile phosphate buffered saline (PBS). | VWR | E404-100TAPBS | |
| Vaccum oven with a connected vacuum pump | JP Selecta, SA | 5900620 | |
| Laminar flow hood | TELSTAR Technologies, SL | TELSTAR AH-100 | 12.0 W lamp of UV-C radiation |
| Class II Biological safety cabinet | LABOGENE | MARS 1200 | |
| Incubator | ASTEC CO, LTD | SCA-165DR | |
| Vortex mixer | Biosan | V-1 Plus | |
| Spectrophotometer | Macherey-Nagel, Germany | Nanocolor UV/VIS II | |
| Bunsen burner | JP Selecta, SA | 7001539 | |
| Alcohol burner | VIDRA FOC, SA | 1658/20 | In case sterilisation is necessary to be performed inside class II biological safety cabinet |
| Orbital shaker | sartorius stedim | 8864845 | |
| Sonicator | SELECTA | 3000617 | 50/60 Hz |
| Digital calliper | ACHA | 17-260 | 0-150 mm |
| Serological pipette | Fisherbrand | 13-678-11 | 25 mL, sterile |
| Serological pipette | VWR | 612-4950 | 5 mL, sterile |
| Serological pipette | VWR | 612-5541 | 10 mL, sterile |
| Micropipette | GILSON | FA10005P | Pipetman L P200L, plastic 20-200 µL |
| Micropipette | GILSON | F123602 | Pipetman P1000, 200-1000 µL |
| Micropipette | GILSON | FA10016 | Pipetman L P12X300L, 20-300 µL |
| Micropipette tips | LABBOX | TIBP-200-960 | 2-200 µL |
| Micropipette tips | LABBOX | TIBP-1K0-480 | 100-1000 µL |
| Pre-sterilized tube | INSULAB | 301402 | 10 mL |
| Photo camera | Canon EOS 5D | Any camera with high resolution can also be utilized | |
| Gram-positive bacteria Staphylococcus aureus | strain V329 | Cucarella et al. J Bacteriol 183 (9), 2888–2896 (2001) | |
| Gram-negative bacteria Escherichia coli | Colección Española de Cultivos Tipo CECT | CECT 101 | |
| Yeast Candida albicans | Colección Española de Cultivos Tipo CECT | CECT 1394 | |
| Microcentrifuge tubes | DASLAB | 175508 | 1,5 mL |
| Autoclave | JP Selecta, SA | 4002136 | |
| Spectrophotometer-cuvettes | UVAT Bio CB | F-0902-02 | 4,5 mL |
| Drigalski spatula | LABBOX | SPRP-L05-1K0 | Sterile, disposable |
| glass balls (2 mm diameter) | Hecht Karl | 1401/2 | Autoclavable, alternative device to the Drigalski spatula |
| Autoclave bags | DELTALAB | 200318 | To sterilize microbiological residues or contaminated material |
| Electronic pipette filling device | JetPip | JET BIOFIL | |
| Laboratory bottle with ISO thread, graduated, borosilicate 3.3 | LABBOX | SBG3-100-010 | 100 mL, for autoclaving culture media |
| Laboratory bottle with ISO thread, graduated, borosilicate 3.3 | LABBOX | SBG3-250-010 | 250 mL, for autoclaving culture media |
| Laboratory bottle with ISO thread, graduated, borosilicate 3.3 | LABBOX | SBG3-500-010 | 500 mL, for autoclaving culture media |
| Laboratory bottle with ISO thread, graduated, borosilicate 3.3 | LABBOX | SBG3-1K0-010 | 1000 mL, for autoclaving culture media |
| Latex gloves | DENIA | 2278000000 | |
| Indicator tape for sterilization | LABBOX | STAP-A55-001 | Self-adhesive tape with impregnated paper turning to colour when exposed to sterilization process. |
| Universal test tube rack | LABBOX | MTSP-001-001 | To hold centrifuge tubes |
| Microcentrifuge tube rack | VWR | 211-0210 | To hold microcentrifuge tubes |
| Sterile loop | ACEFE S.A. | 100140055 | 10 µL of capacity for microbial culture |
| Material M1 | Universidad Católica de Valencia San Vicente Mártir (UCV) | Material type 1 | |
| Material M2 | Universidad Católica de Valencia San Vicente Mártir (UCV) | Material type 2 | |
| Material M3 | Universidad Católica de Valencia San Vicente Mártir (UCV) | Material type3 | |
| Material M4 | Universidad Católica de Valencia San Vicente Mártir (UCV) | Material type 4 | |
| Material C | Universidad Católica de Valencia San Vicente Mártir (UCV) | Control material |
Références
- Sydnor, E. R. M., Perl, T. M. Hospital epidemiology and infection control in acute-care settings. Clin Microbiol Rev. 24 (1), 141-173 (2011).
- Chessa, D., et al. Staphylococcus aureus and Staphylococcus epidermidis Virulence Strains as Causative Agents of Persistent Infections in Breast Implants. PLoS One. 11 (1), e0146668 (2016).
- Pandey, H., Parashar, V., Parashar, R., Prakash, R., Ramteke, P. W., Pandey, A. C. Controlled drug release characteristics and enhanced antibacterial effect of graphene nanosheets containing gentamicin sulfate. Nanoscale. 3 (10), 4104 (2011).
- Jia, Z., Shen, D., Xu, W. Synthesis and antibacterial activities of quaternary ammonium salt of chitosan. Carbohydr Res. 333 (1), 1-6 (2001).
- Liu, Y., Wang, X., Yang, F., Yang, X. Excellent antimicrobial properties of mesoporous anatase TiO2 and Ag/TiO2 composite films. Microporous Mesoporous Mater. 114 (1-3), 431-439 (2008).
- Wang, L., Chen, J., Shi, L., Shi, Z., Ren, L., Wang, Y. The promotion of antimicrobial activity on silicon substrates using a "click" immobilized short peptide. Chem Commun (Camb). 50 (8), 975-977 (2014).
- Kümmerer, K. Resistance in the environment. J Antimicrob Chemother. 54 (2), 311-320 (2004).
- Ng, V. W. L., et al. Antimicrobial hydrogels: A new weapon in the arsenal against multidrug-resistant infections. Adv Drug Deliv Rev. 78, 46-62 (2014).
- Hegstad, K., Langsrud, S., Lunestad, B. T., Scheie, A. A., Sunde, M., Yazdankhah, S. P. Does the Wide Use of Quaternary Ammonium Compounds Enhance the Selection and Spread of Antimicrobial Resistance and Thus Threaten Our Health?. Microb Drug Resist. 16 (2), 91-104 (2010).
- Rana, D., Matsuura, T. Surface modifications for antifouling membranes. Chem Rev. 110 (4), 2448-2471 (2010).
- Lok, C. N., et al. Proteomic analysis of the mode of antibacterial action of silver nanoparticles. J Proteome Res. 5 (4), 916-924 (2006).
- Chen, X., Schluesener, H. J. Nanosilver: A nanoproduct in medical application. Toxicol Lett. 176 (1), 1-12 (2008).
- Ahamed, M., AlSalhi, M. S., Siddiqui, M. K. J. Silver nanoparticle applications and human health. Clin Chim Acta. 411 (23-24), 1841-1848 (2010).
- Yeaman, M. R. Mechanisms of Antimicrobial Peptide Action and Resistance. Pharmacol Rev. 55 (1), 27-55 (2003).
- McLean, D. T. F., Lundy, F. T., Timson, D. J. IQ-motif peptides as novel anti-microbial agents. Biochimie. 95 (4), 875-880 (2013).
- Brogden, K. A. Antimicrobial peptides: Pore formers or metabolic inhibitors in bacteria?. Nat Rev Microbiol. 3 (3), 238-250 (2005).
- Ghosh, C., et al. Small molecular antibacterial peptoid mimics: The simpler the better!. J Med Chem. 57 (4), 1428-1436 (2014).
- Chongsiriwatana, N. P., et al. Peptoids that mimic the structure, function, and mechanism of helical antimicrobial peptides. Proc Natl Acad Sci. 105 (8), 2794-2799 (2008).
- Chen, Y., Mant, C. T., Farmer, S. W., Hancock, R. E. W., Vasil, M. L., Hodges, R. S. Rational design of alpha-helical antimicrobial peptides with enhanced activities and specificity/therapeutic index. J Biol Chem. 280 (13), 12316-12329 (2005).
- Porter, E. A., Wang, X., Lee, H. S., Weisblum, B., Gellman, S. H. Non-haemolytic beta-aminoacid oligomers. Nature. 404 (6778), 565 (2000).
- Gao, Q., Li, P., Zhao, H., Chen, Y., Jiang, L., Ma, P. X. Methacrylate-ended Polypeptides and Polypeptoids for Antimicrobial and Antifouling Coatings. Polym Chem. 8 (41), 6386-6397 (2017).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Gómez-Ribelles, J. L., Monleón-Pradas, M., Vidaurre-Garayo, A., Suay-Antón, J. Characterisation of macroporous poly(methyl methacrylate) coated with plasma-polymerised poly(2-hydroxyethyl acrylate). Eur Polym J. 43 (10), 4552-4564 (2007).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Monleón-Pradas, M., Gómez-Ribelles, J. L. Plasma-induced polymerisation of hydrophilic coatings onto macroporous hydrophobic scaffolds. Polymer (Guildf). 48 (7), 2071-2078 (2007).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Monleón-Pradas, M., Gómez-Ribelles, J. L., Rault, J. Thermal analysis of water in reinforced plasma-polymerised poly(2-hydroxyethyl acrylate) hydrogels. Eur Polym J. 72, 523-534 (2015).
- Monleón-Pradas, M., Gómez-Ribelles, J. L., Serrano-Aroca, &. #. 1. 9. 3. ;., Gallego-Ferrer, G., SuayAntón, J., Pissis, P. Interaction between water and polymer chains in poly(hydroxyethyl acrylate) hydrogels. Colloid Polym Sci. 279 (4), 323-330 (2001).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Monleón-Pradas, M., Gómez-Ribelles, J. L. Effect of crosslinking on porous poly(methyl methacrylate) produced by phase separation. Colloid Polym Sci. 286 (2), 209-216 (2008).
- Monleón-Pradas, M., Gómez-Ribelles, J. L., Serrano-Aroca, &. #. 1. 9. 3. ;., Gallego Ferrer, G., Suay Antón, J., Pissis, P. Porous poly (2-hydroxyethyl acrylate) hydrogels. Polymer (Guildf). 42 (10), 4667-4674 (2001).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Monleón-Pradas, M., Gómez-Ribelles, J. L. Macroporous poly(methyl methacrylate) produced by phase separation during polymerisation in solution. Colloid Polym Sci. 285 (7), 753-760 (2007).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Llorens-Gámez, M. Dynamic mechanical analysis and water vapour sorption of highly porous poly(methyl methacrylate). Polymer (Guildf). 125, 58-65 (2017).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Campillo-Fernández, A. J., Gómez-Ribelles, J. L., Monleón-Pradas, M., Gallego-Ferrer, G., Pissis, P. Porous poly(2-hydroxyethyl acrylate) hydrogels prepared by radical polymerisation with methanol as diluent. Polymer (Guildf). 45 (26), 8949-8955 (2004).
- Rodríguez-Hernández, J. C., Serrano-Aroca, &. #. 1. 9. 3. ;., Gómez-Ribelles, J. L., Monleón-Pradas, M. Three-dimensional nanocomposite scaffolds with ordered cylindrical orthogonal pores. J Biomed Mater Res - Part B: Appl Biomater. 84 (2), 541-549 (2008).
- Brígido-Diego, R., et al. Acrylic scaffolds with interconnected spherical pores and controlled hydrophilicity for tissue engineering. J Mater Sci Mater Med. 40 (18), 4881-4887 (2005).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Ruiz-Pividal, J. F., Llorens-Gámez, M. Enhancement of water diffusion and compression performance of crosslinked alginate with a minuscule amount of graphene oxide. Sci Rep. 7, 11684 (2017).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Deb, S. Synthesis of irregular graphene oxide tubes using green chemistry and their potential use as reinforcement materials for biomedical applications. PLoS One. 12 (9), e0185235 (2017).
- Sánchez-Correa, F., Vidaurre-Agut, C., Serrano-Aroca, A., Campillo-Fernández, A. J. Poly(2-hydroxyethyl acrylate) hydrogels reinforced with graphene oxide: Remarkable improvement of water diffusion and mechanical properties. J Appl Polym Sci. , (2018).
- Serrano-Aroc, &. #. 1. 9. 3. ;., Iskandar, L., Deb, S. Green synthetic routes to alginate-graphene oxide composite hydrogels with enhanced physical properties for bioengineering applications. Eur Polym J. 103, 198-206 (2018).
- Llorens-Gámez, M., Serrano-Aroca, &. #. 1. 9. 3. ;. Low-Cost Advanced Hydrogels of Calcium Alginate/Carbon Nanofibers with Enhanced Water Diffusion and Compression Properties. Polymers (Basel). 10 (4), 405 (2018).
- Bauer, A. W., Kirby, W. M. M., Sherris, J. C., Turck, A. M. Antibiotic susceptibility testing by a standardized single disk method. A J Clin Pathol. 45, 493-496 (1966).
- . . ISO Specification 22196: measurement of antibacterial activity on plastics surfaces. , 584 (2007).
- Taubes, G. The bacteria fight back. Science. 321 (5887), 356-361 (2008).
- Boucher, H. W., et al. 10 x '20 progress--development of new drugs active against Gram-negative bacilli: an update from the infectious diseases society of America. Clinical Infectious Diseases. 56 (12), 1685-1694 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon