Method Article
ヒト胎児標本におけるカンピロバクター・イェジュニの輸送培地における検出と生存の限界を決定する培養方法
要約
カンピロバクターの便培養は不正確ですが、依然として識別のためのゴールドスタンダードと考えられています。ヒト便中のC.セジュニの輸送媒体における検出および生存の限界を決定する方法が、より良い精度で新しい免疫アッセイと比較される。
要約
カンピロバクターベースの腸疾患の診断のためのヒト便からの培養は数日かかり、医師と患者の不屈の精神に課税する待ち時間である。また、培養は、標本処理中の生存率のランダムな損失、他の便叢の過剰増殖、および伝統的な培地上のいくつかの病原性カンピロバクター種の成長不良から偽陰性の結果を起こしやすい。これらの問題は、患者の治療に関する臨床的決定を混乱させることができ、カンピロバクターの成長と感染症に関する基本的な質問に答えることから分野を制限している。我々は、培養によって検出できる細菌数の下限を推定する手順と、この壊れやすい生物の輸送に使用される培地におけるC.セジュニの生存率を定量化する方法を説明する。この情報を知ることで、診断テストに臨床的に関連する検出閾値を設定し、非症候性コロニー形成が蔓延しているかどうか、他の腸内病原体との共感染が一般的である場合、または細菌負荷が症状または重篤な後遺症と相関しているかどうかという未研究の問題に対処することが可能になる。この研究には、従来の培養によって最初に分類され、新しい酵素免疫測定によってさらにテストされた1,552の患者下痢性便標本の試験も含まれていた。その後、陽性および不定の標本を4つの分子方法によってスクリーニングし、真陽性または真陰性の状態を割り当てた。5つの非培養方法は、48個の陽性および不連続の標本すべてについて完全な一致を示し、培養は14(28%)を誤って同定した。培養によって誤って同定された標本には、13個の偽陰性および1つの偽陽性サンプルが含まれていた。この基本的なプロトコルは、複数のカンピロバクター spp.と一緒に使用することができ、ヒトの胃腸炎の症状を生み出すカンピロバクター細菌の数を決定し、有病率を更新することができます。
概要
米国疾病管理センター(CDC)は最近、食品媒介性疾患活動監視ネットワーク(FoodNet)監視プログラムが2018年に実験室で診断されたカンピロバクター感染の9,723例を報告したと発表した。これは、2015-2017年1年に対するカンピロバクター症例報告の12%の増加を表しています。世界的に、カンピロバクター spp.は最も一般的な細菌性腸感染症の1つです 2.それにもかかわらず、毎年発生するカンピロバクターベースの腸疾患の数は、過小報告されている疑いがある 3.ほとんどの患者は中等度の不快感だけで治療を受けないので、この過小評価は予測可能です。しかし、より重篤な症状を有する患者または重篤な疾患のリスクが高い患者、およびその後医療を求める患者にとって、便培養は、カンピロバクターが彼らの苦痛を引き起こしている病原体であるかどうかを評価するための最も一般的な方法である4。
カンピロバクター spp.の場合、便培養は特に厄介です。最も一般的な病原性生物は、C.セジュニ、C.大腸菌、C.アップサリエンシス、およびC.ラリであり、ミクロ好気球5である。これは、細菌が一度空気にさらされると、ランダムで未知の速度で死ぬことを意味します。検体採取と培養のセットアップの間の時間は、培養によって実行可能なカンピロバクター spp.を検出する能力において制御不能な変数となる。
便標本の直接培養では、カンピロバクターの成長の遅さも問題である。カンピロバクターコロニーは、48時間のインキュベーション後も非常に小さく、容易に胎児マトリックス中の競合する生物によって覆われることができる。C.セジュニおよびC.大腸菌のほとんどの株が耐性である抗生物質を含むプレートは広く使用されており、抗生物質は競合する多くの(すべてではない)の増殖を阻害し、カンピロバクターコロニーの視覚化を改善する6。しかし、C.ラリやC.アップサリのような他のカンピロバクター種は、これらの抗生物質の一部に敏感であり、成長が不十分であるか、まったく成長しないかのどちらかである。これは、これらの抗生物質感受性種7からのカンピロバクター感染症の過小報告に寄与する。
カンピロバクターの文化が不正確である可能性がある3番目の理由があります。細菌は、ストレスを受けると、生存可能なままであるが、「非カルト性」8になる可能性がある。これは定義により、培養物がサンプル中に存在する細菌を検出しないことを意味する。これが発生する頻度は8知られていません。
これらの文化に関する潜在的な問題を考えると、我々は、誤った培養結果が単一の比較アッセイを不正確に見せないように、複数の比較参照方法を使用した。使用される培養方法(例えば、カンピロバクター-選択的プレート、輸送媒体、ガス発生用袋)は、便標本培養10の臨床検査室で広く使用されているために選択された。
ここで説明する培養プロトコルは、ヒト便の培養によって検出できるカンピロバクター・イェジュニの数が最も少ないことが知られなかったために開発された。家禽の便に存在するコロニー形成ユニット(CFU)の数の推定値は公表されているが、これらの結果は、カンピロバクター属が鶏の同胞であり、下痢を引き起こさないため、ヒト便と同一視することはできない。この基本的な情報は、ヒトにおける胃腸炎の症状を生み出すカンピロバクター属細菌の数を確立し、菌株または種間の毒性を比較するために必要である。
プロトコル
1. ヒト胎児標本におけるカンピロバクターの列挙
注:すべてのステップは、消毒層流れ安全フード内の使い捨て保護シート上の滅菌技術と材料を使用して行われます。
注意:ライブカンピロバクターは感染性であり、下痢を含む病気を引き起こす可能性があります。細菌を扱う際には、手袋、ラボコート、安全メガネを着用してください。口のピペットを口にしないでください。適切なバイオハザード容器内の細菌に接触したすべての材料を処分する。
- 細菌のストック培養の成長
- C.セジューニ(ATCC-33560)またはC.大腸菌(ATCC 33559)(材料表)の株を乾燥または凍結培養物として入手し、製造業者の指示に従って水分補給または解凍細菌を得る。水分補給された細菌をカンピロバクター特異的寒天プレートにストリークして培養を開始する。微気雰囲気ガス発生小袋を含む嫌気性瓶に37°Cでプレート48時間をインキュベートする。
- 翌日、0.5%トリプチケース、0.5%プロテアーゼペプトン、0.0125%ピルビン酸ナトリウム、および0.0125%亜硫酸ナトリウムを含む脳・心臓注入(BHI)成長ブロスを100 mL調製する。
- フラスコをゆるく覆い、ミクロ好気性環境を作り出す小袋で嫌気性瓶に入れることで、BHIスープをプレ還元します。スープを37°Cで一晩予減させます。同様に、コロニーカウントに使用するカンピロバクター特異的プレートを予め減らし、ステップ1.1.10および1.2.2でカウントする。
- カンピロバクターは空気に敏感なので、スープを接種する前にすべての材料を収集し、文化を扱いながら夜明けしないでください。接種する準備ができたら、牛胎児血清(FBS)を加えて、総量の4%に予め還元したスープにします。1 mLの予め還元されたブロスを保持し、600 nm(OD600)での光学密度の測定値においてブランクとして機能する。
- FBSを含むプレ還元ブロスの3mLを除去し、カンピロバクター培養物を含むスタータープレートを掻き取るためにスープを使用します。プレートを接種ループでそっと削り、細菌のスラリーを滅菌チューブに移します。
- 約3mLの細菌スラリーで100mLの予還元ブロスを接種し、ガス発生袋を含む嫌気性瓶の中で37°Cで115rpmで適度な揺れを行ってインキュベートする。
- OD600で濁度により分光光度の細菌の増殖をモニターする。予約したスープをブランクとして使用します。嫌気性の瓶が開いている場合は、ガス発生小袋を交換してください。
- 48-72時間後、またはOD600値が〜0.4に達する前に、ブロスインキュベーションを停止します。
注: この OD600は、通常、107 ~ 108 CFU/mL に相当します。一般的な結果については、表 1を参照してください。 - 純粋なストック培養で細菌の数を確立するには、900 μLの希釈バッファー(材料表)で100μLの8個の10倍希釈系列のスープを実行する。100 μLのスープを最初の希釈のために取り除いた後、新鮮なガス発生の袋を付けて嫌気性瓶にフラスコを戻し、スピーカープールでの使用を待ちます。
- 滅菌メッキビーズを使用して、ステップ1.1.3から重複する予減カンピロバクター特異的プレート上に10-5〜10-7希釈液の100 μLを広げます。 希釈を使用したラベルプレートは、ガス発生小袋付きの第2の嫌気性瓶に入れ、37°Cで48-72時間インキュベートします。
注: 希釈スキームとコロニーの写真については、図 1および図 2を参照してください。 - 成長後、30-300コロニーの間のプレートを選択してカウントします。数式 1 を使用して、ストックブロス カルチャの CFU/mL を決定するカウントを利用します。
CFU/mL 在庫数 = 選択された(重複した)分析プレート上のコロニーの平均数 ÷ (mL メッキ x プレート希釈) [式 1]
- 工夫された臨床便標本の調製と列挙
- 分析カウント用プレートがステップ1.1.10で調製された直後に、ストックスープとカンピロバクター-陰性便プール(NFP)から10連続2倍希釈液を調製して、ストックスープ希釈液の2番目のセットを作ります。例えば、同量のブロスとNFP(例えば、それぞれ0.1 mL)を混合して最初の希釈液を調製し、その後の希釈液を、指定された量のブロスとNFP混合物を等指定体積NFPのチューブに移して作ります。非カンピロバクターコロニーを識別するために、遊菌を含むスープを含むコントロールプレートを便プールに追加します。
- 以前にテストされ、カンピロバクター酵素免疫測定法や16S rRNA qPCRなどの方法によってカンピロバクター-陰性であることが判明した、非同定された下痢患者の監視標本または健康なドナースツールからNFPを作る。
- 重複した前還元されたカンピロバクター特異的寒天プレート上の各カンピロバクター/スツール希釈のT-ストリーク10 μL。気性の小袋を入れた嫌気性の瓶にプレートを入れ、37°Cで48±2時間インキュベートします。
- 純粋なカンピロバクター培養物に似たコロニーの縞模様のプレートを視覚的に調べます。
注: 3 番目の作業領域は、通常、これらが見つかる場所です。希釈スキームとコロニーサイズ、色、形態の画像については、図1と図2を参照してください。 - 複数のカンピロバクター-のようなコロニーとグラム染色を選択します。油浸レンズを用いた顕微鏡を用いて、グラム陰性湾曲、スパイラル、または葉巻状の小さな細菌について薄く縞模様の領域を調べます。
注意:カンピロバクターはグラム陰性であり、正確に視覚化するために(典型的なサフラニンの代わりに)カウンターステインとして基本的なフクシンを必要とします。古典的なカモメの翼を持つ細菌が見られるかもしれないが、要件ではない。代表的な顕微鏡写真については、図2を参照してください。 - 特定の希釈時の重複プレートのいずれかが1個以上のカンピロバクターコロニーを有する場合、その希釈フェカルカルチャー陽性を考慮する。
- 可視カンピロバクターを含む最後の希釈を考えてみましょう - グラム陰性コロニーのような培養検出の限界。方程式2を使用して、工夫された臨床便標本における正希釈のCFU/mLを計算する:
CFU/mL のフェカルサンプル = 分析 CFU/mL ÷ 最後の正のコロニーによる希釈[式 2]
注: 一般的な結果については、表 2を参照してください。
- 分析カウント用プレートがステップ1.1.10で調製された直後に、ストックスープとカンピロバクター-陰性便プール(NFP)から10連続2倍希釈液を調製して、ストックスープ希釈液の2番目のセットを作ります。例えば、同量のブロスとNFP(例えば、それぞれ0.1 mL)を混合して最初の希釈液を調製し、その後の希釈液を、指定された量のブロスとNFP混合物を等指定体積NFPのチューブに移して作ります。非カンピロバクターコロニーを識別するために、遊菌を含むスープを含むコントロールプレートを便プールに追加します。
2. 輸送メディアに保存されたカンピロバクターの生存率決定
- カンピロバクターブロス培養液1mL(ステップ1.1.8)を1mLのNFPと混合し、NFPで10倍の連続希釈液を10個ずつ調製します。さらに、輸送媒体で調製された臨床検体が処理されるのと同様に、各希釈液をCary-Blair培地でさらに1:4希釈する。
- 20個の希釈管と陰性制御を、96時間2-8°Cのキャップチューブ内のキャリー・ブレア培地に保管し、各希釈からコロニーを郡に保管します。コロニーカウントの場合、スープ:フェカルチューブをサンプリングし、各希釈のコロニーカウントのためのフェカル培養を重複して設定します。
- カンピロバクターのフェカル希釈液の10 μLの各部分を毎日プレート - 選択的寒天、48時間37 °Cでインキュベートするステップ1.1.9−1.2.7で上述したように。
- 上記の手順(ステップ 1.1.9-1.1.11)に従って、元の細菌ストックの分析プレート数を同時に実行します(ステップ1.1.9-1.1.11)。元の細菌ストックのCFU/mLを計算し(式1)、輸送媒体のフェカルサンプルおよびその希釈液中の細菌の濃度を計算する(式2)。
3. 文化結果検証のための非培養アッセイ
- 酵素免疫測定法(EIA)を用いて、偽陽性の結果を最小限にする12を与え、パッケージ挿入指示に従って培養結果を検証する。
- カンピロバクター種13の広い範囲の16S rRNA遺伝子または他の遺伝子を検出できる分子アッセイを使用する。分子アッセイが、標準的な抗生物質含有寒天14で十分に成長しないC.アップサリエンシスやC.ラリなどの種と反応することを確認する。フェカルサンプルからDNAを抽出し、テストを行うためのメーカーの指示に従ってください。
注:16Sアンプリコンの双方向DNAシーケンシングは、陽性の標本中のカンピロバクターの種を確認するために使用することができます。種特異的PCR(標的遺伝子については表3参照)は、不協同または陽性標本15に存在する種を同定するためにも使用することができる。
結果
競合する便叢の中でカンピロバクター spp.コロニーを特定するには、鋭い視力とかなりの判断が必要です。培養によって検出できるコロニーの数は最も少ないが、患者からの標本は106-109 CFU/mL16、17を収容すると推定されている。しかし、正確な細菌数を確立する独立した方法がないため、患者のサンプルを定量的に使用することはできません。この制限を克服するために、1つの細菌ストックで2つの同時測定が行われます。1つのテストは、臨床検体をシミュレートする、ストック細菌の連続希釈からカンピロバクターコロニーの視覚的検出に使用されます。もう一つは、スパイクに使用される細菌ストック培養物に存在するCFU/mLを定量化するために分析的に使用される(図2A)。
カンピロバクターの検出しきい値は、値は定義されません。これは、各便マトリックスが複雑でユニークであり、細菌の増殖が可変であるため、期待される。成功のための重要なパラメータは、競合する胎児叢の中でピンポイントサイズのコロニーを特定することです。スパイク便培養の代表的なプレートを図2Cおよび図2Dに示す。カンピロバクターを添加しない陰性対照板は、他の便叢を同定するのに役立つ重要な。多くの候補のグラム染色はまた、正しい光沢のあるコロニーとフクシン染色されたグラム陰性細菌の中間ピンク色を区別するために眼を訓練し、選択されたコロニー内の細菌の形態を確認する(図2B)。5 C.の水上水産と2C.大腸菌を用いて7つの独立した実験を行い、0.3-5 x 106 CFU/mLから重なり合う閾値を与えた。一般的なデータについては、表 2を参照してください。検出限界は、C.の間欠泉は平均2 x 10 6、C.大腸菌では1.2 x 106 CFU/mLでした。これは、培養が、多くの臨床検査室で使用される標準的な抗生物質含有カンピロバクター特異的寒天体上の胎児標本の1グラム当たり〜1−2 x 106C.の半腸またはC.大腸菌を検出する可能性が高いことを示している。異なる抗生物質を持つ複数の特殊な寒天があり、コロニー検出のための異なる閾値を与える可能性があります。ここで説明する方法は、文化の精度を向上させ、新しいメディアの汎用性を広げるために、より定量的で比較的な研究を奨励する必要があります。例えば、第10−5板に152コロニーをカウントし、第2の10−5プレート上に144コロニーを数えた。2つのプレート間の平均は148コロニーである。プレートは0.1 mL(100 μL)の10-5希釈で接種され、式1は純粋な培養ストック内の148 x 106(14.8 x 107)のCFU/mLに相当する。フェカル希釈が行われたとき、培養は1:1比で陰性の便プールにスパイクされた。したがって、式2により、フェカル曲線上の最初の点(プレート"a")は14.8 x 107を2で割り、7.4 x 10 7 CFU/mLに相当します。この「a」チューブは、9つの追加の希釈を作るために使用されます。図1において、カンピロバクター-様の形態を有する1つの可視グラム陰性コロニーを有する最後の希釈は、プレート"g"にある。これは、この例で検出されるフェーカル培養閾値の 1.1 x 106 CFU/mL に相当します。
持続的な生存率が培養の正確性の鍵であるにもかかわらず、患者から診療所への検体の取り扱いと出荷中のカンピロバクター spp.の生存率の保持は問題である。典型的な貯蔵は空気露出および特別な大気なしで普通の上限の管の標本を冷蔵することである。輸送媒体中の標本(保存サンプルとも呼ばれる)は生存率が高いと考えられているが、定量的データ18を提供する報告はほとんどない。
上記に示した分析的および工夫されたサンプル法の組み合わせは、輸送媒体におけるC.セジュニの生存率および生存時間の推定値を得るために再び使用された。細菌ストックブロスを使用して、10個の重複した2倍から1024倍のサンプル希釈液をフェカルマトリックスで調製した。最初のスープは、分析カウントによって4.8 x 107 CFU/mLの濃度を有することが判明した。0日目に作られたプレートでは、C.イェジュニが32倍希釈で縞模様のプレート上で(2日後)検出され、1.5 x 106 CFU/mLに相当する。しかし、キャリーブレアの便サンプルを24時間冷蔵した後に作られたプレート上では、2倍希釈(2.4 x 107 CFU/mLに相当)だけが目に見えるコロニーを成長させました。研究が停止した96時間まで、これ以上の生存率の損失は見られなかった。この生存率の損失は16倍(94%)に相当する24時間以内に培養可能な生物を喪失し、冷凍しても、107 CFU/mL C.のセジュニ未満のキャリーブレア培地の便が文化によって見逃される可能性があることを示している。
培養結果とは対照的に、EIAは、初期時点および4日間の試験期間を通じて256倍希釈時にC.イェジュニの存在を検出した。スパイクされたフェースサンプルを使用したこのEIAのC.セジュニ検出閾値は8.4 x 104 CFU/mLです。この閾値は、便培養のそれより低く、より敏感で安定したC.セジュニの検出を可能にする。
実際の臨床環境でカンピロバクター spp.を検出する培養能力を試験するために、1,552の臨床便標本は、6つの処置によって特徴付けられていた:便培養、カンピロバクター spp.のための新しい免疫アッセイ、および4分子法。すべてのサンプルは、米国の3つの研究所で従来の培養物によって前向きに収集され、最初に分類され、その後EIAによってクロスチェックされた。次に、培養陽性またはEIA/培養不一見標本を分子法12によってスクリーニングした。標本は5つの非培養方法の結果に基づいて真陽性または真陰性の状態を割り当てた。5つの非培養方法は、48個の陽性および不連続の標本すべてについて完全な一致を示し、培養は14(28%)を誤って同定した。培養によって誤って同定された標本には、13個の偽陰性および1つの偽陽性サンプルが含まれていた。

図1:分析およびスパイクされた便サンプルの同時調製のためのスキーム。この図の大きなバージョンを表示するには、ここをクリックしてください。
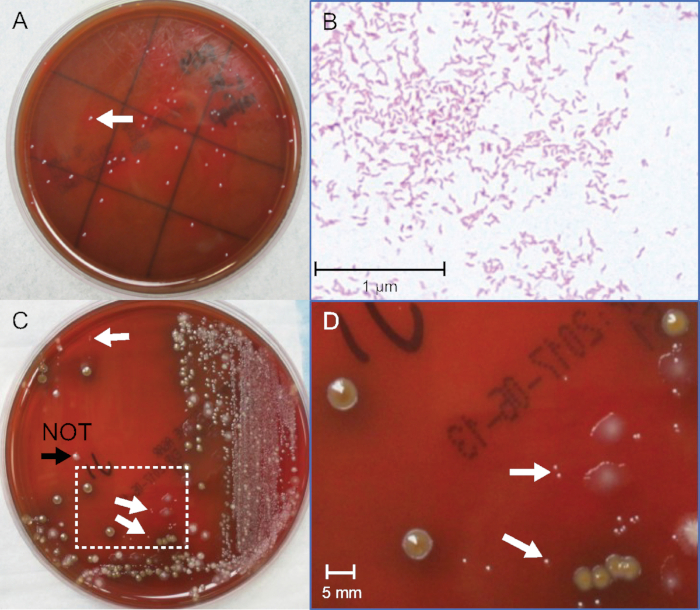
図2:純粋および便培養物からのC.セジュニコロニーの同定。(A)72時間培養後の純粋な細菌培養からのC.セジュニコロニーの写真。(B)純粋な細菌培養からのC.セジュニのグラム染色、油浸400倍倍率。(C)C.の写真は、C.の写真-48時間インキュベーション後に陽性スパイク便培養。(D) ボックス内の拡大領域 (C), 10x 倍率.白い矢印は、ピンポイントサイズグラム陰性C.のセジュニコロニーを示す。黒い矢印は、C.セジュニではなく、わずかに大きく、グラム陽性であるコロニーを示しています。この図の大きなバージョンを表示するには、ここをクリックしてください。
| 文化 | OD600 @ T0 | OD600 @ T ファイナル1 | 最終 CFU/mL |
| C. イェジュニ | 0.146 | 0.321 | 1.28 x 107 |
| C.大腸菌 | 0.245 | 0.508 | 4.50 x 108 |
表1:C.セジューニ株とC.大腸菌株の典型的な成長とCFU/mL。1C. ケイジュニ培養は、インキュベーションの48時間後に停止した。C.大腸菌培養は54時間の培養後に停止した。
| スパイクされたフェカルサンプル用希釈管 | カンピロバクター様コロニー数 | グラム陰性コロニー数 1 | 文化ポジティブ? | スパイクサンプルの計算されたCFU/mL | |
| C. ジェジュニ(1.28 x 108 CFU/mL在庫) | (2倍) | 高 密度 | 第2回 | はい | 6.40 x 107 |
| (4倍) b | 20+ | Nd | はい | 3.20 x 107 | |
| (8倍) c | 4-10 | Nd | はい | 1.60 x 107 | |
| (16倍) d | Nd | はい | 8.00 x 106 | ||
| (32倍) e | Nd | はい | 4.00 x 106 | ||
| (64倍) f | 1-3 | 1/ 2 | はい | 2.00 x 106 | |
| (128倍) g | 2/ 3 | はい | 1.00 x 106 | ||
| 3(256 倍) h | 1/ 2 | はい | 5.00 x 105 | ||
| (512倍) i | 0 の 1 | いいえ | 2.50 x 105 | ||
| (1024倍) j | 0 | Nd | いいえ | Nfp | |
| C.大腸菌(4.50 x 108 CFU/mL在庫) | (2倍) | 高 密度 | Nd | はい | 2.25 x 108 |
| (4倍) b | Nd | はい | 1.13 x 108 | ||
| (8倍) c | 50+ | Nd | はい | 5.63 x 107 | |
| (16倍) d | 30+ | Nd | はい | 2.81 x 107 | |
| (32倍) e | 10+ | Nd | はい | 1.41 x 107 | |
| (64倍) f | 3-8 | Nd | はい | 7.03 x 106 | |
| (128倍) g | Nd | はい | 3.52 x 106 | ||
| 3(256 倍) h | 1-3 | 3 の 1 | はい | 1.76 x 106 | |
| (512倍) i | 0 の 1 | いいえ | 8.79 x 105 | ||
| (1024倍) j | 0 | Nd | いいえ | Nfp |
表2:スパイクされた便サンプルのプレート上のコロニーの典型的な数。1グラムのカンピロバクター-様コロニーの中で、2nd=決定されない、3太字のデータは最後の正希釈を示す。
| 種 | 遺伝子標的 |
| C. イェジュニ | Hipo |
| C.大腸菌 | cadF |
| C. アップサリエンシス | cpn60 |
| C.ラリ | cpn60 |
| C. ヘルヴェティカス | cpn60 |
| C.胎児 | cpn60 |
| C. ヒョ腸症 | cpn60 |
| C. 簡潔 | cpn60 |
表3:個々のカンピロバクター種qPCRの検出に有用な遺伝子。
ディスカッション
ここで説明する培養方法は、ほとんどの研究室で利用可能なシンプルで広く使用されている技術と材料に基づいて構築されています10.これは、胎児培養のための臨床的に関連する検出閾値の新しい情報を提供する分析および工夫されたサンプルの組み合わせです。さらに、5つの別々のアッセイによる培養結果の裁定は、カンピロバクターの便培養が患者検体のかなりの部分を誤って識別するという結論を強める。EIAおよび分子アッセイは、それぞれ異なる原理(抗体とDNA増幅の抗原相互作用)に基づいているため、コントロールとして有用であり、重要なことに、細菌の生存率に依存しないこと。これらの研究に使用されるEIAアッセイは十分に検証されており、4分子試験12に完全に同意することが示されている。
カンピロバクター spp.の培養は特に厄介で、感度は60-76%19、20の範囲に及び、実際陽性の標本を検出できなかったのは〜30%の割合から明らかです。人は、培養データが陰性の場合、制御EIAと分子試験がしばしば肯定的な結果を生み出すことを期待できます。
プロトコルの最も重要なステップは、競合する便叢の間のピンポイントコロニーの同定である。検出閾値付近の希釈値として、コロニー数の推定値(例えば、2、0、1、0、0)を交互に有することは珍しいことではない。培養閾値は、特定のCFU/mLではなく、濃度の範囲であることを認識することが重要です。それにもかかわらず、培養検出の下限として〜1 x 106 CFU/mLの便の推定値は、感染したヒトが1グラムの便1個につきカンピロバクター 106〜10 9を流したという報告とよく比較される。抗生物質や寒天プレートの変化と個々の便標本で避けられない変化は、間違いなく閾値を変更します。このプロトコルは、成長メディアの改善を可能にする必要があります。
培養検出の限界に関するこの最初の情報は、診断検査に臨床的に関連する閾値を設定することを可能にし、カンピロバクターによる非症候性キャリッジ22、23の未研究の問題に対処するために必要な微生物学的基盤を築くか、細菌負荷が症状または重篤な後遺症と相関する場合。
開示事項
著者らは、この記事でコンパレータとして使用されるQUIK CHEK™キットを生産するTECHLAB社の従業員です。
謝辞
これらの研究は、株式会社テックラボによって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| Anaerobic 3.5L Jar | Thermo Fisher | HP0031A | |
| AnaeroGRO Campylobacter Selective Agar | Hardy Diagnostics | AG701 | |
| Bacto Brain Heart Infusion | BD Biosciences | 237500 | |
| Bacto Protease Peptone | Life Technologies Corp | 211684 | |
| Basic Fuchsin | Fisher Scientific | B12544 | |
| BBL Trypticase Peptone | Life Technologies Corp | 211921 | |
| C. coli Type strain | ATCC | 33559 | |
| C. jejuni Type strain | ATCC | 33560 | |
| CampyGen gas generating system sachet | Thermo Fisher | CN0025A | |
| Campylobacter QUIK CHEK | TechLab, Inc. | T5047 / T31025 | |
| Cary-Blair transport medium | Fisher Scientific | 23-005-47 | |
| Coli Roller Sterile plating beads | Millipore Sigma | 71013 | |
| Dilution Buffer | Anaerobe Systems | AS-908 | |
| Fetal bovine serum | Equitech-Bio, Inc | SFBM30 | |
| Sodium bisulfite | Sigma-Aldrich | 243973 | |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| Spectrophotometer cuvettes | USA Scientific | 9090-0460 |
参考文献
- . Annual Summaries of Foodborne Outbreaks Available from: https://www.cdc.gov/fdoss/annual-reports/index.html (2018)
- Kaakoush, N. O., Castaño-Rodríguez, N., Mitchell, H. M., Man, S. M. Global Epidemiology of Campylobacter Infection. Clinical Microbiology Reviews. 28 (3), 687-720 (2015).
- Pitkanen, T. a., H, M. L., Rose, J. B., Jimenez-Cisneros, B. . Global Water Pathogen Project. , (2017).
- Fitzgerald, C., et al. Multicenter Evaluation of Clinical Diagnostic Methods for Detection and Isolation of Campylobacter spp. from Stool. Journal of Clinical Microbiology. 54 (5), 1209-1215 (2016).
- Kirkpatrick, B. D., Tribble, D. R. Update on human Campylobacter jejuni infections. Current Opinion in Gastroenterology. 27 (1), 1-7 (2011).
- CDC. Incidence and Trends of Infection with Pathogens Transmitted Commonly Through Food - Foodborne Diseases Active Surveillance Network, 10 U.S. Sites, 2006-2013. Morbidity and Mortality Weekly Report. 63, 328-332 (2014).
- Jaime, A. L., et al. Campylobacter upsaliensis: Another Pathogen for Consideration in the United States. Clinical Infectious Diseases. 34 (11), 59-60 (2002).
- Bullman, S., O'Leary, J., Corcoran, D., Sleator, R., Lucey, B. Molecular-based detection of non-culturable and emerging campylobacteria in patients preseting with gastroenteritis. Epidemiology and Infection. 140, 684-688 (2012).
- Giltner, C. L., Saeki, S., Bobenchik, A. M., Humphries, R. M. Rapid Detection of Campylobacter Antigen by Enzyme Immunoassay Leads to Increased Positivity Rates. Journal of Clinical Microbiology. 51 (2), 618-620 (2013).
- M'ikanatha, N. M., et al. Culturing stool specimens for Campylobacter spp., Pennsylvania, USA. Emerging Infectious Disease. 18, 484-487 (2012).
- Al Amri, A., Senok, A. C., Ismaeel, A. Y., Al-Mahmeed, A. E., Botta, G. A. Multiplex PCR for direct identification of Campylobacter spp. in human and chicken stools. Journal of Medical Microbiology. 56 (10), 1350-1355 (2007).
- Buss, J. E., et al. Campylobacter culture fails to correctly detect Campylobacter in 30% of positive patient stool specimens compared to non-cultural methods. European Journal of Clinical Microbiology & Infectious Diseases. 38, 1087-1093 (2019).
- Wohlwend, N., Tiermann, S., Risch, L., Risch, M., Bodmer, T. Evaluation of a Multiplex Real-Time PCR Assay for Detecting Major Bacterial Enteric Pathogens in Fecal Specimens: Intestinal Inflammation and Bacterial Load Are Correlated in Campylobacter Infections. Journal of Clinical Microbiology. 54 (9), 2262-2266 (2016).
- Couturier, B. A., Hale, D. C., Couturier, M. R. Association of Campylobacter upsaliensis with Persistent Bloody Diarrhea. Journal of Clinical Microbiology. 50 (11), 3792-3794 (2012).
- Chaban, B., Musil, K. M., Himsworth, C. G., Hill, A. K. Development of cpn60-Based Real-Time Quantitative PCR Assays for the Detection of 14 Campylobacter Species and Application to Screening of Canine Fecal Samples. Applied and Environmental Microbiology. 75, 3055-3061 (2009).
- Allos, B., Blaser, M. J., Mandell, G. L., Bennett, J. E., Dolin, R. . Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases, 7th ed. , 2793-2802 (2009).
- Anderson, N. W., Buchan, B. W., Ledeboer, N. A. Comparison of the BD MAX Enteric Bacterial Panel to Routine Culture Methods for Detection of Campylobacter, Enterohemorrhagic Escherichia coli (O157), Salmonella, and Shigella Isolates in Preserved Stool Specimens. Journal of Clinical Microbiology. 52 (4), 1222-1224 (2014).
- Wasfy, M., Oyofo, B., Elgindy, A., Churilla, A. Comparison of preservation media for storage of stool samples. Journal of Clinical Microbiology. 33 (8), 2176-2178 (1995).
- Bessède, E., Delcamp, A., Sifre, E., Buissonniere, A., Mégraud, F. New Methods for Detection of Campylobacters in Stool Samples in Comparison to Culture. Journal of Clinical Microbiology. 49 (3), 941-944 (2011).
- Bessède, E., et al. Evaluation of the Diagnostic Accuracy of Two Immunochromatographic Tests Detecting Campylobacter in Stools and Their Role in Campylobacter Infection Diagnosis. Journal of Clinical Microbiology. 56 (4), (2018).
- Shane, A. L., et al. Infectious Diseases Society of America Clinical Practice Guidelines for the Diagnosis and Management of Infectious Diarrhea. Clinical Infectious Diseases. 65 (12), 1963-1973 (2017).
- Toledo, Z., Simaluiza, R. J., Astudillo, X., Fernández, H. Occurrence and antimicrobial susceptibility of thermophilic Campylobacter species isolated from healthy children attending municipal care centers in Southern Ecuador. Revista do Instituto de Medicina Tropical de Sao Paulo. 59, 77-77 (2017).
- Lee, G., et al. Symptomatic and asymptomatic Campylobacter infections associated with reduced growth in Peruvian children. PLoS Neglected Tropical Diseases. 7 (1), 2036 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved