Method Article
Культура Методы, чтобы определить предел обнаружения и выживания в транспорте СМИ Campylobacter Jejuni в человека фекальные Specimens
В этой статье
Резюме
Хотя культура стула для Campylobacter неточна, она по-прежнему считается золотым стандартом для идентификации. Методы определения предела обнаружения и выживаемости в транспортных носителях C. jejuni в человеческом стуле описаны и сравниваются с новым иммуноанализом с большей точностью.
Аннотация
Культура из человеческого стула для диагностики Campylobacterоснове кишечной болезни занимает несколько дней, ждать, что налоги на стойкость врача и пациента. Культура также склонна к ложным негативным результатам от случайной потери жизнеспособности во время обработки образцов, разрастания других фекальных флоры и плохого роста нескольких патогенных видов Campylobacter на традиционных носителях. Эти проблемы могут свести с усдолжно клинические решения по лечению пациентов и ограничить поле от ответа на фундаментальные вопросы о росте Campylobacter и инфекций. Мы описываем процедуру, которая оценивает нижний предел бактериальных чисел, которые могут быть обнаружены культурой и методом количественной оценки выживания C. jejuni в средствах массовой информации, используемых для транспортировки этого хрупкого организма. Зная эту информацию, становится возможным установить клинически соответствующие пороги обнаружения для диагностических тестов и решить неизученные вопросы о том, несимптоматической колонизации распространена, если совместное заражение с другими энтерационными патогенами является общим, или если бактериальная нагрузка коррелирует с симптомами или серьезные sequelae. Исследование также включало тестирование 1552 потенциально собранных пациентов диареи фекальных образцов, которые были первоначально классифицированы традиционной культуры и дальнейшего тестирования нового фермента иммуноанализа. Положительные и неустранимые образцы были затем проверены четырьмя молекулярными методами для присвоения истинно-положительного или истинно отрицательного статуса. 5 некультурных методов показали полное согласие по всем 48 положительным и несогласным образцам, в то время как культура неправильно идентифицировала 14 (28%). Образцы, которые были неправильно идентифицированы культурой, включали 13 ложно-отрицательных и 1 ложноположительный образец. Этот базовый протокол может быть использован с несколькими Campylobacter spp. и позволит номера бактерий Campylobacter, которые производят симптомы гастроэнтерита у людей, которые будут определены и распространенности ставки будут обновлены.
Введение
Центры Соединенных Штатов по контролю заболеваний (CDC) недавно опубликовал, что пищевые болезни Активное наблюдение сети (FoodNet) программа эпиднадзора сообщили 9723 случаев лабораторно-диагностированных инфекций Campylobacter в 20181. Это на 12% больше, чем в отчетах о делах Campylobacter за 2015–2017гг. 1. Во всем мире, Campylobacter spp. являются одними из наиболее распространенных бактериальных кишечных инфекций2. Тем не менее, число Campylobacterоснове кишечных заболеваний, которые происходят каждый год, как предполагается, занижены3. Эта недооценка предсказуема, потому что большинство пациентов могут восстановиться только с умеренным дискомфортом и без лечения. Тем не менее, для пациентов с более тяжелыми симптомами или которые подвергаются более высокому риску серьезных заболеваний, а затем обратиться за медицинской помощью, табурет культуры является наиболее распространенным методом для оценки ли Campylobacter является патогеном, который вызывает их бедствия4.
Для Campylobacter spp., культура стула особенно хлопотно. Наиболее распространенными патогенными организмами, C. jejuni, C. coli, C. upsaliensis, и C. lari, являются микроаэрофильные5. Это означает, что бактерии будут умирать наугад, неизвестные темпы после воздействия воздуха. Таким образом, время между сбором и культурой образцов становится неконтролируемой переменной в способности обнаруживать жизнеспособный Campylobacter spp.
Для непосредственной культуры фекальных образцов, медленный рост Campylobacter также является проблемой. Колонии Кампилобактерочень очень малы даже после 48 ч инкубации и могут быть легко покрыты конкурирующими организмами в фекальной матрице. Пластины, которые содержат антибиотики, к которым большинство штаммов C. jejuni и C. coli являются устойчивыми широко используются, как антибиотики подавляют рост многих (но не все) конкурирующих фекальных бактерий, что позволяет лучше визуализации колоний Campylobacter 6. Тем не менее, другие виды Campylobacter, такие как C. lari и C. upsaliensis чувствительны к некоторым из этих антибиотиков, и либо растут плохо или не на всех. Это способствует занижению данных о инфекциях Campylobacter от этих чувствительных к антибиотикам видов7.
Существует третья причина, почему культура для Campylobacter может быть неточным. Бактерии, когда подчеркнул, может оставаться жизнеспособным, но может стать "не-виновной"8. Это по определению означает, что культура не будет обнаруживать бактерии, присутствующие в образце. Как часто это происходит, не известно8.
Учитывая эти потенциальные проблемы с культурой, мы использовали несколько методов сравнения, чтобы неисправные результаты культуры не сделали ни одного анализа компаратора неточным9. Использовались методы культуры (например, Campylobacter-селективныепластины, транспортная среда, газогенерирующие пакетики), потому что они широко используются в клинических лабораториях для образца стула культуры10.
Описанные здесь культурные протоколы были разработаны потому, что не было известно наименьшее число Campylobacter jejuni, которые могли быть обнаружены культурой в человеческом стуле. Хотя оценки были опубликованы для числа колоний формирования единиц (CFU), присутствующих в птицеводческой фекалии11,эти результаты не могут быть приравнены к человеческому стулу, как Campylobacter spp. являются commensals у кур, и не вызывают диарею. Эта фундаментальная информация необходима для определения количества бактерий Campylobacter, которые будут производить симптомы гастроэнтерита у людей и сравнить вирулентность между штаммами или видами.
протокол
1. Перечисление Campylobacter в надуманных человека фекальные образцы
ПРИМЕЧАНИЕ: Все шаги выполняются с использованием стерильной техники и материалов на одноразовом защитном листе в дезинфицированном ламинарном капоте безопасности потока.
ВНИМАНИЕ: Live Campylobacter являются инфекционными и может вызвать болезнь, в том числе диарея. Носите перчатки, лабораторное пальто и защитные очки при обращении с бактериями. Не рот пипетка. Утилизировать весь материал, который контактировал с бактериями в надлежащих контейнерах для биоопасности.
- Рост фондовой культуры бактерий
- Получить штаммы C. jejuni (ATCC-33560) или C. coli (ATCC 33559) (Таблица материалов) в качестве сушеных или замороженных культур и регидратировать или оттепель бактерий в соответствии с инструкциями производителя. Полоса регидратированных бактерий на Campylobacter-специфическийагар пластины, чтобы начать культуру. Инкубировать пластину 48 ч при 37 градусах Цельсия в анаэробной банке, содержащей микроаэробную атмосферу газогенерирующего пакетика.
- На следующий день, подготовить 100 мл инфузии сердца (BHI) рост бульона, содержащего 0,5% триптик, 0,5% протеазы пептон, 0,0125% пируват натрия, и 0,0125% натрия бизурфита.
- Prereduce бульон BHI путем покрывать колбу свободно и устанавливать его в анаэробную банку с пакетиком который произведет микроаэрофильной окружающей среды. Разрешить бульон для предварительного сокращения на ночь при 37 градусах Цельсия. Аналогичным образом, prereduce Campylobacter-специфическиеплиты, которые будут использоваться для колонии рассчитывает в шагах 1.1.10 и 1.2.2.
- Как Campylobacter чувствительны к воздуху, собрать все материалы, прежде чем привить бульон и не бездельничать при обработке культур. Когда готовы привить, добавить сыворотки крупного рогатого скота плода (FBS) для предварительно горит до 4% от общего объема. Сохранить 1 мл предварительно сокращенного бульона, чтобы служить пустым в измерениях оптической плотности на 600 нм (OD600).
- Удалите 3 мл предварительно сокращенного бульона, содержащего FBS, и используйте бульон, чтобы очистить стартерпластинку, содержащую культуру Campylobacter. Аккуратно соскребите пластину с прививки петли, а затем передать бактериальной суспензии в стерильной трубке.
- Прививать 100 мл предварительно уменьшенного бульона с приблизительно 3 мл бактериальной суспензии и инкубировать с умеренной тряской при 115 об/мин при 37 градусах По Цельсию в анаэробной банке, содержащей газогенерирующий пакетик.
- Мониторинг роста бактерий спектрофотометрически при мутности при OD600. Используйте зарезервированный бульон в качестве заготовки. Если анаэробная банка открыта, замените газогенерирующий пакетик.
- Остановить инкубацию бульона после 48-72 ч или до того, как значение OD600 достигнет 0,4 евро.
ПРИМЕЧАНИЕ: Этот OD600 обычно приравнивается к 107 до 108 CFU/mL. См таблица 1 для типичных результатов. - Чтобы установить количество бактерий в чистой культурезапасов,выполнить восемь 10-раз раз разбавления серии 100 л бульона в 900 л буфера разбавления ( Таблица материалов ). После того, как 100 л бульона был удален для первого разбавления, возвращение колбу в анаэробную банку со свежим газогенерающим пакетиком, чтобы ждать использования в колючий фекальный бассейн.
- Используйте стерильные покрытия шариков для распространения 100 зл от 10-5 до 10-7 разбавления на дублировать предварительно кэмпилобактер-специфическиепластины от шага 1.1.3. Этикетка пластин с разбавления используется, поместите их во второй анаэробной банке с газогенерацией пакетик, и инкубировать при 37 градусов по Цельсию для 48-72 ч.
ПРИМЕЧАНИЕ: См. Рисунок 1 и Рисунок 2 для схемы разбавления и фотографии колоний. - После роста выберите табличку с 30-300 колониями для подсчета. Используйте подсчеты для определения CFU/mL культуры бульонного бульона с помощью Equation 1:
CFU/mL на складе - Средний - колоний на выбранных (дубликатовых) аналитических пластинах (mL покрынные х разбавления пластины) «Уравнение 1»
- Подготовка и перечисление надуманных клинических фекальных образцов
- Сразу после того, как пластины для аналитических подсчетов готовятся в шаге 1.1.10, сделайте второй комплект бульонного бульона разбавления, подготовив 10 серийных 2-кратных разбавлений из бульонного бульона и Campylobacter-отрицательный фекальный бассейн (NFP). Например, подготовить первое разбавление путем смешивания равных объемов бульона и НПФ (например, 0,1 мл каждый) и сделать последующие разбавления путем передачи назначенного объема бульона и смеси NFP в трубку с равным обозначенным объемом НПФ. Добавьте контрольную пластину с бульоном, не содержащим Campylobacter добавил в фекальный бассейн, чтобы помочь определить,не-Campylobacter колоний.
- Сделать NFP из де-идентифицированных, диарейный пациент наблюдения образцов или здоровых донорских стульев, которые ранее были протестированы и оказались Campylobacter-негативныйметодами, такими как фермент Campylobacter иммуноанализ и 16S rRNA qPCR.
- T-полоса 10 зл и l каждого Campylobacter/stool разбавления на дублировать prereduced Campylobacter-специфическиеплиты агара. Поместите тарелки в анаэробную банку с газогенерающим пакетиком и инкубировать при 37 градусах по Цельсию за 48 и 2 ч.
- Изучите полосатые пластины визуально для колоний, напоминающих те из чистых культур Campylobacter.
ПРИМЕЧАНИЕ: Третий квадрант, как правило, где они будут найдены. См Рисунок 1 и Рисунок 2 для схемы разбавления и изображения размера колонии, цвета и морфологии. - Выберите несколько Campylobacter-какколонии и Грам пятно. Используя микроскопию с линзой погружения масла, исследуете тонко полосатую область для грамотрицательных изогнутых, спиральных или сигарообразных мелких бактерий.
ПРИМЕЧАНИЕ: Campylobacter являются Грам-отрицательным и требуют основных фуксина в качестве контрпятна (вместо типичного safranin), которые будут визуализированы точно. Классические крылатые бактерии чайки могут быть замечены, но не являются обязательным требованием. См Рисунок 2 для репрезентативного микрографа. - Если любой из дубликатов пластин на конкретный разбавления имеет 1 или более колоний Campylobacter настоящее время, считают, что разбавление фекалий культуры положительные.
- Рассмотрим последний разбавления, который содержит видимые Campylobacter-какграмм-отрицательная колония предел обнаружения культуры. Используйте Equation 2 для расчета CFU/mL положительного разбавления в надуманных клинических фекальных образцов:
CFU/mL в фекальной выборке - Аналитический CFU/mL - Разбавление с последней положительной колонией »Equation 2»
ПРИМЕЧАНИЕ: См. Таблицу 2 для типичных результатов.
- Сразу после того, как пластины для аналитических подсчетов готовятся в шаге 1.1.10, сделайте второй комплект бульонного бульона разбавления, подготовив 10 серийных 2-кратных разбавлений из бульонного бульона и Campylobacter-отрицательный фекальный бассейн (NFP). Например, подготовить первое разбавление путем смешивания равных объемов бульона и НПФ (например, 0,1 мл каждый) и сделать последующие разбавления путем передачи назначенного объема бульона и смеси NFP в трубку с равным обозначенным объемом НПФ. Добавьте контрольную пластину с бульоном, не содержащим Campylobacter добавил в фекальный бассейн, чтобы помочь определить,не-Campylobacter колоний.
2. Определение жизнеспособности Campylobacter Хранится в транспортных средствах массовой информации
- Смешайте 1 мл культа бульона Campylobacter (шаг 1.1.8) с 1 мл NFP и подготовьте 10 дубликатов двукратных серийных разбавлений в НПФ. Дальнейшее разбавление каждого разбавления дополнительные 1:4 в Кэри-Блэр СМИ, так же, как клинический образец, подготовленный в транспортных средствах массовой информации рассматривается.
- Храните 20 пробарованных трубок и отрицательный контроль в среде Кэри-Блэр в крышках труб ок на 2'8 градуса по 96 ч и подсчитайте колонии от каждого разбавления, происходящих в нулевое время и каждые 24 ч. Для подсчета колоний, образец бульона: фекальные трубки и установки фекальной культуры для колонии подсчета каждого разбавления, в дубликате.
- Каждый день пластины 10 порций фекальных разбавлений на Campylobacter-селективныйагар и инкубировать при 37 кс для 48 ч, как описано выше в шагах 1.1.9-1.2.7.
- Выполните одновременный аналитический подсчет пластин оригинального бактериального бульона (от шага 1.1.8 или свежевыращенного бульона), как описано выше (шаги 1.1.9-1.1.11). Рассчитайте CFU/mL оригинального бактериального запаса(Equation 1) для расчета концентрации бактерий в фекальном образце транспортных носителей и его разбавлениях (Equation 2).
3. Некультурные анализы для проверки результатов культуры
- Используйте фермент иммуноанализ (ОВОС), который дает минимальные ложные положительные результаты12 и выполнять в соответствии с инструкциями по вставке упаковки для проверки результатов культуры.
- Используйте молекулярный анализ, который может обнаружить ген 16S rRNA или другой ген широкого спектра видов Campylobacter 13. Подтвердите, что молекулярный анализ реагирует с такими видами, как C. upsaliensis или C. lari, которые плохо растут на стандартном антибиотико-содержащем агаре14. Следуйте инструкциям производителя по извлечению ДНК из фекальных образцов и выполнению теста.
ПРИМЕЧАНИЕ: Двунаправленное секвенирование ДНК ампликона 16S может быть использовано для подтверждения вида Campylobacter в положительном образце. Видовые ПЦР (см. таблицу 3 для генов-мишеней) также могут быть использованы для идентификации видов, присутствующих в нерептилий или положительных образцов15.
Результаты
Выявление Campylobacter spp. колоний среди конкурирующих фекальной флоры требует острого зрения и значительного суждения. Наименьшее число колоний, которые могут быть обнаружены культурой не были изучены, хотя образцы от пациентов, по оценкам, гавани 106109 CFU/mL16,17. Тем не менее, образцы пациентов не могут быть использованы количественно, как нет независимого метода для установления точных бактериальных чисел. Чтобы преодолеть это ограничение, два одновременных измерения производятся с одним бактериальным запасом. Один тест используется для визуального обнаружения колоний Campylobacter от серийных разбавлений фондовых бактерий в фекальной матрице, имитирующих клинические образцы; другой используется аналитически для количественной оценки CFU/mL присутствует в бактериальной культуры запасов, используемых для пикирования(Рисунок 2A).
Пороги обнаружения для Campylobacter не будут определены значениями. Этого следует ожидать, потому что каждая фекальная матрица сложна и уникальна, а рост бактерий является переменным. Ключевым параметром успеха является определение точного размера колоний среди конкурирующих фекальной флоры. Репрезентативная пластина культуры стула с шипами показана на рисунке 2C и рисунке 2D. Отрицательная контрольная пластина без добавления Campylobacter имеет важное значение, чтобы помочь определить другие фекальные флоры. Gram окрашивания многих кандидатов также тренирует глаз, чтобы различать правильные глянцевые колонии и промежуточный розовый цвет фуксина окрашенных грамотрицательных бактерий и подтверждает морфологию бактерий в выбранных колониях (Рисунок 2B). Было проведено семь независимых экспериментов с использованием 5 бульонов C. jejuni и 2 C. coli, и были установлены пороговые значения, которые перекрывались и охватывали от 0,3 х 5 х 106 CFU/mL. См таблица 2 для типичных данных. Пределы обнаружения в среднем 2 x 106 для C. jejuni и 1,2 x 106 CFU/mL для C. coli. Это указывает на то, что культура, скорее всего, может обнаружить 1 х 2 х 106C. jejuni или C. coli на грамм фекального образца на стандартном антибиотико-содержащем Campylobacter-специфическомагаре, используемом во многих клинических лабораториях. Есть несколько специализированных агаров с различными антибиотиками, которые могут дать различные пороги для обнаружения колонии. Описанные здесь методы должны способствовать более количественным и сравнительным исследованиям для повышения точности культуры и расширения универсальности новых средств массовой информации. Например, на первых 10-5 плитах было подсчитано 152 колонии, а на второй 10-5 - 144 колонии. Среднее значение между двумя плитами составляет 148 колоний. Пластины были привиты 0,1 мл (100 л) 10-5 разбавления, что в уравнении 1 приравнивается к 148 х 106 (14,8 х 107) CFU/mL в чистом культурном запасе. Когда фекальные разбавления были сделаны, культура была шипами в отрицательном фекальном бассейне в соотношении 1:1. Таким образом, по уравнению 2, первая точка (пластина "a") на фекальной кривой соответствует 14,8 х 107 разделены на 2 и равна 7,4 х 107 CFU/mL. Эта трубка "а" используется для сделать 9 дополнительных разбавлений. На рисунке 1, последнее разбавление с одной видимой грамм-негативной колонии с Campylobacter-какморфология находится на пластине "g". Это приравнивается к 1,1 х 106 CFU/mL для фекальной культуры порог обнаружения в этом примере.
Несмотря на то, что устойчивая жизнеспособность является ключом к точности культуры, сохранение жизнеспособности Campylobacter spp. во время обработки и отгрузки образцов от пациентов в клиники в справочные лаборатории является проблематичным. Типичным хранением является охлаждение образцов в обычных закрытых трубах с воздействием воздуха и без особой атмосферы. Считается, что в транспортных носителях (также известных как сохраненные образцы) выживаются образцы, но есть несколько отчетов, которые предоставляют количественные данные18.
Сочетание показанных выше аналитических и надуманных методов выборки вновь использовалось для получения оценки жизнеспособности и времени выживания C. jejuni в транспортных средствах массовой информации. Бактериальный бульон был использован для подготовки десяти дубликатов 2-раз 1024-кратный образец разбавления в фекальной матрицы. Первоначальный бульон был обнаружен аналитическими подсчетами, чтобы иметь концентрацию 4,8 х 107 CFU/mL. На пластинах, сделанных на день 0, C. jejuni был обнаружен (2 дня спустя) на пластине полосатый с 32-раз разбавления, что эквивалентно 1,5 х 106 CFU/mL. Однако, на пластинах, сделанных после охлаждения фекального образца Кэри Блэр в течение 24 часов, только 2-кратное разбавление (эквивалент 2,4 х 107 CFU/mL) выросли видимые колонии. Не было замечено дальнейшей потери жизнеспособности до 96 часов, когда исследование было остановлено. Эта потеря жизнеспособности приравнивается к 16-кратной (94%) потеря виновных организмов менее чем за 24 часа и указывает на то, что, даже при охлаждении, стул в Кэри Блэр среде с менее чем 107 CFU/mL C. jejuni может быть пропущенкультуро.
В отличие от результатов культуры, ОВОС обнаружило присутствие C. jejuni на 256-кратном разбавлении в начальную точку времени и в течение 4-дневного периода тестирования. Порог обнаружения C. jejuni для этого ОВОС с использованием шипами фекальных образцов составляет 8,4 х 104 CFU/mL. Этот порог ниже, чем фекальной культуры и позволяет более чувствительным и стабильным обнаружения C. jejuni.
Чтобы проверить способность культуры обнаруживать Campylobacter spp. в реальной клинической обстановке, 1552 клинических образца стула были охарактеризованы 6 процедурами: фекальная культура, новый иммуноанализ для Campylobacter spp., и 4 молекулярных метода. Все образцы были первоначально собраны и первоначально классифицированы по традиционной культуре в 3 лабораториях в Соединенных Штатах, а затем перепроверены ОВОС. Любые культурно-положительные или ОВОС /культурно-дискреантные образцы затем были проверены молекулярными методами12. На основе результатов 5 некультурных методов был присвоен истинно-положительный или истинно-отрицательный статус. 5 некультурных методов показали полное согласие по всем 48 положительным и несогласным образцам, в то время как культура неправильно идентифицировала 14 (28%). Образцы, которые были неправильно идентифицированы культурой, включали 13 ложно-отрицательных и 1 ложноположительный образец.

Рисунок 1: Схема одновременной подготовки аналитических и шипованных фекальных образцов. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
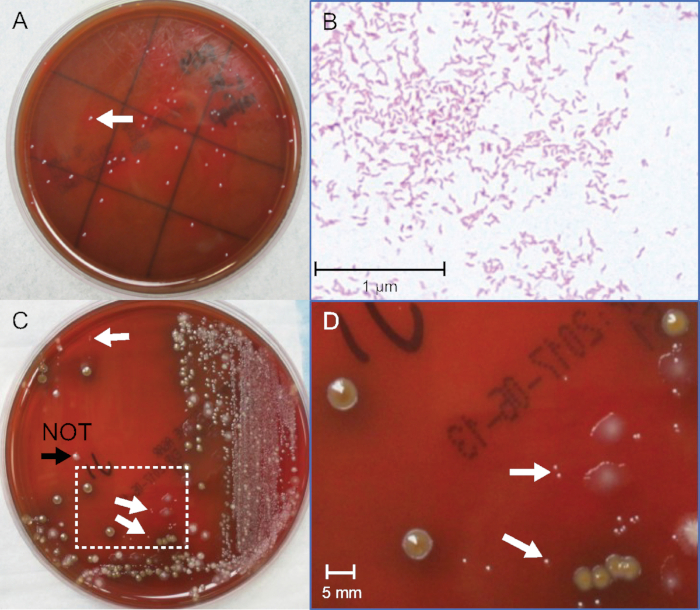
Рисунок 2: Идентификация колоний C. jejuni из чистых и фекальных культур. (A) Фотография колоний C. jejuni из чистой бактериальной культуры после 72 часов инкубации. (B) Грам пятно C. jejuni от чистой бактериальной культуры, масло-погружение 400x увеличение. (C) Фотография C. jejuni-позитивной шипами фекальной культуры после 48 h инкубации. (D) Увеличенная область в коробке в (C), 10x увеличение. Белые стрелки указывают на точечный размер граммотрицательных колоний C. jejuni. Черная наконечник стрелы указывает на колонию, которая немного больше, грамм-положительный, а не C. jejuni. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Культур | OD600 и T0 | OD600 - T Финал1 | Окончательный CFU/mL |
| К. Джеджуни | 0.146 | 0.321 | 1.28 x 107 |
| C. coli | 0.245 | 0.508 | 4.50 x 108 |
Таблица 1: Типичный рост и CFU/mL c. jejuni и C. coli запасов. 1КультураC. jejuni была остановлена после 48 ч инкубации. C. coli культура была остановлена после 54 ч инкубации.
| Пробаренчная трубка для шипового фекального образца | Количество Кампилобактер-какколонии | Количество грамм-отрицательных колоний1 | Культура позитивная? | Рассчитанный CFU/mL шипами образца | |
| C. jejuni (1.28 x 108 CFU/mL шт. | (2 раза) | Плотной | nd2 | Да | 6.40 x 107 |
| (4 раза) b | 20 евро | Nd | Да | 3.20 x 107 | |
| (8 раз) c | 4-10 | Nd | Да | 1.60 x 107 | |
| (16 раз) г | Nd | Да | 8.00 x 106 | ||
| (32 раза) e | Nd | Да | 4.00 x 106 | ||
| (64 раза) f | 1-3 | 1 из 2 | Да | 2.00 x 106 | |
| (128 раз) г | 2 из 3 | Да | 1.00 x 106 | ||
| 3(256 раз) ч | 1 из 2 | Да | 5.00 x 105 | ||
| (512 раз) i | 0 из 1 | Нет | 2.50 x 105 | ||
| (1024 раза) j | 0 | Nd | Нет | Nfp | |
| C. coli (4.50 x 108 CFU/mL stock) | (2 раза) | Плотной | Nd | Да | 2.25 x 108 |
| (4 раза) b | Nd | Да | 1.13 x 108 | ||
| (8 раз) c | 50 лет | Nd | Да | 5.63 x 107 | |
| (16 раз) г | 30 евро | Nd | Да | 2.81 x 107 | |
| (32 раза) e | 10 евро | Nd | Да | 1.41 x 107 | |
| (64 раза) f | 3-8 | Nd | Да | 7.03 x 106 | |
| (128 раз) г | Nd | Да | 3.52 x 106 | ||
| 3(256 раз) ч | 1-3 | 1 из 3 | Да | 1.76 x 106 | |
| (512 раз) i | 0 из 1 | Нет | 8.79 x 105 | ||
| (1024 раза) j | 0 | Nd | Нет | Nfp |
Таблица 2: Типичное количество колоний на пластинах с шипами фекальных образцов. 1 Грамм отрицательных колоний среди Campylobacter-как колонии, 2nd й не определено, 3Данные в смелейшем типе показывает последнее положительное разбавление.
| Видов | Цель гена |
| К. Джеджуни | Hipo |
| C. coli | cadF |
| C. upsaliensis | cpn60 |
| C. lari | cpn60 |
| C. helveticus | cpn60 |
| К. плод | cpn60 |
| C. hyointestinalis | cpn60 |
| C. concisus | cpn60 |
Таблица 3: Гены полезны для обнаружения отдельных видов Campylobacter qPCR.
Обсуждение
Описанные здесь методы культуры основаны на простых, широко используемых методах и материалах, доступных в большинстве лабораторий10. Именно сочетание аналитических и надуманных образцов дает новую информацию о клинически соответствующем пороге обнаружения фекальных культур. Кроме того, вынесение решений о культуре с 5 отдельными анализами укрепляет выводы о том, что фекальная культура Campylobacter неправильно идентифицирует значительную часть образцов пациентов. ОВОС и молекулярные анализы полезны в качестве контроля, потому что каждый из них основан на другом принципе (антигенное взаимодействие с антителами против усиления ДНК) и, что важно, не полагаются на жизнеспособность бактерий. Обратите внимание, что анализ ОВОС, используемый для этих исследований, хорошо проверен и, как было показано, полностью согласен с 4 молекулярными тестами12.
Культура Campylobacter spp. особенно хлопотно, с чувствительностью сообщается, в диапазоне от 60-76%19,20, и, как видно из его 30% скорость неспособности обнаружить истинно положительные образцы здесь. Персонал может ожидать, что контроль ОВОС и молекулярные тесты часто дают положительные результаты, когда данные о культуре отрицательные.
Наиболее важным шагом в протоколе является выявление точечных колоний среди конкурирующих фекальных флоры. Нередко, поскольку разбавления вблизи порога обнаружения имеют переменные нулевые и ненулевые оценки количества колоний (например, 2, 0, 1, 0, 0). Важно признать, что культурные пороговые значения будут диапазоном концентраций, а не конкретным CFU/mL. Тем не менее, оценка в 1 х 106 CFU/mL фекалии в качестве нижнего предела для обнаружения культуры хорошо сравнивает с сообщениями о том, что инфицированные люди пролить 106 до 109Campylobacter за грамм кала21. Изменения в антибиотиках или агарпластинах и вариации, неизбежные в отдельных фекальных образцах, несомненно, изменят пороговые значения. Этот протокол должен способствовать улучшению медиа-медиа роста.
Эта первая информация о пределе для обнаружения культуры позволяет установить клинически значимые пороги для диагностических тестов, и закладывает микробиологическую основу, которая необходима для решения неизученных вопросов несимптоматической перевозки22,23 Campylobacter, или если бактериальная нагрузка коррелирует с симптомами или серьезными сиквелами.
Раскрытие информации
Авторы являются сотрудниками TECHLAB, Inc,, которая производит комплект ™, используемый в качестве компаратора в этой статье.
Благодарности
Эти исследования финансировались TECHLAB, Inc.
Материалы
| Name | Company | Catalog Number | Comments |
| Anaerobic 3.5L Jar | Thermo Fisher | HP0031A | |
| AnaeroGRO Campylobacter Selective Agar | Hardy Diagnostics | AG701 | |
| Bacto Brain Heart Infusion | BD Biosciences | 237500 | |
| Bacto Protease Peptone | Life Technologies Corp | 211684 | |
| Basic Fuchsin | Fisher Scientific | B12544 | |
| BBL Trypticase Peptone | Life Technologies Corp | 211921 | |
| C. coli Type strain | ATCC | 33559 | |
| C. jejuni Type strain | ATCC | 33560 | |
| CampyGen gas generating system sachet | Thermo Fisher | CN0025A | |
| Campylobacter QUIK CHEK | TechLab, Inc. | T5047 / T31025 | |
| Cary-Blair transport medium | Fisher Scientific | 23-005-47 | |
| Coli Roller Sterile plating beads | Millipore Sigma | 71013 | |
| Dilution Buffer | Anaerobe Systems | AS-908 | |
| Fetal bovine serum | Equitech-Bio, Inc | SFBM30 | |
| Sodium bisulfite | Sigma-Aldrich | 243973 | |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| Spectrophotometer cuvettes | USA Scientific | 9090-0460 |
Ссылки
- . Annual Summaries of Foodborne Outbreaks Available from: https://www.cdc.gov/fdoss/annual-reports/index.html (2018)
- Kaakoush, N. O., Castaño-Rodríguez, N., Mitchell, H. M., Man, S. M. Global Epidemiology of Campylobacter Infection. Clinical Microbiology Reviews. 28 (3), 687-720 (2015).
- Pitkanen, T. a., H, M. L., Rose, J. B., Jimenez-Cisneros, B. . Global Water Pathogen Project. , (2017).
- Fitzgerald, C., et al. Multicenter Evaluation of Clinical Diagnostic Methods for Detection and Isolation of Campylobacter spp. from Stool. Journal of Clinical Microbiology. 54 (5), 1209-1215 (2016).
- Kirkpatrick, B. D., Tribble, D. R. Update on human Campylobacter jejuni infections. Current Opinion in Gastroenterology. 27 (1), 1-7 (2011).
- CDC. Incidence and Trends of Infection with Pathogens Transmitted Commonly Through Food - Foodborne Diseases Active Surveillance Network, 10 U.S. Sites, 2006-2013. Morbidity and Mortality Weekly Report. 63, 328-332 (2014).
- Jaime, A. L., et al. Campylobacter upsaliensis: Another Pathogen for Consideration in the United States. Clinical Infectious Diseases. 34 (11), 59-60 (2002).
- Bullman, S., O'Leary, J., Corcoran, D., Sleator, R., Lucey, B. Molecular-based detection of non-culturable and emerging campylobacteria in patients preseting with gastroenteritis. Epidemiology and Infection. 140, 684-688 (2012).
- Giltner, C. L., Saeki, S., Bobenchik, A. M., Humphries, R. M. Rapid Detection of Campylobacter Antigen by Enzyme Immunoassay Leads to Increased Positivity Rates. Journal of Clinical Microbiology. 51 (2), 618-620 (2013).
- M'ikanatha, N. M., et al. Culturing stool specimens for Campylobacter spp., Pennsylvania, USA. Emerging Infectious Disease. 18, 484-487 (2012).
- Al Amri, A., Senok, A. C., Ismaeel, A. Y., Al-Mahmeed, A. E., Botta, G. A. Multiplex PCR for direct identification of Campylobacter spp. in human and chicken stools. Journal of Medical Microbiology. 56 (10), 1350-1355 (2007).
- Buss, J. E., et al. Campylobacter culture fails to correctly detect Campylobacter in 30% of positive patient stool specimens compared to non-cultural methods. European Journal of Clinical Microbiology & Infectious Diseases. 38, 1087-1093 (2019).
- Wohlwend, N., Tiermann, S., Risch, L., Risch, M., Bodmer, T. Evaluation of a Multiplex Real-Time PCR Assay for Detecting Major Bacterial Enteric Pathogens in Fecal Specimens: Intestinal Inflammation and Bacterial Load Are Correlated in Campylobacter Infections. Journal of Clinical Microbiology. 54 (9), 2262-2266 (2016).
- Couturier, B. A., Hale, D. C., Couturier, M. R. Association of Campylobacter upsaliensis with Persistent Bloody Diarrhea. Journal of Clinical Microbiology. 50 (11), 3792-3794 (2012).
- Chaban, B., Musil, K. M., Himsworth, C. G., Hill, A. K. Development of cpn60-Based Real-Time Quantitative PCR Assays for the Detection of 14 Campylobacter Species and Application to Screening of Canine Fecal Samples. Applied and Environmental Microbiology. 75, 3055-3061 (2009).
- Allos, B., Blaser, M. J., Mandell, G. L., Bennett, J. E., Dolin, R. . Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases, 7th ed. , 2793-2802 (2009).
- Anderson, N. W., Buchan, B. W., Ledeboer, N. A. Comparison of the BD MAX Enteric Bacterial Panel to Routine Culture Methods for Detection of Campylobacter, Enterohemorrhagic Escherichia coli (O157), Salmonella, and Shigella Isolates in Preserved Stool Specimens. Journal of Clinical Microbiology. 52 (4), 1222-1224 (2014).
- Wasfy, M., Oyofo, B., Elgindy, A., Churilla, A. Comparison of preservation media for storage of stool samples. Journal of Clinical Microbiology. 33 (8), 2176-2178 (1995).
- Bessède, E., Delcamp, A., Sifre, E., Buissonniere, A., Mégraud, F. New Methods for Detection of Campylobacters in Stool Samples in Comparison to Culture. Journal of Clinical Microbiology. 49 (3), 941-944 (2011).
- Bessède, E., et al. Evaluation of the Diagnostic Accuracy of Two Immunochromatographic Tests Detecting Campylobacter in Stools and Their Role in Campylobacter Infection Diagnosis. Journal of Clinical Microbiology. 56 (4), (2018).
- Shane, A. L., et al. Infectious Diseases Society of America Clinical Practice Guidelines for the Diagnosis and Management of Infectious Diarrhea. Clinical Infectious Diseases. 65 (12), 1963-1973 (2017).
- Toledo, Z., Simaluiza, R. J., Astudillo, X., Fernández, H. Occurrence and antimicrobial susceptibility of thermophilic Campylobacter species isolated from healthy children attending municipal care centers in Southern Ecuador. Revista do Instituto de Medicina Tropical de Sao Paulo. 59, 77-77 (2017).
- Lee, G., et al. Symptomatic and asymptomatic Campylobacter infections associated with reduced growth in Peruvian children. PLoS Neglected Tropical Diseases. 7 (1), 2036 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены