Method Article
創傷による多重化を研究する ショウジョウバエ モデル
要約
創傷誘発倍化は、細胞の損失を補うために分割する代わりに細胞のサイズが成長する保存された組織修復戦略です。ここでは、上皮創傷修復における策略とその遺伝的調節を測定するモデルとしてフルーツフライを使用する方法に関する詳細なプロトコルがあります。
要約
多倍数は、生物の健康と病気への影響がまだ十分に理解されていない頻繁な現象です。細胞は、その染色体の二倍体コピー以上を含む場合、多倍体として定義されます。組織修復では、創傷誘発性多重化(WIP)は、フルーツハエから脊椎動物への保存治癒戦略であることが判明している。WIPは、細胞増殖に対していくつかの利点を有する, 発癌性の成長および遺伝子毒性ストレスへの耐性を含む.課題は、なぜ多倍体細胞が生じ、これらのユニークな細胞がどのように機能するのかを特定することです。提供されるのは、穿刺創傷後2日以内に多プロイド細胞が生成される成体果実フライ上皮におけるWIPを研究するための詳細なプロトコルである。 D.メラノガスター の広範な遺伝的ツールキットを利用して、Mycを含むWIPを開始し、調節するために必要な遺伝子が同定され始めました。この方法を用いた継続的な研究は、性別、食事、年齢を含む他の遺伝的および生理学的変数がWIPの機能を調節し、影響を与える方法を明らかにすることができる。
概要
ショウジョウバエメラノガスターは、上皮創傷修復の細胞および分子機構を研究する魅力的なモデルシステムです。哺乳類と同様に、使用される組織修復機構は、組織とその発達段階の両方に依存する。上皮のリーディングエッジでアクトミオシン「財布ひも」が形成されるフルーツフライ胚では瘢痕のない創傷治癒が起こり、創傷をシームレスに11,22に閉じ込めてしまう。幼虫、子犬、および成体果実ハエにおける胚後創傷治癒は、細胞外マトリックスリモデリング、メラニン瘢痕形成、および上皮細胞増殖33、4、5、64,5,6をもたらす。上皮細胞は、細胞融合と内輪によって大きさが大きくなり、有糸分裂33、4、7、84,7,をバイパスする不完全な細胞周期である。その結果、細胞損失は細胞分裂の代わりに多倍体細胞増殖によって補償される。成人のハエ後腸、中腸、および濾胞上皮も、組織損傷後の細胞喪失を補償するために多発性細胞増殖に依存している99,10,,11.
多倍率は植物や昆虫の生物発達の有名な側面であるが、ここ数年で多プロイディは脊椎動物12の保存された組織修復戦略であるということがより明らかになってきた。その心臓を再生する能力を有するゼブラフィッシュは、損傷した外心13を治癒するために多倍体細胞増殖に依存している。多倍数はまた、急性傷害後の哺乳類の肝臓再生および腎尿細管上皮修復に寄与する14,15。,15これらの例では、多倍体細胞は、エンドサイクルまたはエンドミトーシスのいずれかを介してエンドレプリケーションによって生成され、これはサイトカネシス12のブロックによる二核細胞をもたらす。謎は、創傷修復中に多倍化細胞が生じる理由と、多プロイドが組織機能にどのように影響するかである。最近の研究は、多倍化が治癒の利点または欠点を提供するかどうかの問題に新しい洞察を提供しています。ゼブラフィッシュの外皮において、多倍化は創傷治癒13の速度を高める。D. メラノガスター後腸および哺乳動物の肝臓において、多プロイディは発癌性増殖11,14,14に対する保護であることが判明した。成体のハエ上皮では、最近、多プロイドが遺伝子毒性ストレス16の存在下で創傷修復を可能にすることが分かった。内用複製はDNA損傷に対して耐性があり、細胞増殖が損なわれると創傷治癒が可能になる17.しかし、マウスおよびゼブラフィッシュの心臓における心筋細胞の場合、多倍化は治癒を遅らせ、瘢痕形成18、19,19を増強する。したがって、臓器および/または細胞の種類に応じて、多倍化は有益または有害な組織修復戦略であり得る。D.メラノガスター遺伝学のアクセシビリティと創傷による多重化(WIP)応答の分析により、この創傷治癒戦略を導く分子および細胞機構を解明するための理想的なモデルシステムとなっています。
ここでは、成人 D.メラノガスター 上皮におけるWIPを分析するためのプロトコルを提示する。フルーツフライの損傷、解剖、免疫染色、取り付け、イメージング、および再上皮化、細胞融合、および内用複製(ploidy)の分析のための指示が含まれています。イメージングおよびプロイド解析は、WIPが発生するかどうかをテストするために他のモデルに適応することもできます。なお、核DNA含有量の増加に伴い、核サイズの増加が多い。しかし、生物学では、核の大きさがプロイド20の対応する変化を反映していない例が多くあります。細胞がしばしば広がったり、創傷部位を覆うために伸縮したりする創傷環境の文脈で核の大きさを解釈する場合は、さらに注意する必要があります。したがって、プロイドの変化の唯一の決定的な証拠は、この方法(または全ゲノムシーケンシングのような他の人)21によってDNA含有量を測定することにある。この方法は、創傷修復における多倍数の役割および調節を研究するモデルとして、成人 D.メラノガスター 腹部上皮の適合性を高める。
プロトコル
1. 成体のフルーツハエのステージングと負傷
- 選択した D.メラノガスター 株(すなわち、epi-Gal4/ UAS株、 材料表を参照)。
注:ここでは、Gal4/UASシステムは、UASの下流にコードされた遺伝子またはRNAiの上皮特異的遺伝子発現(epi-Gal4)を可能にするために使用されます。本研究では、蛍光膜タンパク質(UAS-Cd8.mRFP)、有糸誘導体(UAS-fzr RNAi、UAS-stg)、およびWIP阻害剤(UAS-E2F1RNAi;RNAiUAS-RacDN)。 - 生後3~5日まで25°Cの生鮮食品バイアルで、新たに封入された10〜15のメスフルーツハエをそれぞれ2回収集します。1つのバイアルは、以下に説明したように、損傷していないコントロールとして機能し、他のバイアルは負傷します。メスのハエは、雄(〜5/バイアル)で維持する必要があります。
- ハエを巻くために、1つの0.10 mmのステンレス鋼のピンとそれぞれ複数のピンホルダーを組み立てる。ピンの鋭い端が向いていることを確認します。ピンは、フライを穿刺した後に簡単に曲げたり、チップを切ったりすることができ、フックまたは損傷したピンは廃棄する必要があります。
- 老齢の雌のフルーツフライを実体顕微鏡下のCO2フライパッドで麻酔し、ペイントブラシを使用して列に並べます。安全メガネを着用し、片手にピンホルダーを持ち、もう一方の手に鉗子を持ち、腹側腹部を上に向けてハエを配置するために鉗子を使用します。
- 成人雌は、腹側中形の胸状突起の両側にあるテルジットA4の上皮性胸部領域内で飛ぶ(図1A)。この腹側領域を穿刺すると、組織の縁が機械的処理によって引き裂かれる解剖部位から最適な空間が得られます。
- 負傷したハエを食物バイアルに戻し、怪我後の希望の日(dpi)に年齢を重くします。上皮創傷治癒は1dpiから始まり、3dpiで終わる。Endoreplication は 2 dpi でピークを迎え、EdU アッセイに最適です (セクション 4,図 2)。
2. フライ腹部解剖
注:このステップの間、それは上皮の完全性を損なうので、解剖ツールで腹側腹部組織に触れないようにすることが重要です。
- 解剖に必要なすべての材料を入手する:グレースの溶液、鉗子、ヴァンナのスプリングシザー、0.10 mmピン、解剖プレート、9ウェルガラス解剖皿、固定液(1x PBSで4%パラホルムアルデヒド)、1x PBS、ワイプ、ピペット、チップ30μmのチップ( 材料表を参照)。
- 負傷したハエを実体顕微鏡下でCO2-フライパッドで麻酔し、傷の瘢痕の有無を確認してハエが正常に負傷したことを確認します(すなわち、腹部のメラニンスポットは図1BBを参照)。正常に負傷しなかった実験グループからのハエを捨てます。
- 解剖を開始するには、グレースの溶液で9ウェルガラス解剖皿の1つの井戸を埋めます。鉗子のペアを使用して、胸郭の後側で負傷した女性のハエをつかみ、グレースの溶液を含む井戸にハエを沈めます。
- 胸郭を解放せずに反対側の手に鉗子を使用し、テルギートA6の下の後部キューティクルを穿刺し、フルーツフライの後端からキューティクルを引き離します。内臓(卵巣と腸)は通常このステップで出てきます。そうでなければ、残りの器官を絞り出し、空の井戸に捨てる鉗子で腹部の後側を静かに押します。
- 鉗子を使用してテルギテA2の上の胸郭接合部で完全な腹部を取り除き、グレースの溶液の〜100 μLを含む空の井戸に腹部を移します。
- すべてのフライ腹部が解剖されるまで、手順2.3~2.5を繰り返します。
- Graceの溶液の体積を、プールされた解剖された腹部を含む井戸の30 μLに減らします。
- 片方の手に鉗子を持つ後部側の腹部を配置し、他方の手で腹腔にヴァンナのスプリングハサミの底刃を挿入することによって腹部を開くフィレ。腹部が完全に開くまで、後回りの正中線に沿ってカットし、最大3つの切り傷を必要とすることができます(図1C、1D)。
- 腹部取り付け面積あたり4つの0.10 mmピンで乾燥解剖プレートを設置します。各35 mmの解剖の版は7つの土台区域に合うことができる。各取り付け領域にグレースの溶液のピペット30 μLと各液滴に1フィレ腹部を転送します。
- フィレした腹部を4つの裏隅の皿に固定します(図1E)。腹部組織を引き裂いたり伸ばしたりすることなく、組織が平らであることを確認してください。
- 組織を固定するには、Graceの溶液からピペットを取り除き、固定された腹部に30 μLの修正溶液を加えます。
注意:パラホルムアルデヒドは有毒であるため、修正液を取り扱う際に手袋を着用してください。 - すべてのフィレット腹部が解剖プレートに固定されるまで、手順2.10~2.11を繰り返します。
- 各皿の底にテープラベルを貼り、各コントロールと実験グループをマークします。室温(RT)で30〜60分のサンプルを修正します。
- 1.5 mLの1x PBSを各プレートにピペット処理して、溶液を洗い流します。制度上のガイドラインに従って、適切な液体または乾燥した化学廃棄物容器に固定溶液およびプラスチックを処分する。
- 1x PBSの1.5 mLでプレート2倍を洗浄し、1.5mLの1x PBSで覆われた固定組織を蓋付きのプラスチック容器に保管します。湿ったペーパータオルの層を容器の底に加え、解剖後1週間以内に免疫染色剤を準備できるまでサンプルを4°Cで保存します。
3. 免疫蛍光
- 試薬を新たに調製(材料表を参照):洗浄緩衝液(0.3%トリトンX 100、1x PBSで0.3%BSA)。残った洗浄バッファーは4°Cで保存することができ、2日間の染色プロトコルの持続時間に使用されます。抗Grh(1:300アFigure 2フィニティ精製ウサギ抗グレイディヘッド8)または抗RFP(1:1,000ウサギ抗RFP)のいずれかを使用して洗浄バッファーにアンチFasIII(1:50マウス抗ファシクリンIII)を使用してアッセイごとに十分な一次抗体溶液を調製します。一次抗体溶液は4°Cで保存し、シグナルが大幅に低減されるまで複数回再利用できます。
- 1x PBSをピペットオフし、1.5mLの洗浄バッファーを追加し、RTで軌道シェーカー(80 rpm)で少なくとも30分間インキュベートすることによって組織を透過させる。
- 洗浄バッファーと染色組織を一次抗体溶液 1.5 mL で一晩除去し、4 °Cで軌道シェーカー(80 rpm)でインキュベートします。 一次抗体溶液を収集し、将来の実験のために4°Cでチューブに保存します。
- まず、1x PBSでサンプルを素早く洗い流し、次に1.5mLの洗浄バッファーで3倍洗います。各洗浄ごとに、RTでサンプルを軌道シェーカーで少なくとも30分間インキュベートします。
- 最終洗浄中に、2次抗体溶液を調製します:1:1,000ロバ抗ウサギAlexa 488または568と1:1,000ヤギ抗マウスアレクサ488または568(または選択したフルオロフォア)を洗浄バッファーに入れます。
- 洗浄バッファーを除去し、2 次抗体溶液の 1.5 mL で組織を汚します。サンプルをアルミホイルで覆い、RTで軌道シェーカーで3時間インキュベートします。あるいは、サンプルは軌道シェーカー上の4°Cで一晩インキュベートすることができる。
- 最初に二次抗体溶液を廃棄し、次に1x PBSでサンプルを素早く洗い流し、次に1.5mLの洗浄バッファーで3回洗浄します。各洗浄ごとに、RTでサンプルを軌道シェーカーで少なくとも30分間インキュベートします。
- 洗浄バッファーでDAPIを10 μg/mLに希釈してDAPI溶液を調製します。最終洗浄後、RTで30分間インキュベートする1.5 mL DAPI溶液を用いてサンプルを染色する。
- DAPI溶液を廃棄し、1x PBSの1.5 mLで2倍の試料をすすい出します。汚れた組織を1x PBSの1.5mLに暗い状態で保存し、アルミニウム箔で覆い、カバースリップ付きのガラススライドに取り付ける準備ができるまで4°Cで保管します。取り付けステップは1週間以内に行う必要があります。
4. 細胞周期活性(EdUアッセイ)
- DH20でEdU粉末を溶解し、完全に溶解するまで〜15分間混合することにより、Click-iTキット(材料表を参照)から10 mM EdUストック溶液を作ります。ストック溶液は、(チューブあたり250μL)を引用し、-80°Cで保存することができます。
- フィードは、最初にDH2O.で5 mMにEdUストックを希釈することによってEdUを飛ばします。0.5 mLチューブキャップを切り落とし、フライフードバイアルの底に置きます。キャップを食べ物に押し込み、安定しています。
- ハエを麻酔し、バイアルに3〜5日のハエを転送します。ハエを1つの端までタップして、キャップに刺さるものはありません。
- ピペット75 μLのイースト-EdU溶液をキャップに入れた。ハエは毎日新鮮な酵母-EdU溶液を供給し、ハエがバイアルの底に詰まりないように、一日おきにキャップ付きの新鮮な食品バイアルに移す必要があります。
- ハエを転送するには、キャップで新しいバイアルにフリップし、ハエを眠らせ、片方の側にハエをタップし、新鮮な酵母EdU溶液を追加します。
- 3日目にハエを傷つけ、2dpiで解剖するまで酵母EdUに餌を与え続けます(図4A)。解剖および固定方法については、プロトコルセクション2を参照してください。
- EdU染色試薬を調製:洗浄バッファー(0.3%トリトンX 100、1x PBSで0.3%BSA)、パーメビル化緩衝液(1x PBSで0.5%トリトンX 100)、ブロッキングバッファー(1x PBSで3%BSA)、およびEdUアッセイキット( 材料表を参照)から試薬を調製し、1x反応バッファーおよび1x反応剤を含む1x反応バッファーおよび1x反応剤を含む。
- 1時間洗浄サンプルを、1.5 mLの洗浄バッファーでRTで混合します。
- 1.5 mLのパーメビリゼーションバッファーを加え、サンプルを20分間インキュベートします。
注:解凍し、500 μL/プレートのボリュームを使用して反応カクテル溶液を調製します。 - サンプルを1x PBSで素早く洗浄し、1mLのブロッキングバッファーで3倍速く洗浄します。
- 残りのブロッキングバッファーをすべてピペットオフし、1皿あたり500 μLの反応カクテル溶液を加えます。組織が完全に覆われていることを確認するために、旋回プレート。RTで1時間暗闇の中で引き出しにインキュベート。
- ブロッキングバッファーの1.5 mLでサンプルを1倍速く洗浄します。
- 1.5 mLのDAPI溶液を洗浄バッファーで30分間洗浄します。
- 1x PBSで2倍を素早く洗い、ホイルで包み、3日以内にサンプルを取り付ける準備ができるまで4°Cで暗闇の中で保管してください。
5. 染色されたティッシュを取り付ける
- ガラススライド、ガラスカバーリップ、クリアマニキュア、取り付けメディア、鉗子、ワイプなど、取り付けに必要なすべての材料を入手できます。
- 染色されたフライ組織を装着するには、解剖板から腹部を立体顕微鏡下で鉗子を使用して固定解除する。組織を、後側の側触れで鉗子で組織をそっとつかむことで、ガラスのカバースリップに取り付ける媒体の30μLに組織を移し、鉗子で腹側領域に触れないように注意する。
- 実体顕微鏡では、内側がカバースリップに向かって下向きになるように腹部組織を向けます(すなわち、外的なキューティクル/毛が上を向いています)。鉗子を使用して、配向した腹部をメディア液滴の端に引っ張ります。表面張力はティッシュを平らに保つのに役立つ(図1F)。
注: この段階で、列または行に腹部を整理することは、イメージングに役立ちます。 - ガラススライド(制御または実験的)にラベルを付け、ゆっくりとスライドをカバースリップに近づけてカバースリップを拾います。スライドを反転し、余分な取り付けメディアを取り除くためにワイプで静かにブロット。
- カバースリップの端をクリアマニキュアで密封し、残りのすべての実験グループについて繰り返します。スライドボックスにスライドを4°Cで保存し、イメージを作成する準備が整います。
6. イメージングと処理
- 最初に共焦点顕微鏡(図1B)でメラニン瘢痕を見つけることによってフライ腹部の傷領域を画像化し、点スキャナーまたは40x油または乾燥目的で構造化された照明(ApoTome)を配置します。
- 各チャンネルの露出を確認し、信号が飽和以下であることを確認します。イメージング設定は、最も明るいサンプルグループに基づいている必要があります。DAPIチャネルはDNA含有量を正確に測定するために線形範囲にとどまる必要があるため、これは特に策略分析にとって重要です。
- スライス間の最適距離が0.50μm以上の3つのチャンネルすべてで、完全なZスタック画像を撮ります。キャプチャした画像を保存し、画像解析プログラムフィジー (別名 ImageJ) でファイルを開きます。
- 各画像に対して、すべてのチャンネルのスライスの合計オプションを使用して、z スタックプロジェクションを作成します。
- 必要に応じて画像を回転させて、画像全体に水平に並べられるようにします(図3Aと図4E)。
- 傷跡地または傷つけていないコントロールの中心を中心とした300 μm x 300 μmの長方形の選択にすべての画像をトリミングします。四角形を描画し、[編集] を選択して領域を識別 する |選択 |を指定します。すべての画像を解析するために同じサイズのボックスが使用されていることを確認するために、スケール単位がミクロンであることを確認します。
7. 内複製(策略)分析
- フィジーを使用して、Grh チャンネル ウィンドウを選択し、イメージを複製します。次に、しきい値ツールを使用してマスクを作成します。上部のバーをスライドさせて、核が大幅に縮小することなく背景を最小限に抑えて、手動でしきい値を調整します(図4D)。
- Grhチャネル内のいずれかの核が閾値画像に接触している場合は、 ペイントブラシツール (2ピクセル幅)を背景と同じ色で使用し、核間に線を引きます。終了したらクリックして 1x を適用し、最終的なマスクを生成します。
- 「パーティクルを分析」機能を使用して対象領域(ROI)マップを生成します: 背景を含めずにほとんどの核をキャプチャするために、サイズを 5 μm-60 μm に設定します。
- ROI マネージャで必要に応じて 、ROIマップを手動で調整します。核でない選択を削除し、フリーハンド選択ツールで核のアウトラインを表示し 、ROI マネージャ に追加することによって、識別されなかった核をリストに追加します (図 4D)。
- DAPI チャネルを選択し、ROI マネージャで[すべて表示] をクリックして、Grh チャネルで生成された ROI マップを DAPI チャネルに適用します。
- 上皮核の輪郭が、筋や脂肪の核など、無形成核と重なっている場合は、ROIマップから選択を削除します。グレインヘッドは上皮核のみを染色し、DAPIはすべての核を染色する。アウトラインが表示されている各選択に 1 つの核のみが含まれていることを確認し、複数の核を持つ選択を削除または編集します。編集した ROI リストを保存します。
- フィジーの解析ツールを使用して ROI マップ内の各上皮核の面積と統合密度を測定します。値をスプレッドシート プログラムにエクスポートします。
- 円形選択ツールを使用して、平均画像の背景を測定します。DAPI イメージの異なる領域の任意の核と重ならない 3 つの円を描画します。背景画像の明るさを確立するために、スプレッドシートプログラムに各円の面積と統合密度を追加します。
- 各背景の統合密度値を対応する領域で割って、各画像の単位面積あたりの平均背景を計算します。次に、単位面積あたりの平均背景を得るために、画像の面積測定ごとに3つの積分密度を平均します。
- 次に、各DAPI核の総背景を計算し、その核の面積に単位面積当たりの平均背景を掛けます。測定された各核の正規化されたDAPI強度は、その測定された積分密度から各核の総背景を差し引くことによって計算することができる。
- 全ての正規化されたDAPI強度値を、傷つけていない上皮制御から平均化する。この傷つけていない上皮核は、予め2Cの突起値を有するように計算され、実験条件8から上皮核における精滑を計算するための基準として役立つ。
- 各核の正規化された DAPI 強度を、参照の傷つけていない上皮制御 (2C) から正規化された値で割って各核のプロイドを計算し、その値に 2 を掛けて正規化されたプロイド(C値)に等しい値を計算します。
(核統合密度- 背景核統合密度)/平均核統合密度(傷つけていない上皮核=2C)x 2 =上皮核策略(C) - ドットプロットとしてプロイド値を持つグラフ核、 ヒストグラム、またはそれに応じて棒グラフにグループ化(すなわち、2C[0.6-2.9C]、4C[3.0-5.9C]、8C[6.0-12.9C]、16C[13.0-24.9C]、および>32C[>25.0C]図(F3)
結果
D.メラノガスターをモデルとして使用して、創傷による多重化(WIP)を研究するための詳細なプロトコルが提供されています。この創傷治癒モデルは、哺乳類およびWIPの他のフライモデルに対して多くの利点を提供する。多倍率は、昆虫ピンと多倍細胞を用いた機械的穿刺によって容易に誘発され、短時間(2-3dpi)内で生成された(図1A、1B)4。4主な課題は、上皮への摂動を伴わない無傷の腹部組織の解剖である。D. メラノガスター上皮は、鋭い解剖ツールで誤ってぶつかったり傷ついたりしやすい。したがって、このプロトコルの手順は、使用および分析の前に実践する必要があります。
まず、損傷は腹側の女性腹部に制限され、イメージングに理想的な大きな平らな不透明な組織領域を提供する。穿刺傷は、腹側中線胸膜の両側にあり、テルギート(T)セグメントT4-T5の間を標的とする胸膜上皮に与えられた(図1A-C)。この創傷の配置は解剖によって中断されない大きい目に見える区域を提供する。挑戦的なステップは腹部の春のはさみの切り取りおよび固定のステップ(図1D、1E)である。バネ切断ステップは、腹部がグレースの溶液(〜30 μL)の体積を減らして組織の動きを減らすと最も良く働いた。腹筋中線に沿って十分に中心を持つカットは、解剖プレートにピン開けするのに十分な腹部の折り返しの領域を提供するために必要でした(図1C)。腹部は、過度の力をかけずに四隅に静かに固定する必要があります(図1E)。硬すぎるピンプッシュは腹部組織を歪め、組織を解剖プレートに押し込むことさえできる。この場合、組織を廃棄する必要があります。腹部組織が固定されると、免疫蛍光染色が完了し、腹部をイメージング用のガラスカバースリップに取り付けるまで、解剖板に残った(図1F)。
創傷治癒は、連続上皮シートを形成する必要があり、これは、内複製および細胞融合44、1616に依存する。細胞-細胞接合を標識するセプテット接合タンパク質FasIIIは、調製中に何らかの処理摂動が起こったかどうかの指標を提供した(図1G,1H)。傷領域を摂動させる大きな傷(染色されていない領域)を有する腹部は廃棄しなければならず、さらなる分析には使用されなかった(図1H)。
次のステップは、WIPの欠陥がない場合に無傷のサンプルを分析することです。このプロトコルには、WIP応答のさまざまな側面を検出するための個別のアッセイが含まれています(図2)。中央の大きな多核細胞が創傷のかさぶたを覆ったときに創傷修復が完了した(図3A)。ここで細胞融合は、FasIII/Grhに対する染色と、FasIIIの概説領域4に包含されるGrh+上皮核の数を定量することによって検出した。上皮シートの>10μmの隙間が認められた場合、創傷閉鎖または再上皮化の欠陥が検出された(図3B、赤矢印)。これは、例えば、stgの発現を介した有糸分裂サイクルの活性化によってWIPが阻害された場合、fzrRNAiが、最近報告された16のようにした。この遺伝的状態では、創傷の52%が創傷のかさぶたの上に連続的な上皮シートを形成できなかった(図3B、3C)。
このモデルにおける創傷修復を測定する別の方法は、上皮膜をUAS-mCD8-ChRFP4のエピギャル4発現で可視化4した(図2、図3D)。この対照では、上皮創傷の91%が3dpiで完全に閉じたが、エンドレプリケーション(E2f1RNAi)および細胞融合(RacDN)を遮断することによってWIPを阻害すると、同時に、前述のように、上皮創傷の92%が完全に開いたままにした(図3D、3E)8、16。8,16stgの発現による有糸分裂細胞周期の活性化により、fzrRNAiも上皮創傷閉鎖欠陥をもたらした。しかしながら、上皮細胞膜を可視化することにより、再上皮化欠陥の程度を決定することができた。WIP変異体(E2f1RNAi、RacDN)フライ創傷はstgよりも開いていた、fzrRNAi創傷(図3D、破線赤の輪郭)16。この膜創傷治癒アッセイは、創傷修復欠陥の程度に関するより多くの情報を提供した。その結果、再表皮化欠陥は、完全に開いた、部分的に閉じた(すなわち、>10μmのギャップ)、または完全に閉じた(図3D、3E)としてグループ化される可能性がある。
細胞融合に加えて、上皮細胞は、核DNA含有量を倍増させる不完全な細胞周期である内複製によって大きくなる。細胞周期活性と直接核DNAプロイド測定の両方によって、内結複製をアッセイした(図2および図4)。ここで、細胞周期活性は、チミジンアナログ、EdU(図4A、4B)の組み込みによって検出された。D. メラノガスター上皮細胞は、内膜に入ることを発見した, 介入 M 相を介さずに S と G 相の間で振動する不完全な細胞周期4,12.成人D.メラノガスターダイエットは、怪我の前にEdU+食品を補充し、ハエは2dpiで解剖するまでEdU+ダイエットで維持された(図4A)。その後、製造元のClick-iTプロトコルを使用してEdUが検出されました。このEdUアッセイは、創傷に応答してS相に入るために引き起こされた核の場所、時期、および数を決定するために使用されました。Gal4/UASシステムを用いて、最近では、mycの上皮特異的発現がS相に入る上皮細胞の能力をブロック(mycRNAi)または悪化(Myc過剰発現)することができることが分かった。その結果、Mycは、16,22,22の損傷を受けなくても、死後の細胞における内複製を誘導するのに十分であることを示している。
次に、上皮策略は、核DNA含有量を直接測定することによって決定した。上皮核は、上皮特異的マーカー、Grh(図4D)に対する免疫蛍光染色によって同定した。フィジーのイメージングソフトウェアでは、上皮核を全身的に同定し、Grh核染色を使用して閾値を設定した。次いで、核を分離し、ROIをスタックDAPI画像のSUMに重ね合わせた(図4D、緑の矢印)。選択した核の統合密度を測定する前に、重なり合う任意の核を手動で削除した(図4D、赤い矢印)。この半自動化された方法は、損傷を受けていない、修復されたフライ腹部上皮8を通してほとんどの核の分布とプロイドを定量化することを可能にする。最近報告されたように、創傷を取り囲む上皮核は、3dpiで3C以上のDNA含量を有する44%の多重原子核から構成された(図4E、4F)16。16EdUの結果から予想されるように、mycのノックダウンは、上皮核のわずか9%が多倍化であったのに対し、Mycの過剰発現は創傷部位の周りに100%多プロイド上皮核をもたらしたのに対し、内複製において有意なブロックにつながった(図4F)16。上皮核の大きさも、縮小または拡大した核を有するmyc発現によっても目に見えて影響を受けた。しかし、核領域は、プロイドおよび生理的効果の正確な尺度ではなく、細胞伸張などの要因も核DNA含有量20に影響を与えることなく核サイズに影響を与えることができるためである。
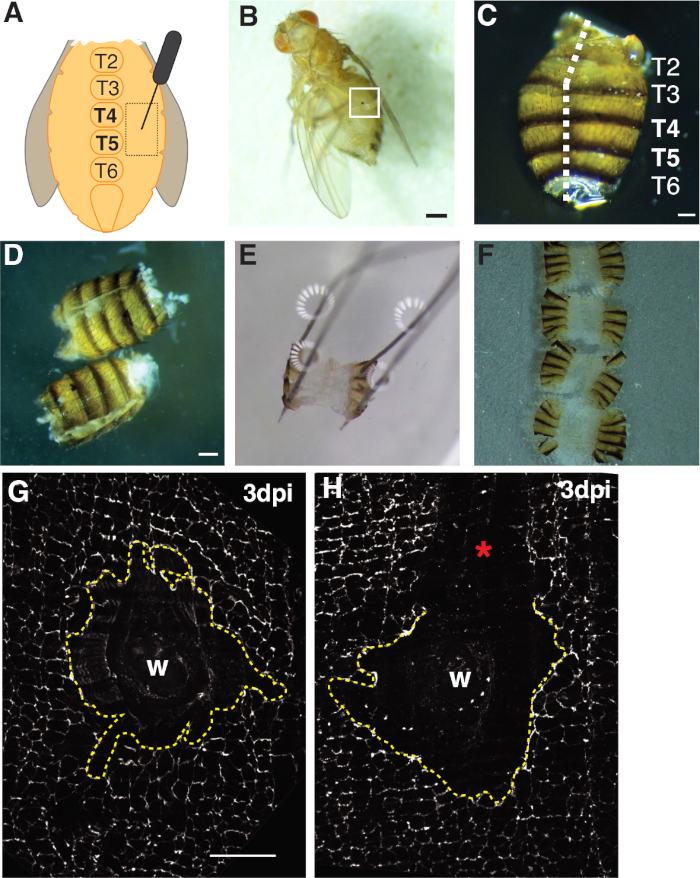
図1:成人フルーツフライ腹部の傷、解剖、および組織の取り付け。(A)成人腹部創傷アッセイの図。ハエはテルギート4(T4)で腹部の両側に負傷する必要があります。(B)成人女性果実フライ3 dpi、創傷治癒から形成されたメラニンのかさぶた(白い箱)。スケールバー= 50 μm(C) 解剖された成人腹部、後ろ図、タージットがラベル付けされている。腹部は、後側の正中線(白い破線)をフィレした。スケールバー= 50 μm(D) ピン留め前に解剖し、成人腹部を充填した。スケールバー= 50 μm(E) 解剖プレートに大人の腹部を固定します。後部側の腹部の四隅にピンを置いた。組織は、引き裂きを避けるために、穏やかに開かれたが、伸ばされなかった。(F)成人腹部を取り付け、腹部の内側をカバースリップに向け、キューティクルをガラススライドに向けたガラスカバースリップの上に置いた。(G) FasIII は、処理の摂動がなく、中央のシンクティウム (黄色の破線) を伴う無傷の創傷領域を染色する。スケールバー= 50 μm(H)シンジチウムを破壊する未染色のFasIII領域を有する傷の傷領域(*)の画像。この図の大きなバージョンを表示するには、ここをクリックしてください。
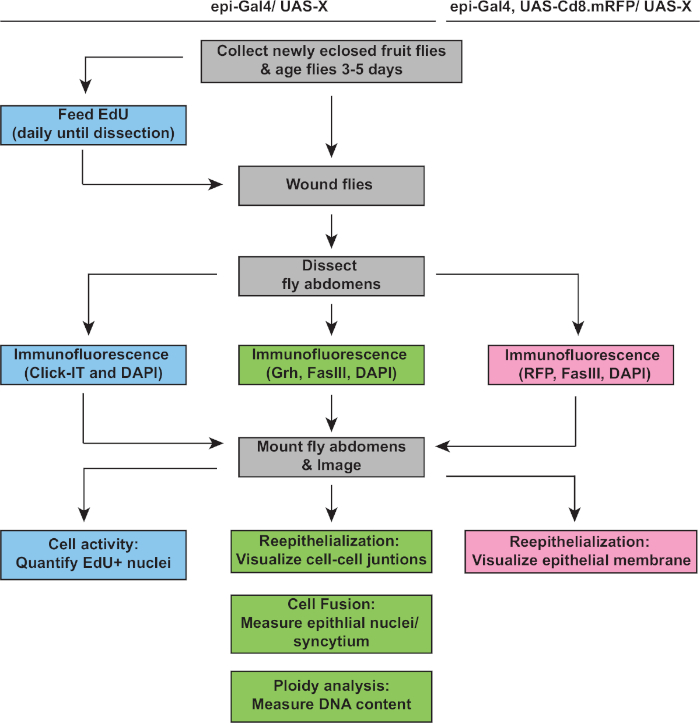
図 2: 仕掛品分析ワークフロー フローチャートは、この研究で説明した3つのアッセイと、WIP応答を検出して測定するための重複する明確なステップを示しています。EdUアッセイは、細胞周期活性(青い箱)を測定し、プロイドおよび再上皮化はGrh/FasIII免疫染色(緑色のボックス)によって検出され、膜RFPの発現は上皮創傷閉鎖の程度(ピンクの箱)の測定を可能にする。一般的なステップは灰色の箱にあり 、D.メラノガスター 株遺伝子型は上記に記載されている。 この図の大きなバージョンを表示するには、ここをクリックしてください。
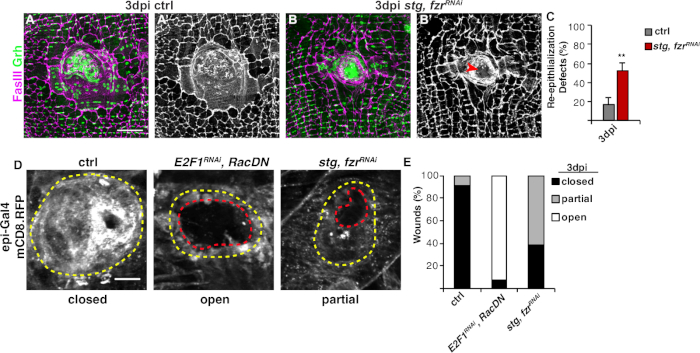
図3:WIP中の再上皮化を検出する方法。WIPが遺伝的に阻害されたときに再上皮化が摂動された。コントロールの免疫蛍光画像(A)およびstg、fzrRNAi(B)を3dpiで示す。B上皮核とセプテ結合は、それぞれGrh(緑色)およびFasIII(マゼンタ)で染色された。(A'とB')FasIII染色単独では、stg、fzrRNAi上皮において再上皮化が損なわれた(赤矢印)ことが示された。スケールバー = 50 μm(C) 再上皮化欠陥の定量化 (%)3 dpi(グレー):コントロール(n = 8)、stg、fzrRNAi(n = 6)で。誤差範囲は標準誤差を示します。統計的有意性は、学生のT検定**P<0.01を介して測定された。創傷修復中の再上皮化は、epi-Gal4,UAS-mCD8-RFPを用いたRFPに連結した膜の発現によっても検出することができた。(D) コントロールの免疫蛍光画像, E2F1RNAi, RacDN, stg, fzrRNAi 3 dpi.スケールバー= 20 μm傷跡(黄色の輪郭)および開いた上皮の創傷領域(赤い輪郭)。(E)ctrl(n=11)、E2F1E RNAi、RacDN(n=13)、RNAiおよびstg、fzr RNAi(n=13)RNAiにおける創傷閉鎖の定量化。グレンドラーら16.この図の大きなバージョンを表示するには、ここをクリックしてください。
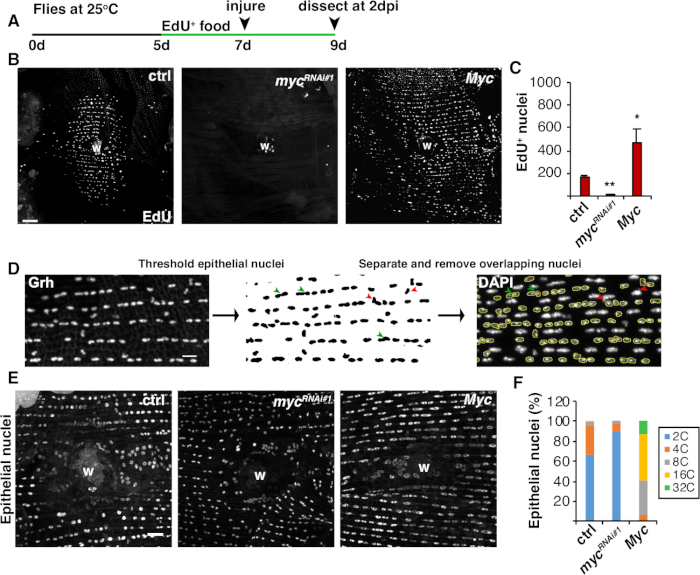
図 4: WIP 中の endoreplication を検出する方法(A)EdUアッセイのタイムライン:成人ショウジョウバエは、怪我の2日前に毎日5mM酵母-EdUの75 μLを与えられ、2 dpiまで続いた。(B) 2 dpi でエピギャル4/UAS系で発現されるハエ株中のEdU標識の免疫蛍光画像。傷つぶし(W).スケールバー= 50 μm(C) 2 dpi での1フライあたりのEdU+上皮核の平均数: ctrl (n = 37)、myc RNAi#1 (n = 10)、Myc (n = 8)。 Myc誤差範囲は標準誤差を示します。統計的有意性は、学生のT検定、*P<0.05、**P<0.01を介して測定された。(D) 上皮核策略の検出と測定の概略図。上皮核は、フィジーの抗Grh染色によって同定され、閾値された。重なり合う上皮核は、無形成核によって重ね合わせれば分離(緑色の矢印)または除去(赤矢印)であった。対応するDAPI染色核画像の積分密度と核面積を測定した。(E)上皮核サイズ(Grh)は3dpiでmyc発現によって変化した。(F)上皮核策略(%)3 dpi: ctrl (n = 4)、mycRNAi#1 (n = 6)、および Myc (n = 3) です。グレンドラーら16.この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
本講演は、創傷修復16の間に再上皮化および内用複製を改変して遺伝子がどのようにWIPを調節するかを研究するために、成人D.メラノガスター腹上皮を解剖し、使用する方法についての詳細なプロトコルである。この方法を用いて、プロトオンコジーンMycは最近、WIPの主要な調節因子として同定された。Mycは、上皮細胞が傷害後に内分化するために必要であり、静止した上皮細胞が成人フライ上皮および付属腺16,22,22の両方で内輪に充分である。また、stgの発現により上皮細胞を有糸分裂細胞周期に切り替えることは、fzrRNAiが創傷修復に有害であることも明らかになった。この方法を用いた継続的な研究は、WIP中の再上皮化および内用複製を調節するために必要な他の遺伝子を同定し、多富高化がどのように調節され、様々な組織において機能するのとの類似性と相違点を明らかにする。
このモデルと方法は、機械的穿刺による多倍数の容易な誘導や、4日目に多倍細胞が生成されるという事実を含む、ユニークな利点を提供する。組織解剖および準備プロトコルは幼虫解離技術23に基づいているが、成人の飛ぶ腹部はより硬く、したがって容易に摂動される。その結果、このプロトコルは、WIPを研究するために無傷の組織を分離するための練習と精度を必要とします。しかし、いったん解剖されると、上皮ははっきりと見え、容易に画像化され、創傷治癒過程のスナップショットを得る。この方法は、成体フライの上皮組織、細胞およびシンクティウムサイズ、および細胞および個々の核の策略に関する豊富な情報を提供する。その不透明なキューティクルによる無傷のフルーツフライ内でのライブイメージングはまだ不可能であるが、このプロトコルは、D.メラノガスターで使用される現在利用可能なex vivo培養条件を含むように適応することができる。
今後、Gal4/UASシステムを用いて他の細胞タイプの関心を持つ遺伝子発現を調節することで、細胞間クロストークや他の細胞タイプのWIPへの寄与を研究するのに理想的なモデルとなるでしょう。同様の質問は、さまざまな遺伝的背景と変異背景を使用して答えることもできます。解剖された成体の飛ぶ腹部には、脂肪体やオエノサイト、横筋線維、感覚ニューロン、気管、マクロファージ様血球など、この方法を用いて容易に可視化できる様々な細胞タイプが含まれています。さらに、このモデルは、生理学的変数が性、食事、感染、年齢、環境ストレッサーを含むWIPにどのような影響を与えるかを調査することを可能にする。プロトコルは、その大きなサイズのために成人の女性のハエを使用していますが、WIPはまた、男性のフルーツフライ(ジェルスヴィークとロシック、未発表)で発生します。多倍化細胞は、哺乳類の肝臓、脳、眼、および心臓12における老化および加齢に伴う疾患の間に生じることが判明した。フルーツフライモデルは、ヒト疾患関連遺伝子が高度に保存されているため、生理学的および疾患の文脈における多重化を研究することを可能にする。
開示事項
なし。
謝辞
ボストン・カレッジでは、イメージング用のラボのカメラとステレオスコープの顕微鏡のセットアップ、ボストン・カレッジ・イメージング・コアのブレット・ジャドソンのインフラとサポートに対するエリック・フォークサー博士に感謝したいと思います。また、ブルーミントン・ショウジョウバエストックセンター(NIH P40OD018537)、ウィーン・ショウジョウバエ資源センター、ハーバード大学医学部TRiPセンター(NIH/NIGMS R01-GM01-GM01-GM084947)のフライコミュニティリソースに感謝します。マウスFasIII抗体は、NIHのNICHDによってサポートされている発生研究ハイブリドーマ銀行から得られ、アイオワ大学、アイオワシティ、アイオワシティ、アイオワシティ、アイオワ市で維持されました。本論文で報告された研究は、賞番号R35GM124691の下で国立衛生研究所の国立一般医学研究所によってサポートされました。コンテンツは著者の責任であり、必ずしも国立衛生研究所の公式見解を表すものではありません。
資料
| Name | Company | Catalog Number | Comments |
| 35 mm Petri dishes | Fisher Scientific | FB0875713 | For creating plates to dissect in |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | For preparing staining reagents in |
| AxioImager M2 with Apotome | Zeiss | NA | For imaging samples |
| Blowgun mini | Genesee Scientific | 54-104M | For anethesizing D. melanogaster strains |
| Bovine Serum Albumin, 30% | Sigma | A7284-500ML | For immuostaining |
| Carbon dioxide tank | various distributors | N/A | For anethesizing D. melanogaster strains |
| Click-iT EdU 594 Kit | Thermofisher | C10339 | For EdU assay |
| Coverslips | Thermofisher | 3406 | For mounting |
| DAPI | Sigma | D9542-10MG | For immuostaining |
| Dissecting Plates (use Sylgard 184 Sil Elastic Kit) | Ellsworth Adhesives | 184SIL | For creating plates to dissect in. Mix epoxy as directed, let dry overnight |
| Donkey anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate | Thermofisher | A21206 | For secondary immuostaining |
| Donkey anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 568 conjugate | Thermofisher | A10042 | For secondary immuostaining |
| Drosophila tubing and fittings | Genesee Scientific | 59-124C, 59-123, 59-140 | For anethesizing D. melanogaster strains |
| Dumont #5 Forceps | Fine Science Tools | 11252-20 | For dissecting |
| epi-Gal4 | Bloomington Drosophila Stock Center (b) | b38793 | Losick et al. Current Biology, 2013 |
| epi-Gal4, UAS-mCD8.RFP | Bloomington Drosophila Stock Center (b) | b38793, b27392 | Losick et al. Current Biology, 2013 |
| Excel | Microsoft | For performing ploidy calculations | |
| Fiji/ImageJ (image analysis software) | NIH | https://imagej.nih.gov/ij | For image analysis |
| Fly food | Archon Scientific | N/A | Corn Syrup/Soy food |
| Flystuff Flypad | Genesee Scientific | 59-114 | For anethesizing D. melanogaster strains |
| Glass dissecting dish | Fisher Scientific | 13-748B | For performing dissections in |
| Glass slides | Fisher Scientific | 12-518-104C | For mounting |
| Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate | Thermofisher | A11001 | For secondary immuostaining |
| Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 568 conjugate | Thermofisher | A11031 | For secondary immuostaining |
| Grace's Insect Medium, unsupplemented | Thermofisher | 11595030 | For dissecting in |
| Insect pins | Fine Science Tools | 26002-10 | For wounding and pinning fly abdomens flat |
| Mouse anti-Fasciclin III (Drosophila) Primary Antibody | Developmental Studies Hybridoma Bank | 7G10 | For immunostaining epithelial cell-cell junctions |
| Mouting media | Vector Laboratories | H-1000 | Anti-fade mounting media to prevent photo bleaching during imaging |
| Nail polish | Electron Microscopy Sciences | 72180 | For sealing slides |
| Ortibal shaker | Fisher Scientific | 02-217-988 | For immuostaining |
| Phosphate Buffered Saline, PH 7.4 | Sigma | P3813-10PAK | For staining |
| Pin holders | Fine Science Tools | 91606-07 | For wounding |
| Rabbit anti-Grainyhead Primary Antibody | N/A | N/A | For immunostaining epithelial nuclei. Protocol to make antibody can be found (Ref. #4 and 8) |
| Rabbit anti-RFP Primary Antibody | MBL | PM005 | For immunostaining mCD8-RFP fly epithelium |
| Stereomicroscope | Olympus | SZ51 | For dissecting and mounting fly tissue |
| Triton X-100 | Sigma | 10789704001 | For immuostaining |
| UAS-E2F RNAi, UAS-RacDN | VDRC (v) and Bloomington Drosophila Stock Center (b) | v108837, b6292 | Losick et al. Current Biology, 2013 |
| UAS-fzr RNAi, UAS-Stg | VDRC (v) and Bloomington Drosophila Stock Center (b) | v25550, b56562 | Grendler et al. Development, 2019 |
| UAS-Myc | Bloomington Drosophila Stock Center (b) | b9674 | Grendler et al. Development, 2019 |
| UAS-myc RNAi | Bloomington Drosophila Stock Center (b) | b36123 | Grendler et al. Development, 2019 |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | For dissecting |
参考文献
- Abreu-Blanco, M. T., Verboon, J. M., Liu, R., Watts, J. J., Parkhurst, S. M. Drosophila embryos close epithelial wounds using a combination of cellular protrusions and an actomyosin purse string. Journal of Cell Science. 125 (Pt 24), 5984-5997 (2012).
- Wood, W., et al. Wound healing recapitulates morphogenesis in Drosophila embryos. Nature Cell Biology. 4 (11), 907-912 (2002).
- Galko, M. J., Krasnow, M. A. Cellular and genetic analysis of wound healing in Drosophila larvae. PLoS Biology. 2 (8), E239 (2004).
- Losick, V. P., Fox, D. T., Spradling, A. C. Polyploidization and cell fusion contribute to wound healing in the adult Drosophila epithelium. Current Biology. 23 (22), 2224-2232 (2013).
- Wang, Y., et al. Integrin Adhesions Suppress Syncytium Formation in the Drosophila Larval Epidermis. Current Biology. 25 (17), 2215-2227 (2015).
- Ramos-Lewis, W., LaFever, K. S., Page-McCaw, A. A scar-like lesion is apparent in basement membrane after wound repair in vivo. Matrix Biology. 74, 101-120 (2018).
- Lee, C. W., Kwon, Y. C., Lee, Y., Park, M. Y., Choe, K. M. cdc37 is essential for JNK pathway activation and wound closure in Drosophila. Molecular Biology of the Cell. 30 (21), 2651-2658 (2019).
- Losick, V. P., Jun, A. S., Spradling, A. C. Wound-Induced Polyploidization: Regulation by Hippo and JNK Signaling and Conservation in Mammals. PLoS One. 11 (3), e0151251 (2016).
- Tamori, Y., Deng, W. M. Tissue repair through cell competition and compensatory cellular hypertrophy in postmitotic epithelia. Developmental Cell. 25 (4), 350-363 (2013).
- Xiang, J., et al. EGFR-dependent TOR-independent endocycles support Drosophila gut epithelial regeneration. Nature Communications. 8, 15125 (2017).
- Cohen, E., Allen, S. R., Sawyer, J. K., Fox, D. T. Fizzy-Related dictates A cell cycle switch during organ repair and tissue growth responses in the Drosophila hindgut. Elife. 7, e38327 (2018).
- Gjelsvik, K. J., Besen-McNally, R., Losick, V. P. Solving the Polyploid Mystery in Health and Disease. Trends in genetics: TIG. 35 (1), 6-14 (2019).
- Cao, J., et al. Tension Creates an Endoreplication Wavefront that Leads Regeneration of Epicardial Tissue. Developmental Cell. 42 (6), 600-615 (2017).
- Zhang, S., et al. The Polyploid State Plays a Tumor-Suppressive Role in the Liver. Developmental Cell. 44 (4), 447-459 (2018).
- Lazzeri, E., et al. Endocycle-related tubular cell hypertrophy and progenitor proliferation recover renal function after acute kidney injury. Nature Communications. 9 (1), 1344 (2018).
- Grendler, J., Lowgren, S., Mills, M., Losick, V. P. Wound-induced polyploidization is driven by Myc and supports tissue repair in the presence of DNA damage. Development. 146 (15), 173005 (2019).
- Mehrotra, S., Maqbool, S. B., Kolpakas, A., Murnen, K., Calvi, B. R. Endocycling cells do not apoptose in response to DNA rereplication genotoxic stress. Genes & Development. 22 (22), 3158-3171 (2008).
- Patterson, M., et al. Frequency of mononuclear diploid cardiomyocytes underlies natural variation in heart regeneration. Nature Genetics. 49 (9), 1346-1353 (2017).
- Gonzalez-Rosa, J. M., et al. Myocardial Polyploidization Creates a Barrier to Heart Regeneration in Zebrafish. Developmental Cell. 44 (4), 433-446 (2018).
- Webster, M., Witkin, K. L., Cohen-Fix, O. Sizing up the nucleus: nuclear shape, size and nuclear-envelope assembly. Journal of Cell Science. 122 (Pt 10), 1477-1486 (2009).
- Knouse, K. A., Lopez, K. E., Bachofner, M., Amon, A. Chromosome Segregation Fidelity in Epithelia Requires Tissue Architecture. Cell. 175 (1), 200-211 (2018).
- Box, A. M., et al. Endocycles support tissue growth and regeneration of the adult Drosophila accessory gland. bioRxiv. , 719013 (2019).
- Karim, M. R., Moore, A. W. Morphological analysis of Drosophila larval peripheral sensory neuron dendrites and axons using genetic mosaics. Journal of Visualized Experiments. (57), e3111 (2011).
- Dai, W., Montell, D. J. Live Imaging of Border Cell Migration in Drosophila. Methods in Molecular Biology. 1407, 153-168 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved