Method Article
Un modelo de Drosophila para estudiar la poliploidización inducida por heridas
En este artículo
Resumen
La poliploidización inducida por heridas es una estrategia de reparación de tejido conservada donde las células crecen en tamaño en lugar de dividirse para compensar la pérdida celular. Aquí hay un protocolo detallado sobre cómo utilizar la mosca de la fruta como modelo para medir la ploidy y su regulación genética en la reparación epitelial de heridas.
Resumen
La poliploidía es un fenómeno frecuente cuyo impacto en la salud y las enfermedades del organismo sigue siendo poco comprendido. Una célula se define como poliploides si contiene más que la copia diploide de sus cromosomas, que es el resultado de la endoreplicación o fusión celular. En la reparación de tejidos, la poliploidización inducida por heridas (WIP) se ha encontrado para ser una estrategia de curación conservada de moscas de la fruta a vertebrados. WiP tiene varias ventajas sobre la proliferación celular, incluyendo la resistencia al crecimiento oncogénico y el estrés genotóxico. El desafío ha sido identificar por qué surgen las células poliploides y cómo funcionan estas células únicas. Se proporciona un protocolo detallado para estudiar la WIP en el epitelio de la mosca de la fruta adulta donde se generan células polioploides dentro de los 2 días después de una herida punzante. Aprovechando el extenso kit de herramientas genéticas de D. melanogaster, los genes necesarios para iniciar y regular wiP, incluyendo Myc, han comenzado a ser identificados. Los estudios continuos que utilizan este método pueden revelar cómo otras variables genéticas y fisiológicas, como el sexo, la dieta y la edad, regulan e influyen en la función del TRABAJO ENV.
Introducción
Drosophila melanogaster es un atractivo sistema modelo para estudiar los mecanismos celulares y moleculares de reparación de heridas epiteliales. Al igual que en los mamíferos, los mecanismos de reparación de tejidos utilizados dependen tanto del tejido como de su etapa de desarrollo. La cicatrización de heridas sin cicatrices se produce en el embrión de la mosca de la fruta donde se forma una "cuerda de bolsa" de actomio en el borde delantero epitelial que permite que la herida se cierre sin problemas1,,2. La cicatrización post-embrionaria de heridas en larvas, pupas y moscas de la fruta adulta da como resultado remodelación de matriz extracelular, formación de cicatrices de melanina y crecimiento de células epiteliales3,,4,,5,,6. Las células epiteliales aumentan de tamaño por fusión celular y el endociclo, un ciclo celular incompleto que evita la mitosis3,4,7,8. Como resultado, la pérdida celular se compensa con el crecimiento de células poliploides en lugar de la división celular. La chelta de la mosca adulta, la parte media y el epitelio folicular también dependen del crecimiento de células poliploides para compensar la pérdida celular después del daño tisular9,,10,,11.
La poliploidía es un aspecto bien conocido del desarrollo del organismo en plantas e insectos, pero en los últimos años se ha hecho más evidente que la poliploidía es una estrategia de reparación de tejidos conservada en vertebrados12. El pez cebra, que tiene la capacidad de regenerar su corazón, depende del crecimiento de células poliploides para curar el epicario13dañado. La poliploidía también contribuye a la regeneración hepática de los mamíferos y a la reparación del epitelio del túbulo renal después de una lesión aguda14,15. En estos ejemplos, las células poliploides se generan por endorplicación a través de endociclo o endomitosis, lo que resulta en una célula binucleada debido a un bloque en la citoquinesis12. El enigma es por qué las células poliploides surgen durante la reparación de la herida y cómo la poliploidía afecta la función tisular. Estudios recientes han proporcionado una nueva visión de la cuestión de si la poliploidía ofrece una ventaja curativa o desventaja. En el epicardium de pez cebra, la poliploidía mejoró la velocidad de cicatrización de heridas13. En D. melanogaster hindgut y el hígado de mamíferos, se encontró que la poliploidía era protectora contra el crecimiento oncogénico11,14. En el epitelio de la mosca adulta, recientemente se encontró que la poliploidía permite la reparación de heridas en presencia de estrés genotóxico16. La endreplicación es resistente al daño del ADN, permitiendo la cicatrización de heridas cuando la proliferación celular se vería comprometida de otro modo17. Para los cardiomiocitos en corazones de ratón y pez cebra, sin embargo, la poliploidía ralentiza la curación, lo que resulta en una mayor formación de cicatrices18,,19. Por lo tanto, dependiendo del tipo de órgano y/o célula, la poliploidía puede ser una estrategia de reparación de tejido beneficioso o perjudicial. La accesibilidad de la genética D. melanogaster junto con el análisis de la respuesta de poliploidización inducida por heridas (WIP) lo convierten en un sistema modelo ideal para esclarecer los mecanismos moleculares y celulares que guían esta estrategia de cicatrización de heridas.
Aquí, presentamos un protocolo para analizar wi-p en el epitelio adulto D. melanogaster. Se incluyen instrucciones para lesiones en la mosca de la fruta, disección, inmunosufero, montaje, toma de imágenes y análisis de ree epitelización, fusión celular y endoreplicación (ploidy). El análisis de imágenes y ploidy también se puede adaptar a otros modelos para probar si se produce WIP. Cabe señalar que con un aumento en el contenido de ADN nuclear a menudo hay un aumento correspondiente en el tamaño nuclear. Sin embargo, hay muchos ejemplos en biología donde el tamaño nuclear no refleja un cambio correspondiente en la ploidy20. Se debe tener aún más precaución al interpretar el tamaño nuclear en el contexto de un ambiente de herida donde las células a menudo se propagan o se estiran para cubrir el sitio de la herida. Por lo tanto, la única prueba definitiva de cambio en la ploidy es medir el contenido de ADN por este método (u otros, como la secuenciación del genoma completo)21. Este método aumenta la idoneidad del epitelio abdominal adulto D. melanogaster como modelo para estudiar el papel y la regulación de la poliploidía en la reparación de heridas.
Protocolo
1. Escenificación e heridas de moscas de la fruta adultas
- Seleccione D. melanogaster cepa de elección (es decir, epi-Gal4 / UAS cepa, ver Tabla de materiales).
NOTA: Aquí, el sistema Gal4/UAS se utiliza para habilitar la expresión génica específica epitelial (epi-Gal4) de un gen o ARNI codificado aguas abajo de UAS. Este estudio utiliza proteína de membrana fluorescente (UAS-Cd8.mRFP), inductor mitótico (UAS-fzrRNAi,UAS-stg) e inhibidor WIP (UAS-E2F1RNAi; UAS-RacDN). - Recoger dos viales de 10-15 moscas hembra recién cerradas cada uno y envejecer en viales de alimentos frescos a 25 oC hasta 3-5 días de edad. Un vial servirá como control no lesionado y el otro vial será herido como se describe a continuación. Las moscas hembra deben mantenerse con machos (5 euros/vial).
- Para enrollar las moscas, ensamble varios soportes de pasador cada uno con un solo pasador de acero inoxidable de 0,10 mm. Asegúrese de que el extremo afilado del pasador esté mirando hacia fuera. Los pasadores pueden doblarse o astillarse fácilmente después de perforar la mosca y se deben desechar los pasadores enganchados o dañados.
- Anesthetizar moscas de la fruta de la mujer envejecida en una almohadilla de CO2-fly bajo un estereomicroscopio y alinearlos en una fila usando un pincel. Usar gafas de seguridad, sosteniendo el soporte del pasador en una mano y fórceps en la otra, utilizar fórceps para colocar una mosca con su abdomen ventral hacia arriba.
- Perforar las moscas hembra adultas dentro de la región del pleurito epitelial de tergito A4 a ambos lados de los esternitas de línea media ventral(Figura 1A). Perforar esta región ventral proporciona un espacio óptimo lejos de los sitios de disección donde los bordes del tejido se romperán mediante el procesamiento mecánico.
- Devolver las moscas heridas al vial de alimentos y la edad al día deseado después de la lesión (dpi). La cicatrización de heridas epiteliales comienza en 1 ppp y termina en 3 ppp. La terminación alcanza los picos de 2 ppp, lo que es ideal para el ensayo EdU (sección 4, Figura 2).
2. Disección abdominal fly
NOTA: Durante este paso, es importante evitar tocar el tejido abdominal ventral con las herramientas de disección porque comprometerá la integridad del epitelio.
- Obtener todos los materiales necesarios para la disección: solución de Grace, fórceps, tijeras de primavera de Vanna, pasadores de 0,10 mm, placas de disección, plato de disección de vidrio de 9 pozos, solución fijativa (4% paraformaldehído en 1x PBS), 1x PBS, toallitas, pipetas y puntas para 30 m, y guantes (ver Tabla de materiales).
- Confirme que las moscas resultaron heridas con éxito por anestesia de moscas heridas en una almohadilla de CO2-fly bajo un estereomicroscopio y comprobando la presencia de la cicatriz de la herida (es decir, una mancha de melanina en el abdomen, ver Figura 1B). Deseche las moscas del grupo experimental que no hayan herido con éxito.
- Para comenzar la disección, llene un pozo de un plato de disección de vidrio de 9 pozos con la solución de Grace. Usa un par de fórceps para agarrar a una hembra herida volando por el lado dorsal del tórax y sumergir la mosca en el pozo que contiene la solución de Grace.
- Usando fórceps en la mano opuesta sin soltar el tórax, perfore la cutícula dorsal debajo del tergito A6 y tire de la cutícula del extremo posterior de la mosca de la fruta. Los órganos internos (ovario e intestino) generalmente saldrán en este paso. Si no es así, empuje suavemente el lado dorsal del abdomen con los fórceps para exprimir los órganos restantes y desechar en un pozo vacío.
- Apriéte el abdomen completo en la unión del tórax por encima del tergito A2 usando los fórceps y transfiere el abdomen a un pozo vacío que contenga 100 ml de la solución de Grace.
- Repita los pasos 2.3-2.5 hasta que se diseccionen todos los abdomens de la mosca.
- Reduzca el volumen de la solución de Grace a 30 ml en el bien que contiene abdomens agrupados y diseccionados.
- Redondea los abdomens abiertos colocando el abdomen en el lado dorsal con los fórceps en una mano y luego insertando la hoja inferior de las tijeras de resorte de Vanna en la cavidad abdominal con la otra mano. Corte a lo largo de la línea media dorsal hasta que el abdomen esté completamente abierto, lo que puede requerir hasta tres cortes(Figura 1C, 1D).
- Configure una placa de disección seca con cuatro pines de 0,10 mm por área de montaje abdominal. Cada placa de disección de 35 mm puede caber hasta siete áreas de montaje. Pipetear 30 l de la solución de Grace en cada área de montaje y transferir un abdomen fileteado a cada gota.
- Anclar los abdomens fileteados al plato en las cuatro esquinas dorsales(Figura 1E). Asegúrese de que el tejido se encuentra plano sin rasgar o estirar demasiado el tejido abdominal.
- Para fijar el tejido, pipetee la solución de Grace y agregue 30 l de la solución fija al abdomen clavado.
ADVERTENCIA: Use guantes mientras manipula la solución fija, ya que el paraformaldehído es tóxico. - Repita los pasos 2.10-2.11 hasta que todos los abdomens empalmados estén fijados en la placa de disección.
- Coloque una etiqueta de cinta en la parte inferior de cada plato para marcar cada control y grupo experimental. Fijar muestras durante 30-60 min a temperatura ambiente (RT).
- Lavar la solución de fijación pipeteando en 1,5 ml de 1x PBS a cada plato. Deseche la solución fija y los plásticos en contenedores de residuos químicos líquidos o secos apropiados de acuerdo con las directrices institucionales.
- Lavar las placas 2x con 1,5 ml de 1x PBS y almacenar el tejido fijo cubierto en 1,5 ml de 1x PBS en un recipiente de plástico con tapa. Agregue una capa de toalla de papel húmeda a la parte inferior del recipiente y almacene las muestras a 4 oC hasta que estén listas para la inmunosumanidad dentro de 1 semana de la disección.
3. Inmunofluorescencia
- Reactivos recién preparados (ver Tabla de Materiales):solución tampón de lavado (0,3% Tritón X 100, 0,3% BSA en 1x PBS). El tampón de lavado sobrante se puede guardar a 4 oC y se puede utilizar durante la duración del protocolo de tinción de 2 días. Preparar suficiente solución de anticuerpos primarios por ensayo (Figura 2) utilizando Anti-FasIII (1:50 ratón anti-Fasciclina-III) en tampón de lavado con anti-Grh (1:300 afinidad conejo purificado anti-Grainyhead8) o anti-RFP (1:1,000 conejo anti-RFP). Las soluciones de anticuerpos primarios se pueden guardar a 4 oC y reutilizarse varias veces hasta que la señal se reduzca significativamente.
- Permeabilizar el tejido mediante la pipeteación de 1x PBS, la adición de 1,5 ml de tampón de lavado, y la incubación durante al menos 30 minutos en un agitador orbital (80 rpm) en RT.
- Retire el tampón de lavado y el tejido de la tinción durante la noche con 1,5 ml de solución primaria de anticuerpos, incubando en un agitador orbital (80 rpm) a 4 oC. Recoger la solución de anticuerpos primarios y guardarlo en un tubo a 4 oC para futuros experimentos.
- Primero enjuague la muestra rápidamente con 1x PBS y luego lave 3x con 1,5 ml de tampón de lavado. Para cada lavado, incubar muestras en RT en un agitador orbital durante al menos 30 min.
- Durante el lavado final, preparar la solución secundaria de anticuerpos: 1:1,000 burro anti-conejo Alexa 488 o 568 y 1:1,000 cabra antiratón Alexa 488 o 568 (o fluoróforos de elección) en el tampón de lavado.
- Retire el tampón de lavado y los tejidos de la tinción con 1,5 ml de solución de anticuerpos secundarios. Cubra las muestras con papel de aluminio e incubar en un agitador orbital a RT durante 3 h. Alternativamente, las muestras se pueden incubar durante la noche a 4 oC en un agitador orbital.
- Lave las muestras desechando primero la solución secundaria de anticuerpos y luego enjuague rápidamente la muestra con 1 PBS seguido de tres lavados con 1,5 ml de tampón de lavado. Para cada lavado, incubar muestras en RT en un agitador orbital durante al menos 30 min.
- Preparar la solución DAPI diluyendo DAPI a 10 g/ml en el tampón de lavado. Después del lavado final, manche muestras con 1,5 ml de solución DAPI incubando a RT durante 30 min.
- Deseche la solución DAPI y enjuague las muestras 2x en 1,5 ml de 1x PBS. Almacene el tejido teñido en 1,5 ml de 1x PBS en la oscuridad, cubierto con papel de aluminio, a 4 oC hasta que esté listo para montar en un portaobjetos de vidrio con tapaplo. El paso de montaje debe realizarse en el plazo de 1 semana.
4. Actividad del ciclo celular (ensayo EdU)
- Incomponer una solución de EdU de 10 mM a partir del kit Click-iT (ver Tabla de materiales)disolviendo el polvo de EdU en dH20 y mezclando durante 15 min hasta que se disuelva por completo. La solución en stock puede ser alícuota (250 ml por tubo) y almacenarse a -80 oC.
- La alimentación vuela EdU diluyendo primero el caldo de EdU a 5 mM en dH2O. Agregue levadura seca hasta que la solución esté turbia y brevemente vórtice para mezclar. Corte una tapa de tubo de 0,5 ml y colóquela en la parte inferior del vial de comida para moscas. Empuje la tapa en la comida, para que esté estable.
- Anesthetizar las moscas y transferir 3-5 días de edad moscas en el vial. Toque las moscas a un borde para que ninguno quede atascado en la tapa.
- Pipetear 75 l de solución de levadura-EdU en la tapa. Las moscas deben ser alimentadas con levadura fresca-EdU solución todos los días y se transfieren a un vial de alimentos frescos con una tapa cada dos días para asegurarse de que las moscas no se atascan en la parte inferior del vial.
- Para transferir moscas, voltee a un nuevo vial con una tapa, ponga moscas en reposo, toque moscas a un lado y agregue una solución de levadura fresca-EdU.
- Al tercer día, lesionar a las moscas y seguir alimentando levadura-EdU hasta la disección a 2 ppp(Figura 4A). Consulte la sección 2 del protocolo para conocer los métodos de disección y fijación.
- Preparar reactivos de tinción EdU: tampón de lavado (0,3% Tritón X 100, 0.3% BSA en 1x PBS), búfer de permeabilización (0.5% Tritón X 100 en 1x PBS), tampón de bloqueo (3% BSA en 1x PBS), y preparar reactivos del kit de ensayo EdU (ver Tabla de Materiales),incluyendo 1x buffer de reacción y 1x aditivo de reacción de reacción según las instrucciones del fabricante.
- Lavar las muestras durante 1 h, mezclando a RT en 1,5 ml de tampón de lavado.
- Añadir 1,5 ml de tampón de permeabilización e incubar muestras durante 20 min.
NOTA: Descongele y prepare la solución de cóctel de reacción utilizando un volumen de 500 l/placa. - Lave las muestras 1 veces rápidamente con 1x PBS y luego 3 veces rápidamente con 1 ml de búfer de bloqueo.
- Pipetear todo el tampón de bloqueo restante y añadir 500 ml de solución de cóctel de reacción por plato. Gire las placas para asegurar que los tejidos estén completamente cubiertos. Incubar en un cajón en la oscuridad durante 1 h en RT.
- Lave las muestras 1x rápidamente con 1,5 ml de tampón de bloqueo.
- Manchar con 1,5 ml de solución DAPI a 1:5.000 en tampón de lavado durante 30 min.
- Lavar 2x con 1x PBS rápidamente, envolver en papel de aluminio y conservar en la oscuridad a 4 oC hasta que estén listos para montar las muestras en un plazo de 3 días.
5. Monte el tejido manchado
- Obtenga todos los materiales necesarios para el montaje: portaobjetos de vidrio, cubreobjetos de vidrio, esmalte de uñas transparente, medios de montaje, un par de fórceps y toallitas.
- Para montar tejido mosca manchado, desenganches los abdomens de la placa de disección usando fórceps debajo del estereomicroscopio. Transfiera el tejido a 30 ml de medios de montaje en un cubreobjetos de vidrio agarrando suavemente el tejido con fórceps por sus flancos dorsales, teniendo cuidado de evitar tocar el área ventral con fórceps.
- Debajo del estereomicroscopio orientar el tejido abdominal de modo que el interior esté mirando hacia abajo hacia el cubreobjetos (es decir, la cutícula/cerdas externas estén mirando hacia arriba). Tire de los abdomens orientados hasta el borde de la gota de medios usando los fórceps. La tensión superficial ayudará a mantener el tejido plano (Figura 1F).
NOTA: Es útil para la toma de imágenes organizar el abdomen en una columna o fila en esta etapa. - Etiquete un portaobjetos de vidrio (es decir, control o experimental) y recoja el cubreobjetos acercando lentamente la diapositiva al cubreobjetos. Dé la vuelta a la diapositiva y borre suavemente con una toallita para eliminar el exceso de medios de montaje.
- Selle los bordes del cubreobjetos con esmalte de uñas transparente y repita para todos los grupos experimentales restantes. Almacene las diapositivas en un cuadro deslizante a 4 oC hasta que estén listas para la imagen.
6. Imágenes y procesamiento
- I imagen de la zona de la herida abdominal de la mosca localizando primero la cicatriz de melanina con un microscopio confocal(Figura 1B),ya sea un escáner puntual o una iluminación estructurada (ApoTome) con un aceite 40x o un objetivo seco.
- Compruebe la exposición en cada canal, asegurándose de que la señal está por debajo de la saturación. La configuración de imágenes debe basarse en el grupo de muestras más brillante. Esto es particularmente importante para el análisis de ploidy, ya que el canal DAPI necesita permanecer en el rango lineal para medir con precisión el contenido de ADN.
- Tome una imagen de pila z completa en los tres canales con una distancia óptima de al menos 0,50 m entre sectores. Guarde las imágenes capturadas y abra el archivo en el programa de análisis de imágenes Fiji (también conocido como ImageJ).
- Para cada imagen, cree una proyección de pila z utilizando la opción sum of slices para todos los canales.
- Gire las imágenes según sea necesario para asegurarse de que los núcleos estén alineados horizontalmente entre imágenes(Figura 3A y Figura 4E).
- Recorte todas las imágenes en una selección rectangular de 300 m x 300 m centrada alrededor del sitio de la herida o en el centro del control no lesionado. Identifique el área dibujando un rectángulo y seleccionando Editar . Selección de la selección de la selección de Especifique. Compruebe que las unidades escaladas están en micras para asegurarse de que se utiliza la misma caja de tamaño para todas las imágenes que se van a analizar.
7. Análisis de endorplicación (ploidy)
- Con Fiji, seleccione la ventana del canal Grh y duplique la imagen. A continuación, utilice la herramienta de umbral para crear una máscara. Ajuste manualmente el umbral deslizando la barra superior para minimizar el fondo sin hacer que los núcleos se reduzcan drásticamente(Figura 4D).
- Si algún núcleo del canal Grh se está tocando en la imagen de umbral, utilice la herramienta de pincel (2 píxeles de ancho) en el mismo color que el fondo para dibujar una línea entre los núcleos. Haga clic para aplicar 1x cuando haya terminado para generar la máscara final.
- Generar un mapa de región de interés (ROI) mediante la función Analizar partículas: establezca el tamaño en 5 m-60 m para capturar la mayoría de los núcleos sin incluir el fondo.
- Ajuste manualmente el mapa de ROI según sea necesario en el gestor de ROI. Elimine las selecciones que no sean núcleos y añada núcleos a la lista que no se identificaron delineando el núcleo con la herramienta de selección a mano alzada y agregándolo al gestor de ROI ( Figura4D).
- Seleccione el canal DAPI y, a continuación, haga clic en Mostrar todo en el gestor de ROI para aplicar el mapa de ROI generado en el canal Grh al canal DAPI.
- Elimine las selecciones en las que el contorno de los núcleos epiteliales se superponga con núcleos no llamativos (por ejemplo, núcleos de músculo o grasa) del mapa ROI. Grainyhead sólo mancha núcleos epiteliales, mientras que DAPI mancha todos los núcleos. Compruebe que cada selección delineada contiene solo un núcleo y elimine o edite cualquier selección con más de un núcleo. Guarde la lista de ROI editada.
- Mida el área y la densidad integrada de cada núcleo epitelial en el mapa de ROI utilizando las herramientas de análisis de Fiji. Exporte los valores a un programa de hoja de cálculo.
- Mida el fondo medio de la imagen con la herramienta de selección circular. Dibuje tres círculos que no se superpongan con ningún núcleo en diferentes áreas de la imagen DAPI. Agregue el área y la densidad integrada de cada uno de los círculos a un programa de hoja de cálculo para establecer el brillo de la imagen de fondo.
- Comience calculando el fondo medio por unidad de área para cada imagen dividiendo cada valor de densidad integrada de fondo por su área correspondiente. A continuación, promediar las tres mediciones de densidad integrada por área para la imagen con el fin de obtener el fondo promedio por unidad de área.
- A continuación, calcule el fondo total de cada núcleo DAPI multiplicando el área del núcleo por el fondo promedio por unidad de área. La intensidad DAPI normalizada para cada núcleo medido se puede calcular restando el fondo total de cada núcleo de su densidad integrada medida.
- Promedio de todos los valores de intensidad DAPI normalizados del control epitelial no lesionado. Los núcleos epiteliales no lesionados se calcularon previamente para tener un valor de ploidy de 2C y pueden servir como referencia para calcular la ploidey en los núcleos epiteliales de las condiciones experimentales8.
- Calcular la ploidy de cada núcleo dividiendo la intensidad DAPI normalizada de cada núcleo por el valor normalizado del control epitelial no lesionado de referencia (2C), luego multiplique el valor por 2 para igualar la ploidía normalizada (valor C):
(Densidad Nuclear Integrada - Densidad Integrada Nuclear de Fondo)/Densidad Nuclear Integrada Promedio (núcleos epiteliales no lesionados a 2C) x 2o ploidía nuclear epitelial (C) - Graficar núcleos con valores ploidy como una gráfica de puntos, histograma o agrupados en un gráfico de barras en consecuencia (es decir, 2C [0.6-2.9C], 4C [3.0-5.9C], 8C [6.0-12.9C], 16C [13.0-24.9C] y >32C [>25.0C] (Figura 3F).
Resultados
Se proporciona un protocolo detallado para utilizar D. melanogaster como modelo para estudiar la poliploidización inducida por heridas (WIP). Este modelo de cicatrización de heridas proporciona muchas ventajas sobre los modelos de mamíferos y otros modelos de mosca de WIP. La poliploidía fue fácilmente inducida por una punción mecánica con un pasador de insecto y células poliploides se generaron en un corto período de tiempo (2-3 dpi) (Figura 1A, 1B)4. El principal desafío es la disección del tejido abdominal intacto sin perturbaciones en el epitelio. El epitelio D. melanogaster se golpea o raya fácilmente con las herramientas de disección afiladas. Por lo tanto, los pasos de este protocolo deben practicarse antes de su uso y análisis.
En primer lugar, la lesión se limitó al abdomen femenino ventral, que proporciona un área de tejido opaco grande y plana ideal para la toma de imágenes. Las heridas punzantes fueron infligidas en el epitelio pleurito, que se encuentra a ambos lados de los esternitas ventrales de la línea media y dirigido entre los segmentos de tergito (T) T4-T5 (Figura 1A-C). Esta colocación de la herida proporciona un área visible grande que no se interrumpe por la disección. Los pasos desafiantes incluyen el corte de tijera de resorte abdominal y los pasos de fijación(Figura 1D, 1E). El paso de corte del resorte funcionó mejor cuando los abdomens se cortaron en un volumen reducido de la solución de Grace (30 l) para disminuir el movimiento del tejido. Un corte bien centrado a lo largo de la línea media dorsal era necesario para proporcionar suficiente área en las aletas dorsales abdominales para fijar abierto en la placa de disección (Figura 1C). El abdomen debe fijarse suavemente en las cuatro esquinas sin fuerza excesiva(Figura 1E). Un empuje de alfiler que es demasiado duro distorsionará el tejido abdominal e incluso podría empujar el tejido en la placa de disección. Si esto sucede, el tejido debe desecharse. Una vez fijado el tejido abdominal, permaneció en la placa de disección hasta que se completó la tinción de inmunofluorescencia y los abdomens se montaron en un cubreobjetos de vidrio para la toma de imágenes (Figura 1F).
La cicatrización de heridas requiere una hoja epitelial continua para formarse, que depende de la endoreplicación y la fusión celular4,,16. La proteína de unión septada FasIII, que etiqueta las uniones de células celulares, proporcionó un indicador de si se produjeron perturbaciones de procesamiento durante la preparación (Figura 1G, 1H). Los abdomens con grandes arañazos (área no manchada) que perturban el área de la herida deben desecharse y no se utilizaron para su posterior análisis (Figura 1H).
El siguiente paso fue analizar muestras intactas en busca de defectos en WIP. Este protocolo incluye ensayos distintos para detectar diferentes aspectos de la respuesta WIP (Figura 2). La reparación de heridas se completó cuando una célula central, grande y multinucleada cubría la costra de la herida (Figura 3A). Aquí se detectó la fusión celular mediante tinción para FasIII/Grh y cuantificando el número de núcleos epiteliales De Grh+ incluidos en el área esbozada FasIII4. Se detectaron defectos en el cierre de la herida o en la ree epitelización cuando se observaron huecos de >10 m en la hoja epitelial(Figura 3B, flecha roja). Este fue el caso, por ejemplo, cuando wip fue inhibido por la activación del ciclo mitótico a través de la expresión de stg, fzrRNAi, como se informó recientemente16. En esta condición genética, el 52% de las heridas no fueron capaces de formar una hoja epitelial continua sobre la costra de la herida (Figura 3B, 3C).
Otro método para medir la reparación de heridas en este modelo fue visualizando la membrana epitelial con expresión epi-Gal4 de UAS-mCD8-ChRFP4 (Figura 2, Figura 3D). En el control, el 91% de las heridas epiteliales se cerró completamente en 3 ppp, pero la inhibición de la WIP mediante el bloqueo de la endoreplicación (E2f1RNAi) y la fusión celular (RacDN) simultáneamente, como se informó anteriormente, hizo que el 92% de las heridas epiteliales permanecieran completamente abiertas (Figura 3D, 3E)8,16. La activación del ciclo celular mitótico por expresión de stg, fzrRNAi también resultó en un defecto de cierre de herida epitelial. Sin embargo, al visualizar la membrana celular epitelial, se pudo determinar la extensión del defecto de reepillacionalización. Las heridas de mosca del mutante WIP (E2f1RNAi, RacDN) estaban más abiertas que las heridas stg, fzrRNAi (Figura 3D, contorno rojo discontinuo)16. Este ensayo de cicatrización de heridas de membrana proporcionó más información sobre la extensión del defecto de reparación de la herida. Como resultado, los defectos de reepilación podrían agruparse como completamente abiertos, parcialmente cerrados (es decir, brechas de 10 m) o completamente cerrados(Figura 3D, 3E).
Además de la fusión celular, las células epiteliales crecen en tamaño por enoreplicación, un ciclo celular incompleto que duplica el contenido de ADN nuclear. La endreplicación fue ensayada tanto por la actividad del ciclo celular como por las mediciones directas de la ploidy del ADN nuclear(Figura 2 y Figura 4). Aquí, la actividad del ciclo celular se detectó mediante la incorporación del análogo de timidina, EdU (Figura 4A, 4B). D. Células epiteliales de melanogastro se encontraron para entrar en el endociclo, un ciclo celular incompleto que oscila entre las fases S y G sin una fase M interviniente4,12. La dieta adulta de D. melanogaster se complementó con EdU+ alimentos antes de la lesión y las moscas se mantuvieron en una dieta EdU+ hasta la disección a 2 dpi(Figura 4A). A continuación, se detectó el EdU mediante el protocolo Click-iT del fabricante. Este ensayo de EdU se utilizó para determinar dónde, cuándo y cuántos núcleos se activaron para entrar en la fase S en respuesta a una herida. Usando el sistema Gal4/ UAS, recientemente se encontró que la expresión específica epitelial de mic puede bloquear(mycRNAi) o exacerbar (Mic sobreexpression) la competencia de las células epiteliales para entrar en la fase S. Como resultado, se ha demostrado que Myc es suficiente para inducir la enreplicación en células postmitóticas, incluso sin lesión16,22.
A continuación, la ploidea epitelial se determinó midiendo directamente el contenido de ADN nuclear. Los núcleos epiteliales se identificaron mediante tinción por inmunofluorescencia para el marcador específico epitelial, Grh (Figura 4D). En el software de imágenes de Fiji, los núcleos epiteliales fueron identificados sistémicamente y luego umbralizados utilizando la mancha nuclear Grh. Los núcleos se separaron y los ROI se superponen a la SUMA de la imagen DAPI de pilas(Figura 4D,flecha verde). Los núcleos superpuestos se eliminaron manualmente antes de medir la densidad integrada de los núcleos seleccionados(Figura 4D, flechas rojas). Este método semiautomatado permite cuantificar la distribución y la ploidy de la mayoría de los núcleos a lo largo del epitelio abdominal de mosca no lesionado y reparado8. Como se ha informado recientemente, los núcleos epiteliales que rodearon la herida estaban compuestos por un 44% de núcleos de poliploides con un contenido de ADN superior a 3C a 3 ppp (Figura 4E, 4F)16. Como se esperaba de los resultados de EdU, la eliminación del micción condujo a un bloqueo significativo en la endoreplicación, ya que sólo el 9% de los núcleos epiteliales eran poliploides, mientras que la sobreexpresión de Myc dio lugar a núcleos epiteliales 100% poliploides alrededor del sitio de la herida (Figura 4F)16. El tamaño nuclear epitelial también se vio visiblemente afectado por la expresión micética con núcleos reducidos o ampliados presentes. Sin embargo, la zona nuclear no es una medida exacta de los efectos fisiológicos y de ploide, porque factores como el estiramiento celular también pueden influir en el tamaño nuclear sin afectar al contenido de ADN nuclear20.
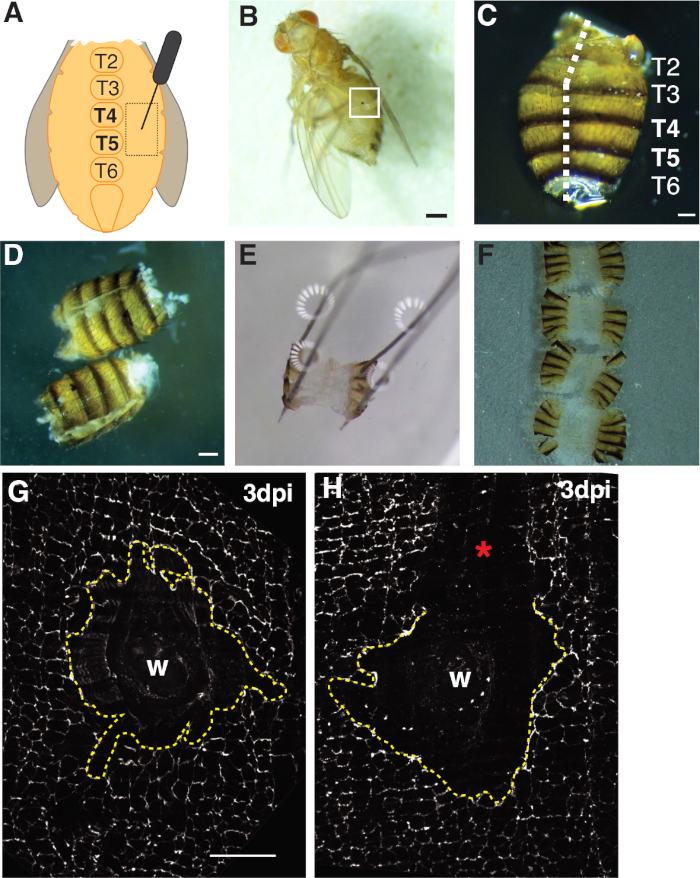
Figura 1: Heridas abdominales de mosca de fruta adulta, disección y montaje de tejido. (A) Diagrama del ensayo adulto de heridas abdominales. Las moscas deben lesionarse a ambos lados del abdomen en tergito 4 (T4). (B) La fruta femenina adulta vuela 3 ppp con costra de melanina formada a partir de cicatrización de heridas (caja blanca). Barra de escala a 50 m. (C) Abdomen adulto diseccionado, vista dorsal, con tergites etiquetados. Los abdomens estaban empalmados por la línea media del lado dorsal (línea blanca discontinua). Barra de escala a 50 m. (D) Abdomens adultos diseccionados y fileteados antes de fijar. Barra de escala a 50 m. (E) Abdomen adulto anclado en una placa de disección. Se colocó un alfiler en cada una de las cuatro esquinas del abdomen en el lado dorsal. El tejido se abrió suavemente pero no se estiró, para evitar el desgarro. (F) Los abdomens adultos se montaron y colocaron en un cubreobjetos de vidrio con el interior del abdomen mirando hacia abajo hacia el cubreobjetos y la cutícula orientada hacia el portaobjetos de vidrio. (G) Mancha de FasIII del área intacta de la herida sin perturbación de procesamiento y un sincio central (línea amarilla discontinua). Barra de escala a 50 m. (H) Imagen de un área de herida rayada (*) con una región de FasIII no manchada que interrumpe el sincitio. Haga clic aquí para ver una versión más grande de esta figura.
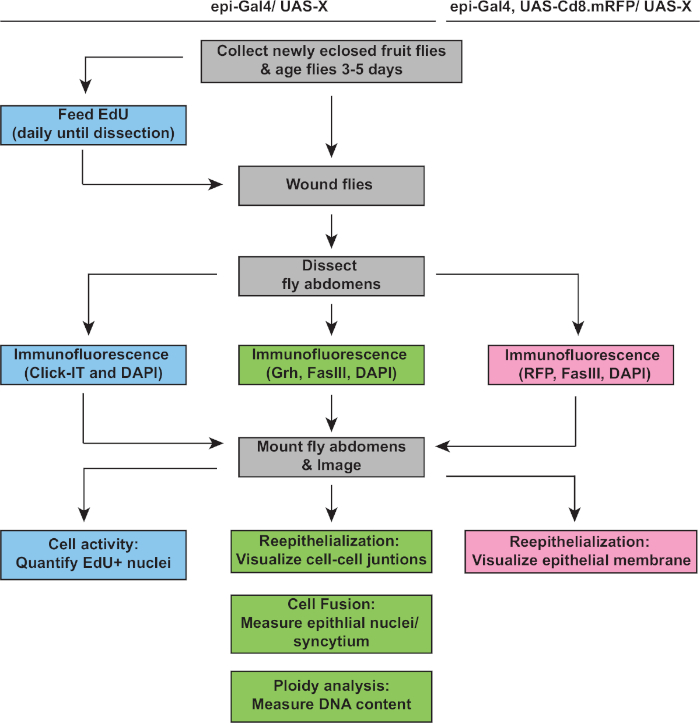
Figura 2: Flujo de trabajo de análisis WIP. El diagrama de flujo muestra los tres ensayos descritos en este estudio y los pasos superpuestos y distintos para detectar y medir la respuesta WIP. El ensayo EdU mide la actividad del ciclo celular (cajas azules), la ploidy y la reepitelización son detectadas por la inmunostaining Grh/FasIII (cajas verdes), y la expresión de la membrana RFP permite medir la extensión del cierre de la herida epitelial (cajas rosas). Los pasos comunes están en cajas grises y los genotipos de deformación unitaria de D. melanogaster se enumeran arriba. Haga clic aquí para ver una versión más grande de esta figura.
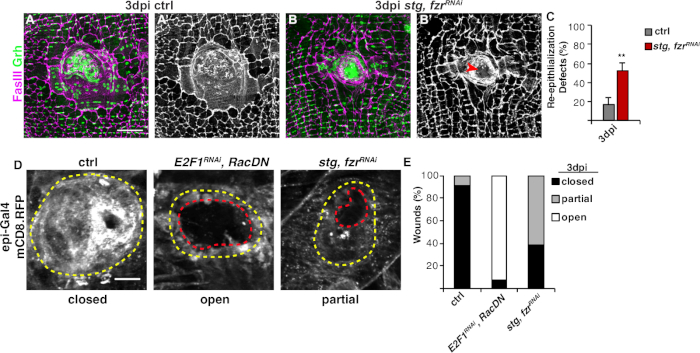
Figura 3: Métodos para detectar la reepitelización durante el trabajo en curso. La reepitelización se perturbó cuando se inhibió genéticamente la PEB. Imágenes inmunofluorescentes de control (A) y stg, fzrRNAi (B) a 3 ppp. Los núcleos epiteliales y las uniones septato se teñiron con Grh (verde) y FasIII (magenta), respectivamente. (A' y B') La tinción de FasIII por sí sola mostró que la reepilación estaba deteriorada (flecha roja) en el epitelio stg, fzrRNAi. Barra de escala a 50 m. (C) Cuantificación de defectos de reepillacionalización (%) a 3 ppp (gris): control (n a 8), stg, fzrRNAi (n a 6). Las barras de error indican un error estándar; significación estadística se midió a través de la prueba T del estudiante, **P < 0.01. La reepitelización durante la reparación de heridas también podría detectarse mediante la expresión de una RFP vinculada a membrana utilizando epi-Gal4, UAS-mCD8-RFP. (D) Imágenes inmunofluorescentes de control, E2F1RNAi, RacDNy stg, fzrRNAi a 3 ppp. Barra de escala a 20 m. Costra de heridas (contorno amarillo) y área abierta de la herida epitelial (contorno rojo). (E) Cuantificación del cierre de la herida en ctrl (n a 11), E2F1RNAi, RacDN (n n 13) y stg, fzrRNAi (n a 13). Adaptado de Grendler et al.16. Haga clic aquí para ver una versión más grande de esta figura.
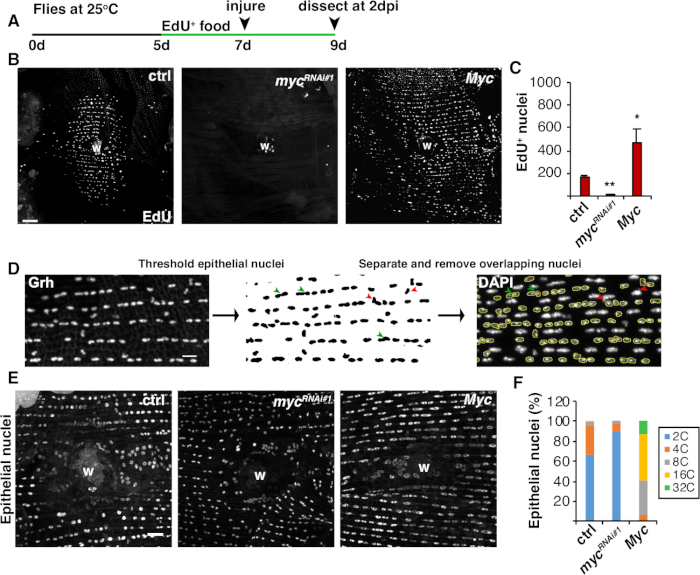
Figura 4: Métodos para detectar la endoreplicación durante el trabajo en curso. (A) Cronología del ensayo de EdU: Drosophila adulta fueron alimentadas con 75 l de 5 mM de levadura-EdU cada día 2 días antes de la lesión y continuaron hasta 2 dpi. (B) Imágenes inmunofluorescentes de la etiqueta EdU en cepas de mosca expresadas con sistema epi-Gal4/UAS a 2 ppp. Costra de heridas (W). Barra de escala a 50 m. (C) Número medio de núcleos epiteliales EdU+ por mosca a 2 ppp: ctrl (n a 37), mycRNAi-1 (n a 10) y Myc (n a 8). Las barras de error indican un error estándar; significación estadística se midió a través de la prueba T del estudiante, *P < 0.05, **P < 0.01. (D) Esquema de detección y medición de la ploidía nuclear epitelial. Los núcleos epiteliales fueron identificados y umbralados por la mancha anti-Grh en Fiji. Los núcleos epiteliales superpuestos se separaron (cabezas de flecha verdes) o se eliminaron (cabezas de flecha rojas) si se superponían por núcleos nopiteliales. Se midió la densidad integrada y el área nuclear de la imagen de núcleos teñidos de DAPI correspondiente. (E) El tamaño nuclear epitelial (Grh) fue alterado por la expresión mic a 3 ppp. (F) Ploidía nuclear epitelial (%) a 3 ppp: ctrl (n a 4), mycRNAi-1 (n á 6) y Myc (n a 3). Adaptado de Grendler et al.16. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Presentado es un protocolo detallado sobre cómo diseccionar y utilizar el epitelio abdominal D. melanogaster adulto para estudiar cómo los genes regulan el WIP mediante la alteración de la reepitelización y la endoreplicación durante la reparación de la herida16. Usando este método, el proto-oncogene Myc fue identificado recientemente como un regulador clave de WIP. Myc es necesario para que las células epiteliales endoplican después de la lesión y es suficiente para que las células epiteliales en reposo endociclen tanto en el epitelio de la mosca adulta como en las glándulas accesorias16,,22. También se encontró que cambiar las células epiteliales a un ciclo celular mitótico por expresión de stg, fzrRNAi es perjudicial para la reparación de heridas. Los estudios continuados utilizando este método identificarán otros genes necesarios para regular la reepitelización y la endoreplicación durante el trabajo en curso, revelando similitudes y diferencias a cómo se regula la poliploidía y funciona en una variedad de tejidos.
Este modelo y método ofrecen ventajas únicas, incluyendo la fácil inducción de la poliploidía con una punción mecánica y el hecho de que las células poliploides se generan en los días4. Los protocolos de disección y preparación de tejidos se basan en las técnicas de disección larvaria23,pero el abdomen de la mosca adulta es más rígido y, por lo tanto, se perturba fácilmente. Como resultado, este protocolo requiere práctica y precisión para aislar un tejido intacto para estudiar WIP. Una vez diseccionado, sin embargo, el epitelio es claramente visible y fácil de imaginar, produciendo una instantánea del proceso de cicatrización de la herida. Este método proporciona una gran cantidad de información sobre la organización epitelial de la mosca adulta, el tamaño celular y del sintimio, y la ploidy de las células y los núcleos individuales. Si bien la imagen en vivo aún no es posible dentro de la mosca de la fruta intacta debido a su cutícula opaca, este protocolo podría adaptarse para incluir las condiciones de cultivo ex vivo disponibles actualmente utilizadas en D. melanogaster para realizar estudios de imágenes en vivo a corto plazo24.
En el futuro, este modelo será ideal para estudiar la conversación cruzada de célula a célula y la contribución de otros tipos de células a WIP mediante la regulación de la expresión génica con el sistema Gal4/UAS en otros tipos de interés celular. Preguntas similares también pueden ser respondidas usando una variedad de antecedentes genéticos y mutantes. El abdomen de la mosca adulta diseccionada contiene una variedad de tipos de células que se pueden visualizar fácilmente utilizando este método, incluyendo cuerpo de grasa y ovonocitos, fibras musculares laterales, neuronas sensoriales, tráquea, y hemocitos similares a los macrófagos. Además, este modelo permitirá a los investigadores investigar cómo las variables fisiológicas influyen en el WIP, incluyendo el sexo, la dieta, la infección, la edad y los factores estresantes ambientales. Mientras que el protocolo utiliza la mosca hembra adulta debido a su mayor tamaño, WIP también ocurre en la mosca de la fruta masculina (Gjelsvik y Losick, inédito). Se ha encontrado que las células poliploides surgen durante el envejecimiento y la enfermedad asociada a la edad en el hígado de los mamíferos, cerebro, ojo y corazón12. El modelo de mosca de la fruta permitirá a los investigadores estudiar la poliploidización en contextos fisiológicos y de enfermedades porque los genes relacionados con enfermedades humanas están altamente conservados.
Divulgaciones
Ninguno.
Agradecimientos
En Boston College, nos gustaría agradecer al Dr. Eric Folker por el uso de la configuración del microscopio de cámara y estereoscopio de su laboratorio para imágenes y Bret Judson en el Boston College Imaging Core por la infraestructura y el apoyo. También nos gustaría agradecer a los recursos comunitarios de fly: Bloomington Drosophila Stock Center (NIH P40OD018537), Vienna Drosophila Resource Center y TRiP Center en Harvard Medical School (NIH/NIGMS R01-GM084947) por proporcionar existencias transgénicas utilizadas en este estudio. El ratón FasIII anticuerpo fue obtenido de Estudios de Desarrollo Hybridoma Bank apoyado por NICHD del NIH y mantenido en la Universidad de Iowa, Departamento de Biología, Iowa City, IA. La investigación reportada en esta publicación fue apoyada por el Instituto Nacional de Ciencias Médicas Generales de los Institutos Nacionales de Salud bajo el premio número R35GM124691. El contenido es responsabilidad exclusiva de los autores y no representa necesariamente las opiniones oficiales de los Institutos Nacionales de Salud.
Materiales
| Name | Company | Catalog Number | Comments |
| 35 mm Petri dishes | Fisher Scientific | FB0875713 | For creating plates to dissect in |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | For preparing staining reagents in |
| AxioImager M2 with Apotome | Zeiss | NA | For imaging samples |
| Blowgun mini | Genesee Scientific | 54-104M | For anethesizing D. melanogaster strains |
| Bovine Serum Albumin, 30% | Sigma | A7284-500ML | For immuostaining |
| Carbon dioxide tank | various distributors | N/A | For anethesizing D. melanogaster strains |
| Click-iT EdU 594 Kit | Thermofisher | C10339 | For EdU assay |
| Coverslips | Thermofisher | 3406 | For mounting |
| DAPI | Sigma | D9542-10MG | For immuostaining |
| Dissecting Plates (use Sylgard 184 Sil Elastic Kit) | Ellsworth Adhesives | 184SIL | For creating plates to dissect in. Mix epoxy as directed, let dry overnight |
| Donkey anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate | Thermofisher | A21206 | For secondary immuostaining |
| Donkey anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 568 conjugate | Thermofisher | A10042 | For secondary immuostaining |
| Drosophila tubing and fittings | Genesee Scientific | 59-124C, 59-123, 59-140 | For anethesizing D. melanogaster strains |
| Dumont #5 Forceps | Fine Science Tools | 11252-20 | For dissecting |
| epi-Gal4 | Bloomington Drosophila Stock Center (b) | b38793 | Losick et al. Current Biology, 2013 |
| epi-Gal4, UAS-mCD8.RFP | Bloomington Drosophila Stock Center (b) | b38793, b27392 | Losick et al. Current Biology, 2013 |
| Excel | Microsoft | For performing ploidy calculations | |
| Fiji/ImageJ (image analysis software) | NIH | https://imagej.nih.gov/ij | For image analysis |
| Fly food | Archon Scientific | N/A | Corn Syrup/Soy food |
| Flystuff Flypad | Genesee Scientific | 59-114 | For anethesizing D. melanogaster strains |
| Glass dissecting dish | Fisher Scientific | 13-748B | For performing dissections in |
| Glass slides | Fisher Scientific | 12-518-104C | For mounting |
| Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate | Thermofisher | A11001 | For secondary immuostaining |
| Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 568 conjugate | Thermofisher | A11031 | For secondary immuostaining |
| Grace's Insect Medium, unsupplemented | Thermofisher | 11595030 | For dissecting in |
| Insect pins | Fine Science Tools | 26002-10 | For wounding and pinning fly abdomens flat |
| Mouse anti-Fasciclin III (Drosophila) Primary Antibody | Developmental Studies Hybridoma Bank | 7G10 | For immunostaining epithelial cell-cell junctions |
| Mouting media | Vector Laboratories | H-1000 | Anti-fade mounting media to prevent photo bleaching during imaging |
| Nail polish | Electron Microscopy Sciences | 72180 | For sealing slides |
| Ortibal shaker | Fisher Scientific | 02-217-988 | For immuostaining |
| Phosphate Buffered Saline, PH 7.4 | Sigma | P3813-10PAK | For staining |
| Pin holders | Fine Science Tools | 91606-07 | For wounding |
| Rabbit anti-Grainyhead Primary Antibody | N/A | N/A | For immunostaining epithelial nuclei. Protocol to make antibody can be found (Ref. #4 and 8) |
| Rabbit anti-RFP Primary Antibody | MBL | PM005 | For immunostaining mCD8-RFP fly epithelium |
| Stereomicroscope | Olympus | SZ51 | For dissecting and mounting fly tissue |
| Triton X-100 | Sigma | 10789704001 | For immuostaining |
| UAS-E2F RNAi, UAS-RacDN | VDRC (v) and Bloomington Drosophila Stock Center (b) | v108837, b6292 | Losick et al. Current Biology, 2013 |
| UAS-fzr RNAi, UAS-Stg | VDRC (v) and Bloomington Drosophila Stock Center (b) | v25550, b56562 | Grendler et al. Development, 2019 |
| UAS-Myc | Bloomington Drosophila Stock Center (b) | b9674 | Grendler et al. Development, 2019 |
| UAS-myc RNAi | Bloomington Drosophila Stock Center (b) | b36123 | Grendler et al. Development, 2019 |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | For dissecting |
Referencias
- Abreu-Blanco, M. T., Verboon, J. M., Liu, R., Watts, J. J., Parkhurst, S. M. Drosophila embryos close epithelial wounds using a combination of cellular protrusions and an actomyosin purse string. Journal of Cell Science. 125 (Pt 24), 5984-5997 (2012).
- Wood, W., et al. Wound healing recapitulates morphogenesis in Drosophila embryos. Nature Cell Biology. 4 (11), 907-912 (2002).
- Galko, M. J., Krasnow, M. A. Cellular and genetic analysis of wound healing in Drosophila larvae. PLoS Biology. 2 (8), E239 (2004).
- Losick, V. P., Fox, D. T., Spradling, A. C. Polyploidization and cell fusion contribute to wound healing in the adult Drosophila epithelium. Current Biology. 23 (22), 2224-2232 (2013).
- Wang, Y., et al. Integrin Adhesions Suppress Syncytium Formation in the Drosophila Larval Epidermis. Current Biology. 25 (17), 2215-2227 (2015).
- Ramos-Lewis, W., LaFever, K. S., Page-McCaw, A. A scar-like lesion is apparent in basement membrane after wound repair in vivo. Matrix Biology. 74, 101-120 (2018).
- Lee, C. W., Kwon, Y. C., Lee, Y., Park, M. Y., Choe, K. M. cdc37 is essential for JNK pathway activation and wound closure in Drosophila. Molecular Biology of the Cell. 30 (21), 2651-2658 (2019).
- Losick, V. P., Jun, A. S., Spradling, A. C. Wound-Induced Polyploidization: Regulation by Hippo and JNK Signaling and Conservation in Mammals. PLoS One. 11 (3), e0151251 (2016).
- Tamori, Y., Deng, W. M. Tissue repair through cell competition and compensatory cellular hypertrophy in postmitotic epithelia. Developmental Cell. 25 (4), 350-363 (2013).
- Xiang, J., et al. EGFR-dependent TOR-independent endocycles support Drosophila gut epithelial regeneration. Nature Communications. 8, 15125 (2017).
- Cohen, E., Allen, S. R., Sawyer, J. K., Fox, D. T. Fizzy-Related dictates A cell cycle switch during organ repair and tissue growth responses in the Drosophila hindgut. Elife. 7, e38327 (2018).
- Gjelsvik, K. J., Besen-McNally, R., Losick, V. P. Solving the Polyploid Mystery in Health and Disease. Trends in genetics: TIG. 35 (1), 6-14 (2019).
- Cao, J., et al. Tension Creates an Endoreplication Wavefront that Leads Regeneration of Epicardial Tissue. Developmental Cell. 42 (6), 600-615 (2017).
- Zhang, S., et al. The Polyploid State Plays a Tumor-Suppressive Role in the Liver. Developmental Cell. 44 (4), 447-459 (2018).
- Lazzeri, E., et al. Endocycle-related tubular cell hypertrophy and progenitor proliferation recover renal function after acute kidney injury. Nature Communications. 9 (1), 1344 (2018).
- Grendler, J., Lowgren, S., Mills, M., Losick, V. P. Wound-induced polyploidization is driven by Myc and supports tissue repair in the presence of DNA damage. Development. 146 (15), 173005 (2019).
- Mehrotra, S., Maqbool, S. B., Kolpakas, A., Murnen, K., Calvi, B. R. Endocycling cells do not apoptose in response to DNA rereplication genotoxic stress. Genes & Development. 22 (22), 3158-3171 (2008).
- Patterson, M., et al. Frequency of mononuclear diploid cardiomyocytes underlies natural variation in heart regeneration. Nature Genetics. 49 (9), 1346-1353 (2017).
- Gonzalez-Rosa, J. M., et al. Myocardial Polyploidization Creates a Barrier to Heart Regeneration in Zebrafish. Developmental Cell. 44 (4), 433-446 (2018).
- Webster, M., Witkin, K. L., Cohen-Fix, O. Sizing up the nucleus: nuclear shape, size and nuclear-envelope assembly. Journal of Cell Science. 122 (Pt 10), 1477-1486 (2009).
- Knouse, K. A., Lopez, K. E., Bachofner, M., Amon, A. Chromosome Segregation Fidelity in Epithelia Requires Tissue Architecture. Cell. 175 (1), 200-211 (2018).
- Box, A. M., et al. Endocycles support tissue growth and regeneration of the adult Drosophila accessory gland. bioRxiv. , 719013 (2019).
- Karim, M. R., Moore, A. W. Morphological analysis of Drosophila larval peripheral sensory neuron dendrites and axons using genetic mosaics. Journal of Visualized Experiments. (57), e3111 (2011).
- Dai, W., Montell, D. J. Live Imaging of Border Cell Migration in Drosophila. Methods in Molecular Biology. 1407, 153-168 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados