Method Article
軟リソグラフィの改変を用いた根表面微細構造の生物模倣複製
要約
バイオミメティクスは、以前葉と微生物の相互作用を研究するためのツールとして使用されてきました。ただし、ルートに対してそのようなツールは存在しません。ここでは、根と環境の相互作用の研究のために、根表面微細構造を模倣した合成表面を形成するプロトコルを開発する。
要約
バイオミメティクスは、生物系、特に生物学的構造を模倣し、人類を改善するために化学と材料科学を使用することです。近年、葉表面の微細構造を模したバイオミメティック表面を用いて、葉と環境相互作用に対する葉の微細構造の影響を研究するために用いられた。ただし、ルートに対してそのようなツールは存在しません。根表面微細構造の合成模倣を人工表面に可能にするツールを開発しました。葉表面微細構造複製で知られるソフトリソグラフィ法に頼り、2段階のプロセスを用いた。最初のステップは、生物学的組織を含むより挑戦的なものです。ここでは、強く硬いポリウレタンに頼り、根型成形のためにUVによって硬化する別のポリマーと硬化戦略を使用しました。これにより、根毛などの繊細で挑戦的な特徴を含む根表面微細構造の信頼性の高い負のイメージを達成することができました。その後、この陰性画像をテンプレートとして使用して、確立されたポリジメチルシロキサン(PDMS)と、根の近似を表すセルラーゼ酵素によって分解することができるセルロース誘導体エチルセルロースの両方を使用して、根表面微細構造複製を達成しました。この新しく形成されたプラットホームは葉で示されていたものと同じような方法で根と微生物の相互作用の表面の微小構造効果を研究するために使用することができる。さらに、このシステムにより、細胞の分泌の形で、表面の特徴に対する微生物の位置、および将来的にその活性を追跡することができます。
概要
葉表面微細構造の複製は、バイオミメティクス研究分野11,2,3,42,3,4における公知の方法である。葉表面微細構造の初期の複製は、微細構造のより良い視覚化のために葉表面に適用されるマニキュアおよびゴム材料を使用して行った、具体的にはストマタ565、6、7、8、9、10。,7,8,9,10,その後、改良された方法を改良し、特に超疎水性表面,,22、3、4、11、123のバイオミメティクスの文脈において、軟リソグラフィを用いて葉表面微細構造を模倣するために高度なポリマー11を12用いた。4近年、この方法は、天然葉フィロスフィア15の一部として、それらが病原性であるが、13、14または14有益であるか、表面に存在する葉表面と微生物との相互作用の研究において有用なツールとして証明された。自然システムの単純化は、純粋に合成系が表面,15、16、17、18として使用された場合でも16、17表面微生物相互作用の研究において非常に有用であることが証明された。,18
葉表面微細構造の複製は、異なる微生物を用いて葉の表面に生じる相互作用を研究するための有用なツールであることが示されたが、植物根にはそのようなツールは存在しない。植物の根は地下に存在し、すべての相互作用が土壌内で発生するため、研究が困難です。葉と同様に、根表面微細構造は根と微生物の相互作用に役割を果たす可能性が高い。しかしながら、現在、複雑な根-微生物相互作用における根表面微細構造の特定の役割を分離する方法は存在しない。最も研究された根表面の微細構造特徴は、根毛19、20、2120,21である。19根毛は、表面積を増加させる上で重要な役割を有し、栄養素および水22のより効率的な摂取を可能にすることによって、根と微生物の相互作用における構造的特徴としての関与は一度もテストされていない。
葉のソフトリソグラフィーに最も広く使用されているポリマーは、ポリジメチルシロキサン(PDMS)です。PDMS特性は、葉のキューティクル15、23,23の特性に似ています。しかし、植物根において最も豊富な材料は、PDMS26、27、28と28は異なる特性を有するセルロース24、25である。26,27,25PDMSを使用して、根環境相互作用における表面微細構造効果を研究するための合成プラットフォームを構築することは、したがって、理想的ではない。
ここで提示されるプロトコルは、様々な材料からの合成根表面微細構造レプリカの形成を可能にする。葉表面微細構造複製の方法と同様に、これは2段階のプロセスです。最初のステップでは、ポリウレタン型(負のレプリカ)に成形するためのソースとして、生物学的組織(根)を使用します。根表面微細構造の負の画像を表すポリウレタン型は、次いで、PDMSおよびセルロース誘導体を含む様々な材料から根表面微細構造の正の複製を生成するベースとして使用することができる。この根面複製は、後に根-微生物相互作用における表面構造の役割を理解するプラットフォームとして使用することができる。
プロトコル
植物の栽培と根の準備
- オプション1:茎から冒険的な根を準備します。
- 成長する植物のための根付けトレイを取ります。
- トレイに土を入れ。
- トレイの各セルにM82トマト品種の1種を加えます。
- 種を少し土で覆う。
- 水がトレイの底を満たし、土壌が水を吸収するので、下からドロッパーでトレイに水を与えます。
- 週に一度トレイの底に水1Lあたり2mLの肥料を加えます。
- 25°Cで成長室で成長します。
- 暗闇の15時間と交互に9 h光(7:00-16:00)の照明条件を使用してください。
- 3週間後、土壌から植物を除去します。
- 茎との相互作用のポイントで植物から根系をカットします。
- 水で満たされたビーカーに根のない植物を入れてください。
- 数日後、茎から出てくる冒険的な根を切り取り、複製に使用します。
- オプション2:種子の発芽根を準備します。
- ペトリ皿サイズのろ紙を水で濡らします。
- ペトリ皿の中に、紙の上にいくつかのM82シード(10以上)を置きます。
- プレートを25°Cでインキュベートします。
- 毎日紙を水分補給してください。
- 発芽した根が十分に長い(約5日間)後、種子を取り除き、複製のために根を使用します。
2. ポリウレタンからの根陰性レプリカの調製
- 負のレプリカ溶液を生成するには、20 mLバイアルに9.49 gのジメサクリレートを加えます。
- バイアルに1.45mLのエチルメタクリレートを加えます。
- 溶液が透明に見え、均質になるまで室温(RT)でかき混ぜます。
注: 約 2 時間は、均一なソリューションに到達するのに十分です。 - 可塑剤3mLを加え、フタル酸ジエチルを加え、RTで1時間かき混ぜます。
注:ジエチルフタル酸は、アクリルモノマーで混和性である。 - 写真のイニシエーター、2-ヒドロキシ-2-メチルプロピオフェノンの300 μLを加え、RTで一晩かき混ぜます。
注: プロトコルはここで一時停止することができます。ソリューションはRTで維持することができます。
- 根の負のレプリカを生成するには、きれいなガラススライドを取り、その上に負のレプリカ溶液の1 mLを注ぎます。
- ソリューションの上に 2\u20123 のルートを配置します。ルートがソリューションによって完全にカバーされることを許可しないでください。
- 8\u201210 分間、8 W の紫外線 (UV) ランプの下にスライドを保管します。溶液をUV光の下に長時間置いておかないでください。
注:ポリウレタンが硬くなりすぎて根元を取り除けなくなるので、UVライトの下に溶液を長く保たないことが重要です。 - UVランプをオフにし、ガラススライドからレプリカを取り出し、エタノールで満たされたペトリ皿に入れて、未反応のモノマーを取り除きます。
- ネガティブなレプリカを取得するには、鉗子を使用して非常にゆっくりとレプリカからルートを削除します。
3. PDMS からルートポジティブレプリカを準備します。
- 陽性レプリカの混合物を生成するには、10gのジメチルシロキサンを紙コップに入れます。
- 1gの硬化剤を加え、十分に混ぜます。
- 空気泡を除去するために2時間真空下でデシケーターに混合物を保管してください。
- 正のレプリカを生成するには、ポリウレタン陰性レプリカをペトリ皿に入れます。
- PDMS混合物をネガティブレプリカの上に注ぎます。
- 微小構造のカバレッジを確保するために2時間真空を適用します。
- RTでペトリ皿を一晩保管してください。
- レガネガティブレプリカから、硬化したポジティブレプリカを手入力で分離します。
4. エチルセルロースから根陽性レプリカを準備します。
- エチルセルロース溶液を生成するには、100mlカップに1.32mlのジエチルプタレートを可塑剤として入れる。
- エタノールを20mL加え、RTで2時間かき混ぜます。
- エチルセルロースを3.3g加え、一晩かき混ぜます。
- 正のレプリカを生成するには、ポリウレタン陰性レプリカをペトリ皿に入れます。
- ネガティブレプリカの上にエチルセルロース溶液を注ぎます。
- フードの下にRTで一晩ペトリ皿を保ちます。
- フォースによってネガティブ レプリカからポジティブ レプリカを削除する。
結果
根表面の微細構造複製を形成するには、成形用にルートを選択する必要があります。私たちは土壌中のトマト植物を栽培し、根系の天然根を利用することは非常に困難です。根系からの土の除去は困難であり、さらに根系根は壊れやすく、成形の試み時に壊れる可能性があります。したがって、まず、より堅い根を使用して、ラボでプロトコルを確立することをお勧めします。このような根の形成は図1Aに記載されている。植物根系は、植物が3週間成長した後に除去され、根のない植物は、茎から出現する根が出てくるまで約1週間水中に置かれる。これらのルートは、プロトコルの確立中にレプリケーションに使用できます。プロトコルが確立されたら、より現実的なルートサーフェス構造が望まれる。ここでは、非常に困難な土壌の完全な除去として土壌で成長した根を避けることをお勧めします。代わりに、遺伝的に特定の植物の根表面微細構造に関する貴重な情報を提供し、発芽根の使用を提案する。このような根の成長は図1Bに記載されています。種子は、湿ったフィルター紙の上に置かれ、25°Cでインキュベートされます。約5日後、濾紙が湿った状態に保たれ、発芽した根は複製に十分な長さになる。これらの根は、以前に提案された根よりも脆弱であり、より繊細なケアを必要とします。
根表面微細構造レプリカの製造は、2段階のプロセスです。最初のステップでは、天然根はポリウレタンベースの金型(負のレプリカ)に成形されています。このステップの利点は、ポリウレタン型のすべての材料が準備され、ルートがUVへの10分の露出のために最後に調製された溶液の上に置かれているということです。その結果、生体組織は過酷な条件にさらされすぎて、プロセスの最後に穏やかに処理することができます。すべてのプロトコル・ステップに従えば、良好なネガティブ・レプリカが生成されます。このレプリカには、ルート サーフェスのセル構造と、根ヘアの位置を表す穴が表示されます (図 2A)。プロトコルの重要な手順が実行されない場合、その手順は失敗します。そのようなステップの1つは、硬化前のポリウレタン溶液上の根の配置である。ポリウレタン溶液中の水没を避けるために、根は非常に穏やかに配置されなければならない。このような水没は、根の任意の部分の、それを除去する能力を持たない硬いポリマー中の根の封じ込めを引き起こす。このようなイベントが発生した場合、ルートは、削除後も負のレプリカ内に残ります (図 2B)。もう一つの重要なステップは、UV光による硬化時間に関することです。推奨硬化時間は8\u201210分です。10分を過ぎると非常に硬いポリウレタン型が発生し、ポリウレタン型の中で根を壊さずに取り除かれなくなります。大きな部分が壊れたときなど、根の破損は肉眼で見えることがあります(図2C、上、紫色の矢印でマーク)。しかし、肉眼で見つけにくい材料に小さな根片が残り、顕微鏡を使用しなければならない場合があります(図2C、下、紫色の矢印でマーク)。プロトコルの継続前にポリウレタン陰性レプリカを顕微鏡で慎重に調べ、残留根がないことを確認することをお勧めします。
ポリウレタンネガティブレプリカが準備されると、多くの材料は、ポジティブなレプリカの調製に使用することができます。正のレプリカの調製は、ポリウレタンネガティブレプリカを金型として使用し、まっすぐ進み、ポリウレタンネガティブレプリカの品質に完全に依存します。正のレプリカを生成するために、ソフトリソグラフィ(図3A)の分野でよく知られているPDMSと、主にセルロースで構成される根表面の特性をよりよく模倣する材料としてエチルセルロースの両方を使用しました(図3B)。PDMS レプリカの SEM イメージは、根ヘアを非常に明確に示しています。毛は伸び帯にあり、そこから現れ始めます。したがって、根のヘアの長さは、自然なルートのように長くなるにつれて、根の表面に沿って変化します(図3A)。エチルセルロースはPDMSよりも硬く、柔軟性の低いフィルムを生成します。したがって、負の金型から除去するには、より多くの注意が必要です。しかし、一部の毛髪および表面微細構造は、光顕微鏡下で見える(図3B)。これらの2つの材料を使用して正のレプリカを生成したが、フィルムを形成できる材料は、ポリウレタンネガティブレプリカを使用して、陽性レプリカの良い候補となるだろう。

図1:複製用のトマト植物の根。(A)トマト(M82)植物は、光の9時間と15時間の暗闇で25°Cで栽培されています。3週間後、植物は土壌から取り除かれ、根系は遮断される。根のない植物は、約1週間後に茎から出現する根が出てくるまで水に入れられます。これらのルートは、ルート システムからのルートとして正確な構造を示すわけではありませんが、優れたモデルを表します。これらのルートはルート システム ルートよりも脆弱ではないため、ラボでの技術の確立時に使用することが推奨されます。(B)トマト(M82)種子はペトリ皿に湿ったフィルター紙に入れ、25°Cでインキュベートする。紙は毎日水分補給され、種子は発芽しています。根は増大しており、約5日後にはレプリケーションに使用できる長さになります。これらの根は穏やかで、メソッドが確立されたら使用する必要があります。この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:ポリウレタン陰性レプリカの顕微鏡画像(A) すべての手順に従うプロトコルに従って作られたポリウレタンネガティブレプリカのSEM画像。細胞構造がはっきりと見える。黄色の矢印は、根の毛によって形成された穴を指します。(B)ポリウレタンネガティブレプリカの光顕微鏡画像は、溶液で完全に覆われていて、それを除去することは不可能であった。ポリウレタン陰性を、根を内部で硬化させた。根は目で見ることができ、光顕微鏡を用いる。このルートを、硬化したレプリカから削除することは不可能です。(C)UV光下に長時間保存されていたポリウレタン陰性レプリカの光顕微鏡画像。その結果、重層は、大きな粒子が目で見える(上の画像、紫色の矢印でマークされている)、または顕微鏡でのみ見える小さな分数(紫色の矢印でマークされた下の画像)のいずれかでポリマーから完全に除去することができませんでした。この図の大きなバージョンを表示するには、ここをクリックしてください。
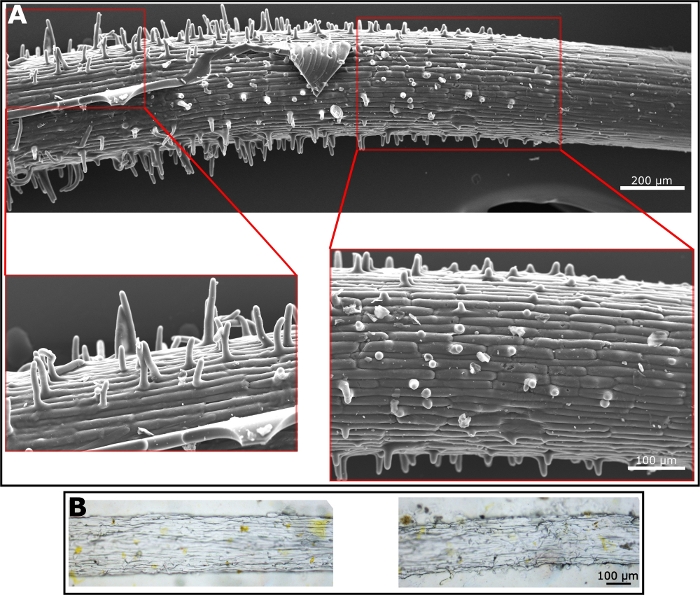
図3:陽性レプリカの顕微鏡画像。(A) PDMSから作られたポジティブレプリカのSEM顕微鏡写真。拡大は根の毛を示す。(B)エチルセルロースから作られた陽性レプリカの光顕微鏡画像。ヘアは右側の画像に表示され、サーフェス テクスチャは左側のイメージに表示されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
根表面微細構造の複製のための新しい方法を提示する。この方法は、葉表面微細構造複製4の既存の方法に依存しています。この方法を開発するためには、葉の既存の方法を微調整する必要がありました。葉の複製方法を根にコピーする際の問題となるステップは、根型成形の第一歩を伴うことを認識しました。これは、生物学的組織を含む方法の最も敏感な部分です。その結果、硬化のために比較的穏やかな条件を必要とし、生物学的組織への損傷を最小限に抑えるポリマーを選択したいと考えました。ポリウレタンは、UV光29の下で迅速に(10分以内に)重合することができるので、我々は選んだ。さらに、一度重合した30は非常に難しく、この特性がポリウレタン型から根を比較的容易に除去することを可能にすることを期待した。
提示された方法は、最初のステップでネガティブイメージ(ネガティブレプリカ)を形成し、第2ステップでレプリケーションを形成する2段階のアプローチです。これにより、作業できる材料の範囲が拡張されます。葉表面微細構造複製は、主にPDMSまたはエポキシ材料11,31,31に対して行った。いくつかの作業は、他の材料、特に微生物の成長を支える材料13、32で32行われました。これは、近年、この方法が葉表面構造の文脈における微生物と表面の相互作用を研究するために使用されているからである。しかし、この方法では葉の文脈ではセルロース状の材料は使用されていない。ポリウレタンネガティブレプリカを金型として、また、ポジティブレプリカ用の様々な材料を使用することをお勧めします。つまり、ポジティブレプリカを作ることは、様々な材料から、一度良いネガティブレプリカが作られると比較的容易である。現在、セルロース誘導体を使用していますが、セルロース誘導体と組み合わせてペクチンやリグニン33、34,34などの根面に関連する材料を使用する可能性を探っています。
この方法は、リーフが2Dサーフェスであり、ルートサーフェスが曲がり、3Dサーフェスであるため、リーフ表面の微細構造複製の既存の方法にも拡張されます。この方法では、ポリウレタン溶液に根全体を埋め込むため、表面全体の複製は可能ではありません。したがって、根の表面の微細構造を複製する際に、根の片側を選択する必要があります。生成された合成サーフェスは湾曲しており、サーフェスの約半分を表しますが、そのすべてを表すわけではありません。私たちの仮定は、根表面の構造的特徴が根の長さに沿った軸に対してほとんど対称であるということです。しかし、このような対称性が想定されていない研究では、複製する適切な側根を選択するように注意する必要があります。
根を金型として使用する 2 つのオプションを提示します。1つ目は茎から成長した出現の根のオプションであり、2つ目は紙の上に発芽した根のオプションです。最初の選択肢は、これらのルーツがより堅牢で作業しやすいため、研究者がこの方法を実践するのを助けることを主に目的としています。第二の選択肢は、環境条件に関係なく、異なる品種の根の間で見つけることができる遺伝的な違いを表します。これらの表面は重要な研究ツールとして使用することができるが、根表面構造、特に根が35、36,36に成長する土壌に環境が強い影響を及ぼす可能性があることを認識する必要がある。土壌によって引き起こされた機械的ストレスのために、根が土壌37を貫通する際に表面に発生する創傷に加えて、いくつかの形態学的変化が起こるに違いない。土壌から根を除去し、それらを洗浄するが、その構造を損傷することなく、非常に困難な作業です。したがって、土壌で栽培された根の根表面微細構造を確実に模倣するためにこの方法を使用する能力について楽観的ではありません。しかし、微細構造の変化が顕著に明らかな遺伝的差異や環境の違いに焦点を当てた研究では、根表面微細構造の影響を研究するツールとして使用することができます。
我々の方法は、根表面の微細構造特性のみを模倣する不活性な表面を生成する。この方法は、根と環境の相互作用における構造的効果を他のすべての効果から分離するように設計されていますが、それらの相互作用の化学化合物を無視することはできません。一部の微生物は、化合物、特に栄養素を添加せずに表面上で生き残ったり機能したりしない場合があります。このプラットフォームの開発の次のステップは、構造と組み合わせると、異なる相互作用に対するそれらの効果を研究するために、化学化合物の制御された添加になります。
この方法は、根と微生物の相互作用を研究する合成プラットフォームの開発の第一歩として開発されました。ここでは根元表面の微細構造を模倣し、この初期プラットフォームを用いて、微生物の挙動に対する表面微細構造の影響を調べることができる。しかし、このプラットフォームは、自然システムからの他の多くの要素を欠いているので限られています。このプラットフォームは、表面を生成するための適切な材料を使用して、システムに他の重要な化学物質を追加して、さらに開発する必要があります。より高度なプラットフォームでは、化学物質の空間分布も想像できます。しかし、現在、根と微生物の相互作用における構造的効果を分離する他の方法は存在しないため、研究者がこの初期プラットフォームを使用して、それらの相互作用に構造固有の質問を行うことを望んでいます。
開示事項
著者らは開示するものは何もない。
謝辞
研究は、農業研究機構からMKへのシード資金によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| 2-hydroxy-2-methylpropiophenone | Sigma | 405655 | |
| Diethyl phthalate | Across | 114520010 | |
| Diurethane dimetharylate | Sigma | 436909 | |
| Ethyl cellulose | Across | 232705000 | |
| Ethyl methacrylate | Sigma | 234893 | |
| Shaphir Solution | GAT fertilizer | 6-2-4 | |
| Sylgard 184 kit | Polymer-G | 510018400500 |
参考文献
- Bhushan, B., Jung, Y. C., Niemietz, A., Koch, K. Lotus-Like Biomimetic Hierarchical Structures Developed by the Self-Assembly of Tubular Plant Waxes. Langmuir. 25, 1659-1666 (2009).
- Koch, K., Barthlott, W. Superhydrophobic and superhydrophilic plant surfaces: an inspiration for biomimetic materials. Philosophical transactions. Series A, Mathematical, physical, and engineering sciences. 367, 1487-1509 (2009).
- Schulte, A. J., Koch, K., Spaeth, M., Barthlott, W. Biomimetic replicas: Transfer of complex architectures with different optical properties from plant surfaces onto technical materials. Acta Biomaterialia. 5, 1848-1854 (2009).
- Koch, K., Schulte, A., Fischer, A., Gorb, S., Barthlott, W. A fast, precise and low-cost replication technique for nano- and high-aspect-ratio structures of biological and artificial surfacese. Bioinspiration & Biomimetics. 3, 046002 (2008).
- Weyers, J. D. B., Johansen, L. G. Accurate Estimation of Stomatal Aperture From Silicone Rubber Impressions. New Phytology. 101, 109-115 (1985).
- Hilu, K. W., Randall, J. L. Convenient Method for Studying Grass Leaf Epidermis. Taxon. 33, 413-415 (1984).
- Sampson, J. A. Method of replicating Dry or Moist Surfaces for Examination by Light. Nature. 191, 932-933 (1961).
- Weyers, J. B. D., Travis, A. J. Selection and Preparation of Leaf Epidermis for Experiments on Stomatal Physiology. Journal of experimental botany. 32, 837-850 (1981).
- Groot, J. The Use of Silicone Rubber Plastic for Replicating Leaf Surfaces. Acta Botanica. Neerlandica. 18, 703-708 (1969).
- Wu, S., Zhao, B. Using Clear Nail Polish to Make Arabidopsis Epidermal Impressions for Measuring the Change of Stomatal Aperture Size in Immune Response. Plant Pattern Recognition Receptors. , 243-248 (2017).
- Wu, W., Guijt, R., Silina, Y., Koch, M., Manz, A. Plant leaves as templates for soft lithography. RSC Advances. 6, 22469-22475 (2016).
- Barthlott, W., Mail, M., Bhushan, B., Koch, K. Plant Surfaces: Structures and Functions for Biomimetic Innovations. Nano-Micro Letters. 9, 23 (2017).
- Zhang, B., et al. Fabrication of biomimetically patterned surfaces and their application to probing plant-bacteria interactions. ACS Applied Materials and Interfaces. 6, 12467-12478 (2014).
- Szyndler, M. W., Haynes, K. F., Potter, M. F., Corn, R. M., Loudon, C. Entrapment of bed bugs by leaf trichomes inspires microfabrication of biomimetic surfaces. Journal of the Royal Society Interface. 10, 20130174 (2013).
- Doan, H. K., Leveau, J. H. J. Artificial Surfaces in Phyllosphere Microbiology. Phytopathology. 105, 1036-1042 (2015).
- Chung, K. K., et al. Impact of engineered surface microtopography on biofilm formation of Staphylococcus aureus. Biointerphases. 2, 89-94 (2007).
- Sirinutsomboon, B., Delwiche, M. J., Young, G. M. Attachment of Escherichia coli on plant surface structures built by microfabrication. Biosystems Engineering. 108, 244-252 (2011).
- Bhattacharjee, A., Khan, M., Kleiman, M., Hochbaum, A. I. Effects of Growth Surface Topography on Bacterial Signaling in Coculture Biofilms. ACS Applied Materials and Interfaces. 9, 18531-18539 (2017).
- Mancuso, S. . Measuring roots: an updated approach. , (2011).
- Schneider, K., Wells, B., Dolan, L., Roberts, K. Structural and genetic analysis of epidermal cell differentiation in Arabidopsis primary roots. Development. 1798, 1789-1798 (1997).
- Dolan, L., et al. Clonal relationships and cell patterning in the root epidermis of Arabidopsis. Development. 2474, 2465-2474 (1994).
- Leitner, D., et al. A dynamic model of nutrient uptake by root hairs. New Phytology. 185, 792-802 (2010).
- Soffe, R., Bernach, M., Remus-emsermann, M. N. P., Nock, V. Replicating Arabidopsis Model Leaf Surfaces for Phyllosphere Microbiology. Scientific Reports. 9, 1-12 (2019).
- Sorieul, M., Dickson, A., Hill, S. J., Pearson, H. Plant fibre: Molecular structure and biomechanical properties, of a complex living material, influencing its deconstruction towards a biobased composite. Materials. 9, 618 (2016).
- Gibson, L. J. The hierarchical structure and mechanics of plant materials. Journal of the Royal Society Interface. 9, 2749-2766 (2012).
- Poletto, M., Pistor, V., Zattera, A. J. Structural characteristics and thermal properties of native cellulose. Cellulose-fundamental aspects. , 45-68 (2013).
- Moon, R. J., Martini, A., Nairn, J. A., Simonsen, J., Youngblood, J. Cellulose Nanomaterials Review: Structure, Properties. Chemical Society Reviews. 40, 3941-3994 (2011).
- Johnston, I., McCluskey, D., Tan, C., Tracey, M. Mechanical characterization of bulk Sylgard 184 for microfluidics and microengineering. Journal of Micromechanics and Microengineering. 24, 035017 (2014).
- Yan-yan, W., Ying-wu, L., Bao-fang, L., Bo-geng, L. Water-soluble UV curable urethane methyl acrylate coating: preparation and properties. Journal of Zhejiang University-SCIENCE A. 5, 906-911 (2004).
- Bao, L., Huang, Y. Synthesis and Properties of UV Curable Waterborne Polyurethane Acrylate Based on Modified Castor Oil. The pharmaceutical and chemical journal. 4, 34-40 (2017).
- Sharma, V., Orejon, D., Takata, Y., Krishnan, V., Harish, S. Gladiolus dalenii Based Bioinspired Structured Surface via Soft Lithography and Its Application in Water Vapor Condensation and Fog Harvesting. ACS Sustainable Chemistry & Engineering. 6, 6981-6993 (2018).
- Soffe, R., Altenhuber, N., Bernach, M., Remus-Emsermann, M. N. P., Nock, V. Comparison of replica leaf surface materials for phyllosphere microbiology. PloS one. 14, 1-19 (2019).
- Whitehead, D. C., Buchan, H., Hartlay, R. D. Composition and decomposition of roots of ryegrass and red clover. Soil Biology and Biochemistry. 11, 619-628 (1979).
- Ververis, C., Georghiou, K., Christodoulakis, N., Santas, P., Santas, R. Fiber dimensions, lignin and cellulose content of various plant material and their suitability for paper production. Industrial crops and products. 19, 245-254 (2004).
- Croser, C., Bengough, A. G., Pritchard, J. The effect of mechanical impedance on root growth in pea (Pisum sativum). II. Cell expansion and wall rheology during recovery. Physiologia Plantarum. 109, 150-159 (2000).
- Lipiec, J., Horn, R., Pietrusiewicz, J., Siczek, A. Effects of soil compaction on root elongation and anatomy of different cereal plant species. Soil and Tillage Research. 121, 74-81 (2012).
- Potocka, I., Szymanowska-Pulka, J. Morphological responses of plant roots to mechanical stress. Annals of botany. 122, 711-723 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved