Method Article
Yumuşak Litografi Değişimi Ile Kök Yüzey Mikroyapısının Biyomimetik Replikasyonu
Bu Makalede
Özet
Biyomimetikler daha önce yaprak-mikroorganizma etkileşimlerini incelemek için bir araç olarak kullanılmıştır. Ancak, kökler için böyle bir araç yoktur. Burada, kök-çevre etkileşimlerinin incelenmesi için kök yüzeymikroyapısını taklit eden sentetik yüzeyler oluşturmak için bir protokol geliştiriyoruz.
Özet
Biyomimetik, kimya ve malzeme bilimlerinin biyolojik sistemleri, özellikle de biyolojik yapıları taklit etmek için daha iyi insanoğlu için kullanılmasıdır. Son zamanlarda yaprak yüzeyinin mikro yapısını taklit eden biyomimetik yüzeyler, yaprak mikroyapısının yaprak-çevre etkileşimleri üzerindeki etkilerini incelemek için kullanılmıştır. Ancak, kökler için böyle bir araç yoktur. Kök yüzeymikroyapısının sentetik taklitini yapay bir yüzeye dönüştüren bir araç geliştirdik. Biz iki aşamalı bir süreç kullanarak, yaprak yüzeymikroyapı replikasyonu için bilinen yumuşak litografi yöntemi, dayanıyordu. Biyolojik doku içeren ilk adım daha zorlu bir. Burada, farklı bir polimer ve kür stratejisi, güçlü, sert, poliüretan, kök kalıplama için UV tarafından tedavi güvenerek kullanılır. Bu bize kök kılları gibi hassas, zorlu özellikleri de dahil olmak üzere kök yüzeymikroyapısı güvenilir bir negatif görüntü elde etmek için izin verdi. Daha sonra bu negatif görüntüyü, hem köklü polidimethyl siloksan (PDMS) hem de kökün daha yakın bir mimiksini temsil eden ve mikroorganizmalar tarafından salgılanan selüloz enzimleri tarafından bozulabilen selüloz türevi, etil selüloz kullanarak kök yüzeymikroyapı replikasyonunu elde etmek için şablon olarak kullandık. Bu yeni oluşan platform, daha önce yapraklarda gösterilene benzer bir şekilde kök-mikroorganizma etkileşimlerinde yüzeyin mikroyapısal etkilerini incelemek için kullanılabilir. Ayrıca, sistem bize mikroorganizmanın konumlarını izlemek için izin sağlar, yüzey özelliklerine göre, ve gelecekte aktivitesi, selülaz salgısı şeklinde.
Giriş
Yaprak yüzeymikroyapısının replikasyonu biyomimetik araştırma alanında bilinen bir yöntemdir1,2,3,4. Yaprak yüzeyi mikroyapısının ilk replikasyonları, özellikle stomata5,6,7,8,9,10olmak üzere, yaprak yüzeyine uygulanan oje ve kauçuk malzemeler kullanılarak gerçekleştirilmiştir. Yöntem daha sonra geliştirilmiş ve gelişmiş polimerler yumuşak litografi kullanarak yaprak yüzeymikroyapı taklit etmek için kullanılmıştır, süper hidrofobik yüzeylerin biyometikbağlamında özellikle2,3,4,11,12. Son yıllarda, bu yöntem, doğal yaprak fillosfer15bir parçası olarak, patojenik13,14 veya yararlı olup olmadığını yüzeyde yaşayan yaprak yüzeyi ve mikroorganizmalar arasındaki etkileşimin çalışmada yararlı bir araç olarak kanıtlanmıştır. Tamamen sentetik sistemler yüzey olarak kullanıldığında bile doğal sistemin basitleştirilmesi yüzey-mikroorganizma etkileşimleri çalışmalarında son derece yararlı olduğu kanıtlanmıştır15,16,17,18.
Yaprak yüzeyi mikroyapısının replikasyonunun farklı mikroorganizmalarla yaprağın yüzeyinde oluşan etkileşimi incelemek için yararlı bir araç olduğu gösterilmiş olsa da, bitki kökleri için böyle bir alet bulunmamaktadır. Bitki kökleri toprağın altında ikamet ettikleri ve tüm etkileşimleri toprak içinde meydana geldiğinden çalışmak daha zordur. Yapraklara benzer şekilde kök yüzeymikroyapısının kök-mikroorganizma etkileşimlerinde rol oynaması muhtemeldir. Ancak, şu anda karmaşık kök-mikroorganizma etkileşimlerinde kök yüzey mikroyapısının özel rolünü izole etmek için bir yöntem bulunmamaktadır. En çok çalışılan kök yüzey mikroyapısal özelliği kök kılları19,20,21. Kök kıllar yüzey alanının artırılmasında önemli bir role sahiptir ve besin ve su22daha verimli alımı sağlayan tarafından, ancak kök-mikroorganizma etkileşimleri yapısal bir özellik olarak katılımı test edilmemiştir.
Yapraklarda yumuşak litografi için en yaygın olarak kullanılan polimer polidimethyl silokaksane 'dir (PDMS). PDMS özellikleri yaprak mırık15,23olanlar benzer. Ancak, bitki kökleri, en bol malzeme selüloz24,25 pdms26,27,,28daha farklı özelliklere sahiptir. Kök-çevre etkileşimlerinde yüzey mikroyapı etkilerini incelemek için sentetik bir platform oluşturmak için PDMS'nin kullanılması idealden daha azdır.
Burada sunulan protokol, çeşitli malzemelerden sentetik kök yüzey mikroyapı replikasının oluşmasını sağlar. Yaprak yüzeyi mikroyapı replikasyonu yöntemi gibi bu da iki aşamalı bir süreçtir. İlk adım bir poliüretan kalıp (negatif bir çoğaltma) içine kalıp için bir kaynak olarak biyolojik doku (kök) kullanır. Kök yüzeymikroyapısının negatif görüntüsünü temsil eden poliüretan kalıp, daha sonra PDMS ve selüloz türevleri de dahil olmak üzere çeşitli malzemelerden kök yüzey mikroyapısının pozitif replikasyon oluşturmak için bir üs olarak kullanılabilir. Bu kök yüzey çoğaltma daha sonra kök-mikroorganizma etkileşimlerinde yüzey yapısı rolünü anlamak için bir platform olarak kullanılabilir.
Protokol
1. Bitkilerin yetiştirimi ve kök hazırlığı
- Seçenek 1: Kökten adventif kökler hazırlayın.
- Büyüyen bitkiler için bir kökleme tepsisi alın.
- Tepsiyi toprakla doldurun.
- Tepsideki her hücreye bir tohum M82 domates çeşitleri ekleyin.
- Tohumları biraz toprakla kaplayın.
- Su tepsinin alt doldurur ve toprak su emer gibi bir damlalık ile alttan tepsisu.
- Tepsinin altına haftada bir kez 1 L su başına 2 mL gübre ekleyin.
- 25 °C'de büyüyen bir odada yetişin.
- 15 saat karanlıkta dönüşümlü 9 saat ışık (7:00-16:00) aydınlatma koşullarını kullanın.
- 3 hafta sonra bitkiyi topraktan çıkarın.
- Kök ile etkileşim noktasında bitkiden kök sistemi kesin.
- Köksüz bitkiyi su yla dolu bir kabın içine koyun.
- Birkaç gün sonra, kök ortaya adventif kökleri kesmek ve çoğaltma için kullanabilirsiniz.
- Seçenek 2: Tohum çimlenme kökleri hazırlayın.
- Su ile Petri çanak büyüklüğünde filtre kağıdı ıslayın.
- Bir Petri kabının içine birkaç M82 tohumu (en fazla 10) koyun.
- Plakayı 25 °C'de kuluçkaya yatırın.
- Gazeteyi her gün nemlendir.
- Çimlenmiş kökler yeterince uzun olduktan sonra (yaklaşık 5 gün), tohumları çıkarın ve çoğaltma için kökleri kullanın.
2. Poliüretan kök negatif çoğaltma hazırlanması
- Negatif çoğaltma çözeltisi oluşturmak için, 20 mL'lik bir şişeye 9,49 g diüretan dimetakrilat ekleyin.
- Şişeye 1,45 mL etil metakrilat ekleyin.
- Çözelti net görünene ve homojen hale gelene kadar oda sıcaklığında (RT) karıştırın.
NOT: Homojen bir çözeltiye ulaşmak için yaklaşık 2 saat yeterlidir. - Plastikleştirici, dietil ftalat 3 mL ekleyin ve RT 1 saat karıştırın.
NOT: Dietil ftalat akrilat monomer yanlış. - Fotoğraf başlatıcısı, 2-hidroksi-2-methylpropiophenone 300 μL ekleyin ve RT gecede karıştırın. Tüm kabarcıklar kaldırılana kadar karıştırmaya devam edin.
NOT: Protokol burada duraklatılabilir. Çözelti RT'de tutulabilir.
- Kökün negatif kopyasını oluşturmak için, temiz bir cam slayt alın ve üzerine negatif çoğaltma çözeltisinin 1 mL dökün.
- Çözeltinin üzerine 2\u20123 köklerini yerleştirin. Köklerin çözelti yle tamamen kaplanmasına izin vermeyin.
- 8\u201210 dk için 8 W ultraviyole (UV) lamba altında slayt tutun. Çözeltiyi UV ışığı altında çok uzun süre tutmayın.
NOT: Poliüretan çok sert hale getirir, kök kaldırmak imkansız hale çok uzun süre UV ışığı altında çözelti tutmak için önemlidir. - UV lambasını kapatın, cam kaydıraktan kopyayı çıkarın ve tepkisiz monomer'i çıkarmak için etanol dolu bir Petri kabına koyun.
- Negatif yinelemeyi elde etmek için, root'u çok yavaş bir şekilde forceps kullanarak çoğaltmadan çıkarın.
3. PDMS kök pozitif çoğaltma hazırlayın.
- Pozitif çoğaltma için karışımı oluşturmak için, bir kağıt fincan dimetil silokaksane 10 g yerleştirin.
- Kür ajan 1 g ekleyin ve iyice karıştırın.
- Hava kabarcıkları kaldırmak için 2 saat vakum altında bir kurutucu karışımı tutun.
- Pozitif çoğaltma oluşturmak için, bir Petri kabında poliüretan negatif çoğaltma yerleştirin.
- PDMS karışımını negatif çoğaltmanın üzerine dökün.
- Mikroyapının kapsama alanını sağlamak için 2 saat vakum uygulayın.
- Petri kabını bir gece RT'de saklayın.
- Tedavi edilen pozitif yinelemeyi negatif yinelemeden elle ayırın.
4. Etil selüloz kök pozitif çoğaltma hazırlayın.
- Etil selüloz çözeltisi oluşturmak için, 100 ml fincan bir plastikleştirici olarak diethyl pthalate 1.32 ml koyun.
- 20 mL etanol ekleyin ve 2 saat boyunca RT'de karıştırın.
- Etil selüloz 3.3 g ekleyin ve bir gecede karıştırın.
- Pozitif çoğaltma oluşturmak için, bir Petri kabında poliüretan negatif çoğaltma yerleştirin.
- Negatif çoğaltma üstüne etil selüloz çözeltisi dökün.
- Petri kabını bir gece boyunca RT'de kaputun altında tutun.
- Pozitif yinelemeyi negatif çoğaltmadan çok yavaş bir şekilde forceps ile çıkarın.
Sonuçlar
Kök yüzeymikroyapı replikasyon oluşturmak için, bir kök kalıplama için seçilmelidir. Biz toprakta domates bitkileri büyümek, kök sisteminden doğal kök kullanımı son derece zor hale. Kök sisteminden toprağın çıkarılması zor olabilir ve ayrıca kök sistem kökleri kırılgandır ve kalıplama girişimleri üzerine kırılabilir. Bu nedenle, ilk olarak laboratuvarda protokolü oluşturmak için daha sert kökler kullanmanızı öneririz. Bu tür köklerin oluşumu Şekil 1A'daaçıklanmıştır. Bitki kök sistemi 3 hafta boyunca yetiştirilen sonra kaldırılır ve köksüz bitki adventif kökleri kök ortaya çıkana kadar yaklaşık bir hafta boyunca suya yerleştirilir. Bu kökler protokol kuruluşu sırasında çoğaltma için kullanılabilir. Protokol iyi kurulduktan sonra daha gerçekçi bir kök yüzey yapısı istenir. Burada toprakta yetişen köklerden kaçınmanızı son derece zorlu bir ortamda toprağın tamamen uzaklaştırılması olarak öneriyoruz. Bunun yerine genetik olarak özel bir bitkinin kök yüzeymikroyapısı hakkında değerli bilgiler sağlayarak, çimlenme kökleri nin kullanılmasını öneriyoruz. Bu tür köklerin büyümesi Şekil 1B'deaçıklanmıştır. Tohumlar ıslak filtre kağıdına konur ve 25 °C'de kuluçkaya yatırılır. Yaklaşık 5 gün sonra, filtre kağıdı nemli tutulur sırasında, çimlenmiş kökleri çoğaltma için yeterince uzun. Bu kökler daha önce önerilen köklere göre daha kırılgan dır ve daha hassas bakım gerektirir.
Kök yüzeymikroyapı çoğaltma üretimi iki aşamalı bir süreçtir. İlk adımda doğal kök poliüretan bazlı kalıp (negatif çoğaltma) kalıp ediliyor. Bu adımın avantajı poliüretan kalıp için tüm malzemeler hazırlanıyor ve kök UV 10 dakika maruz kalma için en sonunda hazırlanan çözeltinin üstüne yerleştirilir. Sonuç olarak, biyolojik doku çok uzun süre sert koşullara maruz değildir ve yavaşça sürecin sonunda ele alınabilir. Tüm protokol adımları izlenirse, iyi bir negatif yineleme oluşturulur. Bu çoğaltma kök yüzeyinin hücre yapısının yanı sıra kök kıllarının yerini gösteren delikleri gösterecektir(Şekil 2A). Protokoldeki bazı kritik adımlar izlenmezse, yordam başarısız olur. Böyle bir adım kür önce poliüretan çözeltisi üzerinde kök yerleştirilmesidir. Kök poliüretan çözeltisi içinde batırılmasını önlemek için çok nazikçe yerleştirilmelidir. Kökün herhangi bir parçasının bu şekilde batırılması, kökün sert polimerde, kökün onu çıkarma yeteneği olmadan tuzağa düşürülmesine neden olur. Böyle bir olay oluşursa, kök iyileştikten sonra negatif çoğaltma içinde kalır (Şekil 2B). Bir diğer önemli adım uv ışık ile kür süresi ile ilgili. Önerilen kür süresi 8\u201210 dk. 10 dk'yı geçmek son derece sert poliüretan kalıbı ile sonuçlanır ve bu da kökü poliüretan kalıbın içinde kırmadan çıkarmayı imkansız hale getirir. Kökün kırılması bazen çıplak gözle görülebilir, örneğin, büyük bir parça kırıldığında(Şekil 2C, üst, mor oklarla işaretlenmiş). Ancak, bazen küçük kök parçaları çıplak gözle fark edilmesi zor malzeme içinde bırakılır ve bir mikroskop kullanılması gerekir(Şekil 2C, alt, mor oklar ile işaretlenmiş). Protokolün devamı öncesinde poliüretan negatif kopyanın mikroskopla dikkatle incelenmesini ve artık kökün bulunmadığından emin olmamızı öneririz.
Poliüretan negatif çoğaltma hazırlandıktan sonra; birçok malzeme pozitif çoğaltma hazırlanması için kullanılabilir. Pozitif çoğaltma hazırlanması, bir kalıp olarak poliüretan negatif çoğaltma kullanarak, düz ileri ve poliüretan negatif çoğaltma kalitesine tamamen bağlıdır. Olumlu çoğaltma oluşturmak için her iki PDMS kullandık-iyi yumuşak litografi alanında bilindiği gibi(Şekil 3A)—ve etil selüloz daha iyi çoğunlukla selüloz oluşan kök yüzeyinin özelliklerini taklit eden bir malzeme olarak (Şekil 3B). PDMS çoğaltma SEM görüntü çok net kök kılları gösterir. Tüyler uzama bölgesinde, ortaya çıkmaya başlarlar. Bu nedenle, kök kıllarının uzunluğu kök yüzeyi boyunca değişir, onlar daha uzun hale geldikçe, çok doğal kök gibi(Şekil 3A). Etil selüloz, PDMS'den daha sert ve daha az esnek bir film üretir. Bu nedenle, negatif kalıp tan kaldırılması daha fazla bakım gerektirir. Ancak, bazı kıllar ve yüzey mikroyapısı ışık mikroskobu altında görülebilir (Şekil 3B). Biz pozitif çoğaltma oluşturmak için bu iki malzeme kullanılır, ancak, bir film oluşturabilirsiniz herhangi bir malzeme pozitif çoğaltma için iyi bir aday olacak, poliüretan negatif çoğaltma kullanarak.

Şekil 1: Replikasyon için domates bitki kökleri. (A) Bir domates (M82) bitki 25 °C'de 9 saat ışık ve 15 saat karanlık ile yetiştirilir. 3 hafta sonra bitki topraktan çıkarılır ve kök sistemi kesilir. Köksüz bitki yaklaşık bir hafta sonra kökten adventif kökler çıkana kadar suya konur. Bu kökler kök sisteminden kökler olarak tam yapısını göstermez, ancak iyi bir modeli temsil eder. Bu kökler kök sistem köklerine göre daha az kırılgandır ve bu nedenle laboratuvarda tekniği oluştururken çalışmak tercih edilir. (B) Domates (M82) tohumları Petri kabında ıslak filtre kağıdına konur ve 25 °C'de kuluçkaya yatırılır. Kağıt her gün sulu ve tohumlar çimleniyor. Kökleri büyüyor ve yaklaşık 5 gün sonra çoğaltma için kullanılmak üzere yeterince uzun. Bu kökler daha naziktir ve yöntem iyi kurulduktan sonra kullanılmalıdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Poliüretan negatif replikanın mikroskopi görüntüleri. (A) TÜM adımları takip eden bir protokole göre yapılan poliüretan negatif çoğaltma SEM görüntü. Hücre yapısı açıkça görülebilir. Sarı oklar kökteki kılların oluşturduğu delikleri işaret eder. (B) Tamamen çözelti ile kaplı olduğu gibi içinde bir kök ile poliüretan negatif çoğaltma ışık mikroskobu görüntüleri ve kaldırılması mümkün değildi. Poliüretan negatif içinde kök ile tedavi edildi. Kök göz ve ışık mikroskobu kullanılarak görülebilir. Bu kökü kürlenmiş çoğaltmadan kaldırmak mümkün değildir. (C) UV ışığı altında çok uzun süre tutulan poliüretan negatif kopyanın ışık mikroskobu görüntüleri. Sonuç olarak, kök, gözle görülebilen büyük parçacıklar (üstteki görüntü, mor oklarla işaretlenmiş) veya yalnızca mikroskopla görünen küçük kesirler (mor oklarla işaretlenmiş alt görüntü) ile polimerden tam olarak çıkarılamaz. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
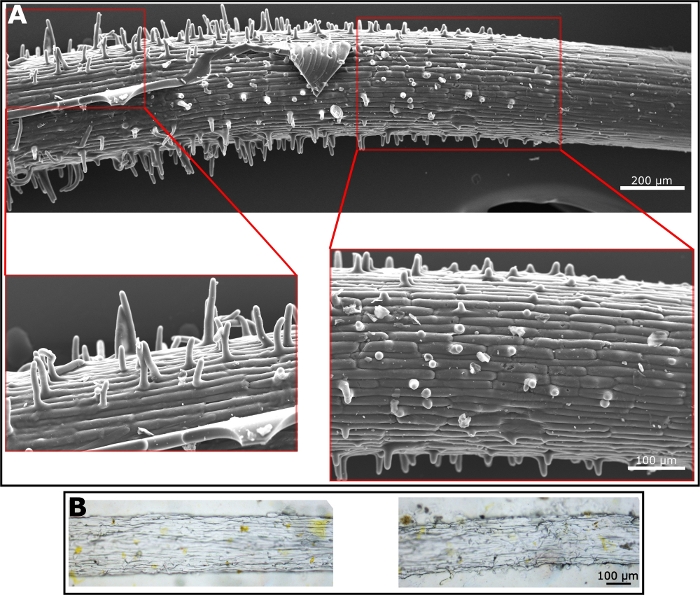
Şekil 3: Pozitif çoğaltmanın mikroskop görüntüleri. (A) PDMS'den yapılan pozitif bir kopyanın SEM mikrografı. Genişleme kök kılları gösterir. (B) Etil selülozdan yapılan pozitif bir kopyanın ışık mikroskobu görüntüleri. Yüzey dokusu soldaki resimde görünürken sağdaki görüntülerde kıllar gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Kök yüzey mikroyapısının replikasyonu için yeni bir yöntem salıyoruz. Bu yöntem, yaprak yüzeyi mikroyapı replikasyonu4mevcut yöntemlere dayanır. Bu yöntemi geliştirmek için, biz yaprakları için mevcut yöntem çimdik vardı. Yaprak çoğaltma yönteminin köklere kopyalanmasındaki sorunlu adımın kök kalıplamanın ilk adımını içerdiğini fark ettik. Bu biyolojik doku içeren yöntemin en hassas parçasıdır. Sonuç olarak, tedavi için nispeten yumuşak koşullar talep edecek ve bu nedenle biyolojik doku ya da en az hasara neden olacak bir polimer seçmek istedim. Uv ışığı altında hızlı bir şekilde (10 dakika içinde) polimerize edilebilir çünkü poliüretan seçti29. Ayrıca, bir kez polimerize30 çok zor ve biz bu özelliği poliüretan kalıp kökü nispeten kolay kaldırılması için izin vereceğini umuyordu.
Sunulan yöntem, negatif görüntünün (negatif yineleme) ilk adımda oluşturulduğu ve çoğaltmanın negatif yinelemeye dayalı olarak ikinci adımda oluşturulduğu iki aşamalı bir yaklaşımdır. Bu, çalışabileceğimiz malzeme yelpazesini genişletir. Yaprak yüzeyi mikroyapı replikasyonu esas olarak PDMS veya epoksi malzemeler11,31yapıldı. Bazı çalışmalar diğer malzemeler, özellikle mikroorganizma büyümesini destekleyen malzemeler ile yapıldı13,32. Bunun nedeni, son yıllarda bu yöntemin yaprak yüzey yapısı bağlamında mikroorganizma-yüzey etkileşimlerini incelemek için kullanılmasıdır. Ancak bu yöntemde yapraklar bağlamında selüloz benzeri malzemeler kullanılmamıştır. Biz bir kalıp ve pozitif çoğaltma için malzemelerin çeşitli olarak poliüretan negatif çoğaltma kullanılmasını öneririz. Başka bir deyişle, olumlu çoğaltma yapma, malzemelerin çeşitli, iyi bir negatif çoğaltma yapıldığında nispeten kolaydır. Şu anda selüloz türevleri kullanmak, ancak selüloz türevleri ile birlikte pektin ve lignin33,,34 gibi kök yüzeyine daha alakalı malzemeler kullanma olanaklarını araştırıyoruz.
Bu yöntem aynı zamanda yaprak yüzeyi mikroyapı replikasyonunun mevcut yöntemine de göre genişler, çünkü yaprak 2B yüzey, kök yüzeyi ise 3Boyutlu bir yüzeydir. Yöntemimiz, tüm kökü poliüretan çözeltisine gömmek serbest bırakılmasına izin vermediğinden, tüm yüzeyin çoğaltılmasını sağlamaz. Bu nedenle, kök yüzeymikroyapısını kopyalarken kökün bir tarafı seçilmelidir. Üretilen sentetik yüzey kavisli ve kabaca yarım yüzeyi temsil eder, ancak hepsi değil. Varsayımımız, kök yüzeyinin yapısal özelliklerinin çoğunlukla kök uzunluğu boyunca eksen hakkında simetrik olduğudur. Ancak, bu tür simetri nin varsayılmayan çalışmalarda, çoğaltmak için uygun yan kökü seçmek için dikkatli olmak gerekir.
Köklerin kalıp olarak kullanılması için iki seçenek salıyoruz. Birincisi kökten yetişen adventif kökler seçeneği, ikincisi ise kağıt üzerinde çimlenmiş köklerin seçeneğidir. Bu kökleri daha sağlam ve çalışmak daha kolay olduğu gibi ilk seçenek çoğunlukla yöntemi pratik araştırmacılara yardımcı olmak içindir. İkinci seçenek, çevre koşullarına bakılmaksızın, farklı çeşitlerin kökleri arasında bulunabilen genetik farklılıkları temsil eder. Bu yüzeyler önemli araştırma araçları olarak kullanılabilir, ancak, bir çevre kök yüzey yapısı üzerinde güçlü bir etkiye sahip olabilir farkında olmalıdır, özellikle kökleri yetiştirilen toprak35,36. Toprağın neden olduğu mekanik stres nedeniyle, kök toprağa nüfuz ettikçe yüzeyde biriken yaralara ek olarak bazı morfolojik değişiklikler meydana gelecektir37. Köklerin topraktan uzaklaştırılması ve temizlenmesi, yapılarına zarar vermeden çok zor bir iştir. Bu nedenle, toprakta yetişen köklerin kök yüzeymikroyapısını güvenilir bir şekilde taklit etmek için bu yöntemi kullanabilme konusunda iyimser değiliz. Ancak, mikroyapıdaki değişimin belirgin bir şekilde açık olduğu genetik farklılıklar a¤rınla¤ çevresel farklar a¤¤rınla odaklanan araştırmalarda, bu yöntem kök yüzey mikroyapisinin etkisini incelemek için bir araç olarak kullan¤edilebilir.
Yöntemimiz, kök yüzeyinin sadece mikroyapısal özelliklerini taklit eden inert bir yüzey üretir. Bu yöntem kök-çevre etkileşimlerinde yapısal etkileri diğer tüm etkilerden ayırmak için tasarlanmış olsa da, bu etkileşimlerde kimyasal bileşikler göz ardı edemez. Bazı mikroorganizmalar, özellikle besin maddeleri eklenmeden yüzeyde yaşayamayabilir veya işlev göremeyebilir. Bu platformun geliştirilmesinde bir sonraki adım, yapı ile birleştirildiğinde farklı etkileşimler üzerindeki etkilerini incelemek için kimyasal bileşiklerin kontrollü eklenmesi olacaktır.
Bu yöntem kök-mikroorganizma etkileşimlerini incelemek için sentetik bir platformun geliştirilmesinde ilk adım olarak geliştirilmiştir. Burada kök yüzeyinin mikroyapısını taklit ediyoruz ve bu ilk platform yüzey mikroyapısının mikroorganizma davranışı üzerindeki etkisini incelemek için kullanılabilir. Ancak, doğal sistemden birçok diğer unsurları yoksun olduğu için bu platform sınırlıdır. Bu platform, yüzeyi oluşturmak için doğru malzemelerin kullanılması ve sisteme diğer, kritik kimyasalların eklenmesiyle geliştirilmelidir. Daha gelişmiş bir platformda, kimyasalların mekansal dağılımını da hayal edebiliriz. Ancak, şu anda kök-mikroorganizma etkileşimlerinde yapısal etkileri izole etmek için başka bir yöntem bulunmadığından, araştırmacıların bu etkileşimlerde yapıya özgü sorular sormak için bu ilk platformu kullanabileceklerini umuyoruz.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Araştırma, Tarımsal Araştırma Örgütü'nden MK'ye tohum fonları ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2-hydroxy-2-methylpropiophenone | Sigma | 405655 | |
| Diethyl phthalate | Across | 114520010 | |
| Diurethane dimetharylate | Sigma | 436909 | |
| Ethyl cellulose | Across | 232705000 | |
| Ethyl methacrylate | Sigma | 234893 | |
| Shaphir Solution | GAT fertilizer | 6-2-4 | |
| Sylgard 184 kit | Polymer-G | 510018400500 |
Referanslar
- Bhushan, B., Jung, Y. C., Niemietz, A., Koch, K. Lotus-Like Biomimetic Hierarchical Structures Developed by the Self-Assembly of Tubular Plant Waxes. Langmuir. 25, 1659-1666 (2009).
- Koch, K., Barthlott, W. Superhydrophobic and superhydrophilic plant surfaces: an inspiration for biomimetic materials. Philosophical transactions. Series A, Mathematical, physical, and engineering sciences. 367, 1487-1509 (2009).
- Schulte, A. J., Koch, K., Spaeth, M., Barthlott, W. Biomimetic replicas: Transfer of complex architectures with different optical properties from plant surfaces onto technical materials. Acta Biomaterialia. 5, 1848-1854 (2009).
- Koch, K., Schulte, A., Fischer, A., Gorb, S., Barthlott, W. A fast, precise and low-cost replication technique for nano- and high-aspect-ratio structures of biological and artificial surfacese. Bioinspiration & Biomimetics. 3, 046002 (2008).
- Weyers, J. D. B., Johansen, L. G. Accurate Estimation of Stomatal Aperture From Silicone Rubber Impressions. New Phytology. 101, 109-115 (1985).
- Hilu, K. W., Randall, J. L. Convenient Method for Studying Grass Leaf Epidermis. Taxon. 33, 413-415 (1984).
- Sampson, J. A. Method of replicating Dry or Moist Surfaces for Examination by Light. Nature. 191, 932-933 (1961).
- Weyers, J. B. D., Travis, A. J. Selection and Preparation of Leaf Epidermis for Experiments on Stomatal Physiology. Journal of experimental botany. 32, 837-850 (1981).
- Groot, J. The Use of Silicone Rubber Plastic for Replicating Leaf Surfaces. Acta Botanica. Neerlandica. 18, 703-708 (1969).
- Wu, S., Zhao, B. Using Clear Nail Polish to Make Arabidopsis Epidermal Impressions for Measuring the Change of Stomatal Aperture Size in Immune Response. Plant Pattern Recognition Receptors. , 243-248 (2017).
- Wu, W., Guijt, R., Silina, Y., Koch, M., Manz, A. Plant leaves as templates for soft lithography. RSC Advances. 6, 22469-22475 (2016).
- Barthlott, W., Mail, M., Bhushan, B., Koch, K. Plant Surfaces: Structures and Functions for Biomimetic Innovations. Nano-Micro Letters. 9, 23 (2017).
- Zhang, B., et al. Fabrication of biomimetically patterned surfaces and their application to probing plant-bacteria interactions. ACS Applied Materials and Interfaces. 6, 12467-12478 (2014).
- Szyndler, M. W., Haynes, K. F., Potter, M. F., Corn, R. M., Loudon, C. Entrapment of bed bugs by leaf trichomes inspires microfabrication of biomimetic surfaces. Journal of the Royal Society Interface. 10, 20130174 (2013).
- Doan, H. K., Leveau, J. H. J. Artificial Surfaces in Phyllosphere Microbiology. Phytopathology. 105, 1036-1042 (2015).
- Chung, K. K., et al. Impact of engineered surface microtopography on biofilm formation of Staphylococcus aureus. Biointerphases. 2, 89-94 (2007).
- Sirinutsomboon, B., Delwiche, M. J., Young, G. M. Attachment of Escherichia coli on plant surface structures built by microfabrication. Biosystems Engineering. 108, 244-252 (2011).
- Bhattacharjee, A., Khan, M., Kleiman, M., Hochbaum, A. I. Effects of Growth Surface Topography on Bacterial Signaling in Coculture Biofilms. ACS Applied Materials and Interfaces. 9, 18531-18539 (2017).
- Mancuso, S. . Measuring roots: an updated approach. , (2011).
- Schneider, K., Wells, B., Dolan, L., Roberts, K. Structural and genetic analysis of epidermal cell differentiation in Arabidopsis primary roots. Development. 1798, 1789-1798 (1997).
- Dolan, L., et al. Clonal relationships and cell patterning in the root epidermis of Arabidopsis. Development. 2474, 2465-2474 (1994).
- Leitner, D., et al. A dynamic model of nutrient uptake by root hairs. New Phytology. 185, 792-802 (2010).
- Soffe, R., Bernach, M., Remus-emsermann, M. N. P., Nock, V. Replicating Arabidopsis Model Leaf Surfaces for Phyllosphere Microbiology. Scientific Reports. 9, 1-12 (2019).
- Sorieul, M., Dickson, A., Hill, S. J., Pearson, H. Plant fibre: Molecular structure and biomechanical properties, of a complex living material, influencing its deconstruction towards a biobased composite. Materials. 9, 618 (2016).
- Gibson, L. J. The hierarchical structure and mechanics of plant materials. Journal of the Royal Society Interface. 9, 2749-2766 (2012).
- Poletto, M., Pistor, V., Zattera, A. J. Structural characteristics and thermal properties of native cellulose. Cellulose-fundamental aspects. , 45-68 (2013).
- Moon, R. J., Martini, A., Nairn, J. A., Simonsen, J., Youngblood, J. Cellulose Nanomaterials Review: Structure, Properties. Chemical Society Reviews. 40, 3941-3994 (2011).
- Johnston, I., McCluskey, D., Tan, C., Tracey, M. Mechanical characterization of bulk Sylgard 184 for microfluidics and microengineering. Journal of Micromechanics and Microengineering. 24, 035017 (2014).
- Yan-yan, W., Ying-wu, L., Bao-fang, L., Bo-geng, L. Water-soluble UV curable urethane methyl acrylate coating: preparation and properties. Journal of Zhejiang University-SCIENCE A. 5, 906-911 (2004).
- Bao, L., Huang, Y. Synthesis and Properties of UV Curable Waterborne Polyurethane Acrylate Based on Modified Castor Oil. The pharmaceutical and chemical journal. 4, 34-40 (2017).
- Sharma, V., Orejon, D., Takata, Y., Krishnan, V., Harish, S. Gladiolus dalenii Based Bioinspired Structured Surface via Soft Lithography and Its Application in Water Vapor Condensation and Fog Harvesting. ACS Sustainable Chemistry & Engineering. 6, 6981-6993 (2018).
- Soffe, R., Altenhuber, N., Bernach, M., Remus-Emsermann, M. N. P., Nock, V. Comparison of replica leaf surface materials for phyllosphere microbiology. PloS one. 14, 1-19 (2019).
- Whitehead, D. C., Buchan, H., Hartlay, R. D. Composition and decomposition of roots of ryegrass and red clover. Soil Biology and Biochemistry. 11, 619-628 (1979).
- Ververis, C., Georghiou, K., Christodoulakis, N., Santas, P., Santas, R. Fiber dimensions, lignin and cellulose content of various plant material and their suitability for paper production. Industrial crops and products. 19, 245-254 (2004).
- Croser, C., Bengough, A. G., Pritchard, J. The effect of mechanical impedance on root growth in pea (Pisum sativum). II. Cell expansion and wall rheology during recovery. Physiologia Plantarum. 109, 150-159 (2000).
- Lipiec, J., Horn, R., Pietrusiewicz, J., Siczek, A. Effects of soil compaction on root elongation and anatomy of different cereal plant species. Soil and Tillage Research. 121, 74-81 (2012).
- Potocka, I., Szymanowska-Pulka, J. Morphological responses of plant roots to mechanical stress. Annals of botany. 122, 711-723 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır