Method Article
レタス品種におけるビタミンCの定量化のためのUPLC-UV法(ラクチサティバ L.)と野生の親戚の作物(Lactuca spp.)
* これらの著者は同等に貢献しました
要約
UPLC-UVを使用して、他の植物に転移可能な ラクトゥカ spp.でビタミンCを定量化するための迅速かつ信頼性の高い方法を提示します。重要なステップは、安定した条件下でのサンプル調製およびビタミンC抽出、アスコルビン酸へのデヒドロアスコルビン酸の減少、およびクロマトグラフィー手順の最適化です。
要約
ビタミン、特にビタミンCは、果物や野菜に含まれる重要な微量栄養素です。ビタミンCは抗酸化力の主要な要因でもあります。レタスは、世界中の消費者の間で最も人気のある野菜の一つです。レタスおよび他の関連種のビタミンCの含有量を測定するための正確なプロトコルは非常に重要です。ここでは、サンプル調製、ビタミン抽出、クロマトグラフィー条件を最適化した超高性能液体クロマトグラフィー-紫外線(UPLC-UV)法を用いた方法について説明します。
サンプルを回収して植物全体を表し、-80°Cで凍結し、凍結乾燥して望ましくない酸化を防止し、操作を容易にした。ビタミンCの抽出は酸性培地で行い、その安定性にも寄与した。ビタミンCはアスコルビン酸(AA)とデヒドロアスコルビン酸(DHAA)の2つの異なる変換可能な形態で存在することができるので、両方の化合物を正確に定量するために測定する必要があります。AAはスペクトルのUV範囲においてDHAAよりも高い吸収性を示すため、DHAAはAAへの還元後間接的に定量化された。同じ抽出物から、2つの測定を行い、その還元反応の前と後の1つを行った。最初のケースでは、AA含有量を定量化し、2番目のケースでは、AAとDHAA(TAA:総アスコルビン酸)の和をAAの形で定量しました。そして、DhAA量は、TAAから最初の測定から求められるAAを差し引いて間接的に得られた。それらは、商業AA標準を用いてキャリブレーション曲線を構築し、クロマトグラフィー手順を最適化し、短時間で完全に解決されたAAピークを得るために、UPLC-UVによって決定された。このプロトコルは、わずかまたは全く変更なしで他の植物材料に容易に外挿することができる。その精度は、そうでなければ知覚されない統計的に有意な違いを明らかにした。その他の強みや限界については、原稿の中で詳しく議論されています。
概要
栽培レタス(Lactuca sativa L.)は、2018年に約2730万トンの総生産量で、世界で最も生産され、消費された葉野菜の一つです 1.レタスは消費者によって健康であると認識されています。栄養特性は主に、ビタミンCなどの作物中の抗酸化化合物の供給源に起因するが、とりわけポリフェノールやビタミンE2のような。ビタミンCは、他の多くの脊椎動物とは異なり、ヒトにとって必須の微量栄養素であり、生合成経路3における最後のステップ酵素の遺伝子コードに存在する変異のために産生することができない。正常な細胞代謝に必要であり、抗酸化活性3,4による免疫応答にも重要な役割を果たしている。
総ビタミンCはアスコルビン酸(AA)とデヒドロアスコルビン酸(DHAA)で構成されています。AAは、ビタミンの最も生物学的に活性な形態であるが、DHAA(その酸化生成物)も生物活性を示し、人体5において容易にAAに変換することができる。したがって、両方の形態を定量することは、任意の園芸作物のビタミンC含有量の合計を決定するために重要であり、レタスが含まれる。
さまざまな分析技術に基づく多種多様なアプローチが、野菜のビタミンCを測定するために用いられてきたが、例えば、酵素、分光光度、およびtitrimetric法6、7、8。これらの方法は簡単ですが、AA9に対して化学的に特異的ではありません。従って、クロマトグラフィー法が好ましく、特に高速液体クロマトグラフィー-紫外線(HPLC-UV)法は、その高精度10を有するためである。HPLC-UVは、ブロッコリー、ほうれん草、レタス11、12、13のような作物の多様性の中でビタミンCを決定するために使用されています。しかし、AAとDHAAの同時定量は、スペクトルのUV範囲におけるDHAAの吸収率が低いため複雑である。あるいは、DHAAは、DHAAをAAに変換する還元剤を用いて、アスコルビン酸(TAA)の合計を測定し、TAAとAAの差を算出することによって間接的に決定することができる。還元反応の必要性のために、いくつかの研究では、AAのみが14に定量されており、実際にはビタミンC活性の過小評価を表す可能性がある。そのさらなる還元反応は、液体クロマトグラフィー技術の最後の前進、超高性能液体クロマトグラフィー(UPLC)が使用される場合でも、間接的にDHAAを決定するために必要である。そのステップはまた、HPLCと比較した場合UPLCが示す利点から利益を得る:より高い効率と分解能、感度の向上、より短い時間分析および低い溶媒消費15。結果として、UPLC-UV技術は、異なる作物16のビタミンCを定量するために利用されてきた。
さらに、AAは非常に不安定な分子です。したがって、レタスの保存とビタミンC分析9の間にその劣化を防ぐプロトコルを開発することが重要である。この文脈において、以下のプロトコルは、UPLC-UVによるレタス中のビタミンC含有量の迅速かつ改善された定量化と、効率的な抽出手順を提供する。エリート品種だけでなく、本研究に含まれているだけでなく、伝統的な競走や作物の繁殖への潜在的な関心のためにいくつかの野生の親戚、特にレタスの栄養価の向上に含まれています。
プロトコル
1. 植物材料の準備
- 植物全体をより正確に表現するために、50 mLポリプロピレンチューブ、外側(古い)および内側(若い)1本に植物ごとに少なくとも2つの葉をサンプリングします。各サンプルに対して少なくとも3つの生物学的複製を収集する。
- 液体窒素を使用してすぐに凍結し、使用するまで-80°Cで保管してください。液体窒素がチューブに入らないようにしてください。それ以外の場合は、気化中のガス膨張のために除去すると爆発する可能性があります。
注意: 液体窒素の使用に伴う潜在的な危険のために手袋および顔の盾が必要です。 - チューブからキャップを取り出し、凍結乾燥機の凍結乾燥機室内のトレイに置きます (材料表) は、72時間の場合は -25 °C、10時間の場合は -10 °C、0 °Cは10時間、20 °Cは少なくとも4時間です。凍結乾燥プロセス中に凝縮器温度と真空定数を-80.2 °Cおよび112 mTorrにそれぞれ維持します。
- 材料が完全に乾燥している場合(植物とチューブへの圧縮の程度に応じて4〜7日の間)、4°C、-20°Cまたは-80°Cで、短い(数日から数週間)、中(月)または長期(年)の保管をそれぞれ保存します。サンプル含有チューブにシリカゲルビーズを含む袋を含めることをお勧めします。
- 凍結乾燥したサンプルを直径10 mmのステンレス鋼のボールと合わせて20 mLのポリプロピレンチューブに入れ、微細な粉塵を得るために必要な強度と時間を使用して、マルチチューブボルテックスで粉砕します。
注: プロセス全体の間に、直接光への露出からサンプルを保護します。
2. 試薬および溶液調製
- 溶媒抽出液を調製:8%酢酸(v/v)、1%MPA(メタリン酸)(w/v)、1 mM EDTA(エチレンジアミンテトラ酢酸)
- 5 mL をそれぞれに加えることを考慮して、サンプルのセット全体を処理するために必要な溶媒の総量を計算します。1 Lの溶液を調製するには、フラスコに添加する:30gのMPA、0.372gのEDTA脱水、80mLの酢酸および500mLの超純水(それに応じて体積および量をスケールする)。フラスコの口をプラスチックフィルムで密封します。
- 磁気攪拌機の助けを借りて溶解したら、体積フラスコを使用して1 Lを正確に測定し、必要な超純水を加えます。
- 還元反応バッファー(0.5 M トリス(2-アミノ-2-(ヒドロキシメチル)-1,3-プロパンジオール)pH 9.0)および還元溶液(40 mM DTT(1,4-Diththreitol)0.5 M Tris pH 9.0)を調製します。
- 200 μL がそれぞれに追加されることを考慮して、サンプルのセット全体を処理するために必要な還元ソリューションの総量を計算します。バッファーの100 mLを準備するには、ビーカーに追加します:トリスの6.055 gと超純水の90 mL(それに応じて体積と量をスケール)。ビーカーの口をプラスチックフィルムで密封します。
- 磁気攪拌機の助けを借りて溶解したら、2 M HClを加えて溶液をpH 9.0に調整し、体積フラスコを使用して100mLを正確に測定し、必要な超純水を加えます。
- 還元液の100 mLを調製するには、ビーカーに加える:0.629 gのDTT(純度:98%)バッファの90 mL(0.5 MトリスpH 9.0)は、以前に準備された(2.2.1から2.2.2)。それに応じて、ボリュームと数量をスケーリングします。ビーカーの口をプラスチックフィルムで密封します。
- 磁気攪拌機の助けを借りて溶解したら、体積フラスコを使用して正確に100 mLを測定し、必要なバッファー0.5 M Tris pH 9.0の容量を追加します。
注: 還元ソリューションは非常に不安定です。だからこそ、作りたてのソリューションを強くお勧めします。
- 硫酸 (0.4 M H2SO4)
- 200 μL をそれぞれ加えることを考慮して、サンプルのセット全体を処理するために必要な 0.4 M の硫酸の総量を計算します。溶液の100 mLを調製するには、ビーカーに加える:80mLの超純水、そして2.22mLのH2SO4( 純度:96%、密度:1.84 g mL-1)。容積フラスコを使用して正確に100mLを測定し、必要な超純水を加えます。
注意:硫酸は非常に腐食性であるため、保護具を使用してフードの下で処理する必要があります。さらに、酸は、煙を減らし、事故を避けるために、酸に水ではなく、超純水に添加する必要があります。
- 200 μL をそれぞれ加えることを考慮して、サンプルのセット全体を処理するために必要な 0.4 M の硫酸の総量を計算します。溶液の100 mLを調製するには、ビーカーに加える:80mLの超純水、そして2.22mLのH2SO4( 純度:96%、密度:1.84 g mL-1)。容積フラスコを使用して正確に100mLを測定し、必要な超純水を加えます。
- 塩酸(2 M HCl)。
- 2 M塩酸の100 mLを調製するには、ビーカーに加える:80mLの超純水、そして6.13 mLのHCl(純度:37%、密度:1.19g mL-1)。ビーカーの口をプラスチックフィルムで密封します。容積フラスコを使用して正確に100mLを測定し、必要な超純水を加えます。それに応じてボリュームをスケーリングします。
注意:塩酸は非常に腐食性であるため、保護具を使用してフードの下で処理する必要があります。さらに、酸は、煙を減らし、事故を避けるために、酸に水ではなく、超純水に添加する必要があります。
- 2 M塩酸の100 mLを調製するには、ビーカーに加える:80mLの超純水、そして6.13 mLのHCl(純度:37%、密度:1.19g mL-1)。ビーカーの口をプラスチックフィルムで密封します。容積フラスコを使用して正確に100mLを測定し、必要な超純水を加えます。それに応じてボリュームをスケーリングします。
- AA標準(ストックおよび希釈)
- AA標準の正確に10mgの重量を量る(純度:99%)精密バランスを使用し、移動相(ギ酸と超純水pH2.0)の90 mLを追加します。
- 磁気攪拌機の助けを借りて溶解したら、体積フラスコを使用して正確に100 mLを測定し、ギ酸で必要な量の超純水pH2.0を加えます。
注: このストック ソリューションを光への露出から保護します。 - AA規格のストックから5つの希釈液を準備し、 表1 の指示に従ってキャリブレーション曲線を取得し、ステップ5.2に進みます。
| 標準 | [AA](μg mL-1) | AA (100 μg mL-1)溶液 (μL) | 移動相(μL) |
| 1 | 0.5 | 5 | 995 |
| 2 | 2.5 | 25 | 975 |
| 3 | 5 | 50 | 950 |
| 4 | 10 | 100 | 900 |
| 5 | 25 | 250 | 750 |
| a極純水pH2.0は、ギ酸によって酸性化する。 | |||
表1:AA(アスコルビン酸)の5つの標準を準備するためのプロトコル。 溶質および溶媒の容積は、標準の異なる濃度のそれぞれを準備するために示される。
3. AAとDHAAの抽出
注: 抽出のステップの間に低い光強度の条件下で働くことを推薦する。
- ポリプロピレン遠心分離チューブを15 mLに、凍結乾燥した地盤試料50mgと抽出溶媒5 mLを加える(ステップ2.1)。
- 5 sの渦を使用して混合物を振り、2000 rpmで10分間軌道シェーカーを振ります。
- 超音波を作動させた室温で10分間超音波浴中にチューブを導入します。
- 遠心分離機 4,000 x g で 10 分 4 °C.
- 上清を取り、0.22 μm再生セルロースフィルターを通過し、5 mLアンバーバイアルに保存します。これは、AA と DHAA を含む抽出 1 です。
注:プロトコルは、-80 °Cで抽出物を凍結し、AAとDHAAが非常に不安定で、光の存在下で、高温または酸化雰囲気下で容易に劣化するので、光への暴露からそれらを保護することによって、ここで一時停止することができます(補足ファイル1)。
4. TAAを抽出するAAへのDHAA削減
- 200 μLの抽出物 1 を液体クロマトグラフィー用に 2 mL アンバーバイアルに移し、還元液を 200 μL 加えます(ステップ 2.2)。プリオープンのPTFE-シリコーンプラグでバイアルを閉じ、5sの渦で振ります。
- 溶液を室温で30分間放置し、光から保護します。
- 0.4 M H2SO4 の200 μLを加えて反応を停止し、酸性pHでAAを安定化します。結果として得られるソリューションは、AA のみを含み、実際には TAA である Extract 2 です。
5. 決定
- UPLC-UV製剤
- 表2に記載されている作業ソリューションを準備し、0.22 μmフィルタを適切にフィルタリングし、少なくとも10分間超音波処理し、UPLCシステムに配置します。
- 3つのUPLCモジュールのスイッチを入れ、内部キャリブレーションプロセスが完了するのを待ちます。
- ソフトウェアを開き(例えば、Empower 3)、 表2で説明されているインストゥルメンタルプログラムをロードする: Empower 3 |サンプルを実行する |ビタミンC法 |UPLC_PDA |クイック スタート を使用する。
- ソフトウェアに正しいプログラムがロードされたら、UPLC管理コンソールにアクセスします: 第四級溶媒マネージャ |マウスの右ボタンをクリックする |コンソールを起動します。
- UPLC機器の準備と安定化に進む: システム |コントロール |スタートアップ。
- すべてのUPLCラインを少なくとも5分間パージする: プライムソルベント |QSM |チェック A, B, C, D と シールウォッシュ |素数の期間 > 5 分.
- インジェクタをパージして清掃する: プライム溶剤 |SM |洗浄溶剤(>45 s)とチェックパージ溶剤(>35サイクル)を確認してください。
- UPLCをメソッド条件に平衡化する:メソッドに平衡化 |QSM |流れ (0.3 mL 分-1)|ソルベントA (2%) |ソルベントB (0%) |溶剤C (98%) |溶媒D (0%)メソッドとの均衡 |SM |サンプル(5°C) |カラム(30°C)とメソッドに平衡する |その他 |ランプオンを確認する |スタート を押します。
- 装置が安定するまで、少なくとも1時間(さらに時間が推奨されます)を待ちます。起動 コンソールの列の圧力を確認する安定性を確認することができます: システム |第四級溶媒マネージャー |QSM システム圧力.圧力変化(増加または減少)に識別可能な傾向がなく、デルタ値が10 psi未満であることを確認します。
- [ クイック スタート] 画面で、分析する標準とサンプルの名前をマトリックスに入力します。
- 標準における AA 決定
- 液体クロマトグラフィー用に、あらかじめ作成した5つのAA規格(ステップ2.5.3)のそれぞれ1mLを2mLアンバーバイアルに移します。プリオープンのPTFE-シリコーンプラグでバイアルを閉め、UPLC機器に5μLを注入します。
- 最も希釈から最も濃縮までの 手順 2に従ってクロマトグラフィーを実施する。
- サンプルにおけるAAの決定
- 液体クロマトグラフィー用の2mLアンバーバイアルに2mLの抽出1のピペット200 μLを加え、800 μLの超純水を加えます。プリオープンのPTFE-シリコーンプラグでバイアルを閉め、UPLC機器に5μLを注入します。
- 表2に記載の手順に従ってクロマトグラフィーを実施する。
- サンプル中の TAA 判定
- 抽出2に400μLの超純水を加えます。プリオープンのPTFE-シリコーンプラグでバイアルを閉め、UPLC機器に5μLを注入します。
- 表2に記載の手順に従ってクロマトグラフィーを実施する。
| コンポーネントとパラメータ | 説明 |
| 楽器 | アエクイティUPLC Hクラス |
| 検出 器 | AA=245 nm用 PDA eλ 検出器 λabs |
| ソフトウェア | エンパワー 3 |
| 列 | アキシー UPLC HSS T3 (150 mm x 2.1 mm x 1.8 μm) |
| チャンネルA | CH3ああ |
| チャンネルB/ウォッシュ | H2O:CH3OH (50:50 v:v) |
| チャンネルC | 極純水 pH 2.0 酸性酸酸 a |
| チャネルD/シールウォッシュ | 超純水:アセトニトリル(90:10 v:v) |
| モバイルフェーズ | 0.3 mL 分-1 の 2%A + 98%C (アイソクラティック モード) |
| カラム温度 | 30°C |
| オートサンプラー温度 | 5°C |
| 注入容積 | 5 μL |
| AA の保持時間 | 1.874分 |
| 再生時間 | 3分 |
| apH調整まで使用されるギ酸の不定量 | |
表2:レタスおよび野生の親戚からの抽出物中のAA(アスコルビン酸)を決定するために最適化されたクロマトグラフィー手順。 使用されるコンポーネント、条件、およびソリューションの説明。
6. AAおよびDHAAの定量化
- 統計分析
- ベルトリンら(表3)で説明したクロマトグラフィー法の分析パラメータを決定する。
注: 表 3 に示すパラメータの値は、特定の実験条件下で定義する必要があります。
- ベルトリンら(表3)で説明したクロマトグラフィー法の分析パラメータを決定する。
| メソッドの分析パラメータ | 値 |
| リニアレンジ (μg mL-1) | 0.5-25 |
| 線形方程式 | y=53,143.03x |
| R2 | 0.99998 |
| 検出限界(mg AA g-1 の乾燥物質) | 0.013 |
| 定量の限界(mg AA g-1 の乾燥物質) | 0.045 |
| 繰り返し性(CV、%) | 1.75 |
| 中間精度 (CV、%) | 4.22 |
| 回復 (Rec, %b | 95.6±2.4 |
| aCV: 変動係数 | |
| b回収アッセイは、同じ試料の50mgを含む10のアリコート、乾燥物質のAAg-1 の2mgでスパイクした5、および5非スパイクで行った。%Rec=([AA]スパイクサンプル-[AA]サンプル)/([AA]スパイク)x100。 | |
表3:AA(アスコルビン酸)およびTAA(総アスコルビン酸)の検出および定量化のための最適化された分析パラメータ。 線形範囲は、較正(R2)曲線の式および決定係数、ならびにAAの検出と定量の限界(TAAについても同様)、および再現性、中間精度および回復性を、サンプル注入量5μLで得た。
- AAとTAA濃度を計算します。
- 標準クロマトグラムとサンプルクロマトグラムを開く: クイックスタート |プロジェクトを参照する |チャンネル |"標準またはサンプルの名前" |PDA Ch1 245 nm@1.2 nm.
- 基準とサンプルに対応するピーク(AAまたはTAA)を統合するには、その開始点(約1.790分)をクリックし、マウスで終点(約1.910分)までドラッグします。
- 上記で作成した5つのAA規格の濃度に対してクロマトグラフィ的に決定した吸光度値を表すキャリブレーション曲線を構築する(表1)。
- ステップ 5.3 および 5.4 で決定されたサンプルの吸光度値を補間し、それぞれ次の式で AA 濃度と TAA 濃度を取得します。
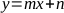
ここで、yは積分ピーク面積、xはppmのAAまたはTAA濃度、mおよびnは、それぞれ得られた回帰直線の傾きとy-切片である。 - DHAA の濃度を計算するには、次の式を適用します。
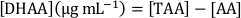
注: 乾燥重量の mg g-1 で DHAA、AA、TAA の合計濃度を取得するには、キャリブレーションカーブで直接補間した値を、合計抽出量と希釈係数を掛け合わせ、抽出に使用したサンプルの重量で割る必要があります。
結果
ラクトゥカマトリックスのビタミンC定量は、信頼性の高い結果を保証できるクロマトグラフィーアプローチの開発が必要です。図1Aは、非最適化プロトコル(補足ファイル2)から生じるクロマトグラムを示しており、これは未確認のマイナー「ショルダー」と共にAAピークを示す。それにもかかわらず、抽出およびクロマトグラフィー条件を改善した後、未知の化合物の干渉を伴わない分解されたAAピークが達成された(図1B)。さらに、HPLC-UVの代わりにUPLC-UV機器を使用することにより、最適化されたクロマトグラムでは1.874分、最適化されていないクロマトグラムでは1.874分、最適化されていないクロマトグラムでは2.980分(図1)、実行時間、最適化されたプロトコルと最適化されていないプロトコルの3分と7分を削減することができました。
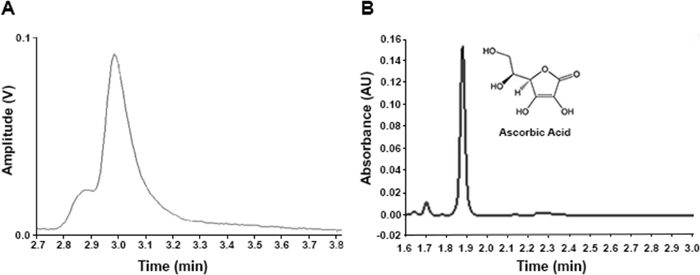
図1:同じレタスサンプル中のAAのクロマトグラム(市販の品種'ベゴーニャ')。(A) 最適化されていないプロトコル(補足ファイル2に記載されている条件)から生じるHPLC-UVクロマトグラム。(B) 最適化されたプロトコルで得られる UPLC-UV クロマトグラム ( 表 2に記載の条件) この図の大きなバージョンを表示するには、ここをクリックしてください。
図1Aで観察されたようなAAピークの干渉は、クロマトグラフィープロセス中の分離が不十分であったため、ビタミンC(AA、DHAAおよびTAA)含有量(図2)を一貫して過小評価する結果となった。このバイアスは、特にDHAAおよびTAAコンテンツにおいて、野生の親族の作物の場合に特に顕著である(図2)。
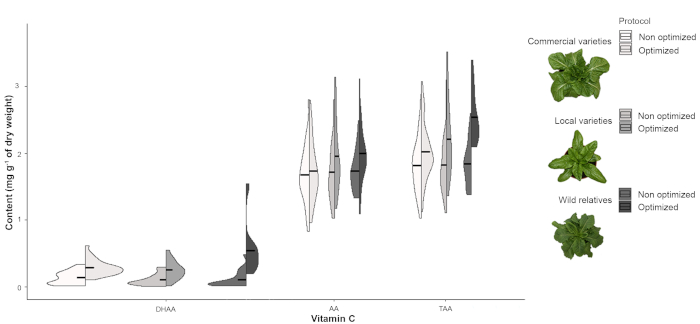
図2:ビタミンCの含有量の分布商業および伝統的なレタスの品種のDHAA、AAおよびTAAの内容(乾燥重量のmg g-1)のスプリットバイオリンプロットと、最適化されていない最適化されたプロトコルを使用するいくつかの野生の親戚。黒い線は平均値を示します。 この図の大きなバージョンを表示するには、ここをクリックしてください。
さらに、最適化されていないプロトコルを使用することで、すべてのサンプル、レタスの両方、野生の親戚が同様のビタミンC含有量を有する結果から有用な結論を抽出することができなかった。対照的に、最適化されたプロトコルは、DHAAとTAAコンテンツ(表4)の間で統計的に有意な差を検出することを可能にし、最も裕福なものは野生種である(図2)。
| 最適化されていない | 最適化 | |||
| F比 | p-値 | F比 | p-値 | |
| DHAA | 0.460 | 0.637ns | 5.613 | 0.009** |
| Aa | 0.070 | 0.932ns | 1.020 | 0.374ns |
| Taa | 0.015 | 0.985ns | 4.438 | 0.022* |
| ns、*および** は、それぞれ p<0.05 および 0.01 で有意で重要でなく意味を持たしていることを示します。 | ||||
表4:ビタミンCの含有量の変動 DHAA、AAおよびTAA含有量のラク トゥカ の種類を考慮した一方行ANOVAのF比(グループ間分散とグループ内分散の2つの分散の商)と有意値
補足ファイル1:AAとTAA安定性5°Cで24時間。(A)24時間を通してAAおよびTAAピーク領域(B)AAおよびTAA含有量(乾燥重量のmg g-1)を通して24時間を通して。バーは、5 °Cでオートサンプラーに保管され、光への暴露から保護された2つの技術的複製(n=2)の標準偏差を表します。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル2:TAA、AAおよびDHAA抽出と定量のための最適化されたプロトコルと最適化されていないプロトコルの主な違い。 どちらの場合も、使用したサンプルは同じであった。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ビタミンCは非常に重要な栄養素ですが、非常に不安定な化合物でもあるため、UPLC-UV定量はサンプルの保存と調製、抽出方法、クロマトグラフィー条件などの複数の要因に依存します。そのため、DHAA(抗酸化作用のない)酸化を防止する迅速かつ簡単な手順が必要であった。また、高いpHと温度条件、ならびに化合物の安定性を促進するために、サンプル処理中に強烈な光と酸化雰囲気を避けるために重要でした。
AA酸化を最小限に抑えるために、以下の対策を講じる。まず、サンプルを両方のプロトコルの出発物質として凍結乾燥し、ビタミンC含有量の正確な定量を確保し、サンプルを容易に操作する。このオプションは、一般的に文献19全体で見られる微細粉砕よりも好ましく、ほこりが非常に迅速に解凍するので、水が再び利用可能になる。抽出手順の間、より酸性の溶液(8%酢酸および1%MPA)の高い容積を、AA分解を防ぐことによって安定剤としても作用する最適化されたプロトコル(補足ファイル2)で抽出剤として使用された。この溶液には、安定化を増加させるキレート剤としてEDTAも含まれ、非最適化プロトコル(補足ファイル2)における抽出剤とは異なる。さらに、標準的な大気条件の代わりに5 mLの単一の抽出物の代わりに2.5 mLの抽出物を用いて抽出手順を2回連続して使用して、抽出手順を強化できるかどうかをテストした。最良の結果は、変更されていない大気の下で1回の抽出のみを使用して到達し、不要な追加のステップ(データは示されていない)を行うことによってプロトコルを簡素化しました。抽出を強化するためにプロトコルに加えられた他のマイナーな変更(すなわち、超音波処理)、より明確な抽出物(より細かいろ過)を得て、プロトコルの持続時間を短縮する(補足ファイル2)。クロマトグラフィー条件に関しては、方法の検証は18より前に報告されたように行われ、良好な分析パラメータを保証する(表3)。また、ギ酸(pH 2.0)とメタノール(98:2 v:v)を用いた超純水を0.3 mLmin-1流で使用し、移動相(補足ファイル2)としてリン酸モノカリウム30mM(pH 3.0)を1mL min-1で使用することで、改良された方法が得られた。最も重要な進歩は、HPLCの代わりにUPLCシステムを使用して、影響条件(温度など)をより制御し、未知の化合物による干渉なしにAAピークを解決し、より短い時間で、抽出物の量を減らすことでした(補足ファイル2)。
それにもかかわらず、この方法には2つの主な制限があります。1つ目は、スペクトルのUV範囲における吸収率が低いため、DHAAをUV検出器を使用して直接測定できないことです。DHAA含有量は、ある種の生物活性を示し、人体5においてAAに容易に転換できるため、定量化することが重要である。そのためには、TAAを測定し、TAAからAA含有量を差し引くことによって間接的にDHAAを決定するために、第2のクロマトグラフィーランと共に、AAAに対するDHAAを減らすための追加の反応が必要である(図3)。この意味で、還元工程は、より高濃度の還元剤(DTT)を用いて最適化され、反応時間を5〜30分に増加させ、硫酸(補足ファイル2)との反応を停止した。AAの低安定性は、方法の第2の制限を構成する。AAが抽出後4時間低下し始めると(補足ファイル1)、この時間間隔で定量化する必要があります。したがって、抽出するサンプルの数は、クロマトグラフィー手順によって調整されます。そのため、このプロトコルのそのステップで凍結することを提案していますが、その場合、すべてのデバイスを自動的に測定するUPLCオートサンプラーに配置できるわけではありません。幸いにも、AAの還元RTは、HPLC(補足ファイル2)を用いて得られた7分クロマトグラムよりもはるかに短い3分クロマトグラムを得ることを可能にした。したがって、ビタミンC含有量は、4時間のウィンドウ内のサンプルの数が多いで決定することができます。
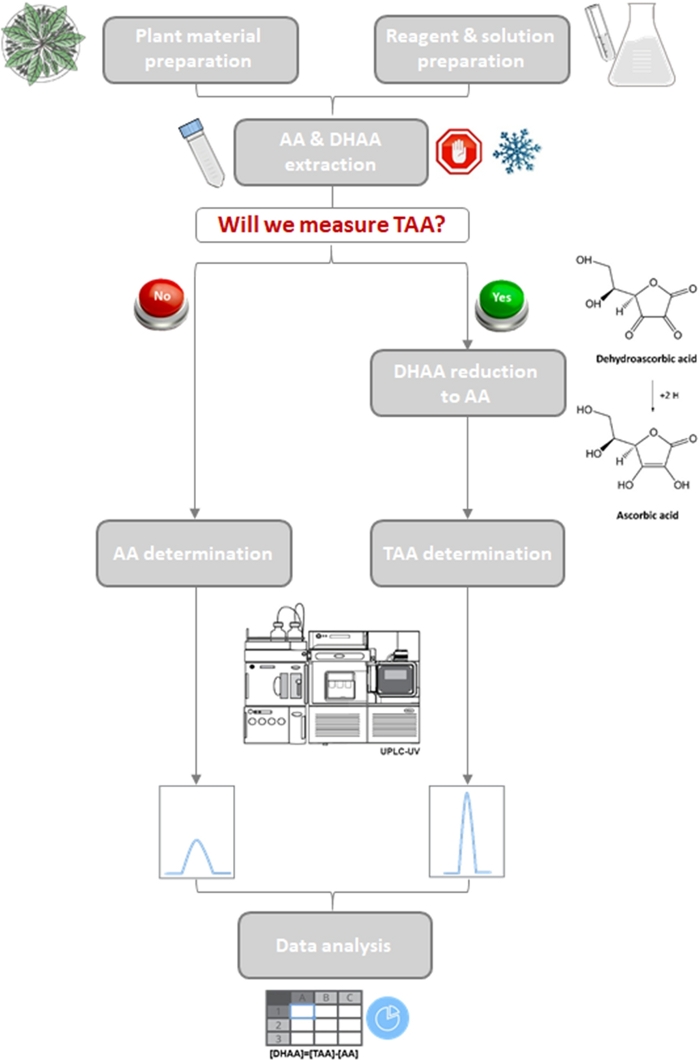
図3:レタスおよびいくつかの野生の親戚におけるビタミンCの定量化のワークフロー。
AAまたはAA+DHAA(TAA)のみの判定のための2つの分岐を示す最適化されたプロトコルの概略図。 この図の大きなバージョンを表示するには、ここをクリックしてください。
ビタミンCは、人間にとって必須栄養素であり、その重要な健康上の利点のために、それは多くの研究の対象となっています。そのため、世界中で最も消費される野菜の一つであるレタスを含む多種多様な作物で定量化されています。単純な古典的な方法は、それらがより具体的かつ正確な10であるため、徐々に液体クロマトグラフィー技術に置き換えられました。しかし、HPLCを介してAAとDHAAの両方を定量化するための追加反応が必要であるため、レタスに関するいくつかの研究では、AA14または唯一のTAA11(AAAへのDHAの還元前にAAを定量化せずに)のみが測定された。さらに、ビタミンC抗酸化活性2に対する両方の分子の寄与にもかかわらず、AAおよびDHAAを定量した著者はごくわずかである。しかしながら、UPLC技術は、いくつかの作物16でビタミンCを測定する際の性能が高いため、近年より重要になってきました。この研究で得られた結果をUPLCとHPLCの2つの方法論と比較すると、これらの利点は確認されています:より高い感度のおかげで明確に定義されたAAピークが達成され、非常に短い時間で、消費されるリソースが少なくなることも意味します。UPLCの効率にもかかわらず、この技術を適用したのはChenら20のみでレタス中のビタミンC含有量を測定し、AA形態のみが定量化されたため、依然として過小評価を引き起こした。
要約すると、この研究は、異なるレタス品種だけでなく、野生の親戚の一部でビタミンC含有量の総量を決定する最初の成功した試みを表しています。ビタミンC定量は、繁殖プログラム内でより高い抗酸化活性を有するレタスを選択するためにも不可欠である。この意味で、ここで見つかったレタス野生の親族のビタミンC含有量の増加と、以前の研究で報告されたAA含有量の増加14、ならびに他の抗酸化化合物21は、レタスの栄養価を向上させるための適切な候補を広げる。
結論として、抽出後数時間後の段階的な分解やDHAA UV吸収率の低さによる還元反応の必要性など、ビタミンCの性質に固有のいくつかの制限があっても、ビタミンC含有量を測定するための労働力の激しい、より時間のかかる方法を提供します。さらに、それはまた非常に強く、高い感受性および解決力を示す。また、わずかな変化を伴う他の植物材料だけでなく、ビタミンCの摂取を人間に供給する加工品にも簡単に移管可能であり、信頼性の高い食品品質の試験分野において将来の幅広い応用が可能です。
開示事項
著者らは開示するものは何もない。
謝辞
我々は、この作業に必要な種子を供給したサラゴサの野菜胚芽期(BGHZ-CITA、スペイン)と遺伝資源センター(CNG、ワーゲニンゲン、オランダ)を感謝しています。J.A.アランフエロ、A.カステラノス、CITAの「ラボラボ・デ・ヴァロラシオン・ヌトリティバ」に対し、英語を見直してくれたD・L・グッドチャイルドに感謝します。この研究は、農業・食品研究技術研究所(INIA)とアラゴン政府からのLMP164_18からプロジェクトRTA2017-00093-00-00によって資金提供されました。そして、運営プログラムFEDERアラゴン2014-2020と欧州連合からの欧州社会基金[グルーポス・コンソリダドスA12-17R:グルーポ・デ・インベスティガシオン・エン・フルティカルチュラ:カラクテリサシオン、 アダシオン・イ・メジョラ・ジェネイカ」とA14-17R:「システマス・アグロガナデロス・アリメンタリオス・ソステンブルス」(SAGAS)。I.M L.は、スペイン科学イノベーション大学省(MCIU)とスペイン国家研究庁(AEI)の医師を訓練するための医師の医師契約によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 1,4-Dithiothreitol (DTT) ≥98% (Ellman′s reagent) | Roche | 10197777001 | |
| 10 mm Φ stainless steel ball | Euro Aznar Supplies S.L. | 20112100 | |
| 15 mL polypropylene tube for centrifuge | Deltalab | 429946 | |
| 2 mL HPLC amber vial | Agilent | 5190-9063 | |
| 2 mL syringe with needle | Deltalab | JS2 | |
| 20 mL polypropylene tubes | Deltalab | 202840 | |
| 2-Amino-2-(hydroxymethyl)-1,3-propanediol (TRIS) ≥99.9% (titration) | Roche | 10708976001 | |
| 50 mL polypropylene tube | Deltalab | 429951 | |
| Acetic acid (CH3COOH) ≥99% purity glacial, ReagentPlus | Sigma-Aldrich | A6283 | |
| Acetonitrile, HPLC super gradient grade (99.9+% CH3CN-0.2 µm filtrated) | Chem-lab | CL00.0189 | |
| Acquity UPLC HSS T3 column (150 mm x 2.1 mm x 1.8 µm) | Waters | 186003540 | |
| Beaker 1 L, 200 mL | Deltalab | 191725, 191722 | |
| Dipotassium phosphate (KH2PO4) | Panreac | 766384 | Only in the non-optimized protocol (Supplemental File 2) |
| Ethylenediaminetetraacetic Acid Disodium salt (EDTA x 2H2O) 99-101% assay, ACS reagent | Panreac | 131669 | |
| Fisherbrand Analog MultiTube Vortexer | Thermo Fisher Scientific | 15549004 | |
| Formic acid 98-100% for HPLC LiChropur | Supelco | 5438040100 | |
| Freeze dryer VirTis genesis 25EL | VirTis | na | |
| Heidolph Multi Reax mixer | Heidolph | na | |
| Heidolph Reax top mixer | Heidolph | na | |
| Hewlett Packard HPLC 1050 equipped with an eλ Detector | Hewlett Packard | na | Only in the non-optimized protocol (Supplemental File 2) |
| Hydrochloric acid (HCl) 37% purity, ACS reagent | Sigma-Aldrich | 320331 | |
| L-Ascorbic acid ≥99%, ACS reagent | Sigma-Aldrich | 255564 | |
| Meta-phosphoric acid (MPA) ACS reagent, chips, 33.5-36.5% | Sigma-Aldrich | 239275 | |
| Methanol ≥99.9% (HPLC supergradient grade) | ChemLab | CL00.0189.2500 | |
| Micropipettes 10-1000 μL | Socorex | na | |
| Nucleosil 120 C18 Tracer column (250 mm x 4 mm x 5 µm) | Merck (Sigma-Aldrich) | 54919 | Only in the non-optimized protocol (Supplemental File 2) |
| PTFE-silicone cap with preaperture | Agilent | 5190-9067 | |
| Refrigerated centrifuge Gyrozen 1248R | Gyrozen | na | |
| Regenerated cellulose filters 0.22 µm (13 mm) | Agilent | 1015190-5108 | |
| Regenerated cellulose filters 0.45-µm (13 mm) | Labbox | SFCA-145-100 | Only in the non-optimized protocol (Supplemental File 2) |
| Spectrophotometer Heλios β | Thermo Scientific Corporation | na | |
| Sulfuric acid (H2SO4) 95.0-98.0% purity, ACS reagent | Sigma-Aldrich | 258105 | |
| Ultrapure water | WasserLab | na | |
| Ultrasons H-D | Selecta | na | |
| Volumetric flasks 1 L, 100 mL | DeltaLab | 191489, 191486 | |
| Waters Acquity UPLC H-Class equipped with a PDA eλ Detector | Waters | na |
参考文献
- Llorach, R., Martínez-Sánchez, A., Tomás-Barberán, F. A., Gil, M. I., Ferreres, F. Characterisation of polyphenols and antioxidant properties of five lettuce varieties and escarole. Food Chemistry. 108 (3), 1028-1038 (2008).
- Carr, A. C., Frei, B. Toward a new recommended dietary allowance for vitamin C based on antioxidant and health effects in humans. American Journal of Clinical Nutrition. 69 (6), 1086-1107 (1999).
- Carr, A. C., Vissers, M. C. M. Synthetic or food-derived vitamin C-Are they equally bioavailable. Nutrients. 5 (11), 4284-4304 (2013).
- Lee, S. K., Kader, A. A. Preharvest and postharvest factors influencing vitamin C content of horticultural crops. Postharvest Biology and Technology. 20 (3), 207-220 (2000).
- Shekhovtsova, T. N., Muginova, S. V., Luchinina, J. A., Galimova, A. Z. Enzymatic methods in food analysis: determination of ascorbic acid. Analytica Chimica Acta. 573-574, 125-132 (2006).
- Zhan, L., et al. Light exposure during storage preserving soluble sugar and L-ascorbic acid content of minimally processed romaine lettuce (Lactuca sativa L.var. longifolia). Food Chemistry. 136 (1), 273-278 (2013).
- Malejane, D. N., Tinyani, P., Soundy, P., Sultanbawa, Y., Sivakumar, D. Deficit irrigation improves phenolic content and antioxidant activity in leafy lettuce varieties. Food Science and Nutrition. 6 (2), 334-341 (2017).
- Tarrago-Trani, M. T., Phillips, K. M., Cotty, M. Matrix-specific method validation for quantitative analysis of vitamin C in diverse foods. Journal of Food Composition and Analysis. 26 (1-2), 12-25 (2012).
- Klimczak, I., Gliszczyńska-Świgło, A. Comparison of UPLC and HPLC methods for determination of vitamin C. Food Chemistry. 175, 100-105 (2015).
- Złotek, U., Świeca, M., Jakubczyk, A. Effect of abiotic elicitation on main health-promoting compounds, antioxidant activity and commercial quality of butter lettuce (Lactuca sativa L.). Food Chemistry. 148, 253-260 (2014).
- Koh, E., Charoenprasert, S., Mitchell, A. E. Effect of organic and conventional cropping systems on ascorbic acid, vitamin C, flavonoids, nitrate, and oxalate in 27 varieties of spinach (Spinacia oleracea L). Journal of Agricultural and Food Chemistry. 60 (12), 3144-3150 (2012).
- Kałuzewicz, A., et al. The influence of short-term storage on the content of flavonoids and vitamin C in Broccoli. European Journal of Horticultural Science. 77 (3), 137-143 (2012).
- van Treuren, R., van Eekelen, H. D. L. M., Wehrens, R., de Vos, R. C. H. Metabolite variation in the lettuce gene pool: towards healthier crop varieties and food. Metabolomics. 14 (11), 1-14 (2018).
- Swartz, M. E. UPLC: An introduction and review. Journal of Liquid Chromatography & Related Technologies. 28 (7), 1253-1263 (2005).
- Spínola, V., Mendes, B., Câmara, J. S., Castilho, P. C. An improved and fast UHPLC-PDA methodology for determination of L-ascorbic and dehydroascorbic acids in fruits and vegetables. Evaluation of degradation rate during storage. Analytical and Bioanalytical Chemistry. 403 (4), 1049-1058 (2012).
- Ball, G. F. M. . Water-soluble vitamin assays in human nutrition. , (1994).
- Bertolín, J. R., et al. Simultaneous determination of carotenoids, tocopherols, retinol and cholesterol in ovine lyophilised samples of milk, meat, and liver and in unprocessed/raw samples of fat. Food Chemistry. 257, 182-188 (2018).
- Spínola, V., Llorent-Martínez, E. J., Castilho, P. C. Determination of vitamin C in foods: Current state of method validation. Journal of Chromatography A. 1369, 2-17 (2014).
- Chen, Y., et al. radiation is beneficial for yield and quality of indoor cultivated lettuce. Frontiers in Plant Science. 10, 1-10 (2019).
- Damerum, A., et al. Elucidating the genetic basis of antioxidant status in lettuce (Lactuca sativa). Horticulture Research. 2 (15055), 1-13 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved