Method Article
腸管内窩からのネズミ原発結上皮単層の生成
要約
本プロトコルでは、腸内窩から直接マウスの一次上皮結腸単層を生成する方法を説明する。透過性フィルター上にコンフルエント単層を生成する実験的アプローチ、傷創傷治癒および生化学的研究のためのコンフルエント単層、免疫蛍光分析のためのまばらでコンフルエントな単層を提供する。
要約
腸上皮は、腸内腔と身体の内部との間の障壁として機能する細胞の単一層で構成される。この障壁の連続性の中断は、炎症性腸疾患などの炎症性疾患をもたらす可能性がある。腸上皮生物学の研究における限界の1つは、一次細胞培養モデルの欠如であり、研究者は癌腫由来のモデル細胞株を使用することを義務付けている。3次元(3D)エンタノイドの出現は、上皮生物学者に一次細胞培養を生成するための強力なツールを与え、それにもかかわらず、これらの構造は細胞外マトリックスに埋め込まれ、分化された腸上皮細胞の成熟特性を欠いている。腸上皮単層を生成するいくつかの技術が公開されているが、ほとんどがプロセスを骨の折れる、高価な確立された3Dエンテロイドに由来する。ここでは、マウス腸内窩から直接一次上皮結腸単層を生成するプロトコルについて説明する。また、このモデルで使用できる実験手法の詳細は、透過性フィルター上のコンフルエント培養物の生成、傷創傷治癒研究のためのコンフルエント単層、免疫蛍光分析のためのまばらでコンフルエントな単層などです。
概要
腸管上皮細胞(IEC)は、微生物や毒素 が体内に入るのを防ぎながら、栄養素と吸水を可能にする選択的に透過性の障壁を形成する腸に並ぶ1。腸粘膜は、絨毛(小腸にのみ存在する)と呼ばれる発光投影と、クリプトと名付けられた膣で構成されています。絨毛と大腸陰窩の表面は分化した上皮細胞で覆われ、陰窩の基部は3〜7日の代謝を有する腸上皮の急速な再生を行う幹細胞で構成される。腸幹細胞(ISC)は、腸内ホメオスタシスを維持するために重要であるだけでなく、損傷した上皮2の適切な修復のために重要である。
腸上皮生物学の研究は、変換細胞株が利用可能な唯一のツールである一次細胞培養の欠如によって制限された。腸上皮モデル細胞株は、正常な腸上皮の生理学を正確に複製することができない。ISCに由来する3D培養物の開発は、腸管粘膜の疾患に類似したインビトロモデルを腸粘膜生物学者に提供した。クリプトは、マウスサンプルから容易に単離することができ、基質膜マトリックス培地(例えば、マトリゲル)に埋め込まれ、Wnt3a、R-spondin、およびNogginを含む条件付き培地で増殖し、エンタイド(小腸)または大腸(大腸)4として知られる3D構造を生成する。エンテロイドとコロノイドは、極形ドメインが内部内腔に向き、バソラテラ領域が細胞外マトリックスに直接接触している偏光球状構造である。エンテロイドおよびコロノイドは、腸球/大腸細胞、パネス、腸内分泌およびゴブレット細胞などの主要な分化された腸上皮サブタイプをすべて含み、それらは5から単離された腸のセクションと比較的同じ割合で現れる。3Dエンタノイドとコロノイドは、腸の発達と生理学の研究における大きな進歩を表していますが、これらのモデルは、上皮細胞(内腔)の有端表面へのアクセスが制限され、培養物を拡大または縮小して目的の分子のハイスループットスクリーニングを達成する能力などの一定の欠点を提示します。これらの制限を克服するために、3Dエンタイド/コロノイドから導き出されたIECの主要な2D培養物を得るためのプロトコルが生成された。2Dエンテロイド/コロノイドは、モデル細胞株と同様に細胞のシートとして増殖し、腸の創傷修復、宿主病原体相互作用、再生医療などを研究するのに理想的です。いくつかの公表された論文では、3D構造から、または腸の納骨堂から直接(6、7、8、9、10、11)から2D単層を生成する方法について説明していますが、これらの方法は労働集約的で再現が困難である傾向があります。このプロトコルでは、単層を単離したばかりのマウス腸管の納骨堂から直接取得するための高速かつシンプルで再現可能な方法が概説されています。
ここでは、この技術のための破片、細胞外マトリックスの選択および異なる表面および用途の最小生成を用いた暗号抽出のためのプロセスを詳細に説明する。この実験的アプローチは大腸窩に最適化されたが、小腸に適用すると同様の結果が得られる。
プロトコル
以下に記載されているすべての手順は、ミシガン大学の制度的動物管理および使用委員会が定めたガイドラインに従って承認され、実施されています。
1. 暗号分離および培養用試薬の調製(組織培養フードで準備)
- 50 mM エチレンアミンテトラ酢酸 (EDTA): カルシウム(Ca2+)およびマグネシウム(Mg2+)を使用せずに、リン酸緩衝生理食塩水の450 mLに50 mL 0.5 Mストックを加え、500 mLを調製します。このプロトコルでは、PBSは特に明記されていない限り、カルシウムとマグネシウムを含まないPBSを参照します。
- シェイクバッファー:PBSで7.4 gスクロース(43.3mM)と5gソルビトール(54.9mM)を溶解し、500 mLを調製します。
- L-WRN (L-Wnt-3A, R-spondinおよびNoggin)メディア:サプリメント高度なダルベッコの修正イーグルミディアム/ハムのF-12(DMEM / F12)(780 mL)と20%の胎児血清(FBS)(200 mL)、1x市販のグルタミンサプリメント(10mL)、100 U/mL陰茎、および 100 g/mL ストレプトマイシン (10 mL) を、0.22 μm フィルターでフィルター滅菌します。
- ATCCを介してL-WRN細胞を取得し、T175フラスコで成長し、ジェネティコリンとハイグロマイシンを使用して選択します。メディアは12日間変更され、収集されます。
注:メディアのすべてのバッチは、TOPflash Wnt Reporterアッセイを使用してWntアクティビティについてテストされます。この場合、ミシガン医学トランスレーショナルティッシュモデリング研究所のプロトコル(https://www.umichttml.org/protocols)に従った。TOPflash HEK 293細胞株はT75フラスコで合流するように成長し、トリプシン化し、96ウェルプレートにメッキします。翌日、採取した培地の異なる希釈液が細胞に添加され、一晩で37°Cで5%CO2 インキュベーターでインキュベーターされる。翌日、細胞はリズされ、ホタルルシファーゼアッセイはメーカーの指示に従って行われます。このアッセイは、組換えWnt-3Aを用いて正規化される。メディアは50 mL円錐管で25 mLのアリコートに分けられ、-80°Cで貯蔵する。
- ATCCを介してL-WRN細胞を取得し、T175フラスコで成長し、ジェネティコリンとハイグロマイシンを使用して選択します。メディアは12日間変更され、収集されます。
- ベースメディア:500 mL、2倍の市販のグルタミンサプリメント(10 mL)、20 mM HEPES(10 mL)、100 U/mLペニシリンと、サプリメント高度なDMEM / F12(448 mL) 100 g/mL ストレプトマイシン (10 mL), 2 mM N-アセチル-L-システイン (2 mL), N2 サプリメント (10 mL) および B27 サプリメント (20 mL), フィルター滅菌 0.22 μm フィルター.50 mL円錐管で25mLのアリコートにメディアを分割し、-80°Cで保管してください。
- LWRN完全な媒体:25 mL LWRN培地を25 mLのベースメディアと組み合わせ、200 ng/mL表皮成長因子(EGF)(20μL)および2x抗生物質抗ミコティック溶液(1 mL)を補充します。4 °Cで完全なメディアを保管してください。
- コラーゲンとラミニン:5mg粉末を100 mMの酢酸を殺菌したフィルターで5mL溶解し(酢酸ストック60 μLを分子グレード水の9.94 mLに加える)、1mg/mLのストック濃度を生成します。4°Cで4時間回転し、0.2 mLチューブで100 μLアリコートを作ります。-20°Cで凍結します。 ラミニンは、100 μg/mLの在庫濃度で購入されます。
- 成長因子を含まない完全な培地(CMGF-):1x市販のグルタミンサプリメント(5mL)、10 mM HEPES(5 mL)、100 U/mLペニシリン、および100 g/mLストレプトマイシン(5mL)を備えた、高度なDMEM/ F12(500mL)。
- 分化媒体:CMGF-培地の9.2 mLに、B27サプリメントの200 μL、N2サプリメントの100 μL、N-アセチルLシステインの20 μL、ノギン培地12 の500 μL(ノギン産生細胞から作られた)および2 μLのEGFを加えて、10mLの異なる培地を作る。
2. プレート、チャンバースライド、細胞培養膜挿入物の調製
- めっき2Dモノレイヤー用の48ウェルプレートおよびチャンバースライドのコーティング:ラミニン(1:40希釈、材料表参照)とコラーゲン(1:30希釈)を冷たいダルベッコのリン酸緩衝生理食塩水に、Ca2+およびMg 2+(DPBS)で構成するコーティング溶液を使用します。各ウェルに200 μLのコーティング溶液を加え、プレート/チャンバースライドを37°Cの5%CO2インキュベーターで2時間以上事前にインキュベートします。
- コーティング 0.4 μm の細胞培養膜挿入: 分子グレードの水にコラーゲンを 1:30 希釈し、各インサートに 200 μL を加えます。膜インサートを含むプレートを氷上の4°Cで30分間保管します。30分間のインキュベーションに続いて、プレートを37°Cで1.5〜2時間、5%CO2インキュベーターに入れておいてください。ポリエステルとポリカーボネート膜挿入は、同等の結果をもたらす。
注:任意の組織培養プレートは、このプロトコルを使用して、このプロトコルを使用して、めっき面の完全なカバレッジを得るためにコラーゲン/ラミニンの体積を調整することによってシード(上下スケーリングを行うことができます)することができます。
3. 暗号化の分離
注:解剖を開始する前に、コラーゲンおよび/またはラミニンコーティングされたプレート/膜インサート/チャンバースライドを準備し、37°Cの5%CO2 インキュベーターに残してください。 手術に適したクリーンワークベンチと無菌手術用器具、2D単層を培養するための生物学的安全キャビネットを用意します。加湿CO2 インキュベーター、卓上遠心分離機(4°Cで維持)、顕微鏡、ピペット(血清ピペットを含む)などの2D単層培養のための他のすべての標準装置を確認します。
- 生後8~12週のC57Bl/6マウスを使用してください。承認された安楽死法を用いてマウスを安楽死させる。
- 70%エタノール(EtOH)溶液でマウスの死体をスプレーし、解剖領域を洗浄し、紙組織を使用して余分なEtOHを除去する。
メモ:暗号分離試薬(PBS、50 mM EDTA、シェイクバッファなど)が冷たく保たれていることを確認してください。これらの試薬は、1日前に調製することができ、4°Cで保存した場合、少なくとも3ヶ月間使用することが良好である。 また、LWRN完全な媒体は使用まで37°Cで維持されるビーズ/水浴に保たれていることを確認してください。 - きれいな解剖はさみと鉗子を使用して、直腸から盲腸に結腸を解剖する。鉗子を使用して結腸の端を保持し、10 mLのシリンジで氷冷PBSを使用して非常に穏やかにフェースを洗い流し、20 Gの給餌管を取り付けた(図1A)。結腸を破裂させないようにしてください。
- 近位コロンを取り除きます。これは、イレオセカル接合部に最も近い結腸の部分になります。
- 鉗子で、遠位コロンを20Gの送電管にそっとスライドさせ、4-0シルク縫合糸で先端でチューブの端にある結腸を結ぶ(図1B)。
- 結ばれた端に指を使って結び、もう一方の端を4-0シルク縫合糸で結んで、結び返しコロンを裏返しにします。手術用ハサミを使用して、給餌管の先端の下にコロンを切断する(図1C、D、E)。
- 1.25 mLリピートシリンジのプランジャーを使用して、1.25 mLリピートシリンジの先端に反転結びコロンのアンタイドエンドをそっと開きます。反転したコロンをシリンジの端にスライドさせ、4-0シルク縫合糸でしっかりと結びます(図1F、G)。
- プランジャーをシリンジに挿入し、結腸を膨らませてソーセージを形成します。コロンソーセージが目に見えるしわなしで急がいくなるまで膨らませる(図1H)。
- 5 mLの細胞回収液を入れた15 mLチューブに20分間、シリンジ/コロンを入れ、5分に1回、結腸を膨張して収縮させます(図1I)。ソーセージは、インキュベーション中に膨らませたままでなければなりません。
- 繰り返しシリンジの先端の下にある4-0シルク縫合糸を結び、結腸を膨らませます。ソーセージを切り落とし、50mM(小腸の場合は2mM)の10mLを含む15mLチューブに40分間、40分間回転させます(図1J、K)。
- EDTA溶液をデカントし、5 mLのシェイクバッファーに交換します。ソーセージを縦位置(激しく)に2分間振ります。
- 新しい15 mLチューブに振る溶液をデカントし、振るバッファー内の納骨堂の合計10 mLの振盪ステップを繰り返します。
- ペトリ皿に20μLのクリプトサスペンションを取り、顕微鏡での納骨堂の数を数えます。crypts/μLでの暗号濃度を計算します。
- 400 x g で 400 x g で 4 °C で 10 分間、分離した納骨堂でチューブをスピンします。
- その間に、インキュベーターから48ウェルプレート/インサート/チャンバースライドを取り出し、バイオセーフティキャビネットに置きます。P200を用いてコーティング液を吸引し、細胞がめっきされる準備ができるまで蓋をわずかにオフセットしてプレートを残します。
4. 2D単層の培養
注:3Dコロノイドから腸の上皮単層を生成する方法についての詳細なプロトコルについては、エステスとKovbasnjukラボによってプロトコルをチェックします (7,11).
- 10 mL血清ピペットを使用して振るバッファーを取り外します。ペレットがそのままで、P1000を使用して残った液体を取り除くことを確認してください。P1000でLWRN完全な媒体およびピペットの3 mLでペレットを再中断する。事前にコーティングされた48ウェルプレート/チャンバースライドの各ウェルに200 μLのクリプトを加え、37°Cの5%CO2 インキュベーターでインキュベートします。
- 翌日、P200を使用してメディアを吸引し、新鮮なメディアを追加します。細胞は24-48時間でコンフルエントになる。
- 細胞培養膜挿入物の場合、挿入部の上部に200μLの暗号(5つの暗号/μL)を加え、完全なL-WRN培地を600μLの下端に加えます。翌日P200を使用してメディアを吸引し、新鮮なメディアを最上部にだけ追加します。プレートを37°Cで5%CO2 インキュベーターにインキュベートします。 上皮電気抵抗(TEER)は上皮ボルト/オームメーター(EVOM)を使用して毎日測定されます。
注: カルチャに 300 Ω.cm2を超える TEER 読み取り値がある場合、それらはコンフルエントであることを意味します。合流は3-4日で達成される。メディアを 2 日ごとに変更します。
結果
主要な上皮結腸単層培養の信頼性を示すために、そのプロトコルに由来する陰窩分離および代表的な画像の概要を示す。ユーザーは、孤立した納骨堂は無菌状態で培養されていることを念頭に置く必要がありますので、正しい解剖と結腸の洗浄が優先事項です。図 1は、crypt 分離時の主要な手順を示しています。孤立した納骨堂(図2A)がカウントされ、濃縮され(図2B)、5つのcrypts/μLの濃度を得るようになりました。クリプトの濃縮調製後、細胞は所望の形式(培養皿、膜挿入物またはチャンバースライド)でめっきされ、実験の必要性に応じて適切な培地でインキュベートされる。図3は、48ウェルプレートにおける培養24時間及び48時間後の培養進行を示す。細胞は所望の合流に達するまでインキュベートされる。この方法の可能な用途を例示するために、我々は48ウェルプレートウェルが合流に達することを許可し、傷傷アッセイを行うことを進めた。図4は、2Dコロノイド単層と同じ創傷24時間後に作成されたスクラッチ(図4A)を示す(図4B)。文化がまだ健康で実行可能であり、創傷修復があることは明らかです。差別化された単層を生成するために、メディアはLWRNから分化媒体に変更される。分化は、高いTEER値(図5A)、ISCマーカーの減少((ロイシンリッチ含有Gタンパク質共役受容体5(Lgr5)およびアカエテスクート2(Ascl2))の減少)および分化マーカーの増加(Ascl2)によって達成される(図5A)。(アラニルアミノペプチダーゼ(アンペプ)、ムチン2(Muc2)、リゾザイム1(Lyz1)、スクロースイソマルターゼ(シス)、クロモグラニンA(Chga))(図5B,C)PCR法。CDX2およびKRT20のような他のマーカーもこのパネルに含めることができる。mRNA発現レベルに加えて、分化条件で成長した2Dコロノイドにおける分化上皮細胞のサブタイプの出現も免疫蛍光(Muc2およびChga;図 5D)。
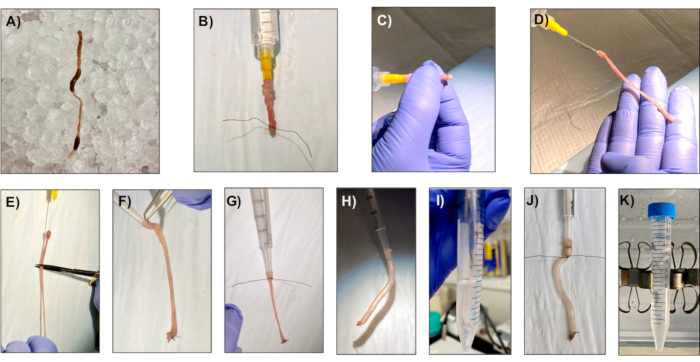
図1: 健康な単層生成のためのサンプル調製 サンプル調製は、健康的な単層の生成に不可欠です。この図では、分離プロセスの主要な手順を示し、読者が簡単に処理できるようにします。コロンはマウスから切除され、毛皮の残り物がないことを確認します。慎重にあなたが結腸を穿穿しないことを確認する便を削除します。;これは、結腸が空気を保持し、膨張し、膨張することができる必要があるので、非常に重要です。 この図の大きなバージョンを表示するには、ここをクリックしてください。
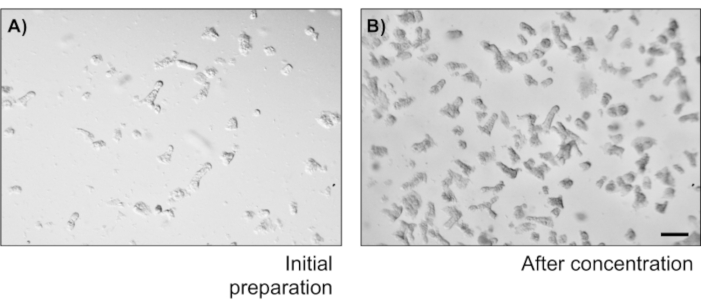
図2:暗号分離数と濃度(A)コロンソーセージを振った後の結腸嚢画像は20 μLのドロップのフィールドを示しています。(B)5つの暗号/μLを得るためにCrypt濃度を測定するスケールバー:1mm。この図のより大きなバージョンを見るにはここをクリックしてください。
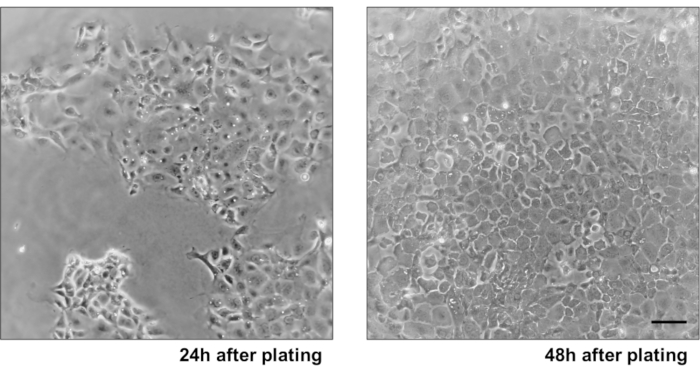
図3:一次IEC単層成長(A)24時間後のめっきおよび細胞デブリの除去後の2D IEC単層。(B)コンフルエント2D IECモノレイヤー48時間後メッキ。スケールバー:10 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
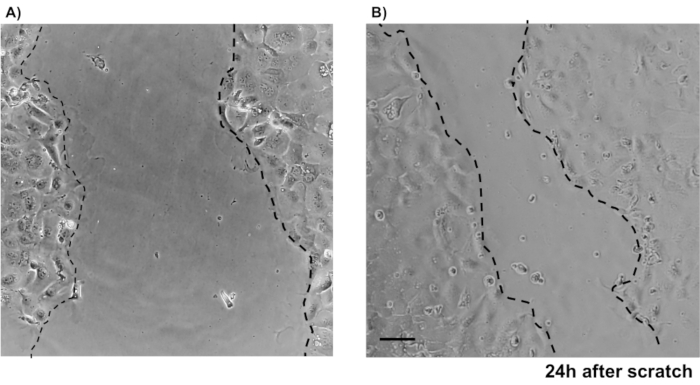
図4:マウス原発IECを用いた傷創傷アッセイ 上皮結腸単層で傷を負った後の創傷治癒を示す画像。スケールバー:5 μm. この図の大きなバージョンを表示するには、ここをクリックしてください。
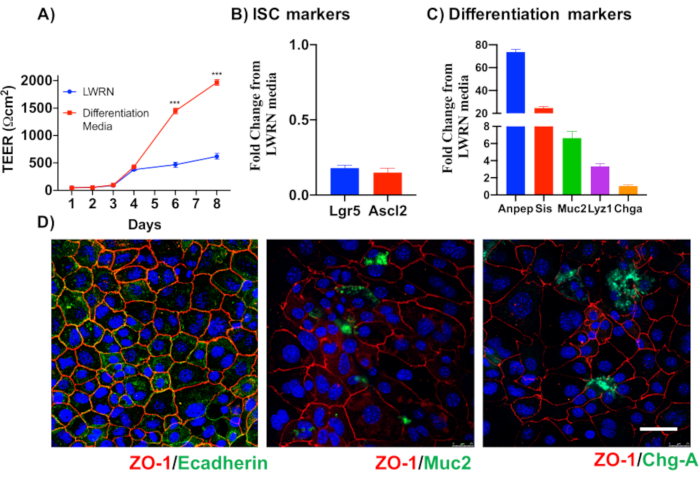
図5:上皮結腸単層の分化(A)分化培地は、TEERが示す緊密な上皮障壁を作り出す。分化媒体は、(B)幹細胞マーカーのmRNA発現の低下および(C)分化マーカーのアップレギュレーションを引き起こす。(D)Muc2やクロモグラニン-Aなどの特殊分化された上皮細胞のマーカーも、直接2Dコロノイドの免疫蛍光を介して検出することができる。スケールバー:5 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
当社のプロトコルは、直接プライマリ2D IECモノレイヤーを生成するための高速で再現性の高い信頼性の高い方法を提供します。コロン上皮単層を生成するために以前に公開されたプロトコルと比較して、私たちのプロトコルの主な違いの1つは、納骨堂を解放するために小片で結腸を切断しないことです。その代わりに、化学力と機械的力の組み合わせによって腸上皮と間葉13 を分離し、非常にきれいな調製物で陰窩を放出するプロトコルを適応させ、研究者に一次培養を生成するための理想的な材料を提供した。我々の分離法は、3Dエンタイドおよびコロノイドを生成するためにも使用することができる。試験を行うたびに、めっきされる暗号の数を正規化するために、毎回 crypt カウントを行うことが重要です。コロンソーセージターゴール、分離速度、ユーザーの専門知識などの変数は、隔離された納骨堂の数に影響を与える可能性があります。プロトコルで言及されている推奨されためっき暗号濃度は出発点ですが、ユーザー主導の変数を考慮するすべてのユーザーはそれを最適化する必要があります。私たちは、8〜20週間の範囲の雄と女性のWTマウスでこの技術を使用しており、理論的には若いマウスから分離されたクリプトは生き残る可能性が高く、細胞生存に大きな違いは見られていません。納骨堂は、表面に付着して生き残るほんの一部の割合だけとして、過剰にめっきされます。メッキの1日後に50%の合流を持つのに十分な納骨堂があるが、死にかけている納骨堂が細胞毒性効果を持つあまりにも多くの納骨堂がないバランスが目標です。LWRN培地は、死んだ納骨堂や破片を排除するためにめっきの24時間後に慎重に取り除かなければならない、これはすでに単層として成長している細胞を剥離することを避けるために慎重に行われなければならない。
LWRN培地を最初に除去した後、ユーザーは、実験条件が幹細胞に近いままの一次IEC単層を必要とするか、または単層の分化が望ましい場合に、分化培地に置き換える必要があるかどうかを決定する必要があります。このプロトコルの最も重要な要素は、分離プロセス中にコロンの整合性を保証することです。破裂が発生した場合、ソーセージを短くして損傷した領域を排除することができます。EDTAにソーセージを入れる前に、結び目ができるだけタイトであることを確認してください。EDTAインキュベーション後にソーセージが収縮した場合、プロトコルは、全体的な納骨収量にほとんどまたは全く影響を及ぼさないと継続することができる。リピートシリンジが使用できない場合、通常のシリンジに取り付けられた通常のマイクロピペットチップをインフレとデフレのプロセスにも使用できます。また、細胞回収液が利用できない場合、インフレ・デフレのステップはEDTA(2mM小腸、50mM結腸)で行うことができますが、この置換は推奨されません。合流性が必要ない場合、納骨堂はコラーゲンのみでコーティングされたプレートやコーティングされていないプレートでも成長する可能性があります。コーティングされていないプレートのみを使用する場合は、他の選択肢はありませんが、細胞はコラーゲンコーティングされたプレートのように健康に成長しません。培養の健康と安定性に関しては、プラスチックでメッキされた単層は4〜5日間健康であり、トランスウェルでメッキされた単層は最大8日間運ぶことができます。
この方法の主な制限の1つは、上皮結腸単層を成長させるために必要な細胞培地である。LWRN細胞はATCCで利用可能ですが、LWRNコンディショニングされた培地生成は労働集約的であり、Wnt活性を決定するために蛍光分光計へのアクセスを必要とします。分化媒体は、使用前に新鮮に添加される試薬の数を必要とし、それは退屈なプロセスになります。最後に、これらの試薬のほとんどは高価であり、速いペースで試薬を燃やすのは簡単です。研究室が以前の腸原発細胞培養なしでこの技術を確立することを望むならば、経験を持つ協力者/大学を見つけ、そのメンバーの1人を訓練することを強くお勧めします。
3D培養の維持は、基質膜マトリックス培地のコストとオルガノイド培養に必要な多数の調整されたメディアのために高価である可能性がありますが、マウスの数を減らし、生成された構造を何度も継ぐことができるという利点があります。エンタノイド(小腸由来)は比較的容易に分離し、維持し、大腸は、より繊細であり、より遅いペースで成長し、より限られた通過容量を有する。3Dコロノイドからの単層生成は、これらの種類の実験に時間とコストがかかる3D構造の不均衡な量を必要とします。反対に、直接上皮結腸単層の準備は速く、結果を得るための迅速な方法である。1つの結腸準備は、メッキ後2〜3日後に75cm2(10〜15mLのコンフルエント領域を生成し、1回交換)することができます(この領域は、マトリゲルのほぼ6mLと250mL以上のコンディションメディアを意味する3Dコロノイドの144ウェルを必要とします)。培地の低消費、細胞培養の低コストの維持および機能試験および高速下流処理を行う能力は、上皮結腸単層の大きな利点である。
このプロトコルは、細胞接着、極性、分化などの領域における腸上皮細胞生物学の研究において貴重なツールです。遺伝子組み換えマウス(ノックアウト、過剰発現、レポーター)から一次細胞培養を生成する利点を与える。原発性腸上皮単層は、異なる細胞タイプの透過性、バリアおよび経上皮移動の研究を可能にする(トランスウェルでメッキされたとき)有端およびバソラショナル表面への容易なアクセスを可能にする。最後に、このモデルは、宿主病原体相互作用、上皮損傷および修復および創薬などの異なる分野で有用であり得る。
開示事項
著者は利害の対立を持っていません。
謝辞
この作品は、クローン・大腸炎財団キャリア開発賞(544599、MQ)とNIH助成金(DK055679、DK089763、DK059888、AN)によって支えられました。ミシガン医科トランスレーショナルティッシュモデリング研究所の継続的な支援と試薬とプロトコルへのアクセスに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| Antibiotic Antimycotic solution | Corning | 30-004CI | |
| B27 supplement (50X) | Gibco | 12587-010 | |
| Cell Recovery Solution | Corning | 354253 | |
| Collagen from human placenta (type IV) | Sigma-Aldrich | C5533 | |
| D-Sorbitol | Sigma | 85529-250G | |
| D-Sucrose | Fisher Scientific | BP220-1 | |
| Dulbecco’s phosphate buffered saline, with Ca2+ and Mg2+ (DPBS) | Corning | 21-030-CV | |
| Epithelial Volt/Ohm meter | World Precision Instruments | 0-10KΩ with STX2 (EVOM2) | |
| Ethylenediamine tetraacetic acid (EDTA) | Lonza | 51201 | |
| Fetal Bovine Serum (FBS) | Corning | 35-016-CV | |
| Firefly Luciferase assay | Biotium | 30085-2 | |
| Geneticin | Gibco | 10131-035 | |
| GlutaMAX (100X) | Gibco | 35050-061 | |
| HEPES (1M) | Corning | 25060CI | |
| Human recombinant EGF | R&D systems | 236-EG | Stock Concentration: 500µg/mL |
| Human recombinant Wnt-3A | R&D systems | W3a-H-005 | |
| Hygromycin B | Invitrogen | 10687010 | |
| LWRN cells | ATCC | CRL-3276 | |
| Molecular grade water | Corning | 46-000-CV | |
| N2 supplement (100X) | Gibco | 17502-048 | |
| N-acetyl-L-cysteine | Sigma-Aldrich | A9165-5G | Stock Concentration: 500mM |
| Noggin | Conditioned media | - | |
| Nunc Lab-Tek Chamber slide system | Sigma-Aldrich | C7182-1PAK | |
| Pencillin-Streptomycin (10,000U/mL) | Corning | 30002CI | |
| Phospahte buffered saline, Ca2+ and Mg2+ free (PBS) | Corning | 21-040-CV | |
| Plastic 20G feeding tube | Fisher Scientific | 50-810-46 | |
| rh-laminin-521 | Gibco | A29248 | Stock concentration: 100µg/mL |
| Roboz Surgical 4-0 Silk Black Braided 100YD | Fisher Scientific | NC9452680 | |
| TOPflash HEK293 cells | ATCC | CRL-3249 | |
| Transwell Permeable supports (0.4µm) | Corning | 3470 |
参考文献
- Quiros, M., Nusrat, A. Contribution of wound-associated cells and mediators in orchestrating gastrointestinal mucosal wound repair. Annual Reviews in Physiology. 81, 189-209 (2019).
- Blutt, S. E., et al. Use of organoids to study regenerative responses to intestinal damage. American Journal of Physiology-Gastrointestinal and Liver Physiology. 317 (6), 845-852 (2019).
- Zhang, M., Liu, Y., Chen, Y. G. Generation of 3D human gastrointestinal organoids: principle and applications. Cell Regeneration. 9 (1), 6 (2020).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Zachos, N. C., et al. Human enteroids/colonoids and intestinal organoids functionally recapitulate normal intestinal physiology and pathophysiology. Journal of Biological Chemistry. 291 (8), 3759-3766 (2016).
- Kozuka, K., et al. Development and characterization of a human and mouse intestinal epithelial cell monolayer platform. Stem Cell Reports. 9 (6), 1976-1990 (2017).
- In, J. G., Foulke-Abel, J., Clarke, E., Kovbasnjuk, O. Human colonoid monolayers to study interactions between pathogens, commensals, and host intestinal epithelium. Journal of Visualized Experiments. (146), e59357 (2019).
- Cardenas, D., et al. Two- and three-dimensional bioengineered human intestinal tissue models for cryptosporidium. Methods in Molecular Biology. 2052, 373-402 (2020).
- Moon, C., VanDussen, K. L., Miyoshi, H., Stappenbeck, T. S. Development of a primary mouse intestinal epithelial cell monolayer culture system to evaluate factors that modulate IgA transcytosis. Mucosal Immunology. 7 (4), 818-828 (2014).
- VanDussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. 64 (6), 911-920 (2015).
- Zou, W. Y., et al. Human intestinal enteroids: New models to study gastrointestinal virus infections. Methods in Molecular Biology. 1576, 229-247 (2019).
- Heijmans, J., et al. ER stress causes rapid loss of intestinal epithelial stemness through activation of the unfolded protein response. Cell Reports. 3 (4), 1128-1139 (2013).
- Nik, A. M., Carlsson, P. Separation of intact intestinal epithelium from mesenchyme. Biotechniques. 55 (1), 42-44 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved