Method Article
D1S80ローカスを用いたDNAフィンガープリントのラボクラスへの応用
要約
ここでは、上皮細胞DNAからVNTR遺伝子座 D1S80 を増幅することによりDNAフィンガープリントプロファイルを生成する簡単なプロトコルについて説明する。
要約
生物科学では、DNAフィンガープリントは、父性検査、法医学的応用、系統学的研究に広く使用されています。ここでは、学部の研究室の授業の文脈でタンデム反復(VNTR)の可変数(VNTR)分析によって個人をジェノタイピングするための信頼性と堅牢な方法を説明します。ヒト D1S80 VNTR遺伝子座は、反復配列の数の変動に基づいて、このプロトコルで非常に多形マーカーとして使用されます。
この簡単なプロトコルは、教師のための有用な情報と実用的な実験室のクラスでのDNAフィンガープリントの実装を伝えます。本研究室での研究では、DNA抽出後にPCR増幅を行い 、D1S80 VNTR遺伝子座の遺伝的変異を決定します。PCR産物のフラグメントサイズの違いはアガロースゲル電気泳動によって可視化されます。フラグメントサイズと繰り返し数は、DNAサイズ標準のサイズと移動距離の線形回帰に基づいて計算されます。
このガイドに従って、受講者は次のことが可能になります。
• 頬粘膜上皮細胞からDNAを採取し、抽出する
• PCR実験を行い、様々な反応成分の機能を理解する
• アガロースゲル電気泳動によるアンプリコンの解析と結果の解釈
• DNAフィンガープリントにおけるVNTRの使用と生物科学への応用を理解する
概要
分子フィンガープリントは、DNAフィンガープリントとも呼ばれ、1984年にレスター大学の遺伝学科で働いていたときにアレック・ジェフリーズ卿によって導入されました。これは、個人間で異なるヒトゲノムの0.1%に基づいており、約300万の変異体で構成されています。遺伝子型のこれらのユニークな違いは、個人間の差別化を可能にし、したがって、単一体性双生児を除く遺伝的指紋として機能することができる。その結果、DNAフィンガープリントは、例えば父性検査や集団多様性研究で適用される異なる個体の関連度の推定に使用される。研究室の授業では、DNAフィンガープリントとアリール周波数の概念を伝えることを目指しました。ここで説明する方法は 、D1S80 遺伝子座におけるタンデム反復数(VNTR)を解析することにより、遺伝的フィンガープリントの信頼性と堅牢性の高い方法を示しています。この方法は、バッカル粘膜上皮細胞からのDNAの抽出および後のポリメラーゼ連鎖反応(PCR)を含み 、D1S80 遺伝子座を増幅し、続いてアガロースゲル上の断片長差の可視化を行う。
D1S80 VNTRの小型衛星の軌跡は非常に可変的であり、染色体1(1p36-p35)のテロメリック領域に位置する。1990年にカルザイと同僚によって16bpのコア反復ユニットを有する軌跡として同定され、記述され、1つのユニット2によって異なる対立遺伝子の分離を可能にした。さらに、D1S80は、約7.77 x10-53の突然変異率を有する高い変動を示す。D1S80は、ヘテロ接合性4,5の高い程度を有する(例えば、白人6人の場合は80.8%のヘテロ接合性、アフリカ系アメリカ人のヘテロ接合性は最大87%である7)。さらに、D1S80遺伝子座はほとんどの集団で多形性であり、通常は14〜41を繰り返す15以上の異なる対立遺伝子を有する。D1S80対立の頻度は集団によって異なる。24の反復ユニット(アリール24)を有するアレスはヨーロッパとアジアの集団で最も頻繁であるが、アアレ21はアフリカの集団4、7、8、9、10で最も一般的である。したがって、アレル頻度分布は、異なるヒト集団の診断であり、関連度の推定(例えば、父性検定)のために考慮される必要がある。
D1S80 VNTR遺伝子座のPCRベースの増幅は、法医学、父性検査、疾患分析および集団多様性研究11、12、13、14において非常に有用な方法であった。今日の法医学ではVNtRの使用は短いタンデム反復によって置き換えられましたが、D1S80 VNTR遺伝子座は、集団4、8、9、11の間の起源と遺伝的関係の決定に広く使用されています。さらに、実用的な実験室クラス15、16でDNAフィンガープリントを教えるためによく使用されます。ここで説明する方法は、学部の研究室の授業で非常に高い成功率を持つ堅牢で費用対効果が高く、使いやすい方法を表しています。本稿の目的は、ヒトD1S80ミニサテライト軌跡の分子解析のワークフローの概要を、頬粘膜上皮細胞から提供することです。これには、技術のデモンストレーション、簡略化されたプロトコル、および以前に公開された作品2、17で説明した実用的な提案が含まれています。
プロトコル
注:このプロトコルは、ジェノティピックプロファイルが遺伝的関係に関する洞察を与えるため、学生またはそれぞれの法的保護者がこのプロトコルの実施に同意した場合にのみ使用されます。DNAフィンガープリントは、主に集団研究や法医学に適用される一般的な分子生物学方法です。したがって、汚染リスクを可能な限り低く保つために注意を払う必要があります。外部ソースまたはDNasesからのDNAによるサンプルの汚染を避けるために、手袋を着用し、器具を十分に洗浄または滅菌し、使用前にフィルター滅菌またはオートクレーブする必要があります。
1. 頬粘膜上皮細胞の収穫
注意:唾液や上皮細胞を使用すると、感染症の伝染につながる可能性があります。したがって、標準および送信ベースの予防措置(例えば、適切な個人用保護具の使用)を適用する必要があります。
注:インストラクターによって提供され、下流の処理手順に含まれる肯定的なコントロール(例えば、インストラクターによって抽出されたDNA)を含めます。
- 標本採取前に歯を食べたり磨いたりした後、少なくとも1時間待ちます。
- 空の無菌2.0 mLマイクロ遠心チューブにラベルを付けます。
- パッケージから1つの無菌頬綿棒を取り出し、頬の内側を30〜40回または30〜40秒間激しくこすり、頬粘膜上皮細胞を収穫します。
- コレクションの先端を以前にラベル付けされた無菌マイクロ遠心分離チューブに入れ、手または滅菌はさみを使用して、端を越えて伸びるプラスチックの長さを断ち切ります。
- キャップをチューブの上にしっかりと置き、コレクションの綿棒を内側に密封します。
ヒト細胞からのゲノムDNAの抽出
- 抽出前に、サンプル溶出のためにサーマルミキサーまたは加熱ブロックを65°Cに設定します。
注意: 使用される化学物質の中には、危険な化学物質が分類されるものもあります。安全データシートをよく読み、取扱う前に適切な安全対策を講じてください。- すべての必要なバッファーおよび溶液(溶解液、8 M酢酸カリウム、2-プロパノール、70%エタノールおよび溶出バッファー)を濾過またはオートクレーブして調製し、滅菌します。
注:すべての遠心段階は、指定されていない限り、室温(20〜30°C)で行う必要があります。
- すべての必要なバッファーおよび溶液(溶解液、8 M酢酸カリウム、2-プロパノール、70%エタノールおよび溶出バッファー)を濾過またはオートクレーブして調製し、滅菌します。
- 500 μL の溶解液(50 mM Tris/HCl、pH 8.0;10 mM エチレンジアミンテトラ酢酸(EDTA)、2%ドデシル硫酸ナトリウム(SDS))をバッカス綿棒に加え、サンプルが溶解溶液に完全に浸漬されていることを確認します。
- 渦は少なくとも5sのために精力的に。
- サーマルミキサーでサンプルを65°Cで10分間インキュベートします。
- インキュベーション中に5sのパルス渦によってサンプルを3〜4回混合する。
- リシスバッファーから綿棒を取り出し、綿棒をチューブの内側に押し付けて最大サンプル量を得る。
- 8 M酢酸カリウムの100 μLを、細胞を分解します。
- 白い沈殿物が出るまでチューブを反転して十分に混ぜます。
- 室温で5分間インキュベートします。
- サンプルを18,000 x gで5分間遠心分離します。
- 450 μLの上清を清潔で無菌の1.5 mLマイクロ遠心チューブに移します。
- 450 μLの2-プロパノールを加え、チューブを反転(DNAの沈殿)して十分に混ぜます。
- 室温で5分間インキュベートします。
- 18,000 x gで 5 分間の遠心分離機 .
- 上清を捨て、きれいなペーパータオルでチューブを反転させてペレットを乾燥させ、クロスコンタミネーションを避けます。
- 65°Cで5分間、加熱ブロックでDNAをインキュベートし、ペレットを完全に乾燥させます。
- DNAを洗浄するには、500 μLの70%エタノールを加えます。
- 18,000 x gで1分間の遠心分離機。
- 上清を捨て、きれいなペーパータオルでチューブを反転させてペレットを乾燥させます。
- 30 μL のリサスペンション バッファー(10 mM トリス/HCl pH 8.0、1 mM EDTA)をペレットに加えます。
- DNasesを不活性化するために、65°CでDNAを65°Cで10分間インキュベートします。
PCRを用いた D1S80 VNTR遺伝子座の増幅
注:使用されるサンプルの数を記録し、必要なプラスチックやその他の材料を収集する前に、必要な試薬とそのボリュームでワークシートを準備します。PCR に使用する滅菌チューブ/ストリップ/プレートにサンプル番号を付けてラベルを付けます。PCRを検証するために、DNAの代わりにH2Oを用いた陰性コントロールと陽性対照(例えば、インストラクターが提供するDNAを使用)を含める必要があります。
- 10 μLの5x PCR反応バッファー(15 mM MgCl2を含む)、デオキシリボヌクレオチド三リン酸(dNtPs)(10 mM)の1 μL、各プライマーpMCT118-fおよびpMCT118-r(前方- 5'-GAACTGGCcCCAACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACAC 逆 - 5'-GTCTGTTGGAGATGCACGTGCGCTTGC-3')Kasaiらによると、超純粋なH2Oの23.8 μL、およびTaq DNAポリメラーゼの0.2 μL(5 U/μL)。
注:プライマーpMCT118-f/pMCT118-rは 、D1S80 VNTR領域の側面領域に設計され、全遺伝子座を増幅しました。 - PCR チューブ/ストリップ/プレートに、使用するサンプル番号を付けます。
- マスターミックスのアリコート45μLは、各標識PCRサンプルチューブまたはウェルに対する。
- 各PCRチューブ/プレートウェルのマスターミックスに5μLのDNAテンプレートを追加して、合計体積50μLを取得します。
- DNAの代わりに超純粋なH2Oを用いて、テンプレートなし制御(NTC)を含める。
- PCRチューブ/ストリップまたはシールプレートを閉じて混ぜます。
- 卓上遠心分離機を使用して、PCRチューブ/ストリップ/プレートを20s用に遠心分離します。
注:このプロトコルで与えられたPCR条件は、DNAポリメラーゼおよび使用されるPCRサーマルサイクラーを使用して最適化されました。一般に、PCR条件はDNAポリメラーゼに適合する必要があります。Taq DNAポリメラーゼの標準延長時間は1分/kbです。 - サンプルチューブ/ストリップ/プレートをサーモサイクラーに入れ、次の条件(DNAポリメラーゼ延長時間)を使用して反応をインキュベートします:95 °Cの1サイクル(2分間)。94°Cの25サイクル15s、60°C(15s)、72°C(30s)72°Cの1サイクル10分間。
- プログラムが完了したら、サーモサイクラーから製品を取り出し、電気泳動まで一晩4°Cまたは-20 °Cで保管してください。
4. PCR産物のアガロースゲル電気泳動
- 1.5%のアガロースゲルを調製します。
- アガロース粉末1.5gを使用し、フラスコに1xトリス酢酸EDTA(TAE)緩衝液100mLと混合します。
- 電子レンジ(600W)で約1.5〜2分間加熱します。内容物を旋回し、必要に応じて再び加熱し、アガロースを完全に溶解する。少し冷やして、アガロースにペクグリーンの2μLを加えます。
- すべてのサンプルに十分なウェルを備えた櫛を使用してゲルをフォームに注ぎ、少なくとも1つの分子量マーカーを追加します。
注意: 煮沸遅滞が発生する場合があります。まだ溶けていないアガロースを再懸濁する際には、フラスコを慎重に振ります。
注:PeqGreenは核酸の検出のための無毒な染料です。これは、二本鎖DNA(dsDNA)および一本鎖DNA(ssDNA)、RNAの染色に適用できます。感度は臭化エチジウムに匹敵する。
- PCR製品を4°Cから取り出し、遠心分離機を約10sで取り除きます。
- ゲルのウェルを10 μLサンプルでロードします。ゲルを過負荷にしないでください。
注:DNAポリメラーゼバッファーには、サンプル密度を高める化合物も含まれており、サンプルは負荷染料を必要とせずにゲルに直接ロードできます。これにより、サンプルが井戸に沈み、染料はDNAサンプルがどこまで移行したかを追跡するのに役立ちます。- 横側のウェルに分子量標準を加える(好ましくは50bp分子量標準)。
注: アガロースゲル電気泳動を繰り返す必要がある場合には、残りの PCR サンプルを -20 °C に保存してください。
- 横側のウェルに分子量標準を加える(好ましくは50bp分子量標準)。
- 1x TAEランニングバッファで約40分間、または約50bpで移動する黄色の色素前面がゲルの下端に達するまで、ゲルを150V(定数)で実行します。
- 青色光または紫外線(UV)光を適用しながらゲルを画像化し、フラグメント長分析のために画像を記録します。
注意:UV光は目や皮膚に損傷を与える可能性があります。UVライトボックスを使用する場合は、常に防護服とUV安全メガネを着用してください。 - 機関の危険物ポリシーに従ってゲルを廃棄してください。
5. フラグメント長の結果の分析
注: 線形回帰分析を使用して、フラグメントの長さを推定します。
- D1S80 PCRフラグメントのサイズを変更するには、50 bpの分子量標準レーン上のゲル写真に定規を置き、定規の上部がサンプルがロードされたウェルの底に並ぶ(図1)。
注:分子量標準(50bp分子量標準)の線形回帰式を計算するために、スプレッドシートプログラムを使用しました。 - 表計算プログラムを用いて、50bpの分子量標準の各バンドのウェルからの距離(例えば、cm単位)を記録する(図2)。
- 50bp分子量標準の各フラグメントサイズのログ(例えば、ベース10)を決定し、そのログ値を表に入力する(図2)。
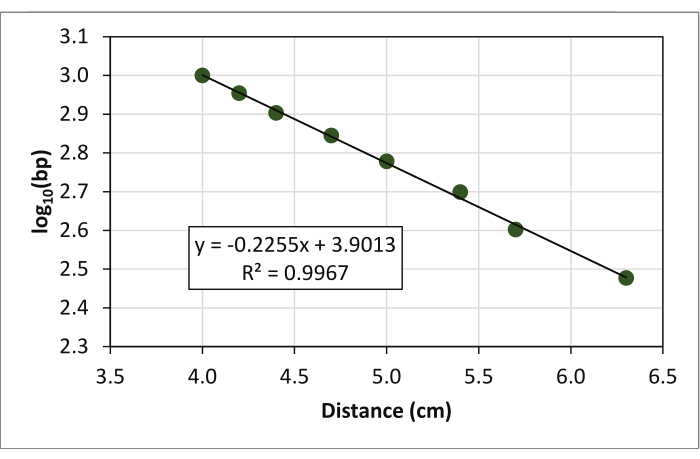
- 各データ点を、散乱図を用いて、縦軸(y軸)上のバンドサイズの対数の対数と、ゲルの上端から、水平軸(x軸)上の分子量標準の各バンドまでの測定実行距離をグラフにプロットする(図3)。
- 近似曲線(線形回帰線)を適合させ、回帰式(y = ax + b)とR2値をグラフに表示します(図4)。
- 各D1S80アンプリコンの移動距離(例えば、cm単位)を測定する(図5)。
- 回帰式を使用して各 D1S80 アンプリコンのサイズを推定する: y = ax + b
ここで y = フラグメントサイズのログ
a = ラインの傾き (ポイント 5 で計算)
x = ウェルからの距離 (cm)
b = 回帰直線が Y 軸を切り取る点(ポイント 5 で計算)
注: y 値はフラグメントサイズのログを表すため、D1S80アンプリコンの bp 単位のフラグメントサイズを取得するには、アンチログ(10y)を計算する必要があります。
6. 試験された個人の対立元素における反復単位数の推定
注: D1S80 リピートユニットの長さは 16 bp です。 D1S80 の最小の既知のアレスは14の繰り返しを有する。ここで説明するアンプリコンスキームは、最終的なサイズに余分な145 bpを加算する隣接領域を持つアンプリコンを生成します。
- 表 1を使用して、各 PCR フラグメントに含まれる反復単位の数を推定します。線形回帰を使用して外挿されたサイズは、特定のアリールの8 bp以内にする必要があります。
- 各試験個体の遺伝子型を、アリール反復サイズ数の組み合わせとして記録する。
結果
上記プロトコルを用いて、スワブサンプリングにより採取した頬粘膜上皮細胞から抽出したヒトゲノムDNAに対して D1S80 VNTRマーカー解析を行った(図6)。PCRを用いた増幅に続いて 、D1S80 アンプリコンを含むアガロースゲルの典型的な表現を 図1に示す。レーン1は、50bp分子量標準を示す。分子量基準の横に、8つの学生サンプルからのPCR産物が可視化されます。レーン10は、テンプレートDNAの代わりに水が使用されたNTCを示す。分析されたサンプルのほとんどは 、D1S80 遺伝子座の個体ヘテロ接合を表す2つのバンドを明確に表示する。レーン2およびレーン9は 、D1S80 軌跡に対する個人ホモ接合体を表す単一のバンドを示す。レーン5は、他のバンドと比較してはるかに広いあいまいなシングルバンドを示しています。これは、2つの D1S80 対立が1つの繰り返しユニットで異なる結果である可能性があります。さらなる分析のために、レーン5におけるサンプルは、ホモ接合体個体を表す単一のバンドとみなされる。
検証済みPCR産物に対して行われた下流ゲル電気泳動フラグメント解析は、異なる学生サンプルのD1S80 VNTR遺伝子座のサイズコールに使用した。PCR分析により得られるアンプリコンサイズの解釈は、使用される分子量基準に依存する。分子量標準の各バンドのウェルからの距離を測定し(図1)記録した(図2)。サイズと移動距離に基づいて、個々のバンドのサイズを線形回帰分析を使用して計算することができます。このログ(基数10)は、学生サンプル(図5)の各バンドについて決定し、それぞれのアンチログは各アンプリコンのbp数を表す。リピート単位数は、得られたアンプリコンサイズに従って計算することができる(表2)。
各学生サンプルについて、アンプリコンサイズを線形回帰で計算し、表2に示すように各バンドを特定のアリールに簡単に割り当てることができる。D1S80の集合体サイズに関する情報は、学部生の小集団の中でアリール周波数を決定するために使用することができます。28リピートアリールは、この繰り返しアレーレ(個体1および4)のための2人のホモ接合個人のために学生の間で最も頻繁である。2番目に頻繁なアレスは、ホモ接合体個体8およびヘテロ接合体個体6によって運ばれる18反復アリールである。低周波対立体は、それぞれ個体6、5、3に1回しか見つからない21、26、30回の反復対立体である。小学生集団のD1S80 VNTR遺伝子座のアレール周波数パターンは、より大きな人口のアレール頻度、例えば、異なる大陸4、7、8、9、10から発生する集団と比較することができる。
学生の間で、個人2と3は24反復アレーレを共有し、個人2と7は20反復アレーレを共有し、個人5と7は23反復アレーレを共有しています。興味深いことに、2人の D1S80 ホモ接合体(個1および4)は28反復アレーレを共有する。2人の個人間で対立感を一致させることは、潜在的な関連性を示すことができます。しかし、共有対立者も偶然に発生する可能性があります。したがって、2人の個人間の対立差の可能性を判断することが重要です。尤度は、一般集団における個々の対立アレスの対立頻度に依存し、統計アプローチは、ベイズアプローチのようなVNTRマーカー分析に統計的重みを付けるために採用されるべきである。要約すると、提示されたフィンガープリント法は、DNAフィンガープリントにおけるVTRの使用と生物科学への応用を教えるために実践的なクラスの実践で利用することができる。
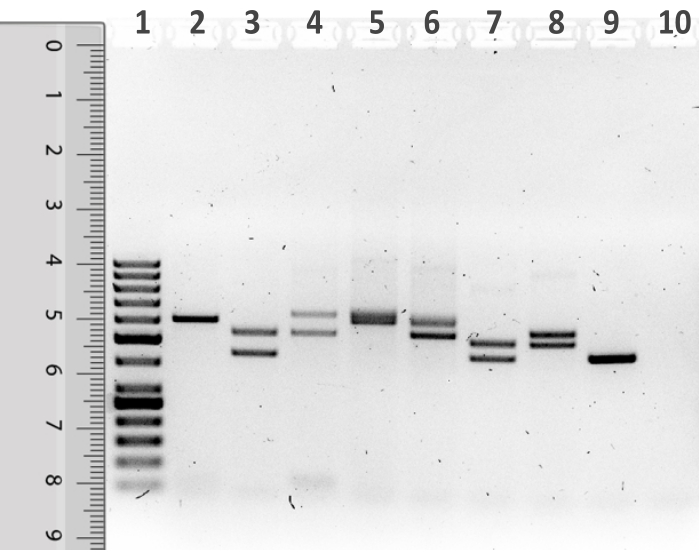
図1:50bp分子量標準レーンの横に定規を置いた D1S80 増幅産物の電気泳動後のアガロースゲルの表現 レーン1は50bp分子量標準を含み、レーン2~9にはPCR反応生成物が含まれています。レーン 10 には、テンプレートなしコントロール (NTC) が含まれています。 この図の大きなバージョンを表示するには、ここをクリックしてください。
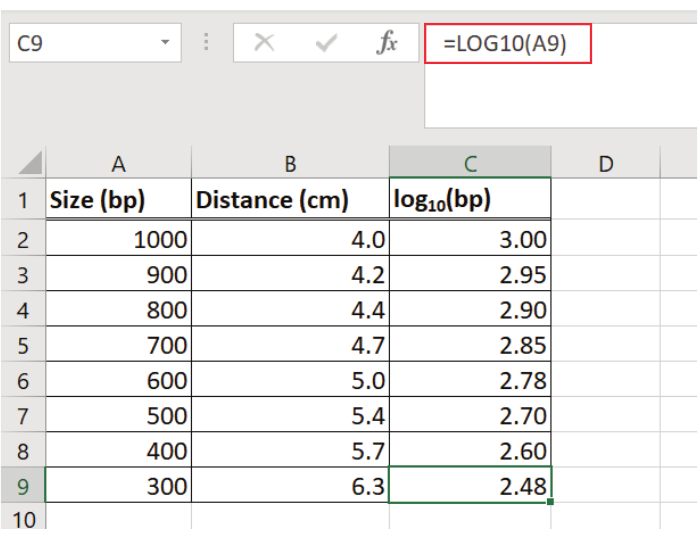
図2:50bp分子量標準の各フラグメントサイズのDNA断片移動距離及び対数の判定 50bp分子量規格の各バンドに対するウェル(cm単位)からの距離が記録され、各フラグメントの対数(基数10)が決定される。値は、表計算プログラムを使用してテーブルに入力されます。 この図の大きなバージョンを表示するには、ここをクリックしてください。
図3:X軸上の分子量標準のDNA断片移動距離を、y軸上の各断片のサイズの対log(基部10)にプロットして生成した散布図。 この図の大きなバージョンを表示するには、ここをクリックしてください。
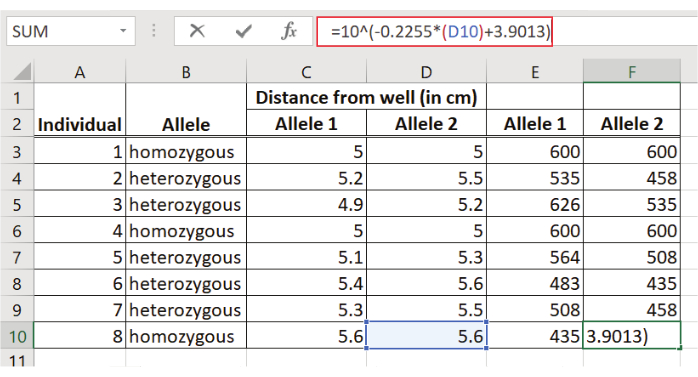
図5: D1S80アンプリコンのサイズの決定各フラグメントのウェルからの距離が回帰式に入力されます。y値のアンチログは、bpでフラグメントサイズを表します。
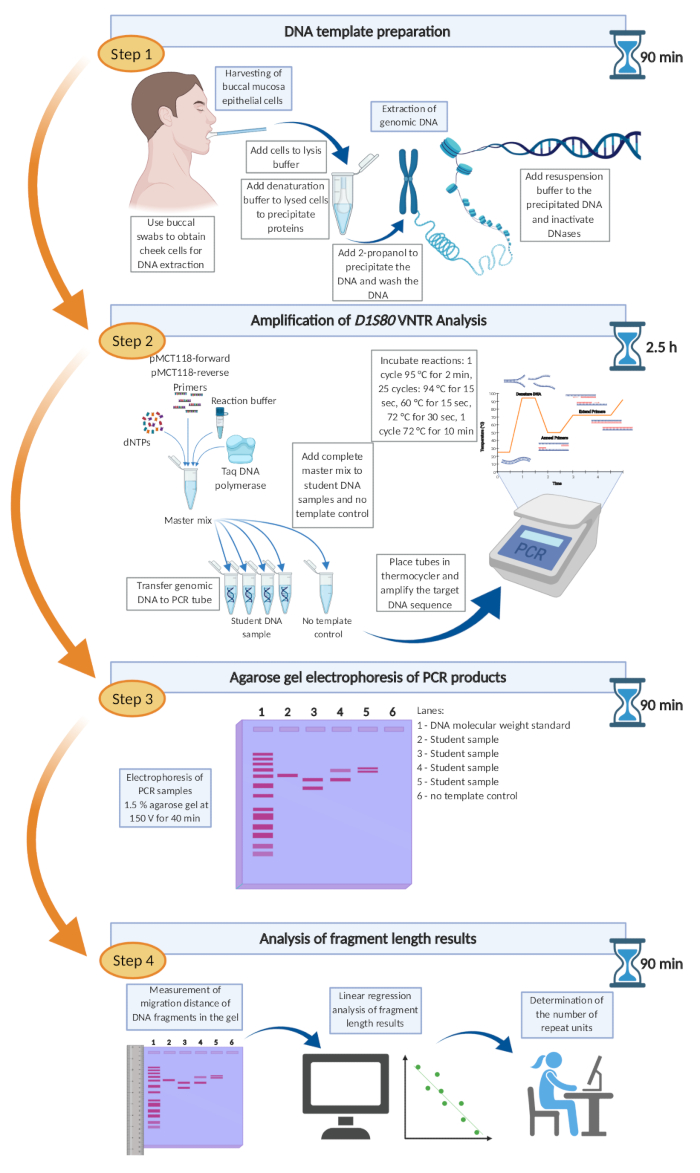
図6: D1S80 VNTR解析の推奨タイムラインとワークフロー ここで提示される D1S80 VNTR分析手順全体を、頬上皮細胞採取からフラグメント長評価まで、単一の作業日以内に完了してもよい。 この図の大きなバージョンを表示するには、ここをクリックしてください。
| アレールサイズ (bp) | 繰り返し回数 |
| 369 | 14 |
| 385 | 15 |
| 401 | 16 |
| 417 | 17 |
| 433 | 18 |
| 449 | 19 |
| 465 | 20 |
| 481 | 21 |
| 497 | 22 |
| 513 | 23 |
| 529 | 24 |
| 545 | 25 |
| 561 | 26 |
| 577 | 27 |
| 593 | 28 |
| 609 | 29 |
| 625 | 30 |
| 641 | 31 |
| 657 | 32 |
| 673 | 33 |
| 689 | 34 |
| 705 | 35 |
| 721 | 36 |
| 737 | 37 |
| 753 | 38 |
| 769 | 39 |
| 785 | 40 |
| 801 | 41 |
表1:各D1S80 VNTR軌跡のアンプリコンサイズ。
| 個体 | 対立遺伝子 | 距離 (cm) | サイズ (bp) | 繰り返し単位数 |
| 1 | ホモ接合 | 5 | 600 | 28 |
| 2 | ヘテロザイグース | 5.2 ;5.5 | 535, 458 | 24, 20 |
| 3 | ヘテロザイグース | 4.9 ;5.2 | 626, 535 | 30, 24 |
| 4 | ホモ接合 | 5 | 600 | 28 |
| 5 | ヘテロザイグース | 5.1 ;5.3 | 564, 508 | 26, 23 |
| 6 | ヘテロザイグース | 5.4 ;5.6 | 483, 435 | 21, 18 |
| 7 | ヘテロザイグース | 5.3 ;5.5 | 508, 458 | 23, 20 |
| 8 | ホモ接合 | 5.6 | 435 | 18 |
表2:テストした異なる個体のアレレ組成物。 リピート単位数は、線形回帰分析により得られるアンプリコンサイズに応じて近似することができる。
ディスカッション
ここでは、学部の実務授業で分子フィンガープリントを実装するための簡単でコスト効率の高い方法について説明しました。
D1S80遺伝子の遺伝子変異をスクリーニングするには、ヒト生物学的サンプル収集とDNA抽出および分析が必要です。人間の生物学的標本の倫理的使用は、プロセス全体を通して確実にすることが不可欠です。サンプル管理は、サンプルおよび関連データ18の正しい使用を保証する包括的な規制フレームワーク内で制御される(例えば、ヒト生物学的物質の使用に同意する)。参加者は、サンプルの使用、遺伝的関係の異常の発見のリスク(関連する個人の場合)、プライバシー保護、および生物学的標本およびデータの将来の保存のための意図について適切に知らされなければなりません。すべての寄付者(学生または同僚)は、自由に同意を与え、理由を与えずに撤退する権利を理解しなければなりません。一般に、この実習クラスを実施する前に、人間のサンプル管理に関するガイドラインや規制を理解しておくことが不可欠です。
学部の研究室のコースで頬粘膜上皮細胞の収集のために、オペレータまたはDNasesからのDNAとDNAサンプルの汚染を避けるために注意する必要があります。ラボコート、手袋、保護メガネ、滅菌綿棒、マイクロ遠心チューブを常に使用することをお勧めします。Buccal綿棒ベースの細胞収穫は、比較的安価で非侵襲的であるため、PCRベースのVNTR分析に適した遺伝物質の収集に便利で費用対効果の高い方法と考えられています。頬の綿棒の他に、唾液は医学研究のための最も一般的な経口サンプリング方法である。頬棒は唾液よりも上皮細胞の割合が高いことが示されており、PCRベースのD1S80 VNTR解析19,20に対してDNAの十分な量および質を提供する際の信頼性が高いことが示されている。さらに、例えば人口多様性研究21で使用すると、自己収集が地理的障害を克服した後に送り出すことができる。
DNAの抽出は、異なる企業からの抽出キットの開発により比較的容易になっています。しかし、これらのキットの使用は限られた財源のために実験室のクラスで適していないかもしれません。ここでは、市販のDNA抽出キットを必要とせずに、ヒトサンプルからDNAを抽出するための簡単で迅速かつコスト効率の高い方法を発表しました。記載したDNA抽出法は、有機溶媒を使用せず、代わりに8M酢酸カリウム溶液を用いて塩濃度を上昇させることにより細胞タンパク質が除去される。この方法はまた、一度に複数のサンプルを処理し、各サンプルのいくつかの遺伝子型分析のための十分なDNAを得ることができます。
PCR は、多くの分子ラボで一般的な手法です。一般的にトラブルフリーですが、他の22で議論されている偽の結果を生み出す反応を複雑にする可能性のある落とし穴があります。ここで示したPCR条件は、テンプレートDNAの品質が悪い面では非常に堅牢に見えましたが、バッカル上皮細胞の収穫不良のためにDNA濃度が極めて低いテンプレートを使用する場合、PCR増幅の欠如は時折観察されました。本研究で用いられたDNAプライマーは、本論文の最後にある資料表に引用されているような、さまざまな企業から注文することができる。DNasesまたはDNAとの汚染を避けるために、DNAプライマーを使用する場合は、特別な注意が必要です。PCR製品は、使用しない場合も冷たく保つ必要があります。
もう一つの重要なステップはアガロースゲル電気泳動である。16bpの1つの繰り返し単位のみによって異なる断片は、ゲル電気泳動中で分離されず、したがって単一のバンドとして現れる。この場合、テストされた D1S80 対立元素の繰り返し単位数の適切な決定は保証できません。したがって、ゲルの実行時間を増やす必要がある一方で電圧を低減する必要があり、ゲル濃度を上げると、単一バンドの分解と分離が向上します。
VNTR遺伝子座のすべての対立遺伝子に完全な反復単位が含まれているわけではないことは言及する価値があります。不完全な反復単位を含む非コンセンサス対立遺伝子(微量変量)は、ほとんどのVNTR遺伝子座で一般的であり、そのサイズは完全な反復単位を有する対立遺伝子のサイズ間に入る。これらの微量変量はアガロースゲル電気泳動によってほとんど検出できない。対照的に、ポリアクリルアミドゲルまたは毛細管電気泳動のような技術は、1〜数個の反復単位または微量変量12、23、24、25、26によって異なる対立アレルを解決することができる。しかし、 後者の技術は、危険な化合物の使用、複雑な準備、機器の不足など多くの欠点があるため、学部の研究室の授業には適していません。フラグメントサイズの決定には、移動したDNA断片の距離を測定する際には特別な注意が必要です。バンドが拡散しすぎて正確に測定できない場合、線形回帰によるD1S80アレスフラグメントサイズの計算が不正確になり、繰り返し単位数の推定が誤る可能性があります。その場合、ゲル条件を最適化した後のアガロースゲル電気泳動の再実行は、ローレンツと同僚22によって先に述べたように推奨される。
ここで提示される D1S80 VNTR分析手順全体を、頬上皮細胞採取からフラグメント長評価まで、単一の作業日で完了してもよい。このプロトコルは、学部の実用的な実験室のクラスに適した堅牢で、コスト効率が良く、使いやすい方法です。
開示事項
著者らは開示する利益相反を持っていません。
謝辞
著者たちは、ケビン・グラハムのナレーションと、この作品のためにサンプルを寄付したすべての参加者に感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | Sarstedt | 72,706 | autoclaved |
| 2 mL microcentrifuge tube | Sarstedt | 7,26,95,500 | autoclaved |
| 2-propanol | Fisher chemical | PI7508/17 | |
| 5x PCR buffer | Promega | M7845 | |
| Acetic acid | Sigma/Merck | A6283-500ML | |
| Agarose | BioBudget | 10-35-1020 | |
| Buccal swabs | BioBudget | 57-BS-05-600 | |
| Centrifuge | Eppendorf | 5430 | |
| Combs | BioRad | ||
| dNTPs (10 mM) | Invitrogen | R0192 | |
| EDTA | Carl Roth | 8043.1 | |
| Ethanol | Honeywell | 32221-2.5L | |
| Gel caster | BioRad | ||
| Gel chamber | BioRad | SubCell GT | |
| Gel Doc XR+ | BioRad | ||
| Geltray | BioRad | SubCell GT | |
| GeneRuler 50 bp DNA Ladder | Thermo Fisher | SM0371 | |
| Go-Taq Polymerase | Promega | M7845 | |
| Heating block | Eppendorf | Thermomixer | 1.5 mL and 2 mL |
| Microwave | Sharp | R-941STW | |
| peqGreen | VWR | 732-3196 | |
| Pipettes | Gilson | 1000 µL, 200 µL, 20 µL, 2 µL | |
| Potassium acetate | Arcos Organics | 217100010 | |
| PowerPac power supply | BioRad | 100-120/220-240V | |
| Primers | Sigma/Merck | ||
| Scale | Kern | PCB 2.5 kg | |
| SDS | Arcos Organics | 218591000 | |
| Shaker | IKA labortechnik | IKA RH basic | |
| Tabletop centrifuge | myFuge | ||
| Thermal Cycler | BioRad | C100 Touch | |
| Tris | VWR | 103156x | |
| Vortex mixer | LMS | VTX-3000L |
参考文献
- Jeffreys, A. J., Wilson, V., Thein, S. L. Hypervariable 'minisatellite' regions in human DNA. Nature. 314 (6006), 67-73 (1985).
- Kasai, K., Nakamura, Y., White, R. Amplification of a variable number of tandem repeats (VNTR) locus (pMCT118) by the polymerase chain reaction (PCR) and its application to forensic science. Journal of Forensic Science. 35 (5), 1196-1200 (1990).
- Balamurugan, K., Tracey, M. L., Heine, U., Maha, G. C., Duncan, G. T. Mutation at the human D1S80 minisatellite locus. The Scientific World Journal. 2012 (917235), (2012).
- Herrera, R. J., Adrien, L. R., Ruiz, L. M., Sanabria, N. Y., Duncan, G. D1S80 single-locus discrimination among African populations. Human Biology. 76 (1), 87-108 (2004).
- Lauritzen, S. L., Mazumder, A. Informativeness of genetic markers for forensic inference - An information theoretic approach. Forensic Science International: Genetics Supplement Series. 1 (1), 652-653 (2008).
- Budowle, B., Chakraborty, R., Giusti, A. M., Eisenberg, A. J., Allen, R. C. Analysis of the VNTR locus D1S80 by the PCR followed by high-resolution PAGE. American Journal of Human Genetics. 48 (1), 137 (1991).
- Budowle, B., et al. D1S80 population data in African Americans, Caucasians, southeastern Hispanics, southwestern Hispanics, and Orientals. Journal of Forensic Science. 40 (1), 38-44 (1995).
- Verbenko, D. A., et al. Polymorphisms at locus D1S80 and other hypervariable regions in the analysis of Eastern European ethnic group relationships. Annals of Human Biology. 33 (5-6), 570-584 (2006).
- Walsh, S. J., Eckhoff, C. Australian Aboriginal population genetics at the D1S80 VNTR locus. Annals of Human Biology. 34 (5), 557-565 (2007).
- Limborska, S. A., Khrunin, A. V., Flegontova, O. V., Tasitz, V. A., Verbenko, D. A. Specificity of genetic diversity in D1S80 revealed by SNP-VNTR haplotyping. Annals of Human Biology. 38 (5), 564-569 (2011).
- Sajib, A. A., Yeasmin, S., Akter, M., Uddin, M. A., Akhteruzzaman, S. Phylogenetic analysis of Bangladeshi population with reference to D1S80 VNTR locus. Bioresearch Communications. 2 (1), 146-151 (2016).
- Köseler, A., Atalay, A., Atalay, E. &. #. 2. 1. 4. ;. Allele frequency of VNTR locus D1S80 observed in Denizli province of Turkey. Biochemical genetics. 47 (7-8), 540-546 (2009).
- Mastana, S. S., Papiha, S. S. D1S80 distribution in world populations with new data from the UK and the Indian sub-continent. Annals of Human Biology. 28 (3), 308-318 (2001).
- Okuda, H., et al. A Japanese propositus with D-- phenotype characterized by the deletion of both the RHCE gene and D1S80 locus situated in chromosome 1p and the existence of a new CE-D-CE hybrid gene. Journal of Human Genetics. 45 (3), 142-153 (2000).
- Campbell, A. M., Williamson, J. H., Padula, D., Sundby, S. Use PCR & a Single Hair to Produce a "DNA Fingerprint.". The American Biology Teacher. 59 (3), 172-178 (1997).
- Jackson, D. D., Abbey, C. S., Nugent, D. DNA profiling of the D1S80 locus: A forensic analysis for the undergraduate biochemistry laboratory. Journal of Chemical Education. 83 (5), 774 (2006).
- Mansoor, S. K., Hussein, E. F., Ibraheem, A. K. Use the Variable Number of Tandem Repeats (VNTR) in DNA fingerprinting and its application biological sciences. EurAsian Journal of BioSciences. 14 (2), 2835-2839 (2020).
- Beier, K., Schnorrer, S., Hoppe, N., Lenk, C. The ethical and legal regulation of human tissue and biobank research in Europe. Proceedings of the Tiss. EU Project. , (2011).
- Aida, J., et al. Telomere length variations in 6 mucosal cell types of gastric tissue observed using a novel quantitative fluorescence in situ hybridization method. Human Pathology. 38 (8), 1192-1200 (2007).
- Theda, C., et al. Quantitation of the cellular content of saliva and buccal swab samples. Scientific Reports. 8 (1), 1-8 (2018).
- McMichael, G. L., et al. DNA from buccal swabs suitable for high-throughput SNP multiplex analysis. Journal of biomolecular techniques: JBT. 20 (5), 232 (2009).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. Journal of Visualized Experiments. (63), e3998 (2012).
- Destro-Bisol, G., Capelli, C., Belledi, M. Inferring microevolutionary patterns from allele-size frequency distributions of minisatellite loci: a worldwide study of the APOB 3'hypervariable region polymorphism. Human Biology. 72 (5), 733-751 (2000).
- Chen, B., et al. Structure and function of alleles in the 3'end region of human apoB gene. Chinese Medical Journal. 112 (3), 221-223 (1999).
- Renges, H. -. H., Peacock, K., Dunning, A. M., Talmud, P., Humphries, S. E. Genetic relationship between the 3 '-VNTR and diallelic apolipoprotein B gene polymorphisms: Haplotype analysis in individuals of European and South Asian origin. Annals of Human Genetics. 56 (1), 11-33 (1992).
- Kravchenko, S. A., Maliarchuk, O. S., Livshits, L. A. A population genetics study of the allelic polymorphism in the hypervariable region of the apolipoprotein B gene in the population of different regions of Ukraine. Tsitologiia i Genetika. 30 (5), 35-41 (1996).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved