Method Article
高細胞密度バイオリアクターを用いたリアルタイム定量細胞内NMRによるヒト細胞におけるタンパク質-リガンド相互作用のモニタリング
要約
このプロトコルは、カプセル化されたヒト細胞を最大72時間生存可能に保つためのNMRバイオリアクターのセットアップを説明し、その後、時間分解された細胞内NMRデータ取得および分析を行う。この方法論は、細胞内のタンパク質-リガンド相互作用をリアルタイムでモニターするために適用されます。
要約
細胞内NMRは、生体高分子の構造的および動的特性を原子分解能で生細胞内で直接観察するユニークなアプローチです。タンパク質のフォールディング、化学修飾、およびリガンド結合によって誘導される立体構造変化が観察され得る。したがって、この方法は、医薬品開発の文脈において大きな可能性を秘めている。しかし、NMR分光計に閉じ込められたヒト細胞の寿命が短いため、細胞内NMRの適用範囲が制限されます。この問題を克服するために、細胞サンプルの安定性を経時的に大幅に改善し、重要なことに、細胞内NMRスペクトルのリアルタイム記録を可能にするNMRバイオリアクターが採用されています。このようにして、リガンドの浸透や細胞内タンパク質標的への結合などのプロセスの進化をリアルタイムで監視することができる。バイオリアクターは、多くの場合、高い細胞数で低い細胞生存率によって制限され、実験の全体的な感度と細胞生存率との間のトレードオフをもたらす。我々は最近、多数のヒト細胞を代謝的に活性な長期間(最大72時間)維持するNMRバイオリアクターを報告した。このセットアップは、タンパク質-リガンド相互作用およびタンパク質化学修飾をモニターするために適用された。また、多変量曲線分解能に基づくリアルタイムNMRデータの定量分析のワークフローも導入しました。この方法は、細胞内に存在する化学種の濃度プロファイルを時間の関数として提供し、これをさらに分析して、関連する動態パラメータを得ることができる。ここでは、NMRバイオリアクターのセットアップと、ヒト細胞におけるタンパク質-リガンド相互作用のモニタリングへの応用について詳しく説明します。
概要
細胞内核磁気共鳴(NMR)分光法は、細胞環境内の巨大分子の構造的および動的特性を調査するための強力なアプローチとして最近登場しました1,2,3,4,5,6。細胞内NMRは、タンパク質のフォールディング/ミスフォールディング7,8,9、金属結合7,10、ジスルフィド結合形成11,12、タンパク質-タンパク質相互作用13、タンパク質-リガンド相互作用14,15,16、核酸-リガンド相互作用17などの機能的関連過程の研究に成功しました17。,18 生きたヒト細胞において。細胞内NMRアプリケーションの制限要因の1つは、実験中の細胞の寿命が短いことです。この問題の解決策は、NMRバイオリアクターの使用を含む。これらの装置では、酸素と栄養素を供給し、有毒な副産物を除去するために、NMR分光計内に閉じ込められた細胞に増殖培地の一定の流れが適用されます。細胞内NMRの出現に続いて、細菌または哺乳動物細胞のいずれかがヒドロゲル19、20、21、22に封入されるか、懸濁液に保持され、微小透析膜の使用によって灌流される、より長期間にわたって細胞生存率を改善するために、いくつかのNMRバイオリアクター設計が開発されている23.このようなバイオリアクターは、増加した信号対雑音比(S/N)5を有するより長いNMR実験の獲得を可能にし、さらに重要なことに、細胞プロセスをリアルタイムで調査するために使用することができる22,23,24。NMRの高い化学的および立体配座感度のおかげで、後者のアプリケーションは、原子分解能で生細胞内の機能プロセスの動力学に関する貴重な洞察を提供することができます。
このプロトコルでは、既存のモジュラーバイオリアクター設計23と他のグループによって開拓されたヒドロゲルへの細胞封入に依存するアプローチを組み合わせることによって得られた、最近報告された改良されたバイオリアクター25をセットアップして運用する方法を示します19,20,21,22,26,27.我々は、HEK293T細胞における細胞内タンパク質観察リガンド結合のリアルタイム細胞内NMR研究へのバイオリアクターの適用を説明する。バイオリアクターでは、細胞はアガロースゲル糸に高密度で封入され、最大72時間にわたって高い生存率および代謝活性を維持し、その間にリアルタイムの細胞内NMR実験が記録される。バイオリアクターは、標準的な5 mm NMRプローブに適合するガラス管で構成され、内部サンプルチャンバの内径が4.2 mm、高さ38 mm、および容量526 μLとなるように、水密でチューブホルダーに接続されています。入口は長さ7メートルのPEEKキャピラリー(o.d. = 1/32インチ、i.d. = 0.5 mm)で、サンプルチャンバーに下部から約6 mmまで挿入され、出口はチューブホルダーの上部に取り付けられた長さ7メートルのPTFEキャピラリー(o.d. = 1/32インチ、i.d. = 0.5 mm)です(図1)。チューブは、水浴に接続された温度制御ラインに同軸に挿入されます。入口と出口は、PEEKチューブを介して、媒体の流れを制御するFPLCポンプと廃棄物容器に取り付けられた4ウェイ、2ポジションバルブに接続されています。
バイオリアクターは、ヒト細胞における2つの薬物、アセタゾラミド(AAZ)およびメタゾラミド(MZA)との間の相互作用の動態を研究するために適用され、ヒト細胞におけるヒト炭酸脱水酵素(CA II)の第2アイソフォーム、薬理学的に関連する標的28,29,30、および小分子ebselen25によって促進される分子内ジスルフィド結合の形成の速度論、図31において、銅フリーの亜鉛結合型のヒト銅のうち、亜鉛スーパーオキシドジスムターゼ(SOD1)は、筋萎縮性側索硬化症の発症に関与するとされる抗酸化酵素である7,8,32。最後に、リアルタイムNMRデータの定量分析は、多変量曲線分解能交互最小二乗法(MCR-ALS)アルゴリズム33を用いてMATLABで実行され、これを通して、観察された種について時間の関数としての純粋なスペクトル成分および濃度プロファイルが得られ、関連する動力学的パラメータを得るためにさらに分析することができる。
このプロトコルは、ヒトCA II(非標識)またはヒトSOD1(15N標識)のいずれかを一過性に過剰発現するHEK293T細胞(フラスコあたり約3 x 107細胞)のT75フラスコから始まります。細胞を増殖させ、DMEM高グルコースを有するT75フラスコ中で3〜4日ごとに1:10継代ずつ維持し、実験の48時間前に目的のタンパク質をコードするcDNAをトランスフェクトした。このフェーズに関連する手順については、他の箇所で詳しく報告されています34。
プロトコル
1. 試薬と溶液のセットアップ
- 完全なDMEMを調製するために、5mLのL-グルタミン200mM、5mLのペニシリン-ストレプトマイシン100x、および50mLのウシ胎児血清(FBS、10%vol/vol最終濃度)を440mLのDMEMに加える。
注:この溶液は、4°Cで1ヶ月間保存することができます。 - 85°Cで10mLのリン酸緩衝生理食塩水(PBS)に150mgの低ゲル化アガロースを溶解してアガロース溶液を調製し、1.5%(w/v)溶液を得た。0.22 μmフィルターでろ過して滅菌します。1.5 mLキャップチューブに1 mLアリコートのアガロース溶液を調製し、4°Cで保存する。
- バイオリアクター培地を調製する。
- 13.4gのDMEM粉末を1Lの超高純度H2Oに溶解する。
注:用途に応じて、必要な最終容量が異なる場合があります(例えば、500mL培地の場合、6.7gの粉末を500mLのH2Oに溶解する)。 - 2% FBS、10 mM NaHCO3、1x ペニシリン-ストレプトマイシン (100x)、および 2% D2O を加える (例えば、500 mL 培地に対して、10 mL の FBS、0.4 g の NaHCO3、5 mL のペニシリン-ストレプトマイシン 100x、および 10 mL の D2O を加える)。
- pHメーターを使用してpHを測定し、必要に応じてHClを加えて7.4に調整します。
注:通常、初期pHは7.4に非常に近いです。 - バイオリアクター媒体を真空駆動滅菌フィルターで滅菌250mLまたは500mLガラス瓶にろ過します。
- 層流フードでは、2つのホースノズルを備えた滅菌スチールヘッドピースでボトルを密封し、ポンプと空気取り入れ用の0.22μmのPTFEシリンジフィルターに接続されるFEPチューブ(o.d. = 1/8インチ、内径= 1.6 mm)に接続します。
- 13.4gのDMEM粉末を1Lの超高純度H2Oに溶解する。
2. バイオリアクターのセットアップ
- 第2のフローユニットNMRチューブを用いてフローユニットを組み立て、これは後で細胞を含むものと交換される。正しいアセンブリについては、フローユニットの取扱説明書を参照してください。
メモ: この時点で、フローユニットはすでにクリーニングされているはずです(クリーニングされていない場合は、手順 4.2 を実行します)。 - フローユニット温度制御に接続された水槽を37°Cに設定してください。 貯水池のボトルを水浴に入れます。
- リザーバボトルのFEPチューブをポンプに接続します。
- バイオリアクターバルブを「バイパス」に回し、ポンプに媒体を予め充填します。
- バイオリアクターバルブを「フロー」させ、バイオリアクターに0.1mL/minの培地をプレフィルします。
細胞試料の調製
- CO2インキュベーターから細胞を回収する。
- トランスフェクトされたHEK293T細胞のT75フラスコをCO2 インキュベーターから取り出し、使用済み培地を除去します。
- 室温(〜20°C)で7mL(各)のPBSで細胞を2回洗浄する。
- 2 mL のトリプシン/EDTA を使用して細胞を剥離します。溶液を加えた後、室温で5分間インキュベートし、細胞を剥離した。
注: 形質転換された細胞が剥離されるまでに少し時間がかかる場合があります。必要に応じて、細胞を37°Cでインキュベートする。 - 20mLの完全DMEMでトリプシンを不活性化する。上下にピペッティングして細胞を徹底的に再懸濁し、50mL遠心チューブに移す。
- 細胞を800 x g で室温で5分間遠心分離し、上清を捨てる。
- 室温で10mLのPBSで細胞を洗浄し、残留培地を除去した。
- 細胞を800 x g で室温で5分間遠心分離し、上清を捨てる。
- 細胞ペレットを1.5mLキャップした微量遠心チューブに移す。
- 細胞をアガロース糸に埋め込む。
- 固化したアガロースの1つのアリコートをウォーターバス中で85°Cで溶かし、続いてブロックヒーターで37°Cで溶液に保った。
- パスツールピペットで、フローユニットNMRチューブの底部に60~70 μLの1.5%アガロースゲルを充填し、氷に入れます。これにより、 1H NMRコイルの活性体積内にセルサンプルを配置できる高さ約5mmのボトムプラグが作成されます。
- ステップ3.1.8で得られた細胞のペレットを37°Cでサーモブロック内で15−20秒間加熱する。
- 細胞を450 μLのアガロース溶液に再懸濁する。気泡の形成を避けるように注意してください。
- 細胞 - アガロース懸濁液を、1 mLシリンジに接続された長さ約30 cmのクロマトグラフィーPEEKチューブ(i.d. = 0.75 mm)に吸引する。
注:吸引前に、チューブとシリンジの死容量は、気泡の形成を避けるために、室温でPBSで事前に充填する必要があります。チューブの長さは重要ではありません。 - チューブを室温で2分間冷却します。
- フローユニットNMRチューブに室温で100 μLのPBSをプレフィルします。
- アガロースに埋め込まれた細胞の糸をシリンジを穏やかに押し込むことによってフローユニットNMRチューブにキャストする。
メモ:NMRチューブを均質に充填するには、まずPEEKチューブの端をNMRチューブの下部に置き、ゆっくりと左右にスイングしながら上部に向かって進みます。 - すべての細胞 - アガロース懸濁液がキャストされるまで、手順3.2.5、3.2.6、および3.2.8を繰り返します。
- バイオリアクターに細胞を挿入します。
- フローユニットから空のNMRチューブを取り外し、数分間流量を2mL/minに増やして、入口チューブ内の残留気泡を除去します。
- 流速を0.2 mL/minに設定し、細胞を入れたNMRチューブをゆっくりと、しかし着実に上方に押し込んで挿入します。
注:媒体の活発な流れは、そうでなければ挿入中に起こるであろう入口を通るチューブ内容物の逆流を回避する。
4. バイオリアクターの運転と洗浄
- NMR実験中のバイオリアクター操作。
- NMR 分光器の温度を 310 K に設定します。
- 分光器にフローユニットを挿入します。
- バイオリアクター培地を、細胞内NMR実験の全期間にわたって0.1mL/minの流速で供給する。
- 実験中の所望の時間に、外部分子の濃縮溶液を滅菌長針シリンジでシリコーンチューブを穿刺することによって培地リザーバボトルに注入する。
注:培地中の分子の最終濃度は、細胞毒性に関する事前の知識と、利用可能な場合は細胞膜を通る予測/推定拡散速度に基づいて選択する必要があります。 - NMR実験の最後に、細胞を含むチューブを空のチューブと交換し、フローユニットを水ですすいでください。
- バイオリアクター定置洗浄。
- 次の溶液を1mL/minで流してフローユニットを洗浄します:0.2 M水酸化ナトリウム(NaOH)。3 Mクエン酸;2 M NaOHを、それぞれ少なくとも30分間、続いて滅菌濾過した超純水を>2時間行った。
- 各実行後にリザーバボトルとチューブアセンブリを清掃してオートクレーブします。
5. NMR実験
- NMR実験のセットアップ。
メモ: 細胞内 NMR サンプルの調製前に、これらの手順を事前に実行して、細胞収集とデータ取得の間の遅延を回避してください。- NMR 分光計で新しいデータセットを作成し、目的の NMR 実験のパラメーターを設定します。
- 1D 1H NMR実験のパラメータを設定します。
- 1Hキャリア周波数を4.7ppmに水信号の中心に配置します。
- zgesgpパルスプログラムを選択し、スペクトル幅を20ppmに設定し、水抑制のために1,000μs 180°の正方形パルスを設定します。スキャン間の遅延を 1 秒に設定します。32回のスキャンでスペクトルを取得します。
- 標識されていないCA IIを発現する細胞の場合:p3919gpパルスプログラムを選択し、スペクトルのイミノ領域をカバーするためにスペクトル幅を30ppmに設定し、最大励起が目的のシグナルの化学シフト(950MHzでd7 = 20μs)を中心とするように二項水抑制の遅延を調整します。スキャン間の遅延を ≥1 秒に設定します。512スキャンで取得します。
- 15N標識SOD1を発現する細胞の場合:sfhmqf3gpphパルスプログラムを選択し、1Hおよび15Nスペクトル幅をそれぞれ16および50ppmに設定し、成形パルスオフセットおよび励起帯域幅をそれぞれ8.5および6ppmに設定し、デカップリングスキーム用の350μsパルス(装置に応じてgarp4または他の)を設定する。スキャン間の遅延を 0.3 秒に設定します。16回のスキャンと15N次元の128回の増分で取得します。
- リアルタイムNMRスペクトル取得。
- バイオリアクターがNMR分光計に挿入されたら、培地の交換を可能にするために数分待ちます。
メモ:このプロセスは、PBSが2%D2Oを含む培地に交換されるため、ロック信号の外観から簡単に監視できます。 - 1Hチャンネルのマッチングとチューニングを調整し、磁石をシムし、1H 90°のハードパルス長を計算します。
- 1Hハードパルスに従って、各パルスシーケンスの1Hパワーレベルを調整します。
- 最初のzgesgp 1Hスペクトルを記録して、サンプル含有量とフィールドの均質性を確認します。
- zgesgp と p3919gp/sfhmqcf3gpph の実験を目的の数にコピーし、取得スプーラにキューイングします。
注:zgesgpスペクトルは、サンプルの状態とフィールドの均質性を制御するためにのみ使用されます。したがって、スキップすることも、記録頻度を減らすこともできます。 - 非標識CA IIを発現する細胞の場合:ゼロ充填および指数線拡幅ウィンドウ関数(LB=20Hz)を適用してp3919gpスペクトルを処理する。
- 15N標識SOD1を発現する細胞の場合:ゼロ充填および二乗正弦ベル窓関数(SSB=2)を両次元に適用することによってsfhmqcf3gpphスペクトルを処理する。
注:処理されたスペクトルのサイズは、信号のない領域を除去することによってさらに縮小することができます(Topspinでは、これは所望のSTSRおよびSTSI値を設定することによって行われます)。
- バイオリアクターがNMR分光計に挿入されたら、培地の交換を可能にするために数分待ちます。
6. MCR-ALS解析
- CA II スペクトルの分析には、MATLAB R2019b に 1D スペクトル領域をインポートします。
- ソフトウェアで、[ データセット リストの処理] メニューでエクスポートする実験のリストを作成します。
- au プログラム convbin2asc の修正版を使用して、スペクトルごとに関心のあるスペクトル領域を ASCII 形式でエクスポートします。
メモ: これにより、各スペクトルサブディレクトリに ascii-spec.txt という名前のテキストファイルが作成されます。 - MATLABで、カスタムスクリプトLoad_ascii_spectraを使用してスペクトル領域をインポートします。
注: このスクリプトは、データセットディレクトリを入力として必要とし、積み重ねられた 1D スペクトルを含む 2D 配列スペクトルと、化学シフトを含む 1D 配列 cs を生成します。 - Load_acqusスクリプトを実行して、1D スペクトルからタイムスタンプを抽出します。
メモ: このスクリプトは、時間単位で表された各スペクトルの時間増分を含む 1D 配列times_hoursを生成し、初期スペクトルは時刻 = 0 です。
- SOD1 スペクトルの分析には、MATLAB R2020b に 2D スペクトルをインポートします。
- Topspin で、[ データセット リストの処理] メニューでエクスポートする実験のリストを作成します。
- MATLABでは、カスタムスクリプトLoad_2D_spectraを使用して2Dスペクトルをインポートします。
注: このスクリプトは、データセットディレクトリを入力として必要とし、積み重ねられた 2D スペクトルを含む 3D 配列スペクトルと、化学シフトを含む 1D 配列 cs を生成します。 - Load_acqusスクリプトを実行して、2D スペクトルからタイムスタンプを抽出します。
- カスタムスクリプトCut_2D_spectraで関心のあるスペクトル領域を指定し、スクリプトを実行して3Dサブアレイ[(1H x 15N)スペクトル強度)x時間]をカットします。それらを2D配列(タイムポイントxスペクトル強度)として再形成し、それらを結合します。
メモ: これにより、再整形および結合されたスペクトル領域を含む 2D 配列JoinSpec_flatが生成されます。
- MCR-ALS 2.0 を GUI モードで実行します。
- MCR-ALS 2.0 GUI を開くには、mcr_main スクリプトを実行します。
- [データ選択]タブで、スペクトルまたはJoinSpec_flat行列をロードします。データは、チェックのためにプロットすることができます。
- コンポーネントの数は、特異値分解 (SVD) によって、または手動で評価します。
注:成分の数は、実験中に存在する異なる種の数に対応するべきである。この場合n=2は、遊離かつ結合したタンパク質に対応する。 - 純粋なスペクトルの初期推定方法を選択します。最も純粋な変数検出または進化因子分析(EFA)のいずれかを使用できます。
- 「データ・セットの選択」ウィンドウで、「続行」を選択します。
- 濃度の制約を 「制約: 行モード」 ウィンドウで設定します。非否定性制約を適用し、「実装と2種」としてfnnls(高速非否定性制約最小二乗法)を選択します。1 つのクロージャ制約を適用し、拘束条件を 1 に設定し、クロージャ条件を「等しい」として、すべての種に適用します。
注:これにより、各種濃度の合計が1に等しくなり、得られた各種のプロファイルが総タンパク質濃度に対して正規化されます。 - スペクトルの制約を 「制約: 列モード」 ウィンドウで設定します。非否定性制約を適用し、「実装と2種」としてfnnlsを選択します。
注: NMR スペクトルに負のシグナルが存在する場合は、この制約を適用しないでください。 - 最後のウィンドウで、50 回の反復と 0.01 回の収束基準を設定します。濃度、スペクトル、および標準偏差の出力名を指定します。MCR-ALS フィッティングを実行するには、[ 続行 ] をクリックします。
注:グラフィカルウィンドウには、濃度プロファイルのプロットと純粋な成分のスペクトルとのフィッティングの結果が表示されます。 - SOD1 データセットの場合: カスタム スクリプト Rebuild_2D_spectraを使用して、MCR-ALS の 1D 出力から 2D スペクトル領域を再構築し、プロットします。
7. トリパンブルー試験
- パスツールピペットでNMRチューブの内容物を回収し、アガロース糸を1.5mLキャップチューブに移します。
- アガロース糸を600 μLのPBSですすぎ、室温で4,000 x g で1分間遠心分離することによって残留培地を除去します。上清を捨てる。
- 250 μLのPBSおよび50 μLの0.4%トリパンブルー溶液を加える。
- 連続ピペッティングで2分間インキュベートする。
- 上清を捨てて600 μLのPBSで2回洗浄する。
- 顕微鏡スライドの上にいくつかのアガロース糸を置き、カミソリの刃でそれらを切り刻んでゲルの小さなスライスを作成します。解析用に最も薄いスライス(厚さ< 0.4 mm、理想的には~0.2 mm)を選択します。
- ゲルスライスを、両側に3層のパラフィンフィルム(総厚さ〜0.4mm)で離間した2枚のスライドガラスからなる自作の細胞計数チャンバに移す。
注:チャンバースライドを使用することもできます。しかし、チャンバーの高さ(0.1mm)よりも厚いゲルスライスは圧迫され、包埋細胞が破裂する。 - アガロース内の細胞の画像を取得し、白と青の細胞を数えます。
- 細胞生存率を(全細胞-青色細胞)/全細胞として算出する。
結果
上記のプロトコールは、ヒドロゲルの糸中の細胞のカプセル化を可能にし、細胞内プロセスをリアルタイムで調査するために必要な長期間にわたって細胞生存率を最大化する。バイオリアクターにおいて、細胞は、トリパンブルー試験によって確認されるように、72時間まで生きたままかつ代謝的に活性に維持される(図2a−c)。原理的には、このプロトコールは、任意の立体構造または化学的変化を受けている目的の細胞内タンパク質を観察するために適用することができる。上述の第1の適用において、バイオリアクターは、HEK293T細胞の細胞質ゾルにおいて過剰発現されるCA IIに対する2つの阻害剤、AAZおよびMZAの結合をリアルタイムでモニターするために適用される。記録された最初の1H励起スカルプティングスペクトル(zgesgp)は、全体的なシグナル強度(細胞数に比例する)、過剰発現タンパク質からのシグナルの存在、およびフィールドの均質性を評価するために使用されます(図2d)。CA IIの場合、2つの阻害剤の細胞内結合は、ウォーターゲート3−9−1935 1D 1H NMRスペクトル(p3919gp)によって、11〜16ppmの間の領域における1Hシグナルを観察することによってモニターすることができる。これらのシグナルは、CA II36の亜鉛配位ヒスチジンおよび他の芳香族残基から生じ、配位子結合時に摂動される14,15。配位子濃度は、拡散速度に基づいて、または利用可能な場合は、以前に決定された透過性値14から選択することができる。成功した結合は、関心のあるスペクトル領域における追加のシグナルセットの出現によって視覚的に確認され、それは徐々に元のシグナルを置き換える(図3)。時間依存結合曲線はMCR-ALS分析によって得られ、MCR-ALS分析は遊離および結合CA IIから生じる2組のNMRシグナルを分離し(図4a)、同時に2つの種の相対濃度プロファイルを提供する(図4b)。第2の用途では、ヒト細胞におけるグルタチオンペルオキシダーゼ模倣体であるebselenによって促進される亜鉛結合SOD1分子内ジスルフィド結合の形成を監視するためにバイオリアクターが適用される。このプロセスは、ジスルフィド結合形成によって誘導されるタンパク質構造の摂動によって引き起こされる1H-15N 2D SOFAST-HMQC37スペクトル(タンパク質主鎖立体構造のフィンガープリントを提供する)の変化を観察することによってモニターされる。ジスルフィド酸化SOD1から生じる追加のシグナルが1H-15Nスペクトルに現れ、ジスルフィド還元SOD1からのシグナルを徐々に置き換える。2Dスペクトルの選択された領域に対するMCR-ALS解析は、2つの種から生じるシグナルを分離し(図5a)、それらの相対濃度プロファイルを提供する(図5b)。得られた濃度曲線は、非線形フィッティングによってさらに分析して、研究中のプロセスの動態に関する情報を提供することができます25。
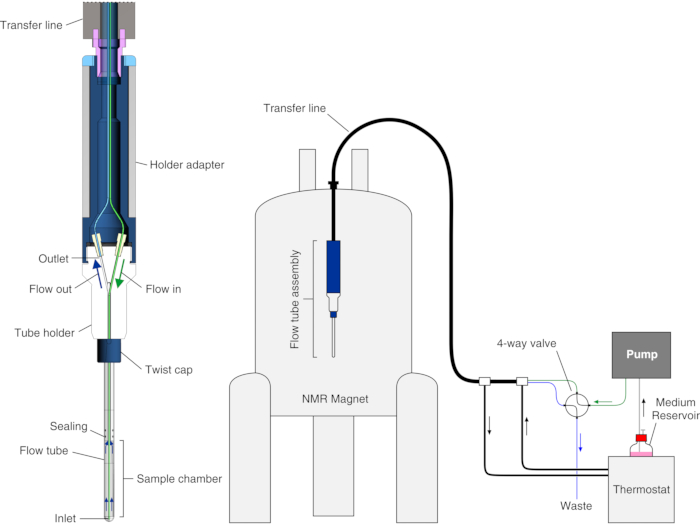
図1:バイオリアクターのスキーム。 左:空のフローユニットの断面図。右:バイオリアクター設置のスキーム。PEEKインレットチューブは緑色で表示されます。PTFEアウトレットチューブは青色で示されています。左パネルはLuchinat et al.25の許可を得て複製されている。 この図の拡大版を表示するには、ここをクリックしてください。
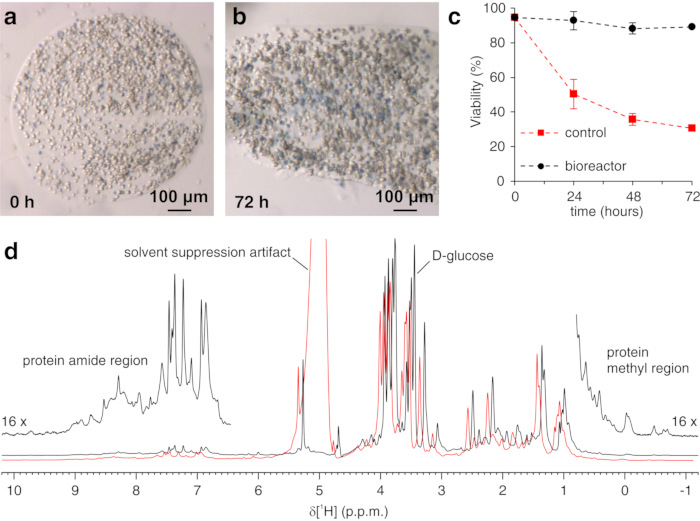
図2:封入細胞に対するトリパンブルー試験および1H NMRによるサンプルチェック。 包埋細胞を含むアガロースの代表的なスライスを、(a)キャスト直後および(b)バイオリアクター中で72時間後にトリパンブルーで染色した;(c)活性流動下(黒色)および静的条件下(赤色)のNMRバイオリアクターにおける時間の関数としての細胞生存率を、トリパンブルー試験により測定する。後者の場合、電界均質性の低下は、ラインの広がりと溶媒抑制アーチファクトの出現を引き起こす。興味深いスペクトル特徴にはラベルが付けられます。パネル(a-c)はLuchinat et al.25の許可を得て複製されている。この図の拡大版を表示するには、ここをクリックしてください。
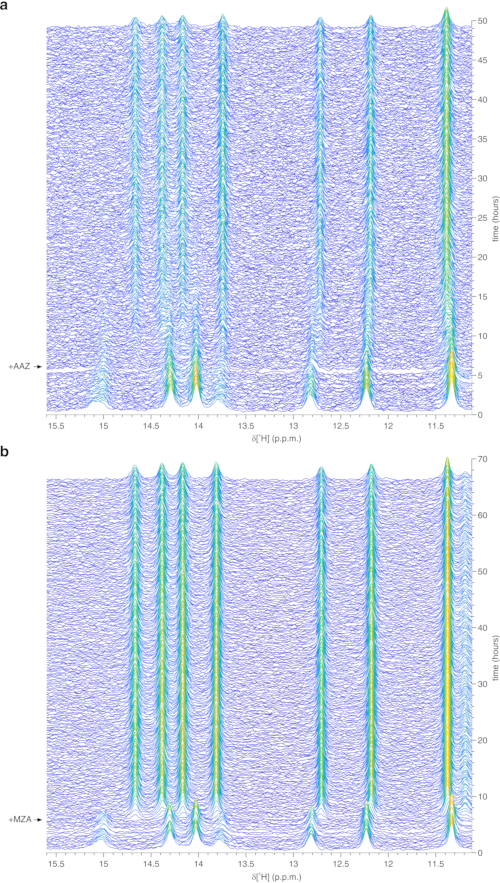
図3:バイオリアクター内のアガロース封入細胞について得られた代表的なリアルタイム細胞内1H NMRデータ。 CA IIを過剰発現し、続いて(a)25μM AAZおよび(b)10μM MZAで処理したHEK293T細胞の1D 1H NMRスペクトル(15.6〜11.1ppmの間の領域)のウォーターフォールプロットを、NMRバイオリアクターにおいて時間の関数として記録した。リガンド処理の時間を矢印で示す。スペクトル強度(a.u.)は、青色(最低)から黄色(最高)に色分けされています。この図はLuchinat et al.25の許可を得て複製されている。この図の拡大版を表示するには、ここをクリックしてください。
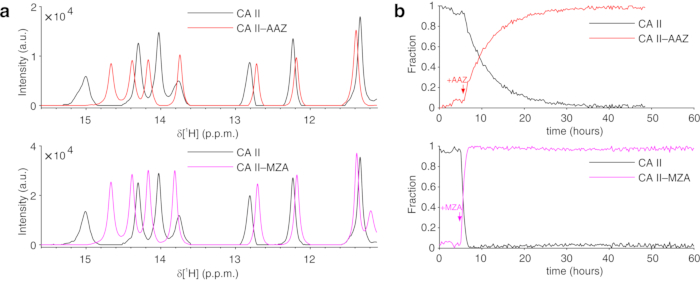
(a)MCR−ALSによって再構成された純粋な成分の1H NMRスペクトル:リガンド(黒色)の非存在下およびAAZ(赤色)またはMZA(マゼンタ)との複合体におけるCAII;(b)MCR−ALSによって得られたAAZ(赤色)またはMZA(マゼンタ)を添加したときの時間の関数としての遊離(黒色)および結合CA IIの相対濃度プロファイル。リガンド処理の時間は矢印でマークされています。この図はLuchinat et al.25の許可を得て複製されている。この図の拡大版を表示するには、ここをクリックしてください。
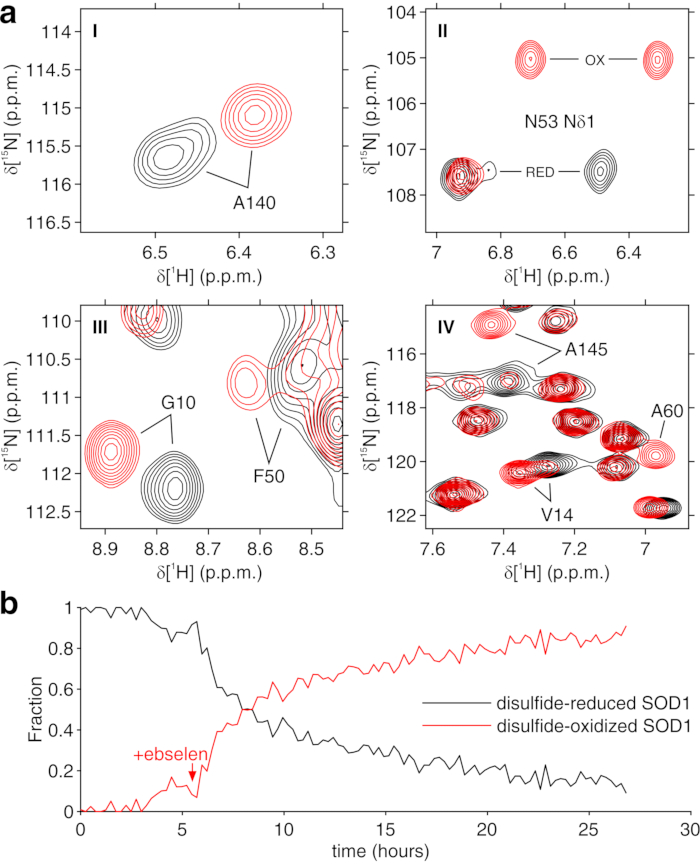
(a)MCR-ALSによって再構成された純粋な成分の1H-15Nスペクトル領域(標識I-IV):ジスルフィド還元SOD1(黒色)およびジスルフィド酸化SOD1(赤色);(b)MCR-ALSにより得られたebselen(矢印で示す)を添加したときの時間の関数としての純粋な成分の相対濃度プロファイル。この図はLuchinat et al.25の許可を得て複製されている。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
細胞内NMR実験にバイオリアクターを使用する目的は、細胞を長期間にわたって生きたまま代謝的に活性に保つことです。この目的を達成するためには、多くの重要な側面を考慮する必要があります。まず、細胞サンプルの調製時およびNMRデータ取得中に細菌汚染を避けることが最も重要です。遺伝子クローニングおよび組換えタンパク質発現に一般的に使用される 大腸菌 または他の細菌の株が実験室で使用される場合、それらはサンプル調製中に細胞を汚染する可能性がある。バイオリアクターに入ると、細菌は新鮮な増殖培地を利用して急速に成長し、エンドトキシンの産生による細胞死を引き起こす。細菌汚染は、増殖培地を黄色く濁った状態に変える高度な段階でのみ発見される。さらに、バイオリアクターの洗浄が不完全であると、ポンプまたはチューブが細菌、酵母、または一般的なカビで汚染される可能性があります。
実験を成功させるための要件は、気泡形成の回避である。NMRコイルの活性体積のアガロース糸間に閉じ込められた気泡は、大きな磁場の不均一性をもたらし、H2O信号の不完全な抑制とスペクトル品質の深刻な損失を引き起こす(図2d)。気泡は、システム内に閉じ込められた空気または気体状のCO2の形成によって引き起こされる可能性がある。前者は、細胞サンプルを挿入する前に系を培地で洗い流すことで容易に回避でき、後者を避けるためには、増殖培地中のNaHCO3濃度を低下させ、CO2溶解度の違いを最小限に抑えるために系のすべての部分を一定温度に保つことが推奨される。細胞の好気性代謝はまた、流量を増加させることによって防止することができる気体CO2の形成を引き起こす可能性がある。
細胞生存率は、トリパンブルーテストによって各実行後にチェックする必要があります.しかし、それは代謝活性に関する洞察を提供しない。バイオリアクター操作中の細胞の代謝状態のより完全な画像を得るために、 31P NMRスペクトルは、時間23、25の関数としてATPの産生を評価するために実施することができる。しかし、この測定には専用のプローブが必要になることが多く、 1H NMRによる同時記録が可能な場合があります。
CA IIの場合、1Hスペクトルの異常な領域によく分解されたレポーターシグナルが存在すると、単純な1D NMRスペクトルからの分析が容易になり、タンパク質発現中に同位体濃縮を必要としません。一般に、他のタンパク質は、0〜-1ppmの間のタンパク質疎水性コアの典型的なものなど、他の領域におけるスペクトル変化をモニターするのに有用な1Hシグナルを生じさせる可能性がある11。しかしながら、これらの領域は、〜10kDaより大きい折り畳まれたタンパク質のために混雑する傾向がある。この場合、SOD1について示すように、タンパク質を15Nで富化させることが好ましく、タンパク質発現時に均一に15N富化増殖培地を提供することにより、2D 1H-15N NMRスペクトルのリアルタイム変化をモニターする。2Dスペクトルは、MATLABに2D配列としてインポートされ、1D配列に再配置され、MCR-ALS解析の前にスタックされます。後者のアプローチは、一般に、検出可能なシグナルを生じさせ、単一残基レベルでのタンパク質立体構造変化に関する情報を提供する任意の細胞内タンパク質に適用可能である。原理的には、後者のアプローチは、nDスペクトルおよび他の同位体標識スキームに一般化することができる。
異なるタイプの細胞への適用に関して、プロトコルは異なる細胞株に容易に適合されるべきであり、目的のタンパク質が細胞内で直接発現される必要はない。したがって、細胞内NMRに対する他のアプローチをこのプロトコールと組み合わせることができ、そこでは、目的の巨大分子が組換えにより産生されるか、または合成され、続いてエレクトロポレーションまたは他の送達方法によって細胞内に挿入される1,9,38。異なる細胞株またはサンプル調製プロトコルを使用する場合、アガロース濃度、糸の太さ、アガロース糸の最終的な細胞密度などのパラメータを経験的に最適化する必要があるかもしれません。さらに、本明細書に記載されるプロトコールの適用可能性は、アガロース封入を許容する細胞に限定される。他の細胞タイプは異なるヒドロゲル製剤を必要とするかもしれないが、懸濁液中でネイティブに増殖する細胞を分析する場合、例えば、懸濁細胞をNMRチューブ内に閉じ込めたまま栄養素拡散を確実にするために同軸微小透析膜を利用する23。
他のNMRバイオリアクター設計19、20、21、22と比較して、ここで説明する装置は、市販のフローユニットに依存しており、わずかな変更を加えて適合している。したがって、この装置は、高い再現性で異なる実験室で容易に複製することができる。さらに、必要に応じて、標準化された操作と厳格な実験室安全規制への完全な準拠を可能にします。全体として、バイオリアクターの柔軟性と操作の容易さは、すでに報告されているものに加えて、細胞およびインビトロの両方で溶液NMRの他の多くの応用を可能にするはずです23,25。最終的には、NMR分光計でそのようなサンプルを生きたまま維持したり、成長を維持したりするための適切な足場が見つかれば、スフェロイドやオルガノイドなど、組織の生理学的環境に似たサンプルにも同じバイオリアクター設計を適用することができます。
開示事項
著者らは、利益相反はないと宣言している。
謝辞
この作業は、欧州委員会のHorizon 2020プログラムから資金提供を受けた助成金番号871037のiNEXT-Discovery、Instruct-ERICのサービスをさらに発展させるためのEU H2020プロジェクトであるInstruct-ULTRA、助成金番号731005、およびMinistero dell'Istruzione、dell'Università e della Ricerca PRIN grant 20177XJCHXによって支援されています。著者らは、ランドマークESFRIプロジェクトであるInstruct-ERICがJRAアワード番号815とCERM/CIRMMPイタリアセンターのリソースを使用することを通じて支援されていることを認めている。InsightMRフローユニットの運用をサポートしてくれたMatteo Pennestri(英国ブルカー)に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Citric acid | Sigma-Aldrich | 251275 | |
| D2O | Sigma-Aldrich | 453366 | |
| DMEM, high glucose | Life Technologies | 10313-021 | |
| DMEM, high glucose, powder | Sigma-Aldrich | D5648 | |
| FBS | Life Technologies | 10270 | |
| HCl | Sigma-Aldrich | 30721 | |
| L-glutamine (200 mM) | Life Technologies | 25030 | |
| Low-gelling agarose, powder | Sigma-Aldrich | A4018 | |
| NaHCO3, powder | Carlo Erba | 478537 | |
| PBS | Life Technologies | 10010 | |
| Penicillin–streptomycin (10,000 U/ml) | Life Technologies | 15140-122 | |
| NaOH, pellets | Sigma-Aldrich | 30620 | |
| Trypan Blue solution (0.4% (wt/vol) | Sigma-Aldrich | T8154 | Hazard statement(s): H350 may cause cancer. |
| Trypsin–EDTA (0.05% (wt/vol)) | Life Technologies | 25300-054 | |
| Equipment | |||
| Avance III Spectrometer equipped with a 5 mm CryoProbe | Bruker | n/a | All modern spectrometers and narrow-bore magnets equipped with 5 mm probes are compatible. |
| InsightMR flow unit | Bruker | n/a | |
| P-920 pump module from ÄKTA FPLC | GE Healthcare | n/a | Any FPLC, HPLC peristaltic or syringe pump should be compatible with the flow unit. |
参考文献
- Inomata, K., et al. High-resolution multi-dimensional NMR spectroscopy of proteins in human cells. Nature. 458 (7234), 106-109 (2009).
- Luchinat, E., Banci, L. In-cell NMR: a topical review. IUCrJ. 4, 108-118 (2017).
- Dzatko, S., et al. Evaluation of the stability of DNA i-motifs in the nuclei of living mammalian cells. Angewandte Chemie (International Ed. in English). 57 (8), 2165-2169 (2018).
- Luchinat, E., Banci, L. In-cell NMR in human cells: direct protein expression allows structural studies of protein folding and maturation. Accounts of Chemical Research. 51 (6), 1550-1557 (2018).
- Tanaka, T., et al. High-resolution protein 3D structure determination in living eukaryotic cells. Angewandte Chemie (International Ed. in English). 58 (22), 7284-7288 (2019).
- Siegal, G., Selenko, P. Cells, drugs and NMR. Journal of Magnetic Resonance. 306, 202-212 (1997).
- Banci, L., et al. Atomic-resolution monitoring of protein maturation in live human cells by NMR. Nature Chemical Biology. 9 (5), 297-299 (2013).
- Luchinat, E., et al. In-cell NMR reveals potential precursor of toxic species from SOD1 fALS mutants. Nature Communications. 5, 5502 (2014).
- Theillet, F. -. X., et al. Structural disorder of monomeric α-synuclein persists in mammalian cells. Nature. 530 (7588), 45-50 (2016).
- Barbieri, L., Luchinat, E., Banci, L. Intracellular metal binding and redox behavior of human DJ-1. Journal of biological inorganic chemistry: JBIC: A Publication of the Society of Biological Inorganic Chemistry. 23 (1), 61-69 (2018).
- Banci, L., Barbieri, L., Luchinat, E., Secci, E. Visualization of redox-controlled protein fold in living cells. Chemistry & Biology. 20 (6), 747-752 (2013).
- Mercatelli, E., Barbieri, L., Luchinat, E., Banci, L. Direct structural evidence of protein redox regulation obtained by in-cell NMR. Biochimica Et Biophysica Acta. 1863 (2), 198-204 (2016).
- Barbieri, L., Luchinat, E., Banci, L. Protein interaction patterns in different cellular environments are revealed by in-cell NMR. Scientific Reports. 5, 14456 (2015).
- Luchinat, E., et al. Drug screening in human cells by NMR spectroscopy allows the early assessment of drug potency. Angewandte Chemie (International Ed. in English). 59 (16), 6535-6539 (2020).
- Luchinat, E., et al. Intracellular binding/unbinding kinetics of approved drugs to carbonic anhydrase II observed by in-cell NMR. ACS Chemical Biology. 15 (10), 2792-2800 (2020).
- DeMott, C. M., et al. Potent inhibitors of mycobacterium tuberculosis growth identified by using in-cell NMR-based screening. ACS Chemical Biology. 13 (3), 733-741 (2018).
- Krafcikova, M., et al. Monitoring DNA-ligand interactions in living human cells using NMR spectroscopy. Journal of the American Chemical Society. 141 (34), 13281-13285 (2019).
- Broft, P., et al. In-cell NMR of functional riboswitch aptamers in eukaryotic cells. Angewandte Chemie (International Ed. in English). , (2020).
- Sharaf, N. G., Barnes, C. O., Charlton, L. M., Young, G. B., Pielak, G. J. A bioreactor for in-cell protein NMR. Journal of magnetic resonance. 202 (2), 140-146 (2010).
- Kubo, S., et al. A gel-encapsulated bioreactor system for NMR studies of protein-protein interactions in living mammalian cells. Angewandte Chemie (International Ed. in English). 52 (4), 1208-1211 (2013).
- Inomata, K., Kamoshida, H., Ikari, M., Ito, Y., Kigawa, T. Impact of cellular health conditions on the protein folding state in mammalian cells. Chemical Communications. 53 (81), 11245-11248 (2017).
- Breindel, L., DeMott, C., Burz, D. S., Shekhtman, A. Real-time in-cell nuclear magnetic resonance: ribosome-targeted antibiotics modulate quinary protein interactions. Biochemistry. 57 (5), 540-546 (2018).
- Cerofolini, L., et al. Real-time insights into biological events: in-cell processes and protein-ligand interactions. Biophysical Journal. 116 (2), 239-247 (2019).
- Breindel, L., Burz, D. S., Shekhtman, A. Active metabolism unmasks functional protein-protein interactions in real time in-cell NMR. Communications Biology. 3, (2020).
- Luchinat, E., Barbieri, L., Campbell, T. F., Banci, L. Real-time quantitative in-cell NMR: ligand binding and protein oxidation monitored in human cells using multivariate curve resolution. Analytical Chemistry. 92 (14), 9997-10006 (2020).
- Koczula, K. M., et al. Metabolic plasticity in CLL: adaptation to the hypoxic niche. Leukemia. 30 (1), 65-73 (2016).
- Alshamleh, I., et al. Real-time NMR spectroscopy for studying metabolism. Angewandte Chemie (International Ed. in English). 59 (6), 2304-2308 (2020).
- Supuran, C. T. Carbonic anhydrases: novel therapeutic applications for inhibitors and activators. Nature Reviews. Drug Discovery. 7 (2), 168-181 (2008).
- Neri, D., Supuran, C. T. Interfering with pH regulation in tumours as a therapeutic strategy. Nature Reviews. Drug Discovery. 10 (10), 767-777 (2011).
- Alterio, V., Di Fiore, A., D'Ambrosio, K., Supuran, C. T., De Simone, G. Multiple binding modes of inhibitors to carbonic anhydrases: how to design specific drugs targeting 15 different isoforms. Chemical Reviews. 112 (8), 4421-4468 (2012).
- Capper, M. J., et al. The cysteine-reactive small molecule ebselen facilitates effective SOD1 maturation. Nature Communications. 9 (1), 1693 (2018).
- Trist, B., Hilton, J. B., Crouch, P. J., Hare, D. J., Double, K. L. Superoxide dismutase 1 in health and disease: How a front-line antioxidant becomes neurotoxic. Angewandte Chemie (International Ed. in English). , (2020).
- Tauler, R. Multivariate curve resolution applied to second order data. Chemometrics and Intelligent Laboratory Systems. 30 (1), 133-146 (1995).
- Barbieri, L., Luchinat, E., Banci, L. Characterization of proteins by in-cell NMR spectroscopy in cultured mammalian cells. Nature Protocols. 11 (6), 1101-1111 (2016).
- Piotto, M., Saudek, V., Sklenár, V. Gradient-tailored excitation for single-quantum NMR spectroscopy of aqueous solutions. Journal of biomolecular NMR. 2 (6), 661-665 (1992).
- Vasa, S. K., Singh, H., Grohe, K., Linser, R. Assessment of a large enzyme-drug complex by proton-detected solid-state NMR spectroscopy without deuteration. Angewandte Chemie (International Ed. in English). 58 (17), 5758-5762 (2019).
- Schanda, P., Brutscher, B. Very fast two-dimensional NMR spectroscopy for real-time investigation of dynamic events in proteins on the time scale of seconds. Journal of the American Chemical Society. 127 (22), 8014-8015 (2005).
- Ogino, S., et al. Observation of NMR signals from proteins introduced into living mammalian cells by reversible membrane permeabilization using a pore-forming toxin, streptolysin O. Journal of the American Chemical Society. 131 (31), 10834-10835 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved