Method Article
食事脂質吸収とカイロミクロン分泌の in vivo 動態を定量化するためのマウスにおける流れる腸間膜リンパの分離
要約
本プロトコールは、マウスにおける十二指腸内栄養注入に応答して流れる腸リンパを単離するための詳細な外科プロトコールを記載する。これにより、様々な実験栄養素に応答した総腸脂質吸収およびカイロミクロン合成および分泌の生理学的決定が可能になる。
要約
腸内リポタンパク質、特にトリグリセリドが豊富なカイロミクロンは、代謝、炎症、および心血管疾患の主要な推進力です。しかし、腸内リポ蛋白はまず小腸から腸間膜リンパ管に分泌されるため、 生体内での 単離は非常に困難です。次に、カイロミクロンを含むリンパ液が胸管から鎖骨下静脈に空になり、食事の成分を心臓、肺、そして最終的には全身循環に届けます。カイロミクロントリグリセリドは、循環中のリポタンパク質リパーゼおよび他のリポタンパク質受容体との相互作用直後に加水分解を受けるため、ナイーブカイロミクロンを血液から単離することは不可能です。したがって、ラットでBollmanらによって記述された元の2日間のリンパ瘻手順は、胸部静脈に入る前に新鮮な腸間膜リンパを分離するために歴史的に使用されてきました。.このプロトコルは、過去45年間、Patrick Tsoの研究室によって改善され、専門化されており、これらの重要なリポタンパク質と腸からの分泌物の分析を可能にしています。Tsoリンパ瘻の手順が更新され、ここで初めて視覚的に提示されます。この改訂手順は、意識のあるマウスで十二指腸栄養チューブを取り付け、腸間膜リンパ管をカニューレ挿入し、食後にリンパを採取するための1日の外科的手法です。これらの新しい技術の主な利点には、マウスからリンパ液を再現的に収集する能力が含まれます(これは遺伝子マウスモデルの力を利用します)。十二指腸注入チューブおよびリンパカニューレの移植中のマウスの麻酔時間の短縮;摂食および食後の期間を通してリンパを継続的にサンプリングする能力。ホルモンおよびサイトカインが血液中で希釈および酵素加水分解される前に定量的に測定する能力。腸内リポタンパク質を単離するために大量のリンパ液を収集する能力。この技術は、食事の栄養素吸収、腸管リポタンパク質合成、およびカイロミクロン分泌を直接かつ定量的に測定するための強力なツールです。
概要
腸間膜リンパ系の生理学的重要性
腸間膜リンパ管は、ヘロフィロスが肝門脈系とすべての「腸内の吸収静脈」を記述した紀元前~300年以来、何らかの形で記載されてきました1,2,3,4,5。この最初の記述から1,700年以上の間、腸リンパ管の決定的な特徴は、食事の直後の腸間膜リンパ液中の乳白色の液体の存在でした3。乳白色のカイロミクロン含有リンパ(「乳び」リンパ)は、門脈や肝臓に排出されず、代わりに精槽乳びを通って胸管に移動し、最終的には左鎖骨下静脈で血液に結合することが知られています6。この解剖学的配置により、乳びリンパは最初に心臓と肺を通って移動し、その後体の残りの部分を循環します。これは、心臓と肺が腸間膜リンパ7への分泌物で「ファーストパス」を得ることを意味します。
腸間膜リンパ管の主な役割は、小腸からの食物脂質の輸送です8,9,10。解剖学的には、カイロミクロン、腸管免疫細胞11,12,13,14、腸内ホルモン15,16,17,18、抗原19,20,21、非カイロミクロン脂溶性化合物22,23、および過剰な液体は、腸球基底膜の下にある乳酸に入り、リンパ毛細血管を通って腸間膜リンパ節に濃縮されます。代謝物、抗原、環境汚染物質、栄養素、シグナル伝達分子など、未知の腸間膜リンパ成分が多数存在する可能性があります。
腸間膜リンパの成分は、主に腸間膜リンパを単離することが困難であるため、体系的に同定されていない。腸間膜リンパ管は無色であり、脂肪の多い食事の後を除いて、乳びで乳白色になるため、腸間膜リンパ管へのアクセスは常に深刻な課題でした6,8,9,10。
腸リンパを分離するための現在および一般的な方法
腸間膜リンパは、ヒトではアクセスできません(深刻なGI外傷が発生したまれで極端な状況を除く)24。生体内リンパ採取は外科的に複雑で要求が厳しいものです。元の2日間のリンパ瘻手順は、Bollmanら25によって記述され、過去45年間、Patrick Tsoの研究室によって改善され、専門化されてきました26,27。リンパ瘻手順により、研究者は意識のある動物から流れるリンパを収集できます 6時間の十二指腸脂質注入期間中。
リンパ瘻モデルは、主にラットでリンパ流量、トリグリセリドとコレステロール(または他の十二指腸注入化合物)の出力、カイロミクロン組成、および腸ホルモン濃度を測定するために使用されてきました。程度は低いですが、この手法はマウスにも使用できますが、外科的生存とリンパ液量が損なわれます。腸間膜リンパ管を見るのが難しいため、歴史的な方法には、ミニブタ28、ヒツジ29、ブタ30、イヌ31、ラット17などの大型動物の腸間膜リンパのカニューレが含まれていました。これらの大規模なモデルでの作業はリソースを大量に消費し、ノックインモデルまたはノックアウトモデルでの研究はできません。
代替アプローチも使用されています。カイロミクロンは、食後の状態の血液から単離することができます(ただし、これらは血漿リポタンパク質リパーゼによって部分的に加水分解されます)32,33,34,35。胸管もカニューレ挿入することができますが、そこに集められたリンパ液には腸間膜リンパと腸外リンパドレナージの混合物が含まれています26,36。インビトロでは、Caco-2細胞は脂肪酸処理に応答してカイロミクロン様粒子を分泌し、これらの細胞は関連するリンパ管内皮細胞または血管細胞と共培養することができる37,38。ヒトおよびマウスの腸管オルガノイド培養は、頂端脂質を処理し、カイロミクロンを分泌することが示されている39,40,41,42。これらのモデルは非常に有利であり、小腸生理学への機構的洞察を可能にしますが、in situ腸間膜リンパ管の複雑さ、物理化学的勾配、または動的リンパ流を再現することはできません。
ここで紹介した1日マウスリンパ瘻モデルの利点
腸内リポタンパク質を単離するこれらの他の方法に関して、Tso Labリンパ瘻法は伝統的に腸間膜リンパへの食事栄養素の吸収を測定するためのゴールドスタンダード技術と考えられてきた。このin vivo技術には、食事性脂質吸収の重要な生理学的側面、つまり吸収期間中の化合物の動的出現を捉えるという利点があり、十二指腸栄養素を含む生きた動物の流れる腸間膜リンパの繰り返しサンプリングが必要です。この外科的手法はまた、腸内ホルモンとサイトカインを血液中ではなく生理学的コンパートメントで直接測定し、そこで希釈して酵素的に分解します17,43。
実験的な質問が脂質分泌動態または疎水性GI化合物または薬物の動的吸収および代謝の理解を必要とする場合、この技術は適切であるだけでなく、近位から遠位腸(胃から結腸)および頂端から基底外側表面への管腔内容物の動きを補間する唯一のアプローチでもあります(管腔内容物から腸細胞を通って乳酸および門脈循環)。この技術は、十二指腸内カテーテルを介した栄養素の管腔送達を採用し、流れる腸間膜リンパを迂回させて収集するため、吸収装置全体が実験的制御下にあり、小腸吸収プロファイルを定性的に評価するために使用できます。
ここで初めて視覚的に提示されるのは、Tso Labリンパ瘻モデルのメジャーアップデートであり、(1)実験時間を1日の外科的移植および実験収集期間に短縮します。(2)マウスの生存率と動物福祉の考慮事項を改善します。(3)マウス遺伝子モデルの力を利用するためのマウスでのアプローチの再現性を高めます。この技術は、腸管分泌物、リポタンパク質、または食事脂質吸収に関するすべての実験的質問のゴールドスタンダードと見なされなければならず、脂質吸収速度論およびカイロミクロンの高忠実度測定のための最良の技術です。
プロトコル
すべての外科的処置は、ピッツバーグ大学の内部動物管理および使用委員会[プロトコル#20047008]によって承認され、実験動物の世話と使用に関するNIHガイドに準拠しています。C57BL6 / J雄マウス、8〜14週齢を本研究に使用しました。マウスは市販の供給源から入手した( 材料表参照)。すべてのマウスは、標準的な飼料と水への 自由 アクセスを伴う12時間の明暗サイクルで飼育されました。
1.動物の準備
- 実験デザインに応じて、マウスに餌を与えるか、マウスを絶食させます。
注:胃が空になる速度の違いが懸念されない限り、一晩の断食は不要です。 - 5%イソフルランガスで麻酔を誘発し、尾とつま先のつまみで適切な麻酔を確実にします。麻酔をかけたら、マウスを2%〜3%のイソフルランガスで適切な麻酔面に保ち、手術プラットフォームにテープで配置します。
- 循環温水を利用する加熱された外科用プラットフォームでマウスを暖かく保ち ます(材料の表を参照)。
2.手術と実験計画
- 獣医軟膏を目に塗布し、腹部を剃り、消毒手術用スクラブ( 材料の表を参照)を手術部位に適用して手術を開始します。これにより、切開部が滅菌され、正中線切開中の空中毛皮の生成が減少します。
- 無菌器具、ドレープ、その他の必要な機器や備品を利用して、無菌の作業エリアを維持します。
- 痛みを和らげるためにカルプロフェンの最初の用量( 材料の表を参照)を5 mg / kgの用量で注射します。.
- ピンセットで皮膚をつかみ、小さなハサミで正中腹部切開を行います。胸骨に向かってカットし(決して上にはありません)、鼠径脂肪までカットします。次に、ハサミを使用して筋肉層を別々に切ります。
注意: 使用前にすべての機器を滅菌してください。 - 開創器を使用して、リンパ管が見えるまで腹膜内臓を邪魔にならないように動かします。
- 生理食塩水に浸したQチップ( 材料の表を参照)を使用して、肝臓を体の右上に向かって動かし、腸と胃を動物の左側に動かします。
- 十二指腸を横方向に左方向に伸ばして、上腸間膜動脈と腸管リンパ管を露出させます。
- カニューレチューブに鈍い針を挿入して長さ30〜40 cmのカニューレチューブを準備し( 材料表を参照)、1 mLシリンジを使用してチューブを通して少量のヘパリン(1,000 U / L)を洗い流します。
注:リンパ流は重力によって補助され、氷上の微量遠心収集チューブに流れ込みます。収集アイスバケットが手術セットアップに隣接して配置されている場所によっては、カニューレチューブの長さを調整する必要がある場合があります。 - はさみを使用して、カニューレチューブの先端にあるベベルを切ります。
- 小腸での出現から約5 mmのリンパ管に虹彩ハサミ( 資料表を参照)で浅い切開を行います。
- カニューレチューブを細かい鉗子で持ち、先端のベベルをダクトにそっと挿入します。
注:カニューレを管に押し込みすぎないようにすると、収縮した臓器が元の位置に戻ったときにリンパの流れが妨げられる可能性があるため、重要です。 - リンパ管は、カテーテルを縫合糸で結ぶことに関連する操作にはあまりにも壊れやすいです。代わりに、シアノアクリレート接着剤( 材料の表を参照)を一滴使用して、リンパカニューレを腸間膜リンパ管に接着します。
- 乳白色のリンパ液(手術前のオリーブオイルの強制投与が使用された場合)またはリンパ瘻カニューレをすぐに流れ始める透明なリンパ液(マウスが手術前に絶食した場合)を確認します。
注:リンパカニューレが正常に配置され、リンパが流れていることを確認してください。十二指腸内カニューレの配置を続けます。 - 18 Gの針を使用して、幽門括約筋の後方の胃の幽門領域に穴を開けます。
- 十二指腸注入チューブ( 材料の表を参照)を胃のその穴から幽門括約筋を越えて十二指腸に約1〜2 mm挿入します。
- シルク5-0縫合糸( 材料表を参照)を使用して財布ひもで固定し、針を胃に当て、シアノアクリレート接着剤を一滴で密封して漏れを防ぎます。
- 5%グルコース-0.9%生理食塩水の十二指腸内注入を0.3 mL / hで開始します。.
注:体重のばらつきが少なく、約25 g(~8週齢)のマウスを使用する場合は、0.3 mL / hのグルコース/生理食塩水の注入が適切です。.マウスが劇的に大きい場合は、体重と血液量の変化を考慮して注入速度を上向きに調整する必要があります。 - 体腔内の臓器を交換し、筋肉組織と皮膚組織を別々に縫合(5-0)します。
注:リンパカニューレと十二指腸内栄養チューブは、どちらも同じ切開部で外装されています。チューブを縫合糸で分離するための優先順位はなく、チューブの外部化の角度は好みません。 - 手術後、麻酔薬を抜く前に、マウスをスナグル拘束具( 材料の表を参照)にそっと置き、運動性を制限します。.
注意: 寄り添う拘束は、マウスが頭をつかんだり回転させたりしてステッチやチューブを噛むのを防ぎます。 - 次に、マウスを回転子の透明なプレキシガラス箱に入れ、穏やかに揺らし、収容箱の側面に接着された温度制御された市販の両生類/爬虫類の加熱パッドを使用して温めます。封じ込めボックスの隅にある滅菌脱イオン水容器の形でも加湿を提供します(材料の表を参照)。
- イソフルランが回収される30分前に、マウスに2回目の鎮痛用量(Buprenex、0.1 mg / kg、i.p.)を投与します。.
- 実験に応じて、マウスに5%グルコース-0.9%生理食塩水の連続十二指腸内注入を0.3 mL / hの速度で1時間提供します。
注:5%グルコース-0.9%生理食塩水は、無菌性の厳格なガイドラインに従って、薬局からの滅菌生理食塩水バッグ(ヒト用、pH 7.4)と50%デキストロースのヒト用滅菌ボトルを使用して調製されます。溶液は新鮮にし、生理食塩水バッグまたはブドウ糖ボトルに記載されている有効期限を過ぎている場合は廃棄する必要があります。 - 表1に列挙した脂質の 1 つを実験用脂質としてマウスに十二指腸内カニューレ を介して 投与する( 材料の表を参照)。
注: 図1に示すすべてのデータについて、SMOFlipid(20%脂質注射用エマルジョン、USP、 材料表を参照)を十二指腸内注入しました。十二指腸内および十二指腸内脂質ボーラスの両方のこの注入は、リンパ管を通って排出される失われた液体を置き換え、絶対的な要件です。これで、マウスに実験的な脂質用量を注入する準備が整いました。 - 十二指腸内注入チューブを介して、0.3 mL脂質エマルジョンボーラス(SMOFlipid 20%脂質注射用エマルジョン、USP) の 古典的な脂質注入を実行します( 材料の表を参照)。
- 十二指腸内脂質のボーラス注入に続いて、注入を0.3 mL / hで5%グルコース-0.9%生理食塩水に戻します。
- 事前に計量した微量遠心チューブにリンパサンプルを60分間収集し、リンパ液を氷上に保ちます。チューブをもう一度計量して、60分ごとに分泌されるリンパ液の重量を確認します。
注:0.3 mLの脂質ボーラス後~6時間で、マウスあたり1時間あたり約50〜300 μLのリンパ液を収集することを期待してください。. - リンパ液は、脂質注入後最大6時間流れることがあります。6時間の時点で、イソフルランと頸部脱臼 を介して マウスを安楽死させます。
注:実験全体を通して動物を監視するために、外科医および/または検査技師が立ち会う必要があります。観察中は、リンパドレナージの血栓や、痛み/苦痛を示す動物の行動の変化に注意してください。実験中のいずれかの時点でリンパ管が詰まった場合、実験は終了し、動物は安楽死させる。動物は技術的には手術後最大24時間生き続けることができます(IACUC生存手術規則に従って)。しかし、生存率は時間とともに減少し、6時間は脂質吸収が 依然としてin vivo 生理機能を模倣している再現可能な生存期間であり、動物は生存に苦しんでいません。 - 安楽死後に終末組織採取を行う(ステップ3.1)。
注:術後6時間または24時間保持されたマウスの食事脂質吸収プロファイルの違いが最近テストされました44。24時間の処置は、動物の生存率とリンパ液への食物脂質の遠足を低下させることがわかりました。これらの理由から、6時間アプローチを強くお勧めします。この更新された手術デザインは、不必要な動物の死と術後の期間における動物の苦痛の可能性を減らします。これは、動物「交換、削減、改良」である実験動物ケア認定のための米国協会の主要な目標をサポートしています[参照PMID:21595115]。
3.管腔内容物および粘膜組織の収集
- 6時間の脂質注入期間の終わりに、イソフルランおよび頸部脱臼を介してマウスを屠殺する。胃、小腸、盲腸の両端を5-0縫合糸で結び、管腔内容物の漏れを防ぎます。
- 胃、盲腸、結腸を集め、それぞれを15mLのガラス管に入れます。小腸を3つまたは4つのセグメントに分割し、縦方向に切断した後、2〜3 mLの冷たいPBSで組織をすすぐことによって管腔内容物を収集します。
- 湾曲したピンセットで2〜3mLの冷たいPBSで各セクションをこすることによって、上皮細胞および関連する固有層を含む腸粘膜を筋肉層から除去する。
- すべての組織、管腔および粘膜分離株、および筋肉層をガラス管に入れ、各管に8 mLの2:1 vol/vol CHCl3:MeOHを加えます。
- Folch抽出後の液体シンチレーションカウントおよび/またはトリグリセリドアッセイキット( 材料の表を参照)によって放射能および/または脂質濃度を決定します45。
4. 薄層クロマトグラフィー(TLC)
- 内腔および粘膜単離物の総脂質を修飾Folch抽出45を介して抽出する。
- 抽出した脂質を窒素蒸発器下で溶媒中で乾燥させ、2:1 vol/vol のCHCl3:MeOHに再懸濁してから、TLCシリカゲルプレートにロードします(材料表を参照)。
- 石油エーテル、エチルエーテル、および氷酢酸の溶媒系(25:5:1 vol/vol/vol)を使用して脂質を分離します。ヨウ素蒸気を使用して、標準物質を含むさまざまな脂質を可視化します。
- モノグリセリド/リン脂質、ジグリセリド、脂肪酸、トリグリセリド、コレステロールエステルに対応するTLCプレート上のスポットを個々のシンチレーションバイアルにこすり落としてから、シンチレーションカウントのために4 mLのシンチレーション液( 材料の表を参照)を追加します。
- データを総ボーラス脂質用量のパーセントとして、または各サンプルで検出された総脂質の割合として表します。
5. カイロミクロンの分離と特性評価
- 結合したリンパサンプルを脂質ボーラス後6時間(ステップ2.29)から超遠心チューブに移し、0.9%NaCl(300-500μL)と混合し、適切な容量の0.87%NaCl(300-500μL)を注意深く重ねます。
- 超遠心分離機( 材料の表を参照)サンプルを110,000 x g で4°Cで16時間。単離されたカイロミクロンを含む上部画分を収集し、それらを新しいマイクロ遠心チューブに移します。
- 以下の手順に従って、カイロミクロントリグリセリド、コレステロール、およびapoB濃度を決定します。
- トリグリセリドおよびコレステロールアッセイキットを使用して、トリグリセリドおよびコレステロール濃度を測定します(材料表を参照)。
- 簡単に説明すると、2 μLのサンプルを200 μLの酵素試薬とともに、37°Cで96ウェルプレートで5分間インキュベートします。プレートリーダーを使用して、トリグリセリドの場合は500 nm、コレステロールの場合は600 nmでプレートを読み取ります。
注:濃度の計算には標準物質とブランクが使用されました。ApoB濃度は、マウスApoB ELISAキットを用いて決定した( 材料の表を参照されたい)。
- カイロミクロンの粒子サイズを決定します。
- TEMイメージングには、トリグリセリド濃度約40 mg/dLの新鮮なカイロミクロンサンプルを使用してください。簡単に説明すると、各サンプル5〜10 μLをTEMグリッドに置き、乾燥させます。
- 透過型電子顕微鏡でグリッドを調べ、画像を撮影します。リポタンパク質の粒子サイズを測定し、ImageJソフトウェアを使用して分析します(材料表を参照)。
結果
図2 は、腸間膜リンパにおけるトリグリセリド分泌および、ここで説明する1日リンパ瘻処置を受けた最新のn=17野生型(WT)マウスにおける平均リンパ流速を示す。 図2Aに示すように、リンパ液中のトリグリセリド濃度は、300μLのSMOFLipidの十二指腸内ボーラスに応答して増加します。ピークトリグリセリド濃度は、ボーラス後~2〜3時間で到達し、6時間(安楽死直前)まで着実に減少します。.トリグリセリド分泌と並行して、リンパ流速は時間0ボーラス注入から実験の終わりまで増加する(図2B)。
これらの結果は、腸間膜リンパ管と十二指腸内カニューレの両方の外科的移植が行われており、他のリンパ管内容物(ホルモン、ペプチド、栄養素)をベンチマークできるポジティブコントロールの代表であることを示しています。ボーラス十二指腸内脂質に応答してリンパ液中のトリグリセリド濃度に変化がない場合、これは手術が小腸に重大な損傷を引き起こし、脂質吸収能力が欠如していることを示すか、または以前に表現型化されていない遺伝子モデルでは、マウスが生理学的に意味のある脂質吸収の欠陥を持っていることを示唆しています。
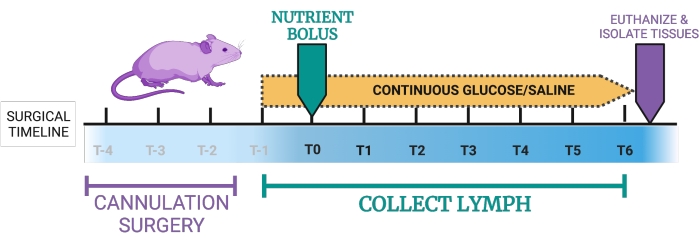
図1:リンパ瘻マウスモデルの提案されたタイムライン。 T−4、T−3、T−2:二重カニュレーションは約2〜4時間かかり、その後、マウスを回収チャンバーに配置する。T-1:マウスが回復期に入ると、5%グルコース-0.9%生理食塩水の連続十二指腸注入を受ける。T0:連続十二指腸内注入は、5%グルコース-0.9%生理食塩水から実験栄養素の注入に切り替えられます。T0-T6:マウスは、生理食塩水中の連続十二指腸内5%グルコース、または代わりに連続栄養素を投与されます。この期間中、リンパ液は毎時収集されます。エンドポイント:マウスを安楽死させ、組織を採取することができます。図は BioRender.com で作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
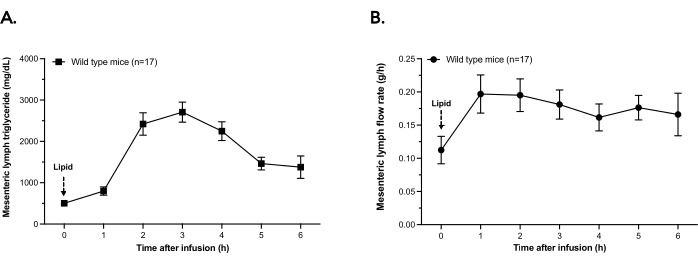
図2:腸間膜リンパトリグリセリド濃度と流速。 野生型マウスには、十二指腸内栄養チューブと腸間膜リンパカニューレを装着した。マウスは300μLの脂質のボーラス注入を受けた。リンパ液を毎時アリコートで6時間採取し、氷上に保持した。(a)リンパトリグリセリド含量は、リンパ液の各時間アリコート中の化学的アッセイによって決定した。(B)ボーラス注入後6時間で、リンパ流は1時間あたりに分泌されるリンパのグラム数としてプロットされます。ポイントはSEM±手段です。 この図の拡大版を表示するには、ここをクリックしてください。
| 脂質送達方法 | 推奨事項/手順 | |||||
| 混合脂質エマルジョンボーラス | 十二指腸内注入チューブを介して、( A )リポシンIII 20%脂質注射剤または (B) SMOFlipid 20%脂質注射用エマルジョン、USPのいずれかの0.3mL用量を使用できます。.これらの乳化脂質は、事前に調製する必要がなく、室温で液体であり、無菌であり、遊離脂肪酸、トリグリセリド、リン脂質、およびタウロコール酸ナトリウムの「消化しやすい」混合物を含むため、有用である。これは、膵臓または胆道の機能不全がある可能性のあるマウスに適したスターター注入です。 | |||||
| トリグリセリドボーラス | 不飽和脂肪、ラード(飽和脂肪含有量の高い食事を反映する)またはココナッツオイル(中鎖トリグリセリド含有量の高い食事を反映する)が豊富な食事を反映する中性脂質として、0.3mLの穏やかに温めたオリーブオイル(または精製トリオレイン)はすべて十二指腸内注入チューブまたは経口強制管栄養によって与えることができます。実験用トリグリセリドが飽和している場合は、室温で液体になるように温める必要があります。 | |||||
| ミックスミールボーラス | 0.3 mL脂肪0.075 g(21.6%)、炭水化物0.5 g(64.0%)、および0.1125 gタンパク質(14.4%)を含み、低脂肪混合食事を反映した製剤で、十二指腸内注入で投与できます。. | |||||
| 放射性標識脂質ボーラス | オリーブオイル0.3 mL中の5.0 μCi 3H標識グリセロールトリオレエートおよび/または1.0 μCi 14C-コレステロールは、十二指腸内注入を介して投与できます。14名C-コレステロール:コレステロール-[4-14C]の比活性は55Ci / mmolで、濃度は0.1mCi / mLです。3H-TGトリオレイン[9,10-3H(N)](3H-TG)比活性60Ci/mmol、濃度1mCi/mL | |||||
| 連続線量 | 上記の実験的栄養製剤のいずれかを0.3 mL / hの速度で注入すると(0.3 mLの総ボーラスではなく)、リンパ液へのトリグリセリドの安定した出力が得られます。.これは、リンパ液中のトリグリセリド濃度が~2〜3時間でピークに達し、その後~6〜8時間でベースライン濃度に戻るボーラス注入とは異なります。. | |||||
表1:脂質注入の表。
ディスカッション
元の2日間のリンパ瘻手順は、Bollmanら25によって記述され、過去45年間Patrick Tsoの研究室によって実践されました26,27。ここで紹介するプロトコルは、小腸の独特の乳び分泌物、および食事栄養素の吸収と代謝、腸ホルモン、腸管免疫のin vivoダイナミクスを識別、定量化、理解するためのこの古典的なゴールドスタンダードの方法への強力な追加です。
このモデルの利点には、(1)吸収、消化、または分泌のいずれかの間のある時点で静的サンプリングではなく、摂食および食後の期間を通じて腸間膜リンパを継続的にサンプリングできることが含まれます。(2)腸内ホルモンおよびサイトカインを血液中ではなく生理学的コンパートメント内で直接測定し、そこで希釈および酵素的に分解する17,44;(3)脂質ミールの摂取および腸間膜リンパ液中の内皮リパーゼの不在後に小腸から分泌されるリポタンパク質を単離、定量、および特徴付ける能力、これはカイロミクロントリグリセリド濃度および天然カイロミクロン構造を維持する46,47;(4)リンパ流量、トリグリセリドとコレステロール(または他の十二指腸注入化合物)の出力、カイロミクロン組成、および腸内ホルモン濃度を直接測定する能力。最後に、このプロトコルにより、6時間にわたって毎時>50μLのリンパ液を比較的大量に収集できます。体液に十二指腸内生理食塩水とブドウ糖注入が補充されるため、リンパ瘻モデルは他のリンパサンプリング技術よりも大幅に改善され、腸間膜リンパの静的プールではなく流動します。体積はリピドミック、プロテオミクス、メタボロームのアプローチにとって大きなハードルであるため、これは大きな強みです。
ここで説明する1日マウスリンパ瘻プロトコルは、手術後の生存率が高いため、前述の2日目のリンパ瘻プロトコルから総実験動物数の減少を含む、元のリンパ瘻プロトコルに比べていくつかの利点があります26,27;全体的な実験時間を2日から1日に短縮する。そして最後に、マウスの回復期間を、突発的な痛みや術後転帰不良が発生する可能性のある一晩(>18時間)から、より管理しやすい~術後6時間に短縮しました。
この1日プロトコルの特徴は、人道的な考慮事項とエンドポイントに焦点を当てていることです。これらは最優先されなければなりません:(1)動物は十二指腸内またはIV置換液を受けなければなりません。(2)それらは暖かく、できるだけ痛みのない状態に保たれなければなりません(実験デザインと抗炎症効果を回避する必要性に応じて、術後のブプレネックスおよび/またはカルプロフェンを使用)。(3)出血、震え、下痢、または苦痛の兆候はすべて、人道的なエンドポイントの説得力のある理由です。厳格なIACUCガイドラインによると、イソフルランとそれに続く頸部脱臼は良好なエンドポイントです。手術の生存率は1日で~70%(元の2日間の手術では~40%)ですが、研究者は苦痛の兆候で実験を終了することを躊躇しないでください。動物の数を計画する際には、これを考慮に入れる必要があります。
この技術のトラブルシューティングに関しては、リンパカニューレの正常な配置がこの外科的処置の主要なボトルネックです。手術の練習中は、手術の約2時間前に0.3mLのオリーブオイルをマウスに強制投与するのに役立ちます。これにより、腸間膜リンパ管へのカイロミクロンの分泌が引き起こされ、「乳白色」でより目立つようになります。メチレンブルーも使用できますが、乳白色のリンパ管ほど目立たないことがよくあります。リンパカニューレの留置および接着剤によるその配置の後に、腸間膜リンパがカニューレを通って収集血管にうまく流れている場合、十二指腸注入チューブの配置に進むことができる。時折、リンパ液は連続的に流れないかもしれませんが、動物が回転テーブルに置かれると再び流れ始めるかもしれません。重要なことに、リンパ管内の血栓に注意してください。これらは、リンパ管への逆流圧力を防ぐためにチューブからマッサージする必要があります。
トリグリセリド分泌およびリンパ流速に加えて、この技術を使用して、以下の脂質吸収動態およびカイロミクロン特性を決定することができる。
カイロミクロン分泌45,48,49
脂肪を含む食事の直後に、循環血漿トリグリセリドの一時的な上昇があります。.トリグリセリドは本質的に疎水性であるため、血液に可溶になるように最初に乳化する必要があります50。小腸腸細胞はこの役割を果たし、食事性トリグリセリドをカイロミクロン乳剤粒子51に包装する。カイロミクロンは、そのコアにコレステロールと食事性トリグリセリドを含み、apoB-48、apoA-I、apoA-IV、およびapoC-III52,53,54,55を含むリン脂質とアポリポタンパク質に囲まれています。ApoB-48は必須の構造タンパク質であり、他のアポリポタンパク質はカイロミクロンの代謝や血液からのクリアランスに必要な様々な機能を持っています。トリグリセリドやアポリポタンパク質の含有量など、カイロミクロンの主要な特性を判断するには、ここに示す1日リンパ瘻法を使用する必要があります。カイロミクロン分泌率は、リンパ液に分泌される注入された3H-トリグリセリドの割合であり、毎時のリンパサンプルをカウントすることによってシンチレーションによって測定されます。これは、詳細なカイロミクロン特性評価48、49、56、57、58と組み合わせることができる。毎時リンパサンプルは、組み合わせることも、別々に保管することもできます。リンパ液を超遠心チューブに移し、0.9%NaClと混合した後、300〜500μLの0.87%NaClを注意深く重ねます。次に、サンプルを110,000 x gで4°Cで16時間超遠心分離します。単離されたカイロミクロンを含むトップフラクションを収集し、トリグリセリドアッセイキットを使用してトリグリセリド濃度をテストします。簡単に説明すると、2 μLのカイロミクロン(1:10希釈)を200 μLの酵素試薬とともに室温で96ウェルプレートで10分間インキュベートします。プレートは500nmのプレートリーダーによって読み取られ、標準物質とブランクはトリグリセリド濃度の計算に使用されます。カイロミクロンサイズは、陰性染色および透過型電子顕微鏡(TEM)14,29によって決定できます。トリグリセリドおよびコレステロールは、化学的アッセイおよびアポリポタンパク質含有量(apoB-48、A-I、C-II、C-III)によってELISAキットまたはウェスタンブロットによって定量することができる。
脂質吸収の一次部位の決定48,59
3H-トリグリセリドまたは放射性標識混合食の注入後6時間で十二指腸、空腸、回腸の管腔および上皮細胞コンパートメントを単離することにより、内容物をフォルチ抽出して、3H-トリグリセリドのどれだけが上皮細胞膜を横切って吸収されるか(正常)、または小腸の長さに沿って内腔に保持されるか(異常)を決定する48.これらの研究は、消化管の運動性に潜在的な違いがある場合60、61、62、胆汁酸(脂質吸収全体で非常に活性が高く、回腸に再吸収される)63、64、65、66、または栄養素が間違った解剖学的位置(回腸または結腸)に吸収されているという懸念がある場合に特に影響を及ぼします67。、68,69,70。
吸収性上皮細胞への3H-トリグリセリド輸送のメカニズムの同定 48
これは、腸管腔で3H-トリグリセリドに加水分解されて3H-遊離脂肪酸に加水分解され、粘膜に吸収され、カイロミクロンとして分泌される前に細胞内の3H-トリグリセリドに再エステル化される割合を計算することによって行われる。これは、食事性トリグリセリドの分解生成物への移動とその後のカイロミクロンへの包装を示すために追跡できるため、吸収/分泌障害の強力なマーカーです。脂肪酸吸収機構(CD36、FABP、ACSL)、再エステル化経路(MGAT、DGAT、MTTP、apoB)、およびアポリポタンパク質(アポC-III、B-48、C-II、A-I、A-IV)のmRNA発現は、RT-PCRによってさらに定量することができます。
この技術の将来の用途は、腸器官クロストーク、代謝、免疫、栄養素吸収、環境食事汚染物質、またはGIシステムに関与するその他の疾患への関心によってのみ制限されます。重要な腸間膜リンパ系へのアクセスが困難なため、多くの説得力のある実験や仮説が行き詰まっている可能性があり、この視覚化されたプロトコルの目標は、この技術をより簡単に利用できるようにすることです。カイロミクロンとそれらが最初に存在する腸間膜リンパを分離することは、全身代謝を理解する上で重要な部分です。1日マウスリンパ瘻モデルは、これらの事象を研究するための強力な生理学的モデルである。
開示事項
著者は開示するものは何もありません。
謝辞
嚢胞性線維症財団(パイロットおよび実現可能性賞1810、ABK)、ライニン財団(シナジー賞、PI GJ RandolphおよびCo-I ABK)、および国立衛生研究所(R01DK118239、R03DK116011からABK)にこれらの研究を支援してくださったことに非常に感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride Injection, USP sterile | Hospira, Lake Forest, IL, US | NDC 0409-4888-06 | |
| 1.7 mL Eppendorf tubes | Fisher Scientific, Waltham, MA, US | 7200184 | |
| 14C-cholesterol: Cholesterol-[4-14C] (0.1mCi/ mL) | American Radiolabeled Chemicals Inc., St. Louis, MO, US | ARC 0857 | |
| 18 G needle | Becton Dickinson, Franklin Lakes, NJ, US | 305199 | |
| 2 Dumont micro-dissecting forceps | Fine Science Tools, Foster City, CA, US | 11251-35 | |
| 2 Forceps | ROBOZ Surgical Instrument Co., Gaithersburg, MD, US | RS-5130 | |
| 3H-TAG: Triolein [9,10-3H(N)] (3H-TG) (1mCi/ mL) | American Radiolabeled Chemicals Inc., St. Louis, MO, US | ART0199 | |
| 3H-TG Triolein [9,10-3H(N)] (3H-TG) | American Radiolabeled Chemicals, INC. St. Louis | MO 63146 | |
| 50% Dextrode Injection, USP 25grams/50 mL sterile | Hospira, Lake Forest, IL, US | NDC-0409-6648-16 | |
| Analtech TLC Uniplates: silica gel matrix Z265500-1PAK | Fisher Scientific, Waltham, MA, US | 11-101-0007 | |
| BD CareFusion ChloraPrep Swabstick | Fisher Scientific, Waltham, MA, US | 14-910-501 | |
| Betadine surgical scrub | Dynarex Corp., Orangeburg, NY, US | 1201 | |
| Bevel-cut cannula | Braintree Scientific., Braintree , MA, US | MRE025 | |
| Buprenorphine HCl Injection Carpuject PFS 0.3mg/mL 10/Bx (Buprenex) | HenrySchein, Warrendale, PA, US | 1278184 | |
| C57BL6/J male mice | Jackson Laboratory, Bar Harbor, Maine | ||
| ChloraPrep | Becton Dickinson, Franklin Lakes, NJ, US | 260100 | |
| Cholesterol Assay Kit | FujiFilm Healthcare, Lexington, MA, US | 99902601 | |
| Cholesterol-[4-14C] | American Radiolabeled Chemicals, INC. St. Louis | MO 63146 | |
| Clear plexiglass box L43cm X W26 X H 21 with temperature-controlled heating pad and humidification | our own design and modifications | ||
| commercially available amphibian/reptile heating pad | ShenZhen XingHongChang Electric CO., LTD. ShenZhen, China | XHC-F035D | |
| Cotton tip applicators | Fisher Scientific, Waltham, MA, US | 22363156 | |
| Duodenal infusion tube - canuala | Braintree Scientific, Braintree , MA, US | MRE037 | |
| Ensure | Abbott Nutrition, Columbus, OH | ||
| Heating pad surgical platform with circulating warm water pump combination | Patterson Scientific, Waukesha, WI, US | Gaymar T/Pump Classic | |
| Hetarin Sodium Injection, USP 1,000 units/mL sterile | Mylan, Morgantown, WV, US | NDC-67457-384-31 | |
| Image J Software | National Institute of Health, Bethesda, Maryland, | ||
| Iris scissors | ROBOZ Surgical Instrument Co., Gaithersburg, MD, US | RS-5602 | |
| Isoflurane | Piramal Pharma Solutions, Riverview, MI, US | NDC 66794-017-25 | |
| Isoflurane induction apparatus and Anesthesia Apparatus | Patterson Scientific, Waukesha, WI, US | mouse induction chamber | |
| Krazy glue | Elmer's products Inc., Columbus, OH, US | KG484 | |
| Liposyn III 20% lipid injectable | Hospira Inc. Lake Forest, Illinois, USA | ||
| LS 6500 Multi-Purpose Scintillation Counter | Beckman Coulter, Brea, CA | ||
| Micro-dissecting Spring Scissors | ROBOZ Surgical Instrument Co., Gaithersburg, MD, US | RS-5602 | |
| Mouse apoB ELISA Kit | ABCAM Inc., Waltham, MA, US | ab230932-1 | |
| Needle Holder | Fine Science Tools, Foster City, CA, US | 12002-12 | |
| Retractors | Kent Scientific Co., Torrington, CT, US | SURGI-5001 | |
| Rimadyl (Carprofen) | Zoetis Inc., Kalamazoo MI, US | 4019449 | |
| Rotating table Barnstead Thermolyne | Labquake, Zürich, Switzerland | Barnstead Thermolyne | |
| SMOFlipid 20% lipid injectable emulsion, USP | Fresenius Kabi, Warrendale, PA, US | NDC-63323-820-01 | |
| Snuggle | Lomir Biomedical Inc., Notre-Dame-de-l'Île-Perrot, QC J7V 7M4, Canada | MS 02.5PM | |
| Surgical Scissors | ROBOZ Surgical Instrument Co., Gaithersburg, MD, US | RS-5912SC | |
| Suture (5-0 silk with needle) | DemeTECH, Miami Lakes, FL, US | DT-719 | |
| Transmission Electron Microscope (JEOL 1400-FLASH 120KV ) | JEOL, Peabody, MA | ||
| Triglyceride Assay Kit | Randox Laboratories, Crumlin, United Kingdom | TR210 | |
| ULTIMA GOLD XR Scintillation Fluid | Perkin Elmer, Hebron, KY, US | 6013119 | |
| Ultracentrifuge, rotor S100AT4-497 | SORVALL RC M120 GX |
参考文献
- Natale, G., Bocci, G., Ribatti, D. Scholars and Scientists in the History of the Lymphatic System. Journal of Anatomy. 231 (3), 417-429 (2017).
- Loukas, M., et al. The lymphatic system: A historical perspective. Clinical Anatomy. 24 (7), 807-816 (2011).
- Suy, R., Thomis, S., Fourneau, I. The discovery of the lymphatic system in the seventeenth century. Part II: The discovery of Chyle vessels. Acta Chirurgica Belgica. 116 (5), 325-331 (2016).
- Azzali, G. Historical notes on the lymphatic vascular system. Acta Bio-medica de L'Ateneo Parmense. 61 (3-4), 113-125 (1990).
- Irschick, R., Siemon, C., Brenner, E. The history of anatomical research of lymphatics - From the ancient times to the end of the European Renaissance. Annals of Anatomy. 223, 49-69 (2019).
- Swartz, M. A. The physiology of the lymphatic system. Advanced Drug Delivery Reviews. 50 (1-2), 3-20 (2001).
- Deitch, E. A. Gut lymph and lymphatics: A source of factors leading to organ injury and dysfunction. Annals of the New York Academy of Sciences. 1207, 103-111 (2010).
- Tso, P., Gollamudi, S. R. Pluronic L-81: A potent inhibitor of the transport of intestinal chylomicrons. American Journal of Physiology. 247, 32-36 (1984).
- Tso, P., Karlstad, M. D., Bistrian, B. R., DeMichele, S. J. Intestinal digestion, absorption, and transport of structured triglycerides and cholesterol in rats. American Journal of Physiology. 268, 568-577 (1995).
- Mansbach, C. M., Dowell, R. F., Pritchett, D. Portal transport of absorbed lipids in rats. American Journal of Physiology. 261, 530-538 (1991).
- Bogunovic, M., et al. Origin of the lamina propria dendritic cell network. Immunity. 31 (3), 513-525 (2009).
- Balmer, M. L., et al. The liver may act as a firewall mediating mutualism between the host and its gut commensal microbiota. Science Translational Medicine. 6 (237), (2014).
- Ji, Y., Sakata, Y., Tso, P. Nutrient-induced inflammation in the intestine. Current Opinion in Clinical Nutrition & Metabolic Care. 14 (4), 315-321 (2011).
- Ji, Y., Sakata, Y., Yang, Q., Tso, P. Intestinal mucosal mast cells is activated by fat absorption. Gastroenterology. 140 (5), (2011).
- Wang, F., et al. Chronic high-fat feeding increases mixed meal-induced incretin secretion in Sprague-Dawley rats. American Journal of Physiology-Gastrointestinal and Liver Physiology. 309 (10), 807-815 (2015).
- Kindel, T. L., Yoder, S. M., D'Alessio, D. A., Tso, P. The effect of duodenal-jejunal bypass on glucose-dependent insulinotropic polypeptide secretion in Wistar rats. Obesity Surgery. 20 (6), 768-775 (2010).
- Kohan, A. B., Yoder, S. M., Tso, P. Using the lymphatics to study nutrient absorption and the secretion of gastrointestinal hormones. Physiology & Behavior. 105 (1), 82-88 (2011).
- Yoder, S. M., Yang, Q., Kindel, T. L., Tso, P. Stimulation of incretin secretion by dietary lipid: Is it dose dependent. American Journal of Physiology-Gastrointestinal and Liver Physiology. 297 (2), 299-305 (2009).
- Wang, Y., et al. Chylomicrons promote intestinal absorption and systemic dissemination of dietary antigen (ovalbumin) in mice. PLoS One. 4 (12), 8442 (2009).
- Vors, C., et al. Postprandial endotoxemia linked with chylomicrons and lipopolysaccharides handling in obese versus lean men: A lipid dose-effect trial. Journal of Clinical Endocrinology and Metabolism. 100 (9), 3427-3435 (2015).
- Ghoshal, S., Witta, J., Zhong, J., de Villiers, W., Eckhardt, E. Chylomicrons promote intestinal absorption of lipopolysaccharides. Journal of Lipid Research. 50 (1), 90-97 (2009).
- Jandacek, R. J., Rider, T., Keller, E. R., Tso, P. The effect of olestra on the absorption, excretion and storage of 2,2',5,5' tetrachlorobiphenyl; 3,3',4,4' tetrachlorobiphenyl; and perfluorooctanoic acid. Environment International. 36 (8), 880-883 (2010).
- Jandacek, R. J., Tso, P. Organochlorine compounds are absorbed via lymph and portal circulation. The FASEB Journal. 22, (2008).
- Utermann, G., Beisiegel, U. Apolipoprotein A-IV: A protein occurring in human mesenteric lymph chylomicrons and free in plasma. Isolation and quantification. European Journal of Biochemistry. 99 (2), 333-344 (1979).
- Bollman, J. L., Cain, J. C., Grindlay, J. H. Techniques for the collection of lymph from the liver, small intestine, or thoracic duct of the rat. Journal of Laboratory and Clinical Medicine. 33 (10), 1349-1352 (1948).
- Tso, P., Balint, J. A., Rodgers, J. B. Effect of hydrophobic surfactant (pluronic L-81) on lymphatic lipid transport in the rat. American Journal of Physiology. 239 (5), 348-353 (1980).
- Liu, M., et al. Sexual dimorphism in intestinal absorption and lymphatic transport of dietary lipids. Journal of Physiology. 599 (22), 5015-5030 (2021).
- Manolas, K. J., et al. Lymph, pancreatic and gastrointestinal hormones in response to feeding in the conscious pig. European Surgical Research. 17 (5), 324-332 (1985).
- Lascelles, A. K., Morris, B. Surgical techniques for the collection of lymph from unanaesthetized sheep. Quarterly Journal of Experimental Physiology and Cognate Medical Sciences. 46, 199-205 (1961).
- Jensen, L. T., Olesen, H. P., Risteli, J., Lorenzen, I. External thoracic duct-venous shunt in conscious pigs for long term studies of connective tissue metabolites in lymph. Laboratory Animal Science. 40 (6), 620-624 (1990).
- Edwards, G. A., Porter, C. J., Caliph, S. M., Khoo, S. M., Charman, W. N. Animal models for the study of intestinal lymphatic drug transport. Advanced Drug Delivery Reviews. 50 (1-2), 45-60 (2001).
- Yasunaga, K., Saito, S., Zhang, Y. -. L., Hernandez-Ono, A., Ginsberg, H. N. Effects of triacylglycerol and diacylglycerol oils on blood clearance, tissue uptake, and hepatic apolipoprotein B secretion in mice. Journal of Lipid Research. 48 (5), 1108-1121 (2007).
- Curtin, A., et al. Elevated triglyceride-rich lipoproteins in diabetes. A study of apolipoprotein B-48. Acta Diabetologica. 33 (3), 205-210 (1996).
- Gordts, P. L. S. M., et al. ApoC-III inhibits clearance of triglyceride-rich lipoproteins through LDL family receptors. Journal of Clinical Investigation. 126 (8), 2855-2866 (2016).
- Ginsberg, H. N., et al. Apolipoprotein B metabolism in subjects with deficiency of apolipoproteins CIII and AI. Evidence that apolipoprotein CIII inhibits catabolism of triglyceride-rich lipoproteins by lipoprotein lipase in vivo. The Journal of Clinical Investigation. 78 (5), 1287-1295 (1986).
- Ormai, S., Palkovits, M. Size distribution of lymphocytes in the thoracic duct lymph in rat after lymphocyte mobilization induced by polymethacrylic acid. Blut Zeitschrift für die Gesamte Blutforschung. 24 (3), 161-165 (1972).
- Luchoomun, J., Hussain, M. M. Assembly and secretion of chylomicrons by differentiated Caco-2 cells. Nascent triglycerides and preformed phospholipids are preferentially used for lipoprotein assembly. Journal of Biological Chemistry. 274 (28), 19565-19572 (1999).
- Nollevaux, G., et al. Development of a serum-free co-culture of human intestinal epithelium cell-lines (Caco-2/HT29-5M21). BMC Cell Biology. 7 (1), 20 (2006).
- Li, D., Dong, H., Kohan, A. B. The Isolation, Culture, and Propagation of Murine Intestinal Enteroids for the Study of Dietary Lipid Metabolism. Organoids. Methods in Molecular Biology. 1576, 195-204 (2019).
- Jattan, J. J., et al. Using murine-derived primary intestinal enteroids for studies of dietary triglyceride absorption and lipoprotein synthesis, and to determine the role of intestine-specific ApoC-III in the intestine. Journal of Lipid Research. 58 (5), 853-865 (2017).
- Haring, E., et al. Bile acids regulate intestinal antigen presentation and reduce graft-versus-host disease without impairing the graft-versus-leukemia effect. Haematologica. 106 (8), 2131-2146 (2021).
- Date, S., Sato, T. Mini-gut organoids: Reconstitution of the stem cell niche. Annual Review of Cell and Developmental Biology. 31 (1), 269-289 (2015).
- Deacon, C. F. Circulation and degradation of GIP and GLP-1. Hormone and Metabolic Research. 36 (11-12), 761-765 (2004).
- Dedousis, N., Teng, L., Kanshana, J. S., Kohan, A. B. A single-day mouse mesenteric lymph surgery in mice: an updated approach to study dietary lipid absorption, chylomicron secretion, and lymphocyte dynamics. J Lipid Res. 63 (11), 100284 (2022).
- Li, D., et al. Intestinal basolateral lipid substrate transport is linked to chylomicron secretion and is regulated by ApoC-III. Journal of Lipid Research. 60 (9), 1503-1515 (2019).
- Glatzle, J., et al. Chylomicron components mediate intestinal lipid-induced inhibition of gastric motor function. American Journal of Physiology-Gastrointestinal and Liver Physiology. 282 (1), 86-91 (2002).
- Huang, J., Sloop, C. H., Roheim, P. S., Wong, L. Lipoprotein lipase and hepatic triacylglycerol lipase activities in peripheral and skeletal muscle lymph. Arteriosclerosis, Thrombosis, and Vascular Biology. 10 (5), 720-726 (1990).
- Wang, F., et al. Overexpression of apolipoprotein C-III decreases secretion of dietary triglyceride into lymph. Physiological Reports. 2 (3), 00247 (2014).
- Kohan, A. B., et al. Apolipoprotein A-IV regulates chylomicron metabolism-Mechanism and function. American Journal of Physiology. Gastrointestinal and Liver Physiology. 302 (6), 628-636 (2012).
- Hayashi, H., et al. Fat feeding increases size, but not number, of chylomicrons produced by small intestine. American Journal of Physiology. 259 (5), 709-719 (1990).
- Tso, P., Balint, J. A. Formation and transport of chylomicrons by enterocytes to the lymphatics. American Journal of Physiology. 250 (6), 715-726 (1986).
- Bhattacharya, S., Redgrave, T. G. The content of apolipoprotein B in chylomicron particles. Journal of Lipid Research. 22 (5), 820-828 (1981).
- Björkegren, J., Karpe, F., Milne, R. W., Hamsten, A. Differences in apolipoprotein and lipid composition between human chylomicron remnants and very low density lipoproteins isolated from fasting and postprandial plasma. Journal of Lipid Research. 39 (7), 1412-1420 (1998).
- Martins, I. J., Sainsbury, A. J., Mamo, J. C., Redgrave, T. G. Lipid and apolipoprotein B48 transport in mesenteric lymph and the effect of hyperphagia on the clearance of chylomicron-like emulsions in insulin-deficient rats. Diabetologia. 37 (3), 238-246 (1994).
- Mar, R., et al. Association of the APOLIPOPROTEIN A1/C3/A4/A5 gene cluster with triglyceride levels and LDL particle size in familial combined hyperlipidemia. Circulation Research. 94 (7), 993-999 (2004).
- Kassis, T., et al. Dual-channel in-situ optical imaging system for quantifying lipid uptake and lymphatic pump function. Journal of Biomedical Optics. 17 (8), 086005 (2012).
- Nauli, A. M., et al. Chylomicrons produced by Caco-2 cells contained ApoB-48 with diameter of 80-200 nm. Physiological Reports. 2 (6), 192-196 (2014).
- Drover, V. A., et al. CD36 deficiency impairs intestinal lipid secretion and clearance of chylomicrons from the blood. Journal of Clinical Investigation. 115 (5), 1290-1297 (2005).
- Kohan, A. B., et al. Is apolipoprotein A-IV rate limiting in the intestinal transport and absorption of triglyceride. American Journal of Physiology-Gastrointestinal and Liver Physiology. 304 (12), 1128-1135 (2013).
- De Lisle, R. C. Altered transit and bacterial overgrowth in the cystic fibrosis mouse small intestine. American Journal of Physiology-Gastrointestinal and Liver Physiology. 293 (1), 104-111 (2007).
- Debas, H. T., Farooq, O., Grossman, M. I. Inhibition of gastric emptying is a physiological action of cholecystokinin. Gastroenterology. 68 (5), 1211-1217 (1975).
- Spiller, R. C., et al. Further characterisation of the 'ileal brake' reflex in man--Effect of ileal infusion of partial digests of fat, protein, and starch on jejunal motility and release of neurotensin, enteroglucagon, and peptide YY. Gut. 29 (8), 1042-1051 (1988).
- Battle, M. A., et al. GATA4 is essential for jejunal function in mice. Gastroenterology. 135 (5), 1676-1686 (2008).
- Morgan, R. G., Borgström, B. The mechanism of fat absorption in the bile fistula rat. Quarterly Journal of Experimental Physiology and Cognate Medical Sciences. 54 (2), 228-243 (1969).
- Davidson, N. O., Kollmer, M. E., Glickman, R. M. Apolipoprotein B synthesis in rat small intestine: Regulation by dietary triglyceride and biliary lipid. Journal of Lipid Research. 27 (1), 30-39 (1986).
- Bouchi, R., et al. FOXO1 inhibition yields functional insulin-producing cells in human gut organoid cultures. Nature Communications. 5, 4242 (2014).
- Bijvelds, M. J. C., et al. Fat absorption in cystic fibrosis mice is impeded by defective lipolysis and post-lipolytic events. American Journal of Physiology-Gastrointestinal and Liver Physiology. 288 (4), 646-653 (2005).
- Struyvenberg, M. R., Martin, C. R., Freedman, S. D. Practical guide to exocrine pancreatic insufficiency - Breaking the myths. BMC Medicine. 15 (1), 29 (2017).
- Tickell, K. D., Atlas, H. E., Walson, J. L. Environmental enteric dysfunction: A review of potential mechanisms, consequences and management strategies. BMC Medicine. 17 (1), 181 (2019).
- Lo, C. M., et al. Cholecystokinin knockout mice are resistant to high-fat diet-induced obesity. Gastroenterology. 138 (5), 1997-2005 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved