Method Article
Die Isolierung von fließender mesenterialer Lymphe in Mäusen zur Quantifizierung der in vivo Kinetik der diätetischen Lipidabsorption und Chylomikron-Sekretion
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt ein detailliertes chirurgisches Protokoll zur Isolierung von fließender Darmlymphe als Reaktion auf intraduodenale Nährstoffinfusionen bei Mäusen. Dies ermöglicht die physiologische Bestimmung der gesamten intestinalen Lipidabsorption und der Chylomikronsynthese und -sekretion als Reaktion auf verschiedene experimentelle Nährstoffe.
Zusammenfassung
Darmlipoproteine, insbesondere triglyceridreiche Chylomikronen, sind ein wichtiger Treiber von Stoffwechsel, Entzündungen und Herz-Kreislauf-Erkrankungen. Die Isolierung von intestinalen Lipoproteinen in vivo ist jedoch sehr schwierig, da sie zunächst aus dem Dünndarm in die mesenterialen Lymphgefäße sezerniert werden. Die Chylomikron-haltige Lymphe entleert sich dann aus dem Ductus thoracicus in die Vena subclavia, um die Bestandteile der Mahlzeit an das Herz, die Lunge und schließlich an den gesamten Körperkreislauf zu liefern. Es ist unmöglich, naive Chylomikronen aus dem Blut zu isolieren, da Chylomikron-Triglyceride sofort nach der Interaktion mit der Lipoproteinlipase und anderen im Kreislauf befindlichen Lipoproteinrezeptoren hydrolysiert werden. Daher wurde das ursprüngliche 2-tägige Lymphfistelnverfahren, das von Bollman et al. bei Ratten beschrieben wurde, in der Vergangenheit verwendet, um frische mesenteriale Lymphe vor ihrem Eintritt in die thorakale Vene zu isolieren. Dieses Protokoll wurde in den letzten 45 Jahren vom Labor von Patrick Tso verbessert und professionalisiert, was die Analyse dieser kritischen Lipoproteine und Sekrete aus dem Darm ermöglicht. Das Verfahren der Tso-Lymphfistel wurde nun aktualisiert und wird hier erstmals visuell dargestellt. Bei diesem überarbeiteten Verfahren handelt es sich um eine eintägige Operationstechnik zur Anlage einer duodenalen Ernährungssonde, zur Kanülierung des mesenterialen Lymphgangs und zur Entnahme von Lymphe nach einer Mahlzeit bei bewussten Mäusen. Zu den Hauptvorteilen dieser neuen Techniken gehört die Fähigkeit, Lymphe von Mäusen reproduzierbar zu sammeln (was die Leistungsfähigkeit genetischer Mausmodelle nutzt); die verkürzte Anästhesiezeit bei Mäusen während der Implantation des Zwölffingerdarm-Infusionsschlauchs und der Lymphkanüle; die Fähigkeit, während der gesamten Fütterungs- und postprandialen Phase kontinuierlich Lymphproben zu entnehmen; die Fähigkeit, Hormone und Zytokine vor ihrer Verdünnung und enzymatischen Hydrolyse im Blut quantitativ zu messen; und die Fähigkeit, große Mengen Lymphe zu sammeln, um intestinale Lipoproteine zu isolieren. Diese Technik ist ein leistungsfähiges Werkzeug zur direkten und quantitativen Messung der Nährstoffaufnahme über die Nahrung, der intestinalen Lipoproteinsynthese und der Chylomikronsekretion.
Einleitung
Die physiologische Bedeutung des mesenterialen Lymphsystems
Die mesenterialen Lymphgefäße wurden in irgendeiner Form seit ~300 v. Chr. beschrieben, als Herophilos das hepatische Pfortadersystem und alle "absorbierenden Venen im Darm" beschrieb1,2,3,4,5. Mehr als 1.700 Jahre nach dieser Erstbeschreibung war das Vorhandensein von Milchflüssigkeit in der mesenterialen Lymphe kurz nach einer Mahlzeit ein bestimmendes Merkmal der intestinalen Lymphe3. Inzwischen weiß man, dass milchige, Chylomikron-haltige Lymphe ("chylöse" Lymphe) nicht in Pfortader und Leber abfließt, sondern durch die Cisterna chyli in den Ductus thoracicus wandert und sich schließlich an der linken Vena subclavia6 mit dem Blut verbindet. Aufgrund dieser anatomischen Anordnung wandert die chylöse Lymphe zunächst durch Herz und Lunge, bevor sie durch den Rest des Körpers zirkuliert. Das bedeutet, dass Herz und Lunge einen "First-Pass" bei den Sekreten in die mesenteriale Lymphe7 erhalten.
Eine wichtige Rolle der mesenterialen Lymphgefäße ist der Transport von Nahrungslipiden aus dem Dünndarm 8,9,10. Anatomisch, Chylomikronen, intestinale Immunzellen 11,12,13,14, Darmhormone 15,16,17,18, Antigene 19,20,21, nicht-chylomikronische lipophile Verbindungen22,23 und überschüssige Flüssigkeit gelangt in die Laktelen, die unter der Basalmembran der Enterozyten liegen, und wird dann durch die Lymphkapillaren zu den mesenterialen Lymphknoten konzentriert. Wahrscheinlich gibt es viele unbekannte mesenteriale lymphatische Komponenten, darunter Metaboliten, Antigene, Umweltschadstoffe, Nährstoffe und Signalmoleküle.
Die Bestandteile der mesenterialen Lymphe wurden nicht systematisch identifiziert, was vor allem auf die Schwierigkeit zurückzuführen ist, mesenteriale Lymphe zu isolieren. Der Zugang zur mesenterialen Lymphe war schon immer eine ernsthafte Herausforderung, da die Lymphkanäle farblos sind und außer nach einer fetthaltigen Mahlzeit, wenn sie chylös und milchig werden, die mesenterialen Lymphgefäße farblose Lymphflüssigkeit enthalten 6,8,9,10.
Aktuelle und gängige Methoden zur Isolierung der Darmlymphe
Mesenteriale Lymphe ist beim Menschen nicht zugänglich (außer in seltenen und extremen Fällen, in denen ein schweres Magen-Darm-Trauma aufgetreten ist)24. Die In-vivo-Lymphentnahme ist chirurgisch komplex und anspruchsvoll. Das ursprüngliche 2-tägige Lymphfistelverfahren wurde von Bollman et al.25 beschrieben und in den letzten 45 Jahren vom Labor von Patrick Tso verbessert und professionalisiert 26,27. Das Lymphfistelverfahren ermöglicht es den Forschern, fließende Lymphe von bewussten Tieren während einer 6-stündigen Zwölffingerdarmlipidinfusion zu entnehmen.
Das Lymphfistelmodell wurde hauptsächlich bei Ratten verwendet, um die Lymphflussrate, die Ausscheidung von Triglyceriden und Cholesterin (oder anderen mit Duodenal angereicherten Verbindungen), die Chylomikronzusammensetzung und die intestinalen Hormonkonzentrationen zu messen. In geringerem Maße kann diese Technik auch bei Mäusen angewendet werden, wobei das chirurgische Überleben und das Lymphvolumen darunter leiden. Aufgrund der Schwierigkeiten, mesenteriale Lymphkanäle zu sehen, umfassten historische Methoden die Kanülierung von mesenterialer Lymphe bei größeren Tieren wie Minischweinen28, Schafen29, Schweinen30, Hunden31 und Ratten17. Die Arbeit mit diesen größeren Modellen ist ressourcenintensiv und erlaubt keine Studien in Knock-in- oder Knock-out-Modellen.
Es wurden auch alternative Ansätze verwendet. Chylomikronen können im postprandialen Zustand aus Blut isoliert werden (obwohl diese teilweise durch Plasma-Lipoproteinlipase hydrolysiert werden)32,33,34,35. Der Ductus thoracicus kann ebenfalls kanüliert werden, wobei die dort gesammelte Lymphe eine Beimischung aus mesenterialer Lymphe und extraintestinaler Lymphdrainage enthält26,36. In vitro sezernieren Caco-2-Zellen als Reaktion auf eine Fettsäurebehandlung ein Chylomikron-ähnliches Partikel, und diese Zellen können mit relevanten lymphatischen Endothel- oder Gefäßzellen kokultiviert werden37,38. Es wurde gezeigt, dass intestinale Organoidkulturen von Mensch und Maus apikale Lipide verarbeiten und Chylomikronen sezernieren 39,40,41,42. Diese Modelle sind sehr vorteilhaft und ermöglichen mechanistische Einblicke in die Dünndarmphysiologie, aber sie können die Komplexität, die physikalisch-chemischen Gradienten oder den dynamischen Lymphfluss von in situ mesenterialen Lymphgefäßen nicht abbilden.
Vorteile des hier vorgestellten 1-Tages-Maus-Lymphfistelnmodells
In Bezug auf diese anderen Methoden zur Isolierung von intestinalen Lipoproteinen gilt die Tso Lab Lymphfistelntechnik traditionell als Goldstandardtechnik zur Messung der Aufnahme von Nahrungsnährstoffen in die mesenteriale Lymphe. Diese In-vivo-Technik hat den Vorteil, dass sie wichtige physiologische Aspekte der diätetischen Lipidabsorption erfasst - das dynamische Erscheinungsbild von Verbindungen während der Absorptionszeit, was die wiederholte Probenahme von fließender mesenterialer Lymphe bei lebenden Tieren mit zwölffingerdarmen Nährstoffen erfordert. Bei dieser Operationstechnik werden auch Darmhormone und Zytokine direkt in ihrem physiologischen Kompartiment und nicht im Blut gemessen, wo sie verdünnt und enzymatisch abgebaut werden17,43.
Wenn die experimentelle Fragestellung ein Verständnis der Dynamik der Lipidsekretion oder der dynamischen Absorption und des Stoffwechsels einer hydrophoben GI-Verbindung oder eines Medikaments erfordert, dann ist diese Technik nicht nur geeignet, sondern auch der einzige Ansatz, der die Bewegung des luminalen Inhalts vom proximalen zum distalen Darm (Magen zum Dickdarm) und von der apikalen zur basolateralen Oberfläche (luminaler Inhalt über Enterozyten zu Milchprodukten und Pfortaderzirkulation) interpoliert. Da bei dieser Technik die luminale Abgabe von Nährstoffen durch den intraduodenalen Katheter verwendet wird und die fließende mesenteriale Lymphe umgeleitet und gesammelt wird, steht der gesamte Resorptionsapparat unter experimenteller Kontrolle und kann zur qualitativen Beurteilung von Dünndarm-Resorptionsprofilen verwendet werden.
Zum ersten Mal visuell vorgestellt wird hier ein großes Update des Tso Lab Lymphfistelnmodells, das (1) die experimentelle Zeit auf eine 1-tägige chirurgische Implantation und experimentelle Entnahmezeit reduziert; (2) verbessert das Überleben der Mäuse und den Tierschutz; und (3) erhöht die Reproduzierbarkeit des Ansatzes in Mäusen, die Leistungsfähigkeit genetischer Mausmodelle zu nutzen. Diese Technik muss als Goldstandard für alle experimentellen Fragen der Darmsekretion, der Lipoproteine oder der diätetischen Lipidabsorption angesehen werden und ist die beste Technik für die High-Fidelity-Bestimmung der Lipidabsorptionskinetik und der Chylomikronen.
Protokoll
Alle chirurgischen Eingriffe wurden vom University of Pittsburgh Internal Animal Care and Use Committee [Protokoll # 20047008] genehmigt und entsprechen dem NIH-Leitfaden für die Pflege und Verwendung von Labortieren. Für die vorliegende Studie wurden männliche C57BL6/J-Mäuse im Alter von 8-14 Wochen verwendet. Die Mäuse wurden aus einer kommerziellen Quelle bezogen (siehe Materialtabelle). Alle Mäuse wurden in einem 12-stündigen Hell/Dunkel-Zyklus mit Ad-libitum-Zugang zu Standardfutter und Wasser untergebracht.
1. Vorbereitung der Tiere
- Füttern Sie die Mäuse je nach Versuchsaufbau oder lassen Sie sie fasten.
HINWEIS: Ein nächtliches Fasten ist unnötig, es sei denn, es bestehen Bedenken hinsichtlich Unterschieden in der Magenentleerungsrate. - Induzieren Sie die Anästhesie mit 5 % Isoflurangas und sorgen Sie für eine ordnungsgemäße Anästhesie durch Schwanz- und Zehenkneifen. Halten Sie die Mäuse nach der Betäubung auf einer geeigneten Anästhesieebene mit 2%-3%igem Isoflurangas und positionieren Sie sie mit Klebeband auf der chirurgischen Plattform.
- Halten Sie die Mäuse auf einer beheizten chirurgischen Plattform, die zirkulierendes warmes Wasser verwendet, warm (siehe Materialtabelle).
2. Chirurgie und Versuchsplanung
- Beginnen Sie die Operation, indem Sie Tiersalbe auf die Augen auftragen, den Bauch rasieren und ein antiseptisches chirurgisches Peeling (siehe Materialtabelle) auf die Operationsstelle auftragen. Dadurch wird der Schnitt sterilisiert und die Bildung von Fell in der Luft während des Mittellinienschnitts reduziert.
- Sorgen Sie für einen sterilen Arbeitsbereich, indem Sie sterile Instrumente, Vorhänge und andere benötigte Geräte und Verbrauchsmaterialien verwenden.
- Injizieren Sie die erste Dosis Carprofen (siehe Materialtabelle) zur Schmerzlinderung (i.p.) in einer Dosis von 5 mg/kg.
- Fassen Sie die Haut mit einer Pinzette und machen Sie mit einer kleinen Schere einen Bauchschnitt in der Mittellinie. Schneiden Sie in Richtung Brustbein (niemals darüber) und schneiden Sie bis zum Leistenfett ab. Schneiden Sie dann die Muskelschicht separat mit der Schere durch.
Anmerkungen: Sterilisieren Sie alle Geräte vor dem Gebrauch. - Bewegen Sie mit dem Retraktor die Peritonealeingeweide aus dem Weg, bis der Lymphgang sichtbar ist.
- Bewegen Sie die Leber mit einem mit Kochsalzlösung getränkten Wattestäbchen (siehe Materialtabelle) in Richtung der oberen rechten Körperseite und den Darm und den Magen links vom Tier.
- Dehnen Sie den Zwölffingerdarm quer nach links, um die Arteria mesenterica superior und den intestinalen Lymphgang freizulegen.
- Bereiten Sie einen 30-40 cm langen Kanülenschlauch vor, indem Sie eine stumpfe Nadel in den Kanülenschlauch einführen (siehe Materialtabelle) und spülen Sie eine kleine Menge Heparin (1.000 E/L) mit einer 1-ml-Spritze durch den Schlauch.
HINWEIS: Der Lymphfluss wird durch die Schwerkraft unterstützt, um auf Eis nach unten und in die Mikrozentrifugen-Sammelröhrchen zu fließen. Je nachdem, wo sich der Sammeleiskübel neben dem chirurgischen Aufbau befindet, muss die Länge des Kanülenschlauchs möglicherweise angepasst werden. - Schneiden Sie mit einer Schere eine Fase an der Spitze des Kanülenschlauchs.
- Machen Sie mit einer Irisschere ( siehe Materialtabelle) einen flachen Schnitt im Lymphgang, etwa 5 mm von ihrem Erscheinungsbild im Dünndarm entfernt.
- Halten Sie den Kanülenschlauch mit einer feinen Pinzette fest und führen Sie die Spitzenfase vorsichtig in den Kanal ein.
HINWEIS: Es ist wichtig, die Kanüle nicht zu weit in den Gang zu schieben, da dies den Lymphfluss verhindern kann, wenn die zurückgezogenen Organe in ihre ursprüngliche Position zurückgebracht werden. - Der Lymphgang ist viel zu fragil für die Manipulationen, die mit dem Einbinden des Katheters mit einer Naht verbunden sind. Verwenden Sie stattdessen einen Tropfen Cyanacrylatkleber (siehe Materialtabelle), um die Lymphkanüle in den mesenterialen Lymphgang zu kleben.
- Achten Sie auf die milchige, weiße Lymphe (wenn vor der Operation Olivenöl-Sonde verwendet wurde) oder klare Lymphe (wenn Mäuse vor der Operation nüchtern waren), die sofort durch die Lymphfistelkanüle zu fließen beginnt.
Anmerkungen: Überprüfen Sie, ob die Lymphkanüle erfolgreich platziert wurde und die Lymphe fließt. Fahren Sie mit der Platzierung der intraduodenalen Kanüle fort. - Punktieren Sie mit einer 18-G-Nadel ein Loch durch die Pylorusregion des Magens hinter dem Pylorusschließmuskel.
- Führen Sie den Zwölffingerdarm-Infusionsschlauch (siehe Materialtabelle) durch dieses Loch im Magen bis etwa 1-2 mm über den Pylorusschließmuskel hinaus in den Zwölffingerdarm ein.
- Mit einer Ligatur aus Seide 5-0 ( siehe Materialtabelle) mit einer Nadel am Bauch befestigen und mit einem Tropfen Cyanacrylatkleber verschließen, um ein Auslaufen zu verhindern.
- Beginnen Sie mit der intraduodenalen Infusion von 5 % Glukose und 0,9 % Kochsalzlösung bei 0,3 ml/h.
HINWEIS: Bei der Verwendung von Mäusen mit geringen Abweichungen im Körpergewicht, die etwa 25 g (~ 8 Wochen alt) sind, ist die Infusion von 0,3 ml/h Glukose/Kochsalzlösung angemessen. Wenn Mäuse dramatisch größer sind, muss die Infusionsrate nach oben angepasst werden, um die Veränderung des Körpergewichts und des Blutvolumens zu berücksichtigen. - Ersetzen Sie die Organe in der Körperhöhle und nähen Sie das Muskel- und Hautgewebe getrennt (5-0).
HINWEIS: Die Lymphkanüle und die intraduodenale Ernährungssonde werden beide durch denselben Schnitt exteriorisiert. Es gibt keinen Präzedenzfall für die Trennung der Röhrchen mit einer Naht und keine Bevorzugung des Exteriorisationswinkels der Röhrchen. - Legen Sie die Mäuse nach der Operation, aber vor dem Absetzen der Betäubung, vorsichtig in Kuschelfesseln (siehe Materialtabelle), um die Motilität zu begrenzen.
Anmerkungen: Die Kuschelfesseln verhindern, dass die Mäuse den Kopf greifen oder drehen, um auf den Stichen und Schläuchen zu kauen. - Legen Sie die Mäuse dann in eine durchsichtige Plexiglasbox auf einen Rotator mit sanftem Schaukeln und erwärmen Sie sie mit einem temperaturgesteuerten, handelsüblichen Amphibien-/Reptilien-Heizkissen, das an der Seite der Eindämmungsbox angebracht ist. Sorgen Sie für eine Befeuchtung auch in Form von sterilen Behältern für deionisiertes Wasser an den Ecken des Containment-Kastens (siehe Materialtabelle).
- 30 Minuten vor dem Absetzen des Isoflurans verabreichen Sie den Mäusen ihre zweite Schmerzmitteldosis (Buprenex, 0,1 mg/kg, i.p.).
- Je nach Experiment erhalten die Mäuse eine kontinuierliche intraduodenale Infusion von 5 % Glukose-0,9 % Kochsalzlösung mit einer Rate von 0,3 ml/h für 1 h.
HINWEIS: Die 5%ige Glukose-0,9%ige Kochsalzlösung wird unter Verwendung eines sterilen Kochsalzbeutels (für den menschlichen Gebrauch, pH 7,4) aus der Apotheke und einer sterilen Flasche für den menschlichen Gebrauch von 50% Dextrose gemäß strengen Richtlinien für die Sterilität hergestellt. Die Lösung muss frisch hergestellt und entsorgt werden, wenn das auf dem Kochsalzbeutel oder der Dextroseflasche angegebene Verfallsdatum überschritten ist. - Verabreichen Sie den Mäusen eines der in Tabelle 1 aufgeführten Lipide als experimentelles Lipid über eine intraduodenale Kanüle (siehe Materialtabelle).
HINWEIS: Für alle in Abbildung 1 gezeigten Daten wurde SMOFlipid (20 % lipidinjizierbare Emulsion, USP, siehe Materialtabelle) intraduodenal infundiert. Diese Infusion sowohl prä- als auch postintraduodenaler Lipidbolus ersetzt die verlorene Flüssigkeit, die durch den Lymphgang abfließt, und ist eine absolute Voraussetzung. Die Mäuse sind nun bereit, mit einer experimentellen Lipiddosis infundiert zu werden. - Führen Sie die klassische Lipidinfusion eines 0,3-ml-Lipidemulsionsbolus (SMOFlipid 20% lipid injectable emulsion, USP) über das intraduodenale Infusionsröhrchen durch (siehe Materialtabelle).
- Nach der Bolusinfusion von intraduodenalen Lipiden wird die Infusion bis zum Ende des Experiments kontinuierlich auf 5 % Glukose-0,9 % Kochsalzlösung bei 0,3 ml/h umgestellt.
- Sammeln Sie die Lymphproben 60 Minuten lang in vorgewogenen Mikrozentrifugenröhrchen und halten Sie die Lymphe auf Eis. Wiegen Sie die Röhrchen ein zweites Mal, um das Gewicht der Lymphe zu bestimmen, die alle 60 Minuten ausgeschieden wird.
HINWEIS: Rechnen Sie mit einer Entnahme von ca. 50-300 μl Lymphe pro Stunde und Maus in den ~6 Stunden nach einem 0,3-ml-Lipidbolus. - Die Lymphe kann nach der Lipidinfusion bis zu 6 h fließen. Zum 6-Stunden-Zeitpunkt werden die Mäuse mittels Isofluran und zervikaler Luxation eingeschläfert.
HINWEIS: Ein Chirurg und/oder Labortechniker sollte anwesend sein, um die Tiere während des gesamten Experiments zu überwachen. Achten Sie während der Beobachtung auf Gerinnsel in der Lymphdrainage und Veränderungen im Verhalten der Tiere, die auf Schmerzen/Stress hinweisen. Wenn der Lymphgang zu irgendeinem Zeitpunkt während des Versuchs verstopft ist, wird der Versuch abgebrochen und das Tier eingeschläfert. Das Tier kann technisch gesehen bis zu 24 Stunden nach der Operation am Leben erhalten werden (gemäß den Regeln der IACUC-Überlebenschirurgie). Die Überlebensraten nehmen jedoch mit der Zeit ab, und 6 h ist eine reproduzierbare Überlebenszeit, in der die Lipidabsorption immer noch die In-vivo-Physiologie nachahmt und das Tier keine Überlebensprobleme hat. - Führen Sie nach der Euthanasie eine terminale Gewebeentnahme durch (Schritt 3.1).
HINWEIS: Der Unterschied in den diätetischen Lipidabsorptionsprofilen bei Mäusen, die 6 Stunden oder 24 Stunden nach der Operation gehalten wurden, wurde kürzlich getestet44. Wir fanden heraus, dass das 24-Stunden-Verfahren die Überlebensraten der Tiere und die Auswanderung von Nahrungslipiden in die Lymphe reduziert. Aus diesen Gründen empfehlen wir dringend den 6-Stunden-Ansatz. Dieses aktualisierte chirurgische Design reduziert unnötige Tiertode und das Potenzial für Tierstress in der postoperativen Phase. Dies unterstützt ein Hauptziel der American Association for Accreditation of Laboratory Animal Care, nämlich das "Replacement, Reduction, Refinement" [ref PMID: 21595115].
3. Entnahme von luminalen Inhalten und Schleimhautgewebe
- Am Ende der 6-stündigen Lipidinfusionsperiode werden die Mäuse mittels Isofluran und Zervixluxation geopfert. Binden Sie beide Enden des Magens, des Dünndarms und des Blinddarms mit 5-0-Nähten zusammen, um ein Auslaufen des luminalen Inhalts zu vermeiden.
- Sammeln Sie den Magen, den Blinddarm und den Dickdarm und geben Sie sie jeweils in ein 15-ml-Glasröhrchen. Teilen Sie den Dünndarm in drei oder vier Segmente und sammeln Sie den luminalen Inhalt, indem Sie das Gewebe nach dem Aufschneiden in Längsrichtung mit 2-3 ml kaltem PBS spülen.
- Entfernen Sie die Darmschleimhaut mit Epithelzellen und der zugehörigen Lamina propria aus der Muskelschicht, indem Sie jeden Abschnitt mit einer gebogenen Pinzette in 2-3 ml kaltem PBS abkratzen.
- Legen Sie das gesamte Gewebe, die luminalen und mukosalen Isolate und die Muskelschicht in Glasröhrchen und geben Sie 8 ml 2:1 vol/vol CHCl3:MeOH in jedes Röhrchen.
- Bestimmen Sie die Radioaktivitäts- und/oder Lipidkonzentrationen durch Flüssigszintillationszählung und/oder ein Triglycerid-Assay-Kit (siehe Materialtabelle) nach der Folch-Extraktion45.
4. Dünnschichtchromatographie (TLC)
- Extrahieren Sie die Gesamtlipide der luminalen und mukosalen Isolate über eine modifizierte Folch-Extraktion45.
- Trocknen Sie die extrahierten Lipide im Lösungsmittel unter einem Stickstoffverdampfer und resuspendieren Sie sie dann in 2:1 vol/vol CHCl3:MeOH, bevor Sie sie auf eine TLC-Kieselgelplatte laden (siehe Materialtabelle).
- Trennen Sie die Lipide mit einem Lösungsmittelsystem aus Petrolether, Ethylether und Eisessig (25:5:1 vol/vol/vol). Verwenden Sie Joddampf für die Visualisierung verschiedener Lipide, einschließlich Standards.
- Kratzen Sie die Stellen auf der TLC-Platte, die Monoglycerid/Phospholipid, Diglyceriden, Fettsäuren, Triglycerid und Cholesterinester entsprechen, in einzelne Szintillationsfläschchen, bevor Sie 4 ml der Szintillationsflüssigkeit (siehe Materialtabelle) zur Szintillationszählung hinzufügen.
- Geben Sie die Daten entweder als Prozentsatz der gesamten Boluslipiddosis oder als Bruchteil des gesamten für jede Probe nachgewiesenen Lipids an.
5. Isolierung und Charakterisierung von Chylomikron
- Die kombinierten Lymphproben aus dem 6-stündigen Post-Lipid-Bolus (Schritt 2.29) werden in Ultrazentrifugenröhrchen überführt, mit 0,9 % NaCl (300-500 μl) gemischt und dann vorsichtig mit einem entsprechenden Volumen von 0,87 % NaCl (300-500 μl) überzogen.
- Ultrazentrifugieren (siehe Materialtabelle) die Proben bei 110.000 x g bei 4 °C für 16 h. Sammeln Sie die oberste Fraktion mit isolierten Chylomikronen und übertragen Sie sie in ein neues Mikrozentrifugenröhrchen.
- Bestimmen Sie die Chylomikron-Triglycerid-, Cholesterin- und ApoB-Konzentrationen, indem Sie die folgenden Schritte ausführen.
- Bestimmen Sie die Triglycerid- und Cholesterinkonzentrationen mit einem Triglycerid- und Cholesterin-Testkit (siehe Materialtabelle).
- Inkubieren Sie kurz 2 μl der Proben mit 200 μl Enzymreagenz bei 37 °C für 5 min in einer 96-Well-Platte. Lesen Sie die Platte mit einem Plattenlesegerät bei 500 nm für Triglyceride und 600 nm für Cholesterin ab.
ANMERKUNG: Für die Berechnung der Konzentrationen wurden Standards und Leerproben verwendet. Die ApoB-Konzentrationen wurden mit dem Mouse ApoB ELISA Kit bestimmt (siehe Materialtabelle).
- Bestimmen Sie die Chylomikron-Partikelgröße.
- Verwenden Sie frische Chylomikron-Proben mit Triglyceridkonzentrationen von etwa 40 mg/dl für die TEM-Bildgebung. Geben Sie kurz 5-10 μL jeder Probe auf ein TEM-Gitter und trocknen Sie sie ab.
- Untersuchen Sie das Gitter mit einem Transmissionselektronenmikroskop und nehmen Sie Bilder auf. Messen Sie die Partikelgrößen der Lipoproteine und analysieren Sie sie mit der ImageJ-Software (siehe Materialtabelle).
Ergebnisse
Abbildung 2 zeigt die Triglyceridsekretion in mesenterialer Lymphe und die durchschnittlichen Lymphflussraten bei den letzten n = 17 Wildtyp-Mäusen (WT), die sich der hier beschriebenen eintägigen Lymphfistelnprozedur unterzogen haben. Wie in Abbildung 2A dargestellt, steigt die Triglyceridkonzentration in der Lymphe als Reaktion auf einen intraduodenalen Bolus von 300 μl SMOFLipid an. Die maximale Triglyceridkonzentration wird ~2-3 h nach dem Bolus erreicht und nimmt während der 6-stündigen Zeit (unmittelbar vor der Euthanasie) stetig ab. Parallel zur Triglyceridsekretion steigt die Lymphflussrate von der Bolusinfusion zum Zeitpunkt 0 bis zum Ende des Experiments an (Abbildung 2B).
Diese Ergebnisse zeigen, dass die chirurgische Implantation sowohl des mesenterialen Lymphgangs als auch der intraduodenalen Kanüle stattgefunden hat und sind repräsentativ für eine Positivkontrolle, mit der andere lymphatische Inhalte (Hormone, Peptide, Nährstoffe) verglichen werden konnten. Kommt es zu keiner Veränderung der Triglyceridkonzentration in der Lymphe als Reaktion auf die intraduodenalen Boluslipide, signalisiert dies, dass die Operation den Dünndarm erheblich geschädigt hat, so dass die Lipidaufnahmekapazität fehlt, oder, in bisher nicht phänotypisierten Genmodellen, würde dies darauf hindeuten, dass die Maus einen physiologisch bedeutsamen Defekt in der Lipidabsorption hat.
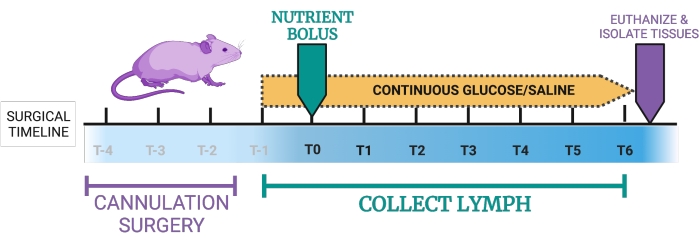
Abbildung 1: Vorgeschlagener Zeitplan für das Mausmodell der Lymphfistel. T-4, T-3, T-2: Die Doppelkanülierung dauert ca. 2-4 h, gefolgt von der Platzierung der Mäuse in Auffangkammern. T-1: Sobald sich die Mäuse in der Erholungsphase befinden, erhalten sie eine kontinuierliche Duodenalinfusion mit 5 % Glukose und 0,9 % Kochsalzlösung. T0: Die kontinuierliche intraduodenale Infusion wird von 5 % Glukose-0,9 % Kochsalzlösung auf eine Infusion experimenteller Nährstoffe umgestellt. T0-T6: Mäuse erhalten kontinuierlich intraduodenale 5% Glukose in Kochsalzlösung oder alternativ kontinuierliche Nährstoffe. In dieser Zeit wird stündlich Lymphe entnommen. Endpunkt: Mäuse werden eingeschläfert und Gewebe kann entnommen werden. Die Figur wurde mit BioRender.com erstellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
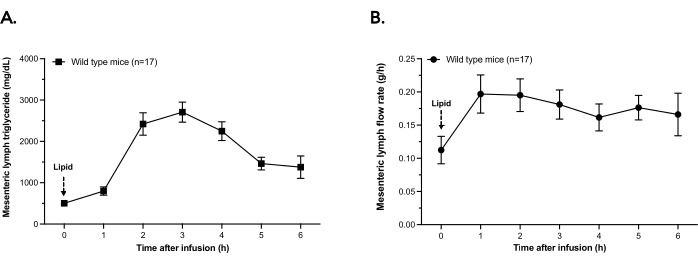
Abbildung 2: Triglyceridkonzentration und Flussrate der mesenterialen Lymphe. Wildtyp-Mäuse wurden mit einer intraduodenalen Ernährungssonde und einer mesenterialen Lymphkanüle versorgt. Die Mäuse erhielten eine Bolusinfusion von 300 μl Lipid. Die Lymphe wurde für 6 h in stündlichen Aliquots gesammelt und auf Eis gehalten. (A) Der Lymphtriglyceridgehalt wurde durch einen chemischen Assay in jedem stündlichen Aliquot der Lymphe bestimmt. (B) In den 6 Stunden nach der Bolusinfusion wird der Lymphfluss in Gramm Lymphe aufgetragen, die pro Stunde ausgeschieden werden. Punkte sind Mittelwerte ± SEM. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Methoden der Lipidverabreichung | Empfehlungen/Hinweise | |||||
| Gemischter Lipidemulsionsbolus | Eine 0,3-ml-Dosis von entweder (A ) Liposyn III 20 % Lipid injizierbar oder (B) SMOFlipid 20 % Lipid injizierbare Emulsion, USP, über ein intraduodenales Infusionsrohr kann verwendet werden. Diese emulgierten Lipide sind nützlich, weil sie nicht im Voraus zubereitet werden müssen, bei Raumtemperatur flüssig sind, steril sind und weil sie eine "leicht verdauliche" Mischung aus freien Fettsäuren, Triglycerid, Phospholipiden und Natriumtaurocholat enthalten. Dies ist eine gute Starterinfusion für Mäuse, die möglicherweise eine Bauchspeicheldrüsen- oder Gallenschwäche haben. | |||||
| Triglycerid-Bolus | 0,3 ml sanft erwärmtes Olivenöl (oder gereinigtes Triolein) als neutrales Lipid, das eine Ernährung widerspiegelt, die reich an ungesättigten Fettsäuren ist, Schmalz (spiegelt eine Diät mit hohem Gehalt an gesättigten Fettsäuren wider) oder Kokosöl (spiegelt eine Ernährung mit hohem Gehalt an mittelkettigen Triglyceriden wider) können alle über eine intraduodenale Infusionssonde oder eine orale Sonde verabreicht werden. Wenn das experimentelle Triglycerid gesättigt ist, muss es bei Raumtemperatur flüssig erwärmt werden. | |||||
| Gemischter Mahlzeit-Bolus | 0,3 ml Stellen Sie sicher, dass die Formulierung 0,075 g Fett (21,6 %), 0,5 g Kohlenhydrate (64,0 %) und 0,1125 g Protein (14,4 %) enthält und eine fettarme Mischmahlzeit widerspiegelt, kann als intraduodenale Infusion verabreicht werden. | |||||
| Radioaktiv markierter Lipidbolus | 5,0 μCi 3 H-markiertes Glycerintrioleat und/oder 1,0 μCi 14C-Cholesterin in 0,3ml Olivenöl können als intraduodenale Infusion verabreicht werden. 14 C-Cholesterin: Cholesterin-[4-14C] mit spezifischer Aktivität von 55Ci/mmol und einer Konzentration von 0,1mCi/ml. 3 H-TG-Triolein [9,10-3H(N)] (3H-TG) mit spezifischer Aktivität von 60Ci/mmol und Konzentration von 1mCi/ml | |||||
| Kontinuierliche Dosis | Die Infusion einer der oben genannten experimentellen Nährstoffformulierungen mit einer Rate von 0,3 ml/h (anstelle von 0,3 ml Gesamtbolus) führt zu einer gleichmäßigen Ausscheidung von Triglyceriden in die Lymphe. Dies unterscheidet sich von einer Bolusinfusion, bei der die Triglyceridkonzentration in der Lymphe nach ~2–3 h ihren Höhepunkt erreicht und dann nach ~6–8 h wieder auf den Ausgangswert zurückkehrt. | |||||
Tabelle 1: Tabelle der Lipidinfusionen.
Diskussion
Das ursprüngliche 2-tägige Lymphfistelnverfahren wurde von Bollman et al.25 beschrieben und in den letzten 45 Jahren im Labor von Patrick Tso praktiziert26,27. Das hier vorgestellte Protokoll ist eine leistungsstarke Ergänzung zu dieser klassischen Goldstandard-Methode zur Identifizierung, Quantifizierung und zum Verständnis der einzigartigen chylösen Sekrete des Dünndarms sowie der In-vivo-Dynamik der Nährstoffaufnahme und des Stoffwechsels in der Nahrung, der Darmhormone und der Darmimmunität.
Zu den Vorteilen dieses Modells gehören (1) die Möglichkeit, während der gesamten Fütterungs- und postprandialen Periode kontinuierlich Proben aus mesenterialer Lymphe zu entnehmen, anstatt eine statische Probenahme zu einem bestimmten Zeitpunkt während der Absorption, Verdauung oder Sekretion durchzuführen; (2) die Messung von Darmhormonen und Zytokinen direkt in ihrem physiologischen Kompartiment und nicht im Blut, wo sie verdünnt und enzymatisch abgebaut werden17,44; (3) die Fähigkeit, die vom Dünndarm nach der Einnahme einer Lipidmahlzeit sezernierten Lipoproteine zu isolieren, zu quantifizieren und zu charakterisieren, und das Fehlen von Endothellipasen in der mesenterialen Lymphe, wodurch die Chylomikron-Triglyceridkonzentrationen und die native Chylomikronstruktur erhaltenbleiben 46,47; (4) die Fähigkeit, die Lymphflussrate, die Ausscheidung von Triglyceriden und Cholesterin (oder anderen duodenal-infundierten Verbindungen), die Chylomikron-Zusammensetzung und die intestinale Hormonkonzentration direkt zu messen. Schließlich ermöglicht dieses Protokoll die stündliche Entnahme relativ großer Mengen von >50 μl Lymphe über einen Zeitraum von 6 Stunden. Da die Flüssigkeit mit intraduodenaler Kochsalzlösung und Glukoseinfusion aufgefüllt wird, wird das Lymphfistelmodell im Vergleich zu anderen Lymphentnahmetechniken deutlich verbessert und führt zu fließenden statt statischen Pools von mesenterialer Lymphe. Da das Volumen eine große Hürde für lipidomische, proteomische und metabolomische Ansätze darstellt, ist dies eine große Stärke.
Das hier beschriebene 1-Tages-Lymphfistelprotokoll der Maus hat mehrere Vorteile gegenüber dem ursprünglichen Lymphfistelnprotokoll, einschließlich einer Verringerung der Gesamtzahl der Versuchstiere gegenüber den zuvor beschriebenen 2-Tage-Lymphfistelnprotokollen26,27 aufgrund einer höheren Überlebensrate nach der Operation; Verkürzung der Gesamtversuchszeit von 2 Tagen auf einen Tag; und schließlich eine Verkürzung der Erholungsphase für Mäuse von Nacht (>18 h), wo Durchbruchschmerzen oder schlechte postoperative Ergebnisse auftreten können, auf eine überschaubarere Zeit von ~6 h nach der Operation.
Ein Merkmal dieses 1-Tages-Protokolls ist der Fokus auf humane Überlegungen und Endpunkte. Diese müssen höchste Priorität haben: (1) Tiere müssen intraduodenale oder intravenöse Ersatzflüssigkeiten erhalten; (2) sie müssen warm und so schmerzfrei wie möglich gehalten werden (mit postoperativem Buprenex und/oder Carprofen, je nach Versuchsaufbau und Notwendigkeit, entzündungshemmende Wirkungen zu vermeiden); (3) Blutungen, Zittern, Durchfall oder Anzeichen von Stress sind zwingende Gründe für einen humanen Endpunkt. Gemäß den strengen IACUC-Richtlinien ist Isofluran gefolgt von einer Zervixluxation ein guter Endpunkt. Die chirurgischen Überlebensraten betragen ~70% für einen einzigen Tag (im Vergleich zu ~40% für die ursprüngliche 2-tägige Operation), aber die Forscher sollten nicht zögern, das Experiment bei einem Anzeichen von Stress zu beenden. Dies sollte bei der Planung der Tierzahlen berücksichtigt werden.
In Bezug auf die Fehlersuche bei dieser Technik ist die erfolgreiche Platzierung der Lymphkanüle der größte Engpass bei diesem chirurgischen Eingriff. Während des Übens der Operation hilft es, die Maus ca. 2 Stunden vor der Operation mit 0,3 ml Olivenöl zu versorgen. Dies führt zur Sekretion von Chylomikronen in den mesenterialen Lymphgang, wodurch dieser "milchig" und sichtbarer erscheint. Methylenblau kann ebenfalls verwendet werden, ist aber oft weniger offensichtlich als der milchige Lymphgang. Wenn nach dem Einsetzen der Lymphkanüle und dem Einsetzen mit Klebstoff die mesenteriale Lymphe erfolgreich durch die Kanüle in ein Auffanggefäß fließt, kann mit dem Legen eines Duodenal-Infusionsschlauchs fortgefahren werden. Gelegentlich kann es vorkommen, dass die Lymphe nicht kontinuierlich fließt, aber wieder zu fließen beginnt, wenn das Tier auf den Drehtisch gelegt wird. Achten Sie vor allem auf Gerinnsel in den Lymphschläuchen. Diese sollten aus den Eileitern herausmassiert werden, um einen Rückflussdruck auf den Lymphgang zu vermeiden.
Neben der Triglyceridsekretion und der Lymphflussrate können mit dieser Technik die folgenden Lipidabsorptionskinetiken und Chylomikron-Eigenschaften bestimmt werden:
Chylomikron-Sekretion45,48,49
Unmittelbar nach einer fetthaltigen Mahlzeit kommt es zu einem vorübergehenden Anstieg des zirkulierenden Plasmatriglycerids. Da Triglyceride von Natur aus hydrophob sind, müssen sie zunächst emulgiert werden, damit sie im Blut löslich sind50. Dünndarmenterozyten übernehmen diese Rolle und verpacken diätetische Triglyceride in Chylomikron-Emulsionspartikel51. Chylomikronen enthalten Cholesterin und Triglyceride aus der Nahrung in ihrem Kern, umgeben von Phospholipiden und Apolipoproteinen, darunter apoB-48, apoA-I, apoA-IV und apoC-III 52,53,54,55. ApoB-48 ist das essentielle Strukturprotein, und die anderen Apolipoproteine haben verschiedene Funktionen, die für den Chylomikron-Stoffwechsel und die Ausscheidung aus dem Blut erforderlich sind. Um die wichtigsten Merkmale von Chylomikronen, einschließlich ihres Triglycerid- und Apolipoproteingehalts, zu bestimmen, sollte die hier gezeigte 1-Tages-Lymphfisteltechnik verwendet werden. Die Chylomikron-Sekretionsrate ist der Prozentsatz des infundierten 3-H-Triglycerids, der in die Lymphe sezerniert und durch Szintillation durch Zählung stündlicher Lymphproben gemessen wird. Dies kann mit einer detaillierten Chylomikron-Charakterisierungkombiniert werden 48,49,56,57,58. Stündliche Lymphproben können kombiniert oder separat aufbewahrt werden. Die Lymphe wird in Ultrazentrifugenröhrchen überführt, mit 0,9 % NaCl gemischt und dann vorsichtig mit 300-500 μl 0,87 % NaCl überlagert. Die Proben werden dann bei 110.000 x g bei 4 °C für 16 h ultrazentrifugiert. Die obersten Fraktionen, die isolierte Chylomikronen enthalten, werden gesammelt und mit dem Triglycerid-Assay-Kit auf Triglyceridkonzentrationen getestet. Kurz gesagt werden 2 μl des Chylomikrons (1:10 Verdünnung) mit 200 μl Enzymreagenz bei Raumtemperatur für 10 min in einer 96-Well-Platte inkubiert. Die Platte wird von einem Plattenleser bei 500 nm gelesen, und die Standards und Leerzeichen werden für die Berechnung der Triglyceridkonzentrationen verwendet. Die Chylomikrongröße kann dann durch negative Färbung und Transmissionselektronenmikroskopie (TEM) bestimmt werden14,29. Triglyceride und Cholesterin können durch chemische Assays und den Apolipoproteingehalt (apoB-48, A-I, C-II, C-III) mit ELISA-Kits oder Western Blot quantifiziert werden.
Bestimmung des primären Ortes der Lipidabsorption 48,59
Durch Isolieren der luminalen und epithelialen Zellkompartimente des Zwölffingerdarms, des Jejunums und des Ileums 6 h nach der Infusion von 3 H-Triglyceriden oder einer radioaktiv markierten Mischmahlzeit wird der Inhalt Folch extrahiert, um zu bestimmen, wie viel des 3H-Triglycerids über die Epithelzellmembran absorbiert wird (normal) oder im Lumen (abnormal) entlang der Länge des Dünndarms zurückgehalten wird48 . Diese Studien sind besonders wirkungsvoll, wenn es potenzielle Unterschiede in der gastrointestinalen Motilität gibt 60,61,62, wenn es eine Hypothese bezüglich Gallensäurengibt (hochaktiv während der gesamten Lipidresorption und selbst im Ileum resorbiert)63,64,65,66, oder wenn die Sorge besteht, dass Nährstoffe an der falschen anatomischen Stelle (Ileum oder sogar Dickdarm) absorbiert werden67 ,68,69,70.
Identifizierung der Mechanismen des Transports von 3-H-Triglyceriden in absorptive Epithelzellen48
Dies geschieht durch Berechnung des Prozentsatzes von 3 H-Triglyceriden, die im Darmlumen zu 3 H-freier Fettsäure hydrolysiert, in die Schleimhaut aufgenommen und vor der Sekretion als Chylomikronen wieder in intrazelluläre 3H-Triglyceride verestert werden. Dies ist ein starker Marker für Absorptions-/Sekretionsdefekte, da er zurückverfolgt werden kann, um die Bewegung von Triglyceriden aus der Nahrung in seine Abbauprodukte und die anschließende Verpackung in Chylomikronen zu zeigen. Die mRNA-Expression der Fettsäureabsorptionsmaschinerie (CD36, FABPs, ACSLs), des Wiederveresterungsweges (MGAT, DGAT, MTTP, apoB) und der Apolipoproteine (apoC-III, B-48, C-II, A-I, A-IV) kann mittels RT-PCR weiter quantifiziert werden.
Zukünftige Anwendungen dieser Technik sind nur durch das Interesse an Darm-Organ-Crosstalk, Stoffwechsel, Immunität, Nährstoffaufnahme, Umweltschadstoffen oder anderen Krankheiten, die eine Rolle im Magen-Darm-System spielen, begrenzt. Es ist wahrscheinlich, dass viele überzeugende Experimente und Hypothesen aufgrund der Schwierigkeit, Zugang zum kritischen mesenterialen Lymphsystem zu erhalten, ins Stocken geraten sind, und das Ziel dieses visualisierten Protokolls ist es, diese Technik leichter verfügbar zu machen. Die Isolierung von Chylomikronen und der mesenterialen Lymphe, in der sie sich ursprünglich befinden, ist ein entscheidender Teil des Verständnisses des Ganzkörperstoffwechsels. Das 1-Tages-Maus-Lymphfistel-Modell ist ein leistungsfähiges physiologisches Modell zur Untersuchung dieser Ereignisse.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken der Cystic Fibrosis Foundation (Pilot and Feasibility Award 1810, an ABK), der Rainin Foundation (Synergy Award, an PI GJ Randolph und Co-I ABK) und den National Institutes of Health (R01DK118239, R03DK116011 an ABK) für ihre Unterstützung dieser Studien.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride Injection, USP sterile | Hospira, Lake Forest, IL, US | NDC 0409-4888-06 | |
| 1.7 mL Eppendorf tubes | Fisher Scientific, Waltham, MA, US | 7200184 | |
| 14C-cholesterol: Cholesterol-[4-14C] (0.1mCi/ mL) | American Radiolabeled Chemicals Inc., St. Louis, MO, US | ARC 0857 | |
| 18 G needle | Becton Dickinson, Franklin Lakes, NJ, US | 305199 | |
| 2 Dumont micro-dissecting forceps | Fine Science Tools, Foster City, CA, US | 11251-35 | |
| 2 Forceps | ROBOZ Surgical Instrument Co., Gaithersburg, MD, US | RS-5130 | |
| 3H-TAG: Triolein [9,10-3H(N)] (3H-TG) (1mCi/ mL) | American Radiolabeled Chemicals Inc., St. Louis, MO, US | ART0199 | |
| 3H-TG Triolein [9,10-3H(N)] (3H-TG) | American Radiolabeled Chemicals, INC. St. Louis | MO 63146 | |
| 50% Dextrode Injection, USP 25grams/50 mL sterile | Hospira, Lake Forest, IL, US | NDC-0409-6648-16 | |
| Analtech TLC Uniplates: silica gel matrix Z265500-1PAK | Fisher Scientific, Waltham, MA, US | 11-101-0007 | |
| BD CareFusion ChloraPrep Swabstick | Fisher Scientific, Waltham, MA, US | 14-910-501 | |
| Betadine surgical scrub | Dynarex Corp., Orangeburg, NY, US | 1201 | |
| Bevel-cut cannula | Braintree Scientific., Braintree , MA, US | MRE025 | |
| Buprenorphine HCl Injection Carpuject PFS 0.3mg/mL 10/Bx (Buprenex) | HenrySchein, Warrendale, PA, US | 1278184 | |
| C57BL6/J male mice | Jackson Laboratory, Bar Harbor, Maine | ||
| ChloraPrep | Becton Dickinson, Franklin Lakes, NJ, US | 260100 | |
| Cholesterol Assay Kit | FujiFilm Healthcare, Lexington, MA, US | 99902601 | |
| Cholesterol-[4-14C] | American Radiolabeled Chemicals, INC. St. Louis | MO 63146 | |
| Clear plexiglass box L43cm X W26 X H 21 with temperature-controlled heating pad and humidification | our own design and modifications | ||
| commercially available amphibian/reptile heating pad | ShenZhen XingHongChang Electric CO., LTD. ShenZhen, China | XHC-F035D | |
| Cotton tip applicators | Fisher Scientific, Waltham, MA, US | 22363156 | |
| Duodenal infusion tube - canuala | Braintree Scientific, Braintree , MA, US | MRE037 | |
| Ensure | Abbott Nutrition, Columbus, OH | ||
| Heating pad surgical platform with circulating warm water pump combination | Patterson Scientific, Waukesha, WI, US | Gaymar T/Pump Classic | |
| Hetarin Sodium Injection, USP 1,000 units/mL sterile | Mylan, Morgantown, WV, US | NDC-67457-384-31 | |
| Image J Software | National Institute of Health, Bethesda, Maryland, | ||
| Iris scissors | ROBOZ Surgical Instrument Co., Gaithersburg, MD, US | RS-5602 | |
| Isoflurane | Piramal Pharma Solutions, Riverview, MI, US | NDC 66794-017-25 | |
| Isoflurane induction apparatus and Anesthesia Apparatus | Patterson Scientific, Waukesha, WI, US | mouse induction chamber | |
| Krazy glue | Elmer's products Inc., Columbus, OH, US | KG484 | |
| Liposyn III 20% lipid injectable | Hospira Inc. Lake Forest, Illinois, USA | ||
| LS 6500 Multi-Purpose Scintillation Counter | Beckman Coulter, Brea, CA | ||
| Micro-dissecting Spring Scissors | ROBOZ Surgical Instrument Co., Gaithersburg, MD, US | RS-5602 | |
| Mouse apoB ELISA Kit | ABCAM Inc., Waltham, MA, US | ab230932-1 | |
| Needle Holder | Fine Science Tools, Foster City, CA, US | 12002-12 | |
| Retractors | Kent Scientific Co., Torrington, CT, US | SURGI-5001 | |
| Rimadyl (Carprofen) | Zoetis Inc., Kalamazoo MI, US | 4019449 | |
| Rotating table Barnstead Thermolyne | Labquake, Zürich, Switzerland | Barnstead Thermolyne | |
| SMOFlipid 20% lipid injectable emulsion, USP | Fresenius Kabi, Warrendale, PA, US | NDC-63323-820-01 | |
| Snuggle | Lomir Biomedical Inc., Notre-Dame-de-l'Île-Perrot, QC J7V 7M4, Canada | MS 02.5PM | |
| Surgical Scissors | ROBOZ Surgical Instrument Co., Gaithersburg, MD, US | RS-5912SC | |
| Suture (5-0 silk with needle) | DemeTECH, Miami Lakes, FL, US | DT-719 | |
| Transmission Electron Microscope (JEOL 1400-FLASH 120KV ) | JEOL, Peabody, MA | ||
| Triglyceride Assay Kit | Randox Laboratories, Crumlin, United Kingdom | TR210 | |
| ULTIMA GOLD XR Scintillation Fluid | Perkin Elmer, Hebron, KY, US | 6013119 | |
| Ultracentrifuge, rotor S100AT4-497 | SORVALL RC M120 GX |
Referenzen
- Natale, G., Bocci, G., Ribatti, D. Scholars and Scientists in the History of the Lymphatic System. Journal of Anatomy. 231 (3), 417-429 (2017).
- Loukas, M., et al. The lymphatic system: A historical perspective. Clinical Anatomy. 24 (7), 807-816 (2011).
- Suy, R., Thomis, S., Fourneau, I. The discovery of the lymphatic system in the seventeenth century. Part II: The discovery of Chyle vessels. Acta Chirurgica Belgica. 116 (5), 325-331 (2016).
- Azzali, G. Historical notes on the lymphatic vascular system. Acta Bio-medica de L'Ateneo Parmense. 61 (3-4), 113-125 (1990).
- Irschick, R., Siemon, C., Brenner, E. The history of anatomical research of lymphatics - From the ancient times to the end of the European Renaissance. Annals of Anatomy. 223, 49-69 (2019).
- Swartz, M. A. The physiology of the lymphatic system. Advanced Drug Delivery Reviews. 50 (1-2), 3-20 (2001).
- Deitch, E. A. Gut lymph and lymphatics: A source of factors leading to organ injury and dysfunction. Annals of the New York Academy of Sciences. 1207, 103-111 (2010).
- Tso, P., Gollamudi, S. R. Pluronic L-81: A potent inhibitor of the transport of intestinal chylomicrons. American Journal of Physiology. 247, 32-36 (1984).
- Tso, P., Karlstad, M. D., Bistrian, B. R., DeMichele, S. J. Intestinal digestion, absorption, and transport of structured triglycerides and cholesterol in rats. American Journal of Physiology. 268, 568-577 (1995).
- Mansbach, C. M., Dowell, R. F., Pritchett, D. Portal transport of absorbed lipids in rats. American Journal of Physiology. 261, 530-538 (1991).
- Bogunovic, M., et al. Origin of the lamina propria dendritic cell network. Immunity. 31 (3), 513-525 (2009).
- Balmer, M. L., et al. The liver may act as a firewall mediating mutualism between the host and its gut commensal microbiota. Science Translational Medicine. 6 (237), (2014).
- Ji, Y., Sakata, Y., Tso, P. Nutrient-induced inflammation in the intestine. Current Opinion in Clinical Nutrition & Metabolic Care. 14 (4), 315-321 (2011).
- Ji, Y., Sakata, Y., Yang, Q., Tso, P. Intestinal mucosal mast cells is activated by fat absorption. Gastroenterology. 140 (5), (2011).
- Wang, F., et al. Chronic high-fat feeding increases mixed meal-induced incretin secretion in Sprague-Dawley rats. American Journal of Physiology-Gastrointestinal and Liver Physiology. 309 (10), 807-815 (2015).
- Kindel, T. L., Yoder, S. M., D'Alessio, D. A., Tso, P. The effect of duodenal-jejunal bypass on glucose-dependent insulinotropic polypeptide secretion in Wistar rats. Obesity Surgery. 20 (6), 768-775 (2010).
- Kohan, A. B., Yoder, S. M., Tso, P. Using the lymphatics to study nutrient absorption and the secretion of gastrointestinal hormones. Physiology & Behavior. 105 (1), 82-88 (2011).
- Yoder, S. M., Yang, Q., Kindel, T. L., Tso, P. Stimulation of incretin secretion by dietary lipid: Is it dose dependent. American Journal of Physiology-Gastrointestinal and Liver Physiology. 297 (2), 299-305 (2009).
- Wang, Y., et al. Chylomicrons promote intestinal absorption and systemic dissemination of dietary antigen (ovalbumin) in mice. PLoS One. 4 (12), 8442 (2009).
- Vors, C., et al. Postprandial endotoxemia linked with chylomicrons and lipopolysaccharides handling in obese versus lean men: A lipid dose-effect trial. Journal of Clinical Endocrinology and Metabolism. 100 (9), 3427-3435 (2015).
- Ghoshal, S., Witta, J., Zhong, J., de Villiers, W., Eckhardt, E. Chylomicrons promote intestinal absorption of lipopolysaccharides. Journal of Lipid Research. 50 (1), 90-97 (2009).
- Jandacek, R. J., Rider, T., Keller, E. R., Tso, P. The effect of olestra on the absorption, excretion and storage of 2,2',5,5' tetrachlorobiphenyl; 3,3',4,4' tetrachlorobiphenyl; and perfluorooctanoic acid. Environment International. 36 (8), 880-883 (2010).
- Jandacek, R. J., Tso, P. Organochlorine compounds are absorbed via lymph and portal circulation. The FASEB Journal. 22, (2008).
- Utermann, G., Beisiegel, U. Apolipoprotein A-IV: A protein occurring in human mesenteric lymph chylomicrons and free in plasma. Isolation and quantification. European Journal of Biochemistry. 99 (2), 333-344 (1979).
- Bollman, J. L., Cain, J. C., Grindlay, J. H. Techniques for the collection of lymph from the liver, small intestine, or thoracic duct of the rat. Journal of Laboratory and Clinical Medicine. 33 (10), 1349-1352 (1948).
- Tso, P., Balint, J. A., Rodgers, J. B. Effect of hydrophobic surfactant (pluronic L-81) on lymphatic lipid transport in the rat. American Journal of Physiology. 239 (5), 348-353 (1980).
- Liu, M., et al. Sexual dimorphism in intestinal absorption and lymphatic transport of dietary lipids. Journal of Physiology. 599 (22), 5015-5030 (2021).
- Manolas, K. J., et al. Lymph, pancreatic and gastrointestinal hormones in response to feeding in the conscious pig. European Surgical Research. 17 (5), 324-332 (1985).
- Lascelles, A. K., Morris, B. Surgical techniques for the collection of lymph from unanaesthetized sheep. Quarterly Journal of Experimental Physiology and Cognate Medical Sciences. 46, 199-205 (1961).
- Jensen, L. T., Olesen, H. P., Risteli, J., Lorenzen, I. External thoracic duct-venous shunt in conscious pigs for long term studies of connective tissue metabolites in lymph. Laboratory Animal Science. 40 (6), 620-624 (1990).
- Edwards, G. A., Porter, C. J., Caliph, S. M., Khoo, S. M., Charman, W. N. Animal models for the study of intestinal lymphatic drug transport. Advanced Drug Delivery Reviews. 50 (1-2), 45-60 (2001).
- Yasunaga, K., Saito, S., Zhang, Y. -. L., Hernandez-Ono, A., Ginsberg, H. N. Effects of triacylglycerol and diacylglycerol oils on blood clearance, tissue uptake, and hepatic apolipoprotein B secretion in mice. Journal of Lipid Research. 48 (5), 1108-1121 (2007).
- Curtin, A., et al. Elevated triglyceride-rich lipoproteins in diabetes. A study of apolipoprotein B-48. Acta Diabetologica. 33 (3), 205-210 (1996).
- Gordts, P. L. S. M., et al. ApoC-III inhibits clearance of triglyceride-rich lipoproteins through LDL family receptors. Journal of Clinical Investigation. 126 (8), 2855-2866 (2016).
- Ginsberg, H. N., et al. Apolipoprotein B metabolism in subjects with deficiency of apolipoproteins CIII and AI. Evidence that apolipoprotein CIII inhibits catabolism of triglyceride-rich lipoproteins by lipoprotein lipase in vivo. The Journal of Clinical Investigation. 78 (5), 1287-1295 (1986).
- Ormai, S., Palkovits, M. Size distribution of lymphocytes in the thoracic duct lymph in rat after lymphocyte mobilization induced by polymethacrylic acid. Blut Zeitschrift für die Gesamte Blutforschung. 24 (3), 161-165 (1972).
- Luchoomun, J., Hussain, M. M. Assembly and secretion of chylomicrons by differentiated Caco-2 cells. Nascent triglycerides and preformed phospholipids are preferentially used for lipoprotein assembly. Journal of Biological Chemistry. 274 (28), 19565-19572 (1999).
- Nollevaux, G., et al. Development of a serum-free co-culture of human intestinal epithelium cell-lines (Caco-2/HT29-5M21). BMC Cell Biology. 7 (1), 20 (2006).
- Li, D., Dong, H., Kohan, A. B. The Isolation, Culture, and Propagation of Murine Intestinal Enteroids for the Study of Dietary Lipid Metabolism. Organoids. Methods in Molecular Biology. 1576, 195-204 (2019).
- Jattan, J. J., et al. Using murine-derived primary intestinal enteroids for studies of dietary triglyceride absorption and lipoprotein synthesis, and to determine the role of intestine-specific ApoC-III in the intestine. Journal of Lipid Research. 58 (5), 853-865 (2017).
- Haring, E., et al. Bile acids regulate intestinal antigen presentation and reduce graft-versus-host disease without impairing the graft-versus-leukemia effect. Haematologica. 106 (8), 2131-2146 (2021).
- Date, S., Sato, T. Mini-gut organoids: Reconstitution of the stem cell niche. Annual Review of Cell and Developmental Biology. 31 (1), 269-289 (2015).
- Deacon, C. F. Circulation and degradation of GIP and GLP-1. Hormone and Metabolic Research. 36 (11-12), 761-765 (2004).
- Dedousis, N., Teng, L., Kanshana, J. S., Kohan, A. B. A single-day mouse mesenteric lymph surgery in mice: an updated approach to study dietary lipid absorption, chylomicron secretion, and lymphocyte dynamics. J Lipid Res. 63 (11), 100284 (2022).
- Li, D., et al. Intestinal basolateral lipid substrate transport is linked to chylomicron secretion and is regulated by ApoC-III. Journal of Lipid Research. 60 (9), 1503-1515 (2019).
- Glatzle, J., et al. Chylomicron components mediate intestinal lipid-induced inhibition of gastric motor function. American Journal of Physiology-Gastrointestinal and Liver Physiology. 282 (1), 86-91 (2002).
- Huang, J., Sloop, C. H., Roheim, P. S., Wong, L. Lipoprotein lipase and hepatic triacylglycerol lipase activities in peripheral and skeletal muscle lymph. Arteriosclerosis, Thrombosis, and Vascular Biology. 10 (5), 720-726 (1990).
- Wang, F., et al. Overexpression of apolipoprotein C-III decreases secretion of dietary triglyceride into lymph. Physiological Reports. 2 (3), 00247 (2014).
- Kohan, A. B., et al. Apolipoprotein A-IV regulates chylomicron metabolism-Mechanism and function. American Journal of Physiology. Gastrointestinal and Liver Physiology. 302 (6), 628-636 (2012).
- Hayashi, H., et al. Fat feeding increases size, but not number, of chylomicrons produced by small intestine. American Journal of Physiology. 259 (5), 709-719 (1990).
- Tso, P., Balint, J. A. Formation and transport of chylomicrons by enterocytes to the lymphatics. American Journal of Physiology. 250 (6), 715-726 (1986).
- Bhattacharya, S., Redgrave, T. G. The content of apolipoprotein B in chylomicron particles. Journal of Lipid Research. 22 (5), 820-828 (1981).
- Björkegren, J., Karpe, F., Milne, R. W., Hamsten, A. Differences in apolipoprotein and lipid composition between human chylomicron remnants and very low density lipoproteins isolated from fasting and postprandial plasma. Journal of Lipid Research. 39 (7), 1412-1420 (1998).
- Martins, I. J., Sainsbury, A. J., Mamo, J. C., Redgrave, T. G. Lipid and apolipoprotein B48 transport in mesenteric lymph and the effect of hyperphagia on the clearance of chylomicron-like emulsions in insulin-deficient rats. Diabetologia. 37 (3), 238-246 (1994).
- Mar, R., et al. Association of the APOLIPOPROTEIN A1/C3/A4/A5 gene cluster with triglyceride levels and LDL particle size in familial combined hyperlipidemia. Circulation Research. 94 (7), 993-999 (2004).
- Kassis, T., et al. Dual-channel in-situ optical imaging system for quantifying lipid uptake and lymphatic pump function. Journal of Biomedical Optics. 17 (8), 086005 (2012).
- Nauli, A. M., et al. Chylomicrons produced by Caco-2 cells contained ApoB-48 with diameter of 80-200 nm. Physiological Reports. 2 (6), 192-196 (2014).
- Drover, V. A., et al. CD36 deficiency impairs intestinal lipid secretion and clearance of chylomicrons from the blood. Journal of Clinical Investigation. 115 (5), 1290-1297 (2005).
- Kohan, A. B., et al. Is apolipoprotein A-IV rate limiting in the intestinal transport and absorption of triglyceride. American Journal of Physiology-Gastrointestinal and Liver Physiology. 304 (12), 1128-1135 (2013).
- De Lisle, R. C. Altered transit and bacterial overgrowth in the cystic fibrosis mouse small intestine. American Journal of Physiology-Gastrointestinal and Liver Physiology. 293 (1), 104-111 (2007).
- Debas, H. T., Farooq, O., Grossman, M. I. Inhibition of gastric emptying is a physiological action of cholecystokinin. Gastroenterology. 68 (5), 1211-1217 (1975).
- Spiller, R. C., et al. Further characterisation of the 'ileal brake' reflex in man--Effect of ileal infusion of partial digests of fat, protein, and starch on jejunal motility and release of neurotensin, enteroglucagon, and peptide YY. Gut. 29 (8), 1042-1051 (1988).
- Battle, M. A., et al. GATA4 is essential for jejunal function in mice. Gastroenterology. 135 (5), 1676-1686 (2008).
- Morgan, R. G., Borgström, B. The mechanism of fat absorption in the bile fistula rat. Quarterly Journal of Experimental Physiology and Cognate Medical Sciences. 54 (2), 228-243 (1969).
- Davidson, N. O., Kollmer, M. E., Glickman, R. M. Apolipoprotein B synthesis in rat small intestine: Regulation by dietary triglyceride and biliary lipid. Journal of Lipid Research. 27 (1), 30-39 (1986).
- Bouchi, R., et al. FOXO1 inhibition yields functional insulin-producing cells in human gut organoid cultures. Nature Communications. 5, 4242 (2014).
- Bijvelds, M. J. C., et al. Fat absorption in cystic fibrosis mice is impeded by defective lipolysis and post-lipolytic events. American Journal of Physiology-Gastrointestinal and Liver Physiology. 288 (4), 646-653 (2005).
- Struyvenberg, M. R., Martin, C. R., Freedman, S. D. Practical guide to exocrine pancreatic insufficiency - Breaking the myths. BMC Medicine. 15 (1), 29 (2017).
- Tickell, K. D., Atlas, H. E., Walson, J. L. Environmental enteric dysfunction: A review of potential mechanisms, consequences and management strategies. BMC Medicine. 17 (1), 181 (2019).
- Lo, C. M., et al. Cholecystokinin knockout mice are resistant to high-fat diet-induced obesity. Gastroenterology. 138 (5), 1997-2005 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten