Method Article
マイクロダイアリシス による ハイスループットタンパク質結晶化
要約
提示されたプロトコルは、96ウェルハイスループット透析プレートを使用してタンパク質結晶化条件と結晶成長をスクリーニングするための簡単なアプローチを説明しています。微結晶の大規模な成長のためのダイアライザーチューブの使用は、シリアル結晶学およびMicroEDアプリケーションでも実証されています。
要約
タンパク質などの高分子の構造と機能の関係を分子レベルで理解することは、生物医学や現代の創薬に不可欠です。今日まで、X線結晶構造解析は、原子分解能で3次元タンパク質構造を解明するための最も成功した方法であり続けています。X線自由電子レーザー(XFEL)やシンクロトロン光源を用いたシリアル結晶学の最近の進歩により、タンパク質結晶学は次のフロンティアに進み、時間分解データを取得する能力は、室温での生体分子の挙動に関する重要な機構的洞察を提供します。このプロトコルは、96ウェル透析プレートを使用して結晶化条件をスクリーニングするための簡単なハイスループット(HTP)ワークフローを記述します。これらのプレートは、生体分子スクリーニング学会(SBS)規格に準拠しており、標準的な結晶化ラボを使用して簡単にセットアップできます。最適な条件が特定されると、透析装置を使用して大量の結晶(数百の微結晶)を生成できます。このアプローチの堅牢性と汎用性を検証するために、2つの膜タンパク質を含む4つの異なるタンパク質を結晶化しました。
概要
前世紀にわたり、X線結晶構造解析は、生体高分子の構造機能パラダイムの解明と理解において重要でした。今日まで、細胞生化学、医学、および初期の創薬の基礎的理解に不可欠な、多くのユニークに異なるタンパク質の原子分解能構造を解明する上で最も成功した方法の1つであり続けています1,2。しかし、タンパク質の結晶化は、多くのタンパク質標的、特に膜タンパク質や大きなタンパク質複合体の研究におけるボトルネックのままです3。その結果、タンパク質の結晶化は、労働集約的な試行錯誤のアプローチが採用されているため、ほとんどの場合芸術と見なされます4,5,6。
沈殿剤は通常、高濃度でタンパク質溶液に添加され、結晶として知られるタンパク質分子の整然とした規則的で繰り返しの格子配列を形成します。温度、pH、濃度、沈殿剤などの好ましい条件下では、過飽和溶液が最終的に形成され、続いて結晶核形成と成長が続きます7,8。結晶化試験のセットアップには、主にハイスループットロボットシステムの開発と既製の「スパースマトリックス」スクリーンの利用可能性など、多くの進歩がありましたが、タンパク質結晶化への一般的なアプローチは長年にわたってほとんど変わっていません。一般的な実験的タンパク質結晶化技術には、蒸気拡散(ハンギングドロップおよびシッティングドロップ)9、マイクロバッチ(油下)10,11、自由界面拡散(マイクロ流体デバイス)12、および透析(ボタンおよびその他の技術を使用)13,14,15が含まれます。しかしながら、膜タンパク質を結晶化するためのメソフェーズアプローチなど、他のより特殊なセットアップも存在する16,17。タンパク質データバンクに蓄積されたX線タンパク質構造の大部分は、これまでのところ蒸気拡散法による結晶化によって解決されてきましたが6,18、透析による結晶化などの他のアプローチは、おそらく実験セットアップに関連する実用的な側面のために十分に活用されていないようです。
透析による結晶化は、タンパク質分子の循環を同時に防ぐ半透膜を介した溶質(沈殿剤、イオン、添加剤、およびバッファー)のゆっくりとした拡散に依存しています。このようにして、タンパク質溶液はゆっくりと平衡状態になり、沈殿剤は結晶化に必要な濃度に達します。システムの動態は、温度、沈殿剤濃度、およびセルロース膜分子量カットオフ(MWCO)19に依存します。これまで、透析による最も一般的な結晶化セットアップは、透明なアクリルシートで作られたマイクロ透析ボタンを使用していました。これらは通常、結晶化沈殿剤溶液を含むリザーバー(主に蒸気拡散ハンギングドロッププレートを使用)に浸されます。ただし、この低スループットの方法では、 図1に示すように、ボタンチャンバーの上に置かれた透析膜内にタンパク質溶液を密封するための特定のアセンブリも必要です。また、透析膜とタンパク質溶液との間に閉じ込められた気泡は結晶成長を損なうという問題が多発している。この方法のもう一つの制約は、透析ボタンに対応するために、蒸気拡散法と比較してはるかに高い濃度と量が必要なサンプル要件です。したがって、マイクロダイアリシスボタンを使用した結晶化は、特に精製収率が低い膜タンパク質などの困難なターゲットにとって、魅力のない方法として認識されてきました。最近、透析によるタンパク質結晶化を促進するマイクロ流体デバイスが開発された15。これらのチップは、バックグラウンドが低く、X線の透明度が高いように設計されているため、室温でのin situ データ収集に使用できるため、結晶の採取や凍結冷却の不便さがなくなります。これらの進歩にもかかわらず、このアプローチは依然として非常に低スループットで高価です。
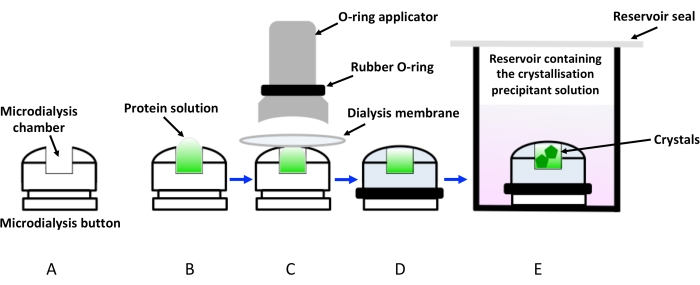
図1:透析ボタンを用いた透析による結晶化の模式図 。 (a)結晶化透析ボタンの模式図。(b)タンパク質溶液をマイクロダイアリシスボタンチャンバーに添加する。(C)透析膜は、アプリケーター を介して 適用されるゴムリング(Oリング)の助けを借りて、微小透析ボタンに保持されます。(d)透析ボタンは、(E)に示すように、結晶化溶液(透析液)を含むリザーバーに浸漬する準備ができている。浸漬透析ボタンを含むバイアルは、蒸発を避けるために密封する必要があります。 この図の拡大版を表示するには、ここをクリックしてください。
ここでは、96ウェルハイスループット透析プレートを使用してタンパク質結晶化条件と結晶成長をスクリーニングするための簡単なプロトコルを示します。これらの使い捨てプレートは、 図2に示すように、蒸気拡散結晶化プレート(ピペット、次にシール)と同様に使用するように設計されています。プレートには、最大3.2 μLのタンパク質と350 μLの透析溶液を収容できます。各ウェルは、ウェル間の相互汚染を防ぐために、個別の再生セルロース膜を備えています。セットアップは完了するまでに約10分かかり、すべての標準的な結晶化ラボにあるもの以外に特別な機器は必要ありません。2つの膜タンパク質を含む4つの異なるタンパク質を使用して、ハイスループット(HTP)タンパク質結晶構造解析の効果的な方法としてこのアプローチを実証および検証します。
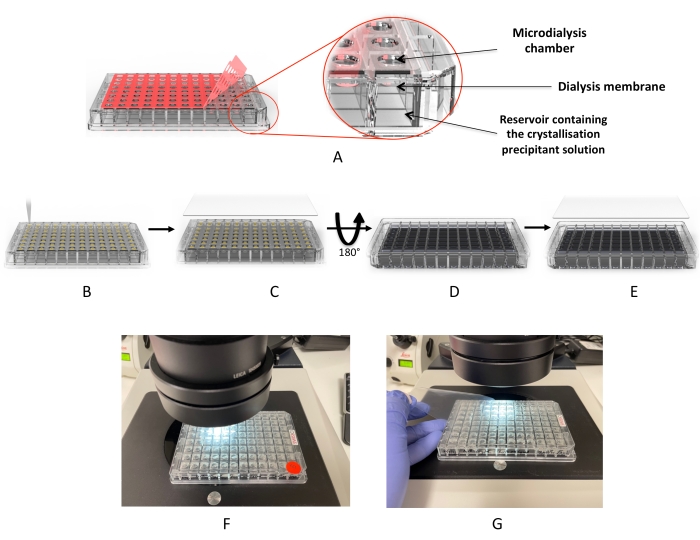
図2:マイクロ透析プレートを用いた結晶化ワークフロー 。 (a)赤色接着剤「カバーフィルム」の除去。(b)タンパク質液滴を各ドロップウェルに分注する工程。(C)ウェルはUV「カバーフィルム」で覆われています。(D)プレートを反転させて透析溶液(または結晶化スクリーン)を追加する。(E)プレートを密封し、インキュベートする。(F,G)滴の顕微鏡検査。 この図の拡大版を表示するには、ここをクリックしてください。
透析プロトコルによるこの結晶化の使用は、XFEL施設20、21、22、23、24およびシンクロトロン25、26、27の両方でのシリアル結晶学などの最先端のデータ収集方法に適した、微結晶の大規模(数百から数千)生産のための0.5 mL透析チューブ(図3)を使用して実証されました。、およびMicroED 28,29,30アプローチ用。
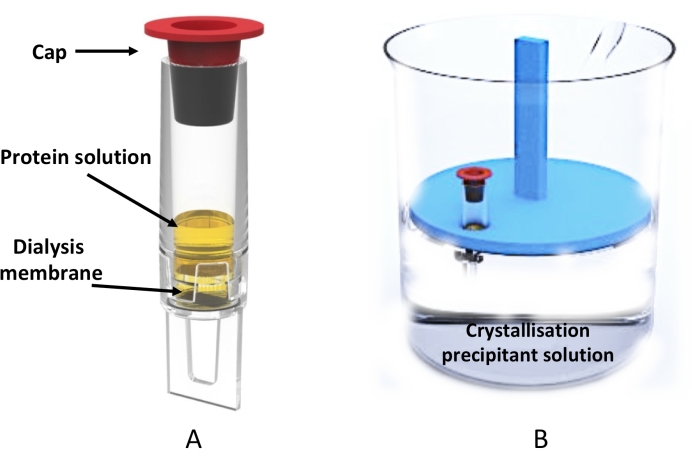
図3:透析管を用いた大規模微小透析結晶化 。 (A)0.5mL透析チューブの模式図。(b)結晶化液を入れたビーカーと、透析管を保持したフローティングチューブラックの側面図。 この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
1. タンパク質サンプル調製
- 0.22 μmフィルターでろ過した適切なバッファー(タンパク質の安定性と結晶化に適したバッファー)で目的のタンパク質を調製し(組換え法などによって)、精製します( 材料の表を参照)。結晶化前にタンパク質の品質(純度、多分散度、安定性の観点から)を評価します31。
注:本研究で使用したタンパク質とバッファーの詳細については、代表的な結果のセクションを参照してください。 - 正しいMWCO濃縮器を使用して、サンプルを最大10〜50 mg.mL-1以上(タンパク質ターゲットによって異なります)まで濃縮します(材料の表を参照)。
注:濃縮されたサンプルは、結晶化のためにすぐに使用することも、-80°Cで凍結保存することもできます。 - タンパク質が凍結されている場合は、ベンチトップ遠心分離機(≥16,000 × g、室温または4°C)でサンプルを10分間遠心分離してペレット化し、不要な物質(沈殿物など)を除去します。
- タンパク質を清潔な200 μLPCRチューブに分注します。タンパク質が室温で不安定な場合は、氷上または4°Cで保管してください。
2. マイクロダイアリシスプレートのセットアップ
注:市販のマイクロダイアリシスプレート( 材料表を参照)は、図2に示すように、再生セルロース膜(異なるMWCOで入手可能)を備えた 2つの側面(「タンパク質側」と「バッファー側」)で構成されています。
- プレートを配向させたタンパク質側を上にして、200 μmの圧力の接着剤スペーサーから粘着カバーテープ(図2A)を剥がします。井戸A1の位置に注意してください。
- マルチチャンネルピペットを使用して、最大3.2 μLのタンパク質を各ウェルにロードします(ステップ1.4)。
注:タンパク質は、リピート分注ピペットを使用してロードすることもできます。シングルチャンネルピペットを使用することは可能ですが、ローディング時間が長くなるために液滴の部分脱水が発生する可能性が高くなります。 - 200 μmのUVカバーフィルム( 材料表を参照)を96ウェルプレートの上に配置し、その完全性を確認します(図2C)。保護フィルムが上を向いていることを確認します。
- シーリングパドル( 材料表を参照)を使用し、UVカバーフィルムを押し下げて、圧力接着剤をアクティブにしてシールします。
- プレートを反転させ、ウェルA1の位置をメモします。プレートがバッファー側を上に向け、ウェル位置がミラー化されていることを確認します(図2D)。
- マルチチャンネルピペットを使用して、最大350 μLの透析溶液を各ウェルにロードします(図2D)。
注:このステップでは、市販の結晶化スクリーン(スパースマトリックススクリーン)または実験室で作られたカスタマイズされたスクリーン(グリッドスクリーン)のいずれかを使用できます( 材料表を参照)。 - 「リザーバーカバーフィルム」( 材料表を参照)でウェルを慎重に密封します(図2E)。
- プレート(バッファー側を上にして)を結晶成長に適した温度制御インキュベーター(20°C)に入れます。
注:本研究のために選択されたタンパク質については、結晶は20°Cで1〜8時間の間に現れ始めました。 - 顕微鏡で結晶を検査するには、図2F、Gに示すように、プレートを反転させてタンパク質側を上にし、200 μmのUVカバーフィルムから保護フィルムを取り除きます(ステップ2.3)。
3. ダイアライザーチューブを用いた大規模結晶化
注:マイクロダイアリシスプレートを使用して結晶化条件を調べたら、 図3に示すように、ダイアライザーチューブを使用してタンパク質の大規模な結晶化(シリアル結晶構造解析またはその他の目的)を実行できます。マイクロダイアリシスプレートと同様に、これらのデバイスは3、5、10、および30 kDa MWCO透析膜で入手可能です。
- 大型容器内での微結晶成長に最適な結晶化条件を用意します(マイクロダイアリシスプレートで最適化された条件を採用)。バッファーが0.2 μmフィルターで事前にろ過されていることを確認してください。
- タンパク質を透析チューブ(最大容量0.5 mL)にピペットで入れ、付属の赤いプラスチックキャップを使用して端を密封します(図3A)。
- 図3Bに示すように、500 μLの透析チューブをフローティングラック(材料の表を参照)を含む適切なサイズの容器(透析液の総量に応じて)に入れます。
注意: ダイアライザーキットに付属のフローティングラックには、最大18本のダイアライザーチューブを同時に収納できます。 - 結晶成長に適した温度制御されたインキュベーター(20°C)に容器を固定します。
- 結晶を検査するには、1〜2 μLの溶液をガラスカバースライドにピペットで貼り付けます。2番目のガラスカバースライドで覆い(過度の脱水を防ぐため)、顕微鏡で観察します( 材料の表を参照)。
注意: 検査中に2つのガラスカバースライドの間に挟まれると、結晶が損傷する可能性があります。結晶は、ダイアライザーチューブを実体高倍率顕微鏡下に置くことによって直接観察することもできる。
結果
2つの膜タンパク質を含む4つのタンパク質をマイクロ透析プレート(10 kDaのMWCO膜付き)を使用して結晶化しました。凍結乾燥粉末(材料表参照)からのニワトリ卵白リゾチームを20mM NaOAc(pH 4.5)中で50 mg.mL−1で調製し、凍結乾燥ソーマチン(材料表参照)を最終濃度25 mg.mL−1になるまで水に溶解した。この研究で使用された2つの膜タンパク質は、大腸菌多剤排出ポンプAcrBと大腸菌ラクトーストランスポーターLacYでした。 AcrBはC43(DE3)細胞を用いて発現させ、10 mM Tris(pH 7.5)、300 mM NaCl、0.03%(w/v)n-ドデシル-β-D-マルトシド(DDM)、および5%(v/v)グリセロール32中でNi-NTAアフィニティークロマトグラフィーおよびサイズ排除クロマトグラフィーによって精製した。続いて、100 kDaのMWCO遠心濃縮装置を用いてタンパク質を最終濃度6 mg.mL-1まで濃縮した。LacYはC43(DE3)細胞でも発現し、Ni-sepharoseアフィニティークロマトグラフィーで精製した後、20 mM Tris(pH 7.5)、150 mM NaCl、0.03%(w/v)DDMでサイズ排除クロマトグラフィーで精製し、100 kDaのMWCO濃縮装置を使用して10 mg.mL-1 4,33に濃縮しました。
リゾチームおよびソーマチンタンパク質については、96ウェルマイクロ透析プレートに透析液として社内で調製した結晶化グリッドスクリーンを充填し、膜タンパク質AcrBについては、以前に公表された結晶化条件34から社内でグリッドスクリーンを調製した。LacYの場合、最初のヒット条件は商用スクリーン( 材料表を参照)から検出され、社内で作られたグリッドスクリーンでさらに最適化されました。リゾチーム、ソーマチン、AcrBの結晶化低下比は1:100で、沈殿剤(透析液)200 μLに対してタンパク質2 μLでした。LacY結晶化ドロップも1:100の比率で、利用可能なタンパク質の量が少ないため、1 μLのタンパク質と100 μLの透析溶液が含まれていました。
膜タンパク質を含む4つのタンパク質すべての結晶は、マイクロダイアリシスプレートでのセットアップ後、20°Cで1〜8時間の間に現れ始めました。この場合、膜タンパク質結晶化のために透析液に界面活性剤を補充する必要はなく、界面活性剤ミセルは透析膜35のMWCOよりも大きいと予想されたので、膜タンパク質凝集を防止するために標準的な透析プロセス中に典型的に行われる。
微小透析プレート上でのタンパク質の結晶化に成功した後(図4)、結晶化条件を記録し、同じ10 kDaMWCO透析膜を備えた透析チューブを使用して透析による大規模な結晶化を行いました。 図5に示すように、個々のタンパク質のそれぞれについて数千の微結晶が透析装置内で成長しました。ソーマチン結晶化のために、250 μLのタンパク質を透析器にロードし、50 mL(1:200の比率)に対して透析しました。AcrBについては、250 μLのタンパク質を25 mLの透析溶液(1:100)に対して透析しました。LacY結晶化も、10 mLの透析溶液に対して100 μLのタンパク質と同じ比率で設定しました。
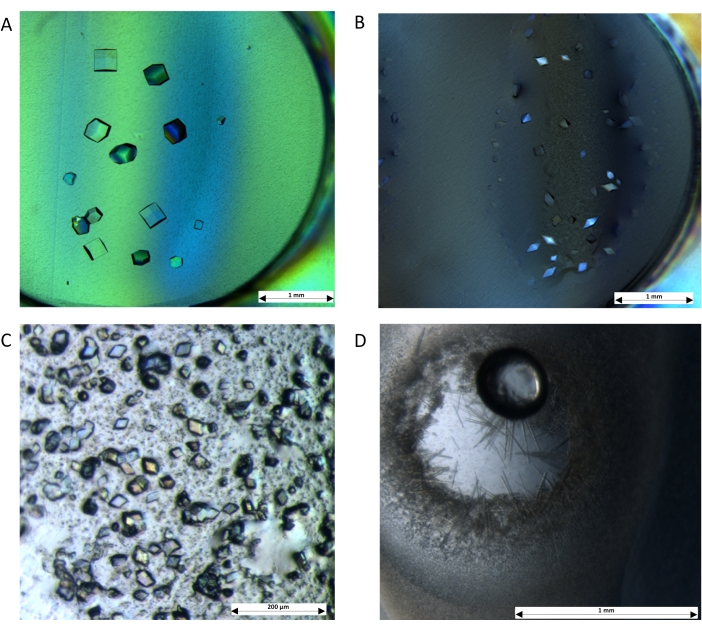
図4:微小透析プレートを用いた透析により結晶を成長させる。 このプロトコルは、可溶性タンパク質を使用したセットアップの適用性を示しています:(A)リゾチームは、0.1 M NaOAc(pH 4.0)、0.5 M NaCl、および25%(v / v)グリセロールに対して透析されました。(B)ソーマチンは、0.1 Mビストリスプロパン(pH 6.6)、1 M K / Na酒石酸塩、および18%(v / v)エチレングリコールに対して透析されました。膜タンパク質についても結晶が得られました:(C)AcrBを0.1 M MES(pH 5.5)、0.3 M NaCl、および20%(v/v)PEG-400に対して透析しました。(D)LacYは、0.1 M MES(pH 6.5)、0.1 M NaCl、および32%(v/v)のPEG-300に対して透析されました。画像は、クロスポラライザーを備えたステレオ高倍率顕微鏡を使用してキャプチャされました。スケールバー:(A、B、D)= 1ミリメートル;(C) = 200 μm。 この図の拡大版を表示するには、ここをクリックしてください。

図5:透析管を用いた透析により成長した膜タンパク質結晶の代表像。 (a)微結晶でいっぱいのチューブを示す画像(黒い矢印で示す)。(B)0.5 mL透析チューブを用いて透析により成長させたソーマチン結晶のスラリーから、0.1 Mビストリスプロパン(pH 6.6)、1.4 M K/Na酒石酸塩、および18%(v/v)エチレングリコールに対して透析した2 μLの顕微鏡画像。(C)0.1 M MES(pH 5.5)、0.3 M NaCl、および20%(v/v)のPEG-400に対する透析によって成長させたAcrB微結晶の暗視野(左)および明視野(右)画像。(D)0.1 M MES(pH 6.5)、0.1 M NaCl、および32%(v/v)のPEG-300に対して透析によって成長させたLacY微結晶の暗視野(左)および明視野(右)画像。いくつかの沈殿物が観察されます。スケールバー:(B、D)= 200μm;(C) = 500 μm. この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
現在、透析による結晶化は、ボタンによるマイクロ透析などの既存のアプローチの低スループットで退屈な性質のために、最も十分に活用されていない結晶化方法です。ここでは、シンプルで堅牢なプロトコルが、市販のマイクロ透析プレートと透析チューブを介した透析によるタンパク質結晶成長のためのHTPワークフローに従います。標的タンパク質に応じて、手順で使用されるマイクロ透析プレートと透析チューブには、3、5、10、または30 kDaのMWCOを備えた透析膜の選択肢があります。このプロトコルは、標準的な結晶化施設で簡単にセットアップでき、可溶性タンパク質と膜タンパク質の両方に適用できるという大きな利点があります。ただし、タンパク質-タンパク質およびタンパク質-核酸複合体は、このプロトコルではテストされませんでした。
透析による任意の結晶化アプローチと同様に、タンパク質サンプルと透析溶液との間の体積比は重要である。このプロトコルでは、サンプルと透析溶液の比率を1:100にすることをお勧めしますが、マイクロ透析プレートは最大350 μLの透析溶液の容量を可能にするため、これらの比率を調べて結晶ヒットを得ることができます。結晶化プレートをセットアップする際に、提示されたプロトコルでは1〜2μLのタンパク質が使用されます。これは、液滴が手動マルチチャンネルピペットで正確にセットされるようにするためです。電動ピペット(マルチチャンネルまたはリピート分注ピペット)またはHTP液体分注ロボットを使用することで、少量の滴を正確に測定できるため、必要なタンパク質の量を減らすことができます。さらに、(他の従来の透析方法とは対照的に)マイクロ透析プレートに必要な透析バッファーの量が比較的少ないため、市販の結晶化スクリーンだけでなく、最適化スクリーン(初期結晶化ヒット条件を中心に設計された)を使用して、大きな化学空間を探索することができます(リソースを大量に使用せずに)。
提示されたHTP手順の重要なステップは、脱水およびサンプル損失を制限するために、透析プレートに少量のタンパク質(条件あたり0.50〜3.2μL)を適時に適用することである。これは、マルチチャンネルピペット、リピート分注ピペット、またはロボット結晶化システムを使用することで簡単に軽減できます。プレートを20°Cで2週間以上インキュベートするなどの長いインキュベーション時間は、タンパク質液滴の脱水や最近形成された結晶の損傷につながる可能性があります。透析プレートを加湿チャンバーまたは密閉可能なバッグ内に保管すると、この影響を軽減できます。さらに、細菌の増殖を避けるために、無菌の材料と技術を使用することをお勧めします。
冒頭で述べたように、最近、疾患メカニズム、タンパク質-リガンド結合相互作用、およびタンパク質間相互作用のためのタンパク質構造ダイナミクスを理解する必要性の高まりに伴い、タンパク質X線結晶構造解析の分野は、新規および既存の結晶化技術、結晶サンプル送達への最新のアプローチ、新世代のX線源、およびデータの取得と処理のための新しい洗練された方法の開発を通じて革命を起こしました36、37,38。したがって、XFELまたはシンクロトロン光源を使用して行われる室温の連続微結晶学の出現は、構造生物学、特に膜タンパク質の分野における注目すべきツールとして浮上しています39。しかし、ロバストな構造解に十分なデータを生成するには、何千もの微結晶が必要であり、これは簡単な作業ではありません(少なくとも従来の結晶化方法では)。ここで説明する透析結晶化法は、多数の微結晶の製造を可能にする。微小透析プレートを用いて微結晶(1-10μm)を製造するための結晶化条件が決定されたら、0.5mL透析装置を用いて高密度微結晶を大量に製造することができる(図5)。これらの結晶は、固定ターゲットまたは液体ジェットサンプル送達システム27,40を使用したデータ収集に最適です。この方法で得られた結晶は、MicroEDアプリケーションにも適しています。ただし、電子はX線光子41よりもはるかに強く結晶と相互作用するため、これらはこの特定の用途に適したサイズと厚さに粉砕する必要があるかもしれません。
結論として、ここで説明する透析による結晶化アプローチは、構造決定のためのタンパク質結晶化における進化する戦略に追加され、これまで他の従来の方法では成功しなかった新規タンパク質標的を決定するために使用できるよりも努力の範囲を拡大します。
開示事項
共著者のパスセル・ドレイパーとポール・リアドンはSWISSCIに雇用されています。
謝辞
我々は、英国のビジネス・エネルギー・産業戦略省(BEIS)からの資金提供を認める。国立物理学研究所のAlex R. Jones氏とMike Shaw氏には、原稿に対するフィードバックをいただき、ありがとうございました。
資料
| Name | Company | Catalog Number | Comments |
| 0.2 mL tubes | Thermo Scientific | AB0620 | For aliquoting protein solutions. |
| 0.2 µm syringe filter | Sartorius | 17823----------K | Surfactant-free cellulose acetate filters. For filtering dialysis solutions. |
| 0.22 µm membrane filters | Millipore | GSTF04700 | Membrane filters for filtering large volumes of buffers |
| 12-channel, variable 0.5 – 10 µL Research plus pipette | Eppendorf | 3125000028 | For dispensing protein drops onto the Diaplate. |
| 12-channel, variable 30 – 300 µL Eppendorf Research plus pipette | Eppendorf | 3125000060 | For dispensing dialysis solutions on the Diaplate reservoirs. |
| 20 mL syringe | Fisherbrand | 15889152 | For use with syringe filters. |
| 96 well 2.2 mL deep-well plates | Thermo Scientific | AB0788 | Polypropylene deep-well storage plates; for preparing screens using the Hamilton Microlab STARlet. |
| Centrifuge 5425 | Eppendorf | 5405000565 | With rotor FA-24x2 with a maximum g-force of 21,300 x g. |
| Diacon dialyser | SWISSCI | W72010 | Dialyzer tubes with a regenerated cellulose membrane with a molecular weight cut-off of 10 kDa. Ideal for protein solutions of up to 0.5 mL. |
| Diaplate 96-well plate | SWISSCI | W82010 | Microdialysis plate. The Diaplate consists of two sides with a regenerated cellulose membrane in-between with a molecular weight cut-off of 10 kDa. |
| Falcon 50 mL High Clarity PP Centrifuge Tube | Corning | 352070 | For holding dialysis solutions. |
| Floating rack | SWISSCI | n/a | Included in the Diacon kit |
| Floor-standing vibration-free incubator | Molecular Dimensions | MD5-01 | 400 L temperature-controlled incubator set to 20 °C. |
| Leica M205 C stereo microscope | Leica | Planapo 1.0x objective, 7.8x – 160x zoom range with DMC 4500 camera | |
| Lysozyme from chicken egg white | Sigma Aldrich | 62971 | Lyophilized protein |
| Memgold2 | Molecular Dimensions | MD1-64 | Sparse-matrix screen |
| Microlab STARlet | Hamilton | n/a | Liquid handler system. |
| Reservoir cover film | SWISSCI | n/a | Included in the Diaplate kit |
| Reusable bottle top filter | Thermo Scientific | DS0320-5045 | For fitering large volumes of buffers, for use with 0.22 µm membrane filters |
| Sealing paddle | SWISSCI | n/a | Included in the Diaplate kit |
| Thaumatin from Thaumatococcus daniellii | Sigma Aldrich | T7638 | Lyophilized protein |
| UV cover film | SWISSCI | n/a | Included in the Diaplate kit |
参考文献
- Brooks-Bartlett, J. C., Garman, E. F. The nobel science: One hundred years of crystallography. Interdisciplinary Science Reviews. 40 (3), 244-264 (2015).
- Maveyraud, L., Mourey, L. Protein X-ray crystallography and drug discovery. Molecules. 25 (5), (2020).
- Kwan, T. O. C., Axford, D., Moraes, I. Membrane protein crystallography in the era of modern structural biology. Biochemical Society Transactions. 48 (6), 2505-2524 (2020).
- Birch, J., et al. The fine art of integral membrane protein crystallisation. Methods. 147, 150-162 (2018).
- Gorrec, F., Löwe, J. Automated protocols for macromolecular crystallization at the MRC laboratory of molecular biology. Journal of Visualized Experiments. 131 (131), (2018).
- Govada, L., Chayen, N. E. Choosing the method of crystallization to obtain optimal results. Crystals. 9 (2), 106 (2019).
- Chayen, N. E. Turning protein crystallisation from an art into science. Current Opinion in Structural Biology. 14 (5), 577-583 (2004).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta Crystallographica Section F: Structural Biology Communications. 70 (1), 2-20 (2014).
- Gulbis, J. Protein crystallography: methods and protocols. Crystallography Reviews. 24 (2), 136-143 (2018).
- D'Arcy, A., Bergfors, T., Cowan-Jacob, S. W., Marsh, M. Microseed matrix screening for optimization in protein crystallization: What have we learned. Acta Crystallographica Section:F Structural Biology Communications. 70 (9), 1117-1126 (2014).
- Shaw Stewart, ., D, P., Kolek, S. A., Briggs, R. A., Chayen, N. E., Baldock, P. F. Random microseeding: a theoretical and practical exploration of seed stability and seeding techniques for successful protein crystallization. Crystal Growth & Design. 11 (8), 3432-3441 (2011).
- Junius, N., et al. A microfluidic device for both on-chip dialysis protein crystallization and in situ X-ray diffraction. Lab on a Chip. 20 (2), 296-310 (2020).
- Junius, N., Vahdatahar, E., Oksanen, E., Ferrer, J. L., Budayova-Spano, M. Optimization of crystallization of biological macromolecules using dialysis combined with temperature control. Journal of Applied Crystallography. 53 (3), 686-698 (2020).
- Vahdatahar, E., Junius, N., Budayova-Spano, M. Optimization of crystal growth for neutron macromolecular crystallography. Journal of Visualized Experiments. 169, (2021).
- Jaho, S., et al. Crystallization of proteins on chip by microdialysis for in situ X-ray diffraction studies. Journal of Visualized Experiments. 170, (2021).
- Liu, W., Cherezov, V. Crystallization of membrane proteins in lipidic mesophases. Journal of Visualized Experiments. 49, 2501 (2011).
- Ujwal, R., Abramson, J. High-throughput crystallization of membrane proteins using the lipidic bicelle method. Journal of Visualized Experiments. 59, (2012).
- Parker, J. L., Newstead, S. Membrane protein crystallisation: Current trends and future perspectives. Advances in Experimental Medicine and Biology. 922. , 61-72 (2016).
- Apostolopoulou, V., Junius, N., Sear, R. P., Budayova-Spano, M. Mixing salts and polyethylene glycol into protein solutions: The effects of diffusion across semi-permeable membranes and of convection. Crystal Growth & Design. 20 (6), 3927-3936 (2020).
- Neutze, R., Wouts, R., Vander Spoel, D., Weckert, E., Hajdu, J. Potential for biomolecular imaging with femtosecond X-ray pulses. Nature. 406 (6797), 752-757 (2000).
- Chapman, H. N., et al. Femtosecond X-ray protein nanocrystallography. Nature. 470 (7332), 73-78 (2011).
- Mizohata, E., Nakane, T., Fukuda, Y., Nango, E., Iwata, S. Serial femtosecond crystallography at the SACLA: breakthrough to dynamic structural biology. Biophysical Reviews. 10 (2), 209-218 (2018).
- Nogly, P., et al. Lipidic cubic phase serial millisecond crystallography using synchrotron radiation. IUCrJ. 2 (2), 168-176 (2015).
- Johansson, L. C., et al. XFEL structures of the human MT2 melatonin receptor reveal the basis of subtype selectivity. Nature. 569 (7755), 289-292 (2019).
- Owen, R. L., et al. Low-dose fixed-target serial synchrotron crystallography. Acta Crystallographica Section D: Structural Biology. 73 (4), 373-378 (2017).
- Weinert, T., et al. Serial millisecond crystallography for routine room-temperature structure determination at synchrotrons. Nature communications. 8 (1), 542 (2017).
- Axford, D., et al. Two states of a light-sensitive membrane protein captured at room temperature using thin-film sample mounts. Acta Crystallographica Section D: Structural Biology. 78 (1), 52-58 (2022).
- Nannenga, B. L., Gonen, T. The cryo-EM method microcrystal electron diffraction (MicroED). Nature Methods. 16 (5), 369-379 (2019).
- Nguyen, C., Gonen, T. Beyond protein structure determination with MicroED. Current Opinion in Structural Biology. 64, 51-58 (2020).
- Mu, X., Gillman, C., Nguyen, C., Gonen, T. An overview of microcrystal electron diffraction (MicroED). Annual Review of Biochemistry. 90, 431-450 (2021).
- Kwan, T. O. C., et al. Selection of biophysical methods for characterisation of membrane proteins. International Journal of Molecular Sciences. 22 (10), 2605 (2019).
- Pos, K. M., Purification Diederichs, K. crystallization and preliminary diffraction studies of AcrB, an inner-membrane multi-drug efflux protein. Acta Crystallographica Section D: Biological Crystallography. 58 (10), 1865-1867 (2002).
- Guan, L., Mirza, O., Verner, G., Iwata, S., Kaback, H. R. Structural determination of wild-type lactose permease. Proceedings of the National Academy of Sciences. 104 (39), 15294-15298 (2007).
- Kwan, T. O. C., Reis, R., Moraes, I. In situ measurements of polypeptide samples by dynamic light scattering: membrane proteins, a case study. Methods in Molecular Biology. , 189-202 (2021).
- Seddon, A. M., Curnow, P., Booth, P. J. Membrane proteins, lipids and detergents: not just a soap opera. Biochimica et Biophysica Acta (BBA)-Biomembranes. (1-2), 105-117 (2004).
- Wickstrand, C., et al. A tool for visualizing protein motions in time-resolved crystallography. Structural Dynamics. 7 (2), 024701 (2020).
- Orville, A. M. Recent results in time resolved serial femtosecond crystallography at XFELs. Current Opinion in Structural Biology. 65, 193-208 (2020).
- Schulz, E. C., Yorke, B. A., Pearson, A. R., Mehrabi, P. Best practices for time-resolved serial synchrotron crystallography. Acta Crystallographica Section D: Structural Biology. 78 (1), 14-29 (2022).
- Neutze, R., Brändén, G., Schertler, G. F. Membrane protein structural biology using X-ray free eletron lasers. Current Opinion in Structural Biology. 33, 115-125 (2015).
- Wierstall, U. Liquid sample delivery techniques for serial femtosecond crystallography. Philosophical Transactions of the Royal Society B: Biological Sciences. 369 (1647), 20130337 (2014).
- Shi, D., Nannenga, B. L., Iadanza, M. G., Gonen, T. Three-dimensional electron crystallography of protein microcrystals. eLife. 2, 01345 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved