Method Article
腸のリモデリングを研究するためのレーザーアブレーションと生体内顕微鏡
* これらの著者は同等に貢献しました
要約
ここでは、レーザー誘導創傷時の腸の画像を取得する方法を紹介します。マウスの腸を多光子レーザーにさらすことによって、単一または複数の陰窩の喪失が局所的に誘発される。損傷領域を数か月にわたって繰り返しイメージングすることにより、腸の回復のリアルタイムのダイナミクスがキャプチャされます。
要約
生体内での腸管回復を調べることは、絶妙な技術的課題です。縦断的なイメージングプロトコルの欠如は、腸の再生を調整する細胞および組織スケールのダイナミクスへのより深い洞察を妨げてきました。ここでは、単一の陰窩スケールで組織損傷を局所的に誘導し、生きているマウスの腸上皮の再生応答を追跡する生体内顕微鏡法について説明します。単一の陰窩またはより大きな腸場は、時間的および空間的に制御された方法で高強度多光子赤外線レーザーによって切除された。その後の長期反復生体内イメージングにより、損傷領域の経時的な追跡が可能になり、数週間にわたる組織回復中の陰窩ダイナミクスのモニタリングが可能になりました。陰窩分裂、融合、消失などの陰窩リモデリングイベントは、レーザー誘発損傷時に隣接組織で観察されました。このプロトコルは、加齢や腫瘍開始などの恒常性と病態生理学的設定の両方における陰窩ダイナミクスの研究を可能にします。
概要
腸の上皮内層は、上皮バリアの破壊を引き起こす可能性のある胃酸、毒素、および微生物叢によって絶えず挑戦されています。腸の構造と組織組織は、絶えず自己修復し、損傷を修復することに特化しています。小腸の単層上皮は陰窩絨毛ユニット1に編成されています。恒常性において、陰窩の基部に存在する自己複製Lgr5+腸幹細胞は、分化した子孫を生じさせる。分化した娘細胞は、コンベアベルト方式で絨毛軸の先端に移動し、そこで腸の内層が3〜5日で補充されるように流されます2,3。長期的には、すべてのLgr5+細胞が組織の再生に等しく寄与するわけではなく、これは細胞がコンベヤーベルトに対して陰窩の基部に向かって移動する能力(すなわち、逆行性運動)にも依存するためです4,5。実際に、例えば放射線によるLgr5+細胞の切除時に、陰窩の基部の外側の前駆細胞は、幹細胞プール6、7、8を脱分化および補充するために塩基に移動する。
急性炎症はLgr5+幹細胞の喪失を引き起こす可能性があります9,10。幹細胞の喪失に加えて、多くの外的要因が陰窩スケールで上皮に急性損傷を引き起こす可能性があります。放射線、化学処理、および抗生物質は、腸の陰窩と絨毛を傷つけることが示されています11。陰窩および絨毛のより大きなフィールドは、細菌、ウイルス、および寄生虫感染の影響を受ける可能性があります12。腸は、陰窩分裂(1つの陰窩を2つに分割すること)によって陰窩スケールでの内部および外部の損傷から回復する驚くべき能力を持っています13。負傷すると、損傷に隣接する領域の地下室は、地下室番号を補充するために核分裂を起こします。この現象は、程度は低いものの、恒常性の間にも発生します14,15。恒常性維持中の陰窩数の潜在的な増加を相殺するために、陰窩は融合することもできます(2つの陰窩を1つにマージします)16,17。クリプトフュージョンが負傷後のクリプト番号の再確立にも役割を果たすかどうかは不明です。さらに、このプロセスのダイナミクスと規制要因はまだ解明されていません。
傷害モデルは、生体内での組織再生を研究するために不可欠です。腸組織再生を研究するために、さまざまな損傷モデルが利用されています。以前の実験戦略では、高線量放射線を使用して幹細胞プールを枯渇させる18、またはデキストラン硫酸ナトリウム(DSS)による治療を使用して、マウスに慢性および急性大腸炎および陰窩喪失を誘発しました19,20。遺伝的または光学的手段による単一細胞アブレーションは、組織の損傷を洗練するために使用されており、幹細胞と前駆細胞の役割を解きほぐし21、22、血管再生を研究するための魅力的なツールと考えられています23。さらに、いくつかの陰窩と絨毛24のより大きなフィールドで損傷を誘発するために生検損傷システムが開発されました。重要なことに、有害な侮辱に対する反応は、結腸25よりも小腸でより多くの損傷を引き起こした放射線について報告されているように、腸の近位遠位軸に沿って変化する可能性があります。これは、有害な侮辱の程度と腸管におけるその局在の両方を制御する標的を絞った方法の必要性を浮き彫りにします。
損傷の程度と回復は、従来、組織回復のダイナミクスに関する限られた情報を提供する静的手段によって評価されてきました。生体内顕微鏡(IVM)は、多くの臓器における幹細胞の挙動、上皮リモデリング、および再生を定量化するユニークな機会を開きました26、27、28、29、30、および腸生物学への影響力のある洞察を提供しました4,5,21,31,32,33,34、35,36。
ここでは、時空間的に定義された腸の損傷を引き起こし、腸上皮内層の回復を捉える方法について述べる。2つの光子ベースのレーザーアブレーションを利用して腸管陰窩を損傷し、反復的な生体内顕微鏡検査による即時の創傷反応と長期的な回復を追跡します。私たちのプロトコルは、局所組織の損傷に応答して腸組織構造の再生リモデリングをマッピングすることを可能にします。核分裂や核融合イベントを含む暗号ダイナミクスは、時間の経過とともに容易に定量化および追跡できます。レーザーアブレーションと反復生体内イメージングの応用は、恒常性および腫瘍開始などの病態生理学中の腸構造の組織スケールのダイナミクスを調査するためのプラットフォームとして利用できます。
プロトコル
この研究に記載されているすべての動物実験は、オランダ癌研究所(NKI)の動物福祉団体(AWB)のガイドラインと承認に従って実施されました。
注:動物実験を行う前に、研究所の動物倫理委員会に相談してください。
1.手術と生体内イメージングの準備
- 手術前の治療
- 手術の4〜6週間前にヒマワリ油に溶解したタモキシフェンを腹腔内に注射することにより、8〜12週齢のK19-CreERT237:Rosa26-CreERT238:Rosa26-Confettei39マウスをヒマワリ油に溶解したタモキシフェンを腹腔内に注射することにより誘導する(図1)。
- 鎮痛剤を適用します。手術の30分前に、マウス30 gあたりNaCl 0.9%に希釈したブプレノルフィン(0.1 mg / kg体重)200 μLを皮下注射します。.手術の24時間前に、125 mLの非酸性化オートクレーブ滅菌飲料水が入ったボトルにカルプロフェン(0.067 mg / mL)を投与します。.または、手術開始の30分前にカルプロフェン注射を皮下(5 mg / kg)投与します。.
- 手術の準備
- オートクレーブ滅菌手術器具をバイオハザードキャビネットに導入します。
- 加熱パッドの電源を入れ、温度を37°Cに設定します。
- 生体内イメージングの準備
- 温度安定化のために十分な時間を確保するために、イメージングの少なくとも4時間前に顕微鏡の温度制御されたチャンバーの電源を入れます。
注意: 必要な時間は、使用するマシンによって異なります。 - クライメートチャンバー内の温度を37°Cで安定させます。
- 2光子顕微鏡、スキャナー、レーザーの電源を入れます。
- イメージングソフトウェアを起動します。
- レーザーの波長を960nmに調整し、シャッターを開きます。
- 温度安定化のために十分な時間を確保するために、イメージングの少なくとも4時間前に顕微鏡の温度制御されたチャンバーの電源を入れます。
2.手術と生体内イメージング
- 腸の外科的暴露
- 2%〜3%のイソフルランを使用してマウスを麻酔し、滅菌布で覆われた加熱パッドの上に置きます。呼吸の頻度と質(1呼吸/秒)を評価し、マウスの反射をチェックして、麻酔の深さを確認します。
- マウスの目を目の軟膏で覆います。
- 200 μLの予熱した滅菌生理食塩水を皮下注射します。
- 腹部を剃り、髪を取り除きます。手術部位の滅菌布を交換してください。
- 直腸プローブを挿入して、マウスの温度を監視します。
注意: 温度は約37°Cである必要があります。 - 新しい滅菌手袋を着用します。
- 消毒液の交互のスクラブとそれに続く80%エタノールで3回、円形に手術領域を洗浄します。滅菌綿棒で余分なエタノールを取り除きます。
注:この時点で、マウスの低体温を監視することが重要です。 - マウスを滅菌外科用ドレープで覆います。
- マウスの反射を確認してください。
- 滅菌メスを使用して、皮膚を通して~10mmの垂直正中線切開を行います。
- ハサミを使用してリネアアルバを切開し、腹直筋を分離し、腹部を開きます。
- 滅菌済みの予熱生理食塩水に浸した滅菌綿棒を使用してマウスの盲腸を見つけ、基準点として使用します。
- 滅菌ガーゼに小さな切り込みを入れ、予熱した滅菌生理食塩水で濡らし、切開の上に置きます。
- 事前に温めた滅菌生理食塩水に浸した滅菌綿棒で腸を取り出します。滅菌済みの予熱生理食塩水を加えて腸を水分補給してください。
- 滅菌済みのカスタムメイドのイメージングチャンバーをマウスの隣に置きます。
- マウスを予熱した滅菌イメージングボックスに移します。
- イメージングボックスの滅菌ガラスの上に腸を置きます。 図1に示すように、マウスの頭をイメージングボックスの吸入チューブの内側に置きます。
- 必要に応じて、滅菌済みの可撓性フィルムとテープでマウスを固定します。
- マウスが入っているイメージングボックスを顕微鏡チャンバーに入れます。
- 生体内イメージング
- 直腸プローブ を介して 呼吸の頻度と深さ、および温度を15分ごとにチェックすることにより、イメージング中にマウスを監視します。イソフルランの割合は1%〜2%の間に保たれるべきである。必要に応じて調整します。
- 顕微鏡の接眼レンズを使用して腸内の領域を見つけます。
- 図2Aに示すように、顕微鏡の内部カメラを使用して関心領域の広視野ビューを取得します。
- 多光子顕微鏡の960nmレーザーを使用して関心領域を画像化します。実験で使用する蛍光色素に応じてレーザー出力と波長を調整します。
- 3 μmの関心領域の10〜20ステップのzスタックを取得します。
- レーザーアブレーション
- 前にイメージしたタイルから 1 つまたは複数の位置を選択します。
- イメージングソフトウェアのブリーチポイントキャリブレーション機能を、32および124 x 124ピクセルの解像度でスキャン速度400 Hzで使用し、狙った損傷のサイズに応じて、双方向スキャンプロパティを3〜10秒間使用します。陰窩領域における損傷の開始は、緑および赤チャネルの両方における自家蛍光の増加によって認識することができる。
- 同じマウス内の複数の領域に対して前の 2 つの手順を繰り返します。
- アブレーション後、損傷領域のzスタックを取得して、損傷の場所と程度を確認します。
- 手術部位の閉鎖
- マウスを麻酔下に置いて、滅菌縫合領域に置きます。
- 予熱した滅菌生理食塩水に浸した滅菌綿棒を使用して、露出した腸を腹部に戻します。
- 吸収性5-0縫合糸を用いて簡易連続縫合を行うことによりリネアアルバを縫合する。外科用結び目で縫合糸の四肢を閉じます。
- スキンレイヤーで同じ手順を繰り返します。
- イソフルランステーションのスイッチを切り、イメージングボックスとインレーを洗浄および滅菌します。
- 手術器具クリーナー、酵素クリーナー、手術器具潤滑剤で手術器具を清掃します。乾燥したら、オートクレーブ内の手術ボックスと一緒に手術器具を滅菌します。
- 術後ケア
- ケージを加熱パッドに~1時間置いた状態で、マウスを手術から回復させます。
注意: 可能であれば、マウスを他のケージメイトと一緒に配置します。孤独な住宅は回復に必要ではありません。 - 回復中は15分ごとにマウスの温度を確認してください。
- 術後6〜12時間、マウス30 gあたりNaCl 0.9%で希釈した200 μLのブプレノルフィン(0.1 mg / kg体重)を皮下に注射します。.
- カルプロフェン(0.067 mg / mL)を、125 mLの非酸性化オートクレーブ滅菌飲料水が入ったボトルに入れて、術後72時間投与します。.
- マウスの体重を量り、術後1週間毎日福祉を監視します。
- ケージを加熱パッドに~1時間置いた状態で、マウスを手術から回復させます。
3.反復手術と生体内イメージング
- 手術
- 2番目の時点(最初のイメージングセッションから少なくとも1週間後)で、手順1.1.2、1.2、1.3、および2.1を繰り返します。
- 生体内イメージング
- 手順 2.2.1-2.2.3 を繰り返します。
- 血管のパターンを使用して、最初の時点で画像化されたのと同じ関心領域を見つけます。
- 手順 2.2.4 と 2.2.5 を繰り返します。
- 手術部位の閉鎖
- 手順 2.4.1 を繰り返します。
- マウスが別の時点で画像化されることを意図していない場合は、終末麻酔下で頸部脱臼を行うことによってマウスを犠牲にする。それ以外の場合は、次の手順に進みます。
注:EU指令2010/63 / EU、付録IVのガイドラインによると、頸部脱臼は許容可能な方法です。 - 手順 2.4.2-2.4.6 を繰り返します。
- 術後ケア
- 手順 2.5.1 から 2.5.5 を繰り返します。
結果
生体内イメージングと組み合わせたレーザーアブレーション法から得られる結果の種類を実証するために、図1に示すような実験を行いました。まず、K19-CreERT2;mTmG(K19cre-mTmG)とLgr5eGFP-IRES-CreERT2を注入しました。Rosa26-Confetti(Lgr5cre-Confetti)マウスにタモキシフェンを投与して、細胞を紙吹雪色の1つ(またはmTmGマウスの場合は緑色蛍光タンパク質[GFP])で確率的に標識します。K19-creはすべての上皮細胞から系統追跡を誘導しますが、Lgr5-creは幹細胞からの追跡を誘導するだけです8,18,37。タモキシフェン注射は、すべての細胞が特定の色に対してモノクローナルである陰窩を得るために、手術および最初の画像化セッションの4〜6週間前に投与された。数週間にわたる同じ組織領域の堅牢な同定は、同じ陰窩の運命を経時的に追跡するために不可欠です。血管系などの固有の組織構造的特徴は、信頼できる組織ランドマークとして使用することができ、ここでは顕微鏡の内部カメラで記録されました。さらに、陰窩のごく一部を(少なくとも2つの)異なる色でラベル付けすることで、各イメージングセッションで同じ陰窩を認識し、レーザー損傷後の再生プロセス中のそれらの動作を追跡するのに役立ちました。マウスの腸を外科的に露光し、関心領域のカメラ画像と蛍光画像の両方を取得すると(図2A)、多光子レーザーの漂白点設定を使用して、1つまたは複数の陰窩をアブレーションできます(図2B、C)。損傷の開始は、緑と赤の両方のチャネルにおける自家蛍光の増加によって認識される可能性があります。陰窩回復のダイナミクスを研究するために、最初の画像セッションから数週間/数か月後に手術と画像診断手順を繰り返し、組織固有の構造(血管系とクローンで標識された陰窩のパターン)をランドマークとして使用して、損傷のまったく同じ場所を見つけました(図2)。この方法をLgr5Cre-Confetiマウスに適用した場合、Lgr5-eGFPは斑状に発現し、レーザー誘発損傷後の陰窩の数と形状の変化を捉えることができました(図3)。一部の地域では陰窩の数と構造に変化が見られませんでしたが(図3B)、他の領域では、陰窩の核分裂および核融合イベントの数(図3C)やレーザー誘発損傷の2週間後の陰窩の喪失(図3D)に見られるように、大規模な陰窩の改造が見られました。(図3E)に示す例のように、さまざまなサイズの損傷を導入し、アブレーション後の核分裂、融合、および消失イベントを定量化することにより、損傷誘発性再生のダイナミクスをさまざまなマウスモデルでマッピングできます。

図1:実験セットアップの概略図。 腸細胞のin vivo標識は、遺伝子改変マウスモデルにタモキシフェンを腹腔内注射して、腸管陰窩におけるCre媒介組換えを誘導することによって達成される。数日または数週間後(陰窩が特定の色に対してモノクローナルである場合)、腸を外科的に曝露し、温度制御されたチャンバーを備えた多光子顕微鏡を使用してレーザーアブレーションにかけます。陰窩損傷の程度はアブレーション直後に特徴付けられ、マウスは手順から回復することができます。反復外科的曝露とIVMは、経時的に腸の回復を監視するために使用されます。血液血管系のパターンと分布、および異なる色の陰窩は、アブレーションの数週間または数か月後に同じ領域を見つけるために使用されます。陰窩のリモデリング(例えば、核分裂または融合)は、アブレーションの数週間後に損傷部位で観察され得る。この図の拡大版を表示するには、ここをクリックしてください。

図2:腸内のレーザー誘発損傷時の組織再生の縦断的イメージング。 腸がまったく同じ方法で配置されている場合、腸の血管をマップとして使用して、まったく同じ領域を見つけて画像化できます。(A)腸のカメラ概要画像。白い破線は、損傷部位(白いボックス)に隣接する血管系のパターンを表し、別の時点で同じレーザーアブレーション領域を見つけるためのランドマークとして使用されます。下の2つの画像は、白いボックスの拡大ビューを示しています。矢印は、1日目と1か月後のレーザーアブレーションの正確な部位を示しています。(B)多光子顕微鏡で撮影された単一の陰窩損傷の蛍光画像。青いボックスの矢印は、1日目と1か月後の損傷の場所を示しています。(C)地下室の損傷したフィールドの蛍光画像。青いボックスの矢印は、1日目と1か月後の損傷の領域を示しています。スケールバー:1ミリメートル(A、トップ);0.25ミリメートル(A、底面);200 μm(大きな概観 B および C);および50μm(ズーム画像 B および C)。 この図の拡大版を表示するには、ここをクリックしてください。
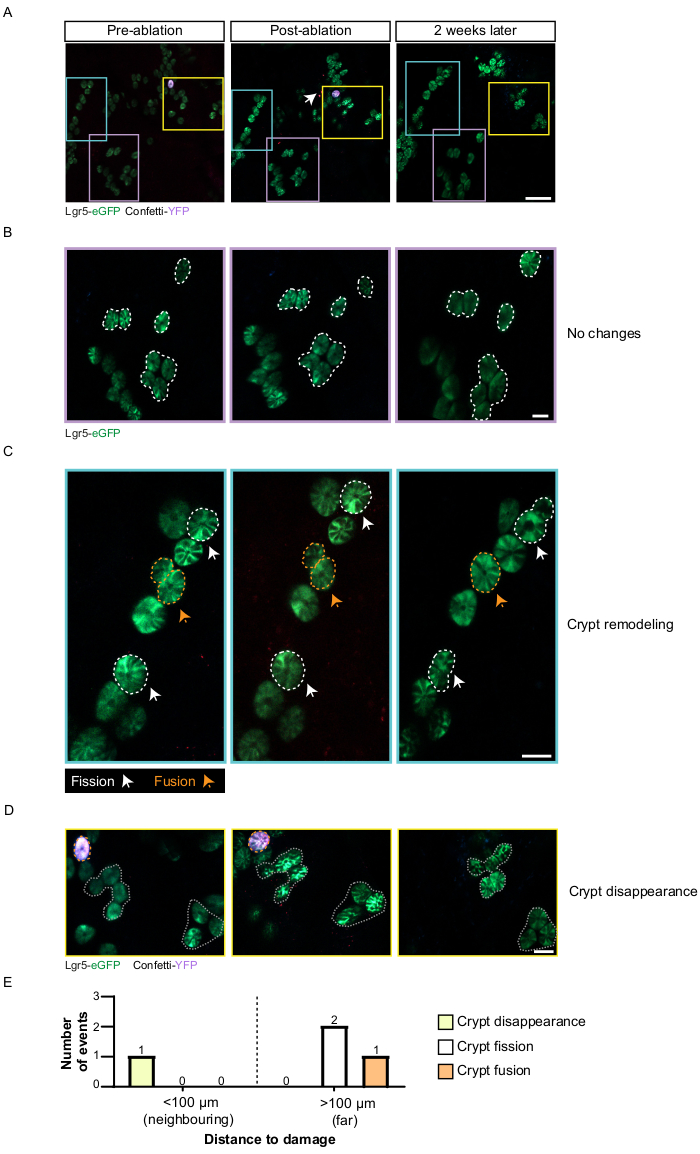
図3:レーザーアブレーション後の陰窩運命の生体内イメージング。 (A)紙吹雪モデルを使用すると、さまざまな色でラベル付けされた陰窩を経時的に追跡して、回復のダイナミクスをマッピングできます。白い矢印はレーザーアブレーションの部位を示しています。黄色のボックスは隣接する領域(損傷部位から<100 μm)を表し、青と紫のボックスはレーザーアブレーション領域から遠い領域(>100 μm)を表します。さまざまな再生モードが観察されます。(B)一部の地域は、紫色のボックスのように変更されていません。(C)他の地域は、陰窩核分裂または核融合の形で陰窩改造を示す。白い破線と矢印はクリプト核分裂イベントを表し、オレンジ色の破線と矢印はクリプト核融合イベントを表しています。(D)一部の地域では、オレンジ色の破線で強調表示された地下室が消えた黄色のボックスのように、地下室の消失が観察されます。(e)損傷部位に隣接(すなわち、100μm未満)および遠方(すなわち、100μm以上)で観察された陰窩リモデリング事象の数を示す定量化の例。スケールバー:200μm(A);50 μm (B-D)この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
このプロトコルは、顕微鏡レーザーアブレーションと縦方向の生体内顕微鏡を組み合わせて、初期の損傷反応から長期的な組織リモデリングまでの腸の再生を追跡します。この技術は、顕微鏡レーザーアブレーションを誘発して画像化するための倫理的考慮事項を厳守して確立されており、正確に従うと動物の健康を維持します。手術中は、腸の完全性が十分に保存されていることを確認することが重要です。これは、組織の出血や乾燥を防ぐ滅菌湿綿棒で組織を穏やかに取り扱うことによって達成できます。レーザー誘発顕微鏡的損傷の程度も、レーザーアブレーション後の領域のさまざまな腸層を画像化することによって注意深く評価する必要があります。研究者がこのプロトコルに記載されている実験ステップの頻度を適応させたい場合は、実験の前に研究所の動物倫理委員会に相談して、福祉への影響を確立する必要があります。
反復生体内顕微鏡検査により、同じマウスの組織回復を経時的に監視することができます。腸の外科的曝露を繰り返すと、腸管全体への光学的アクセスが容易になります。血管系などの組織固有の特徴は、各イメージングセッションで同じ腸領域を識別するためのランドマークとして機能します。したがって、同じ組織領域を数週間にわたって画像化することができ、同じマウスの同じ腸領域における長期の組織再生を定量化することができる。手術とイメージングを組み合わせた方法によって提供される時空間制御は、同じマウスで同じ臓器を恒常性と再生の両方の条件下でイメージングできるという利点をもたらし、これは、コントロールと再生サンプルが異なるマウスに由来する以前の全臓器損傷モデルとは対照的です11,12,18,19,20.したがって、私たちの実験設定は、実験に必要な動物の数を最小限に抑え、動物内の変動を減らします。
プロトコルのトラブルシューティングは、マウスと腸の取り扱い技術のレビュー、および顕微鏡機器と設定の制御から始める必要があります。このプロトコルには、特別な注意を必要とする多くの重要なステップがあります。まず、動物の健康と継続的な高データ品質を確保するために、すべての作業は無菌技術を使用して清潔な無菌環境で実行する必要があり、手術中および各イメージングセッション中にマウスの温度を維持する必要があります。イメージング中に滅菌済みの予熱生理食塩水で組織を水和させることは不可欠であり、組織の線維化を防ぎます。
実験が再現性のある方法で実行されるようにするには、最適な取得のために使用前にレーザーを位置合わせし、各セッションの開始時に多光子レーザーの出力を測定することが重要です。対物レンズの種類、倍率、滞留時間、レーザー出力、波長などのパラメータは、顕微鏡レーザーアブレーションの程度に影響を与えるため、考慮する必要があります。この研究では、レーザーアブレーションとイメージングの両方を、Fluotar VISIR 25x / 0.95 WATER対物レンズを介して、960nmの波長で1.2Wのレーザー出力(レンズ外)で実施します。波長または光学スキャン特性を変更すると、微視的損傷の程度に影響します。より低い波長(840nmなど)は、より高いエネルギーの光子に変換され、多くの場合、レーザーの出力が高くなり、微視的な損傷を強める可能性があります。ズームを高くすると、領域あたりのエネルギーが増えるため、暗号をアブレーションする時間が短くなり、その逆も同様です。ピクセル滞留時間を増減して、アブレーションの速度と損傷の程度を変更することもできます。画像化された組織が安定していない場合(例えば、蠕動運動のため)、アブレーションを迅速に実行する必要があります。この目的のために、アブレーションの速度は、例えば、ズームおよび/またはレーザー出力を増加させることによって最適化されるべきである。
複数のイメージングセッションで同じ腸領域を見つけることは、実験の成功を確実にするために適切に実行する必要がある別の重要なステップです。そのためには、腸を常に同じ方法で配置する必要があります。小腸と大腸の同じ領域を見つけるための基準点として常に盲腸を使用することをお勧めします。綿棒で関心のある組織を穏やかに伸ばすことで、関心のある領域が対物レンズの作動距離の範囲内にあることが保証され、さかのぼることができる領域の数が最大化されます。さらに、後のイメージングセッションでは局在化しない可能性のある領域を考慮して、各マウスの複数の顕微鏡位置を常にアブレーションしてイメージングすることをお勧めします。腸の位置が正しい場合でも、領域が見つからない場合は、マウスの位置を変更し、露出領域の向きを変更するのに役立ちます。経時的に陰窩を追跡することは、いくつかの隣接する陰窩のより大きな腸野がアブレーションされる実験では面倒な場合があります。このような有害な侮辱は、上皮単層を超えた組織のリモデリングを呼び起こす可能性があり、時間の経過とともに領域を追跡するために使用される組織ランドマークの変更に至る可能性があります。損傷部位から十分な距離にあるランドマークを選択し、損傷領域を数百マイクロメートル上回る広い視野をキャプチャすることで、長期実験が成功する可能性が高まります。顕微鏡ステージでの腸の誤った位置に加えて、胃腸管の蠕動運動は画像化を妨げる可能性があります。この問題は、2つの方法で改善される可能性があります。動きの頻度が高すぎない場合は、露光時間を増やして同じ領域でこのプロセスを繰り返すことができます。あるいは、蠕動運動を減少させるために、より多くの麻酔を使用することができる。高用量のイソフルランを短い調整に制限することをお勧めします。.全体として、迅速な回復を確実にするために、イメージングセッションは可能な限り短く、最適には3時間未満に保つ必要があります。
レーザーアブレーションと縦方向の生体内顕微鏡を組み合わせたアプローチには、他の損傷モデルと比較していくつかの利点があります。以前の(化学的)損傷モデルには、有害な侮辱を局所的に閉じ込める能力が欠けていました6,11,12,19,20。レーザーアブレーションは、定義された関心領域への損傷を制限することにより、この欠点を克服します。これにより、研究者は損傷の場所と損傷の程度を制御できます。損傷の重症度を調節して、陰窩または微視的な腸野全体を切除し、陰窩スケールでの再生応答について知らせることができます。空間制御に加えて、レーザーアブレーションは損傷の開始を正確に計ることも可能にし、それによって以前の薬物、化学、および感染モデルの精度を上回ります9,10,11,12,19,20。私たちのプロトコルは、腸の局所的な損傷を誘発する方法としてレーザー誘発熱アブレーションを使用した以前の研究を拡張しています21,23。以前のレーザー誘発損傷モデルは、小腸21または遠位結腸23の管腔表面の局所領域を画像化した。手術とレーザーアブレーションを組み合わせたアプローチにより、腸上皮(特に陰窩)を高解像度で可視化し、小腸、盲腸、近位結腸の任意の位置で組織回復のレーザーアブレーションとフォローアップイメージングを行うことができます。同じ腸領域の経時的な回復を捉え、実験セットアップに従って腸のさまざまな層(粘膜、粘膜下組織、筋肉、漿膜)を視覚化することができます。私たちの技術は、主に数週間/数ヶ月の期間にわたる長期の繰り返しイメージング用に調整されています。陰窩の短期的な回復ダイナミクス(例えば、損傷後の数日間の連続)を研究するために、ここで説明するレーザーアブレーションアプローチを、生体内画像化ウィンドウ27、28、40と組み合わせることができる。
このプロトコルは、再生、免疫学、および癌研究にまたがる多様な科学分野の多数の研究アプリケーションに利用できます。腸管再生の縦断的イメージングは、上皮の完全性とバリア機能を維持し、腸管腔内の病原体に対する宿主防御を可能にし、発癌性変異のクリアランスと拡散の根底にある細胞動態に光を当てます。それぞれの科学的質問は、レーザー誘発損傷の程度とイメージングの期間に独自の要求を投げかけます。蛍光レポーターマウスと注入された色素は、目的の任意の細胞と構造の視覚化を可能にすることにより、取得できるデータを大幅に拡大および洗練することができます。例えば、Lgr5-CreERt2:Rosa26-Confeti マウスは幹細胞の子孫を可視化するために使用でき、Rosa26-mTmG レポーターは組織構造に関する情報を提供します。これらの最近の技術的進歩により、生体内腸実験は、腸の生物学と病気の理解を深めるための有利なツールになっています。
開示事項
著者は開示するものは何もありません。
謝辞
この研究は、オランダ科学研究機構NWO(J.v.R.へのVici助成金09150182110004、H.A.M.へのVeni助成金09150161910151)、OCENWの支援を受けました。GROOT.2019.085(J.v.Rへ)、およびEMBOポスドクフェローシップ(ALTF 452-2019をHAMに付与)。
資料
| Name | Company | Catalog Number | Comments |
| Anesthesia induction box | Veterinary Technics | ||
| Autoclave | Certoclav | ||
| Betadine | Mylan | 202809 | |
| Diaper (underpad) | Absorin comfort | ||
| Dumont forceps | Fine Scientific Tools | 11255-20 or 11272-40 | Inox, style #55, used to hold the peritoneum |
| Enzymatic instrument cleaner | Roboz | EC-1000 | |
| Ethanol 80% | homemade | NA | |
| Eye ointment | Duratears Z (Alcon) | 288/28282-6 | |
| Fine Scissors Straight 9 cm | Fine Scientific Tools | 14060-09 | Used to cut skin and peritoneum of the mouse |
| Gauze 5 cmX5 cm | Cutisoft (Bsn medical) | 45847-00 | |
| Graefe Forceps Curved Serrated | Fine Scientific Tools | 11051-10 | Used to hold the skin |
| Hartman Hemostat Straight | Fine Scientific Tools | 13002-10 | Used for suturing |
| Heating pad | Comfort | T5-5000 | |
| Imaging box | Custom made | ||
| Incision film | Nobafilm | 172215 | |
| Inverted multi-photon microscope with automated stage | Leica Microsystems | NA | |
| Isoflurane (vetflurane) | Pharmachemie BV, Haarlem, Netherlands | 305788 | |
| Isoflurane vaporizer | Penlon sigma delta | ||
| Micropore paper tape | Micropore | ||
| NaCl 0.9% | Braun | Other brands available | |
| Needle 25G | BD | 300600 | |
| Paper tape tesa | Tesa | NA | |
| Parafilm | Bemis | PM-994 | semi-transparent tape |
| Razor blades | Supermax stainless steel | Other brands available | |
| Rectal probe | Kent Scientific | 20250-91 | |
| Rimadyl Cattle (carprofen) | Zoetis B.V | Registration# REG NL 10130 | |
| Student Fine Scissors Straight 11.5 cm | Fine Scientific Tools | 91460-11 | Used to cut gauze |
| Surgical instrument cleaner | Roboz | IC-1000 | |
| Surgical instrument lubricant | Roboz | IL-1000 | |
| Syringes (1 ml) | BD | 303172 | Other brands available |
| Tamoxifen | Sigma | T5648 | |
| Temgesic (Buprenorphine hydrochloride) | Indivior UK Limited/Reckitt Benckiser Healthcare | Registration# RVG 08725 | |
| Vicryl polyglactin suture 5-0 FS-2 needle | Ethicon | V292ZH | |
| VirkonS | Bio-services | antiseptic solution | |
| Wooden cotton swab (sterile) | Klinion | 531530 | Other brands available |
参考文献
- Clevers, H. The intestinal crypt, a prototype stem cell compartment. Cell. 154 (2), 274-284 (2013).
- Darwich, A. S., Aslam, U., Ashcroft, D. M., Rostami-Hodjegan, A. Meta-analysis of the turnover of intestinal epithelia in preclinical animal species and humans. Drug Metabolism and Disposition. 42 (12), 2016-2022 (2014).
- Beumer, J., Clevers, H. Regulation and plasticity of intestinal stem cells during homeostasis and regeneration. Development. 143 (20), 3639-3649 (2016).
- Ritsma, L., et al. Intestinal crypt homeostasis revealed at single-stem-cell level by in vivo live imaging. Nature. 507 (7492), 362-365 (2014).
- Azkanaz, M., et al. Retrograde movements determine effective stem cell numbers in the intestine. Nature. 607 (7919), 548-554 (2022).
- van Es, J. H., et al. Dll1+ secretory progenitor cells revert to stem cells upon crypt damage. Nature Cell Biology. 14 (10), 1099-1104 (2012).
- Tomic, G., et al. Phospho-regulation of ATOH1 is required for plasticity of secretory progenitors and tissue regeneration. Cell Stem Cell. 23 (3), 436-443 (2018).
- Asfaha, S., et al. Krt19+/Lgr5- cells are radioresistant cancer-initiating stem cells in the colon and intestine. Cell Stem Cell. 16 (6), 627-638 (2015).
- Schmitt, M., et al. Paneth cells respond to inflammation and contribute to tissue regeneration by acquiring stem-like features through SCF/c-Kit signaling. Cell Reports. 24 (9), 2312-2328 (2018).
- Davidson, L. A., et al. Alteration of colonic stem cell gene signatures during the regenerative response to injury. Biochimica et Biophysica Acta. 1822 (10), 1600-1607 (2012).
- Ijiri, K., Potten, C. S. Further studies on the response of intestinal crypt cells of different hierarchical status to eighteen different cytotoxic agents. British Journal of Cancer. 55 (2), 113-123 (1987).
- Andersson-Rolf, A., Zilbauer, M., Koo, B. K., Clevers, H. Stem cells in repair of gastrointestinal epithelia. Physiology. 32 (4), 278-289 (2017).
- Totafurno, J., Bjerknes, M., Cheng, H. The crypt cycle. Crypt and villus production in the adult intestinal epithelium. Biophysical Journal. 52 (2), 279-294 (1987).
- Dekaney, C. M., Gulati, A. S., Garrison, A. P., Helmrath, M. A., Henning, S. J. Regeneration of intestinal stem/progenitor cells following doxorubicin treatment of mice. American Journal of Physiology. Gastrointestinal and Liver Physiology. 297 (3), G461-G470 (2009).
- Cairnie, A. B., Millen, B. H. Fission of crypts in the small intestine of the irradiated mouse. Cell and Tissue Kinetics. 8 (2), 189-196 (1975).
- Bruens, L., Ellenbroek, S. I. J., van Rheenen, J., Snippert, H. J. In vivo imaging reveals existence of crypt fission and fusion in adult mouse intestine. Gastroenterology. 153 (3), 674-677 (2017).
- Baker, A. M., et al. Crypt fusion as a homeostatic mechanism in the human colon. Gut. 68 (11), 1986-1993 (2019).
- Barker, N., et al. Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature. 449 (7165), 1003-1007 (2007).
- Okayasu, I., et al. A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice. Gastroenterology. 98 (3), 694-702 (1990).
- Rakoff-Nahoum, S., Paglino, J., Eslami-Varzaneh, F., Edberg, S., Medzhitov, R. Recognition of commensal microflora by toll-like receptors is required for intestinal homeostasis. Cell. 118 (2), 229-241 (2004).
- Choi, J., et al. Intestinal crypts recover rapidly from focal damage with coordinated motion of stem cells that is impaired by aging. Scientific Reports. 8 (1), 10989(2018).
- Tian, H., et al. A reserve stem cell population in small intestine renders Lgr5-positive cells dispensable. Nature. 478 (7368), 255-259 (2011).
- Choi, M., Yun, S. H. In vivo femtosecond endosurgery: an intestinal epithelial regeneration-after-injury model. Optics Express. 21 (25), 30842-30848 (2013).
- Seno, H., et al. Efficient colonic mucosal wound repair requires Trem2 signaling. Proceedings of the National Academy of Sciences. 106 (1), 256-261 (2009).
- Hua, G., et al. Distinct levels of radioresistance in Lgr5+ colonic epithelial stem cells versus Lgr5+ small intestinal stem cells. Cancer Research. 77 (8), 2124-2133 (2017).
- Rompolas, P., et al. Live imaging of stem cell and progeny behaviour in physiological hair-follicle regeneration. Nature. 487 (7408), 496-499 (2012).
- Alieva, M., Ritsma, L., Giedt, R. J., Weissleder, R., van Rheenen, J. Imaging windows for long-term intravital imaging: General overview and technical insights. Intravital. 3 (2), e29917(2014).
- Rakhilin, N., et al. An intravital window to image the colon in real time. Nature Communications. 10 (1), 5647(2019).
- Messal, H. A., et al. Antigen retrieval and clearing for whole-organ immunofluorescence by FLASH. Nature Protocols. 16 (1), 239-262 (2021).
- Farrelly, O., et al. Two-photon live imaging of single corneal stem cells reveals compartmentalized organization of the limbal niche. Cell Stem Cell. 28 (7), 1233-1247 (2021).
- Krndija, D., et al. Active cell migration is critical for steady-state epithelial turnover in the gut. Science. 365 (6454), 705-710 (2019).
- Bruens, L., et al. Calorie restriction increases the number of competing stem cells and decreases mutation retention in the intestine. Cell Reports. 32 (3), 107937(2020).
- Bietar, B., Zhou, J., Lehmann, C. Utility of intestinal intravital microscopy for the study of CNS injury-induced immunodepression syndrome (CIDS). Clinical Hemorheology and Microcirculation. 79 (1), 137-147 (2021).
- Erreni, M., Doni, A., Weigert, R. Method for acute intravital imaging of the large intestine in live mice. Methods in Molecular Biology. 2304, 285-299 (2021).
- Hiltensperger, M., et al. Skin and gut imprinted helper T cell subsets exhibit distinct functional phenotypes in central nervous system autoimmunity. Nature Immunology. 22 (7), 880-892 (2021).
- Martínez-Sánchez, L. D. C., et al. Epithelial RAC1-dependent cytoskeleton dynamics controls cell mechanics, cell shedding and barrier integrity in intestinal inflammation. Gut. 72 (2), 275-294 (2022).
- Means, A. L., Xu, Y., Zhao, A., Ray, K. C., Gu, G. A CK19(CreERT) knockin mouse line allows for conditional DNA recombination in epithelial cells in multiple endodermal organs. Genesis. 46 (6), 318-323 (2008).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45 (9), 593-605 (2007).
- Snippert, H. J., et al. Intestinal crypt homeostasis results from neutral competition between symmetrically dividing Lgr5 stem cells. Cell. 143 (1), 134-144 (2010).
- Messal, H. A., van Rheenen, J., Scheele, C. L. An intravital microscopy toolbox to study mammary gland dynamics from cellular level to organ scale. Journal of Mammary Gland Biology and Neoplasia. 26 (1), 9-27 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved