Method Article
胚性海馬ニューロンの凍結ストックを用いた容易で再現性の高い低密度初代培養
要約
すぐに使用できるニューロンの凍結ストックは、シナプス機能を評価するための強力なツールです。ここでは、96ウェルプレートを用いた凍結ストックからの容易な低密度初代培養を紹介します。
要約
神経細胞培養は、シナプス機能の評価や薬物スクリーニングのための貴重なシステムです。特に、初代海馬ニューロンの低密度培養は、個々のニューロンまたは細胞内成分の研究を可能にする。我々は、低密度初代海馬培養を用いて、免疫細胞化学、神経細胞極性、シナプス形態、およびその発生変化によって、ニューロン内の細胞内タンパク質局在を示した。最近、すぐに使用できるニューロンの凍結ストックが市販されている。これらの凍結ニューロンストックは、動物実験の準備に必要な時間を短縮し、使用する動物数の削減にも貢献します。ここでは、96ウェルプレートを用いた再現性のある低密度初代培養法を紹介します。ラット胚海馬由来のニューロンの市販の凍結ストックを用いた。ニューロンは、特定の時点でのグリア細胞の増殖を減少させることにより、培地を変更することなく長期間安定して培養することができる。低密度培養を用いたこのハイスループットアッセイにより、シナプス可塑性の再現性のあるイメージングベースの評価が可能になります。
概要
学習や記憶に関わるシナプス機能を評価できるin vitro実験系の開発が重要である。神経細胞培養は、in vitroでシナプス機能を評価するための貴重なシステムです。神経培養技術は1980年代に最初に使用され、1990年代には、タンパク質成分の細胞内局在、タンパク質輸送、ニューロン極性、脊椎形態、シナプス発達、および可塑性の観点から個々のニューロンの研究のために、初代海馬ニューロンの低密度培養が開発されました1,2,3 4,5,6,7,8 .ただし、この技術には、動物の交配、胚の解剖、培養容器の準備、週に1回の培地交換による3週間の細胞の培養など、多くのステップが含まれます。また、事前の技術3を必要とする。
我々は、ラット胚9,10から解離した海馬ニューロンの凍結ストックを開発しました。ニューロンの凍結ストックはすぐに使用でき、細胞を培養するための事前技術は必要ありません11,12。言い換えれば、凍結ストックからニューロンを培養することは、実験者の技術に依存しない。動物実験(動物実験の許可、時限妊娠動物の手配、ラット胚の解剖など)が不要になり、使用する動物の数を減らすことができます。最近、ニューロンの高品質ですぐに使用できる凍結ストックが市販されている。ここでは、ラット海馬13、14、15の胎生(E)18日目からの市販の凍結ストックを用いた。凍結ストックからニューロンを培養するには、グリア馴化培地やグリア細胞との共培養は必要ありません。追加の血清を含まない通常の初代培養培地を使用して細胞を培養できます。したがって、再現性のあるデータを取得できます。さらに、グリア細胞の増殖が減少するので、細胞播種後3週間は培地交換の必要がない(図1)。
樹状突起棘は、ほとんどの興奮性シナプスのシナプス後コンパートメントです。それらは、受容体タンパク質、シナプス後足場タンパク質、およびアクチン細胞骨格タンパク質を含む。我々は、アクチン結合タンパク質ドレブリン5,6,7,16,17,18に着目した。ドレブリンは成熟ニューロン19の脊椎頭部に蓄積し、シナプス状態のマーカーとしてドレブリンを報告した15,17,20,21,22,23。最近、ドレブリンをリードアウトとしてハイコンテント解析を行うことにより、フェンシクリジン類縁体のN-メチル-D-アスパラギン酸型グルタミン酸受容体(NMDAR)10に対する阻害効果と、シナプス状態に対する天然化合物と生薬のNMDAR依存的効果15を報告しました。
ここでは、ニューロンの凍結ストックを低密度で培養する方法について詳しく説明します。また、96ウェルプレートを用いたシナプス状態のドレブリンイメージングベースの評価を示す。
プロトコル
1.プレートコーティング
- 96ウェルマイクロプレートをポリ-L-リジン(1 mg/mL、0.1 Mホウ酸塩バッファー[pH:8.5];100 μL/ウェルで希釈)でコーティングし、37°Cで一晩インキュベートします。
注意: 使用する必要のあるウェルのみをコーティングしてください。ここで行われた実験では、中央の60ウェルが使用されます。ホウ酸緩衝液は、滅菌水中で50 mMのホウ酸と12 mMのホウ酸塩を混合することによって調製されます。 - プレートを滅菌水(250μL/ウェル)で2回洗浄します。
- プレートをサプリメントを含まない新鮮な培地(250 μL/ウェル)で1回洗浄します。
- プレートをクリーンベンチで20分間乾燥させます。
- プレートをアルミホイルで包み、使用するまで4°Cに保ちます(1か月間有効)。
2.細胞播種
- 50 μL/ウェルの培地をコーティングプレートに加え、37°C、5%CO2 インキュベーターで30分から1時間保持します。周辺ウェルに滅菌水(200 μL/ウェル)を入れます。
注:培養培地は、50x B-27、400x Glutamax、および100 U / mLのペニシリン/ストレプトマイシンを神経基底培地に添加することによって調製されます(詳細については、 材料の表 を参照してください)。 - 液体窒素タンクからニューロンクライオバイアルを取り出します。ここで使用したニューロンは、DMSO凍結保存されたニューロン11であった。
- クライオバイアルを37°Cのヒートブロックに最大3分間浸し、内容物を部分的に解凍します。クライオバイアルを長時間温めないでください。解凍したらすぐに内容物を50mLチューブに移します。
- ニューロンクライオバイアル内容物を、広い細孔チップを備えた1 mLピペットを使用して、滅菌済みの50 mLチューブに滴状(50 μL / s)でゆっくりと移します。
- 空のクライオバイアルを1 mLの培養液(室温;RT)。この1 mLの培養液をクライオバイアルドロップワイズ(50 μL/s)から細胞懸濁液の入った50 mLチューブに移します。
- 9 mLの培養液(RT)を50 mLチューブに滴下(0.5 mL / s)加え、容量を11 mLに構成します。ピペッティングを繰り返さずに、細胞懸濁液をゆっくりと混合します。
- 細胞数を数えます(細胞カウンターまたは血球計算盤を使用)。
- すべての細胞懸濁液をリザーバーに移し、ワイドポアチップ(1.0 x 104 細胞/ウェル)を備えたマルチチャンネルピペットを使用して、細胞懸濁液を96ウェルプレートに分注します。培地の蒸発を減らすには、周辺ウェルに滅菌水を入れます(ステップ2.1)。
注:この研究では、培地交換なしの3週間の培養では、培地の蒸発が少ないことが確認されています。培地の減少率は3.6%(n=120ウェル)である。したがって、浸透圧の変化は、3週間の潜伏期間中に劇的ではありません。 - ニューロンを37°C、5%CO2 インキュベーター内で1〜2時間インキュベートします。
- 培養液をウェルあたり100 μLの予熱した培養液(37°C)に交換し、37°C、5%CO2 インキュベーターに戻します(培養中に培地を交換する必要はありません)。
3.アラC治療
- in vitro(DIV)で4日間、グリア細胞の増殖を抑えるために、シトシンβ-D-アラビノフラノシド(Ara-C)をウェルあたり0.2 μMの最終濃度まで添加します。
4.薬物治療
- インビトロで21日目に、目的の薬で細胞を処理します。
- 薬物治療中はプレートの温度を37°Cに保ちます。
- ポジティブコントロールの場合は、細胞を100 μMのグルタミン酸塩(最終濃度のウェルあたり)で10分間処理してから固定します。
5.固定
- 固定には、0.1 Mリン酸緩衝液(100 μL/ウェル)中の4%パラホルムアルデヒドを使用します。
- 固定後~20分、リン酸緩衝生理食塩水(PBS;250 μL/ウェル)でウェルを2回ずつ5分間洗浄します。
6. 免疫細胞化学
- 細胞をPBS(250 μL/ウェル)で1回5分間洗浄します。
- PBS中の0.1%Triton X-100(100 μL/ウェル)で細胞を5分間透過処理します。
- 細胞をPBS(250 μL/ウェル)で3回、それぞれ5分間洗浄します。
- ブロッキングには、PBS中の3%ウシ血清アルブミン(PBSA;100 μL/ウェル)をRTで1時間使用します。
- 細胞を抗ドレブリン(1:1)および抗微小管関連タンパク質2(MAP2)(1:000)抗体(60 μL/ウェル)とともに4°Cで一晩インキュベートします。
- 細胞をPBS(250 μL/ウェル)で4回ずつ5分間洗浄します。
- 細胞を適切な二次抗体および4′,6-ジアミジノ-2-フェニルインドール二塩酸塩(DAPI;1:1000)とともにPBSA(60 μL/ウェル)中でRTで2時間インキュベートします。
- 細胞をPBS(250 μL/ウェル)で4回ずつ5分間洗浄します。
- 細胞を0.1%アジ化ナトリウム(150 μL/ウェル)を含むPBSに保存します。
7. 画像の取得と解析
- 画像を取得するには、適切な顕微鏡を使用してください。
- ニューロンの細胞体を特定するには、MAP2陽性領域とDAPI陽性領域の両方を使用します。
- ニューロンの樹状突起を同定するには、細胞体のないMAP2陽性シグナルを使用します。
- ドレブリンクラスターを同定するには、MAP2陽性樹状突起に沿ってドレブリン陽性シグナルを使用します。
結果
プロトコルに従って、ニューロンを96ウェルプレートで21日間培養し、グルタミン酸で処理しました(図1)。ニューロンは、培養液の交換なしで3週間正常に発達しました(図2)。数濃度のグルタミン酸(滅菌水で希釈した1μM、3μM、10μM、30μM、100μM)で10分間処理し、固定しました。免疫細胞化学を行い、sCMOSカメラを備えた自動蛍光顕微鏡を用いてドレブリンおよびMAP2の蛍光画像を取得しました。図3に示すように、MAP2陽性樹状突起に沿ってドレブリン陽性樹状突起棘が明瞭に観察される。グルタミン酸刺激はNMDARを介したCa2+流入を誘発し、樹状突起棘からのドレブリン流出を引き起こし、ドレブリンクラスター密度を低下させることが示されています5,17。したがって、グルタミン酸刺激に対するドレブリンクラスター密度の用量依存的な減少を観察しました10(図4)。図5に示すように、この方法は、ドレブリンをシナプス状態のマーカーとして使用すると再現性が高い。
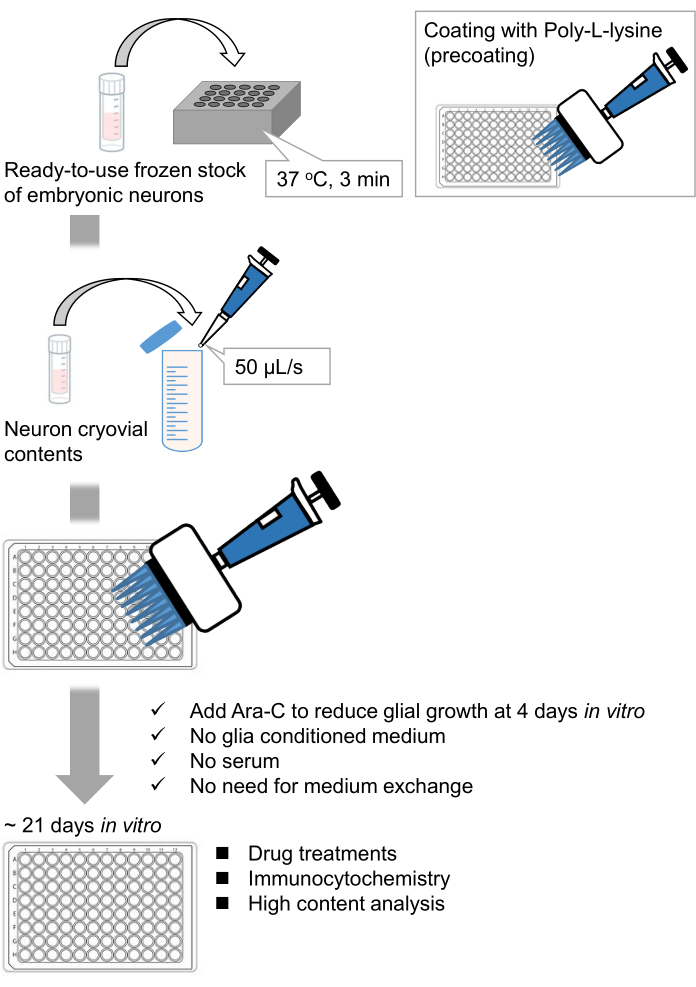
図1:メソッドのスキーム。 ニューロンを96ウェルプレートで21日間培養した後、グルタミン酸で処理した。 この図の拡大版を表示するには、ここをクリックしてください。
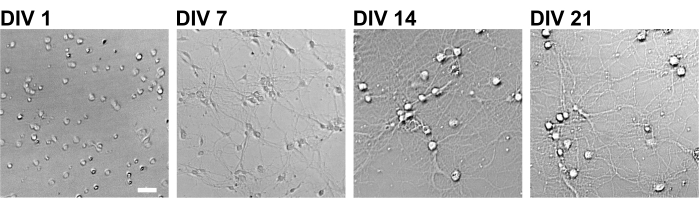
図2:96ウェルプレートを用いた培養ニューロンの明視野画像。 位相差画像は、共焦点定量画像サイトメーターを用いて各発生段階(DIV 1、7、14、21)から得られた。スケールバー:50μm。 この図の拡大版を表示するには、ここをクリックしてください。
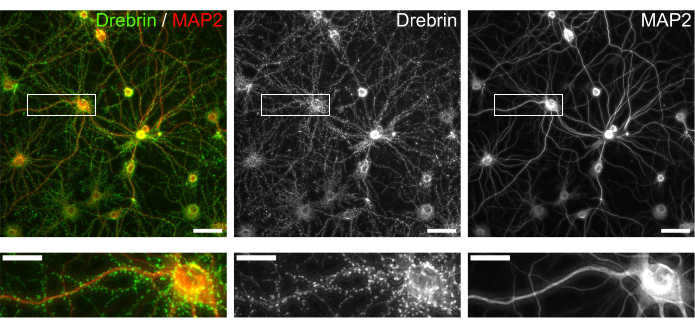
図3:免疫染色培養ニューロンの代表的な画像 。 (左) ドレブリン(緑)とMAP2(赤)の合成蛍光画像。ドレブリンおよびMAP2の各蛍光像をそれぞれ中央パネルおよび右パネルに示した。白い長方形は、下に拡大された領域を示しています。スケールバー;上パネル:50μm、下パネル:20μm。 この図の拡大版を表示するには、ここをクリックしてください。
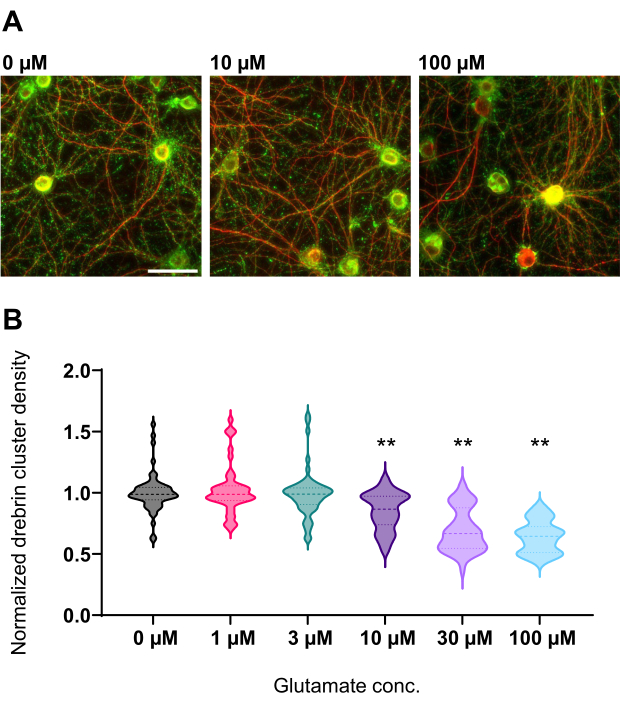
図4:正規化ドレブリンクラスター密度におけるグルタミン酸依存的な用量反応変化。 (A)0 μM、10 μM、および100 μMのグルタミン酸で処理したウェルからのドレブリン(緑)およびMAP2(赤)を使用して免疫染色された代表的な蛍光画像(左から右へ)。スケールバー:50μm。 (B)ドレブリンクラスター密度は、コントロールの平均(0μM)で標準化した。0 μM, N = 58 ウェル;1 μM, N = 46;3 μM, N = 54;10 μM, N = 45;30 μM, N = 54;100 μM、N = 55、異なるロットを使用した13の実験から。** < 0.01 対対照(0 μM)は、ANOVA後のダネットの多重比較検定による。 この図の拡大版を表示するには、ここをクリックしてください。
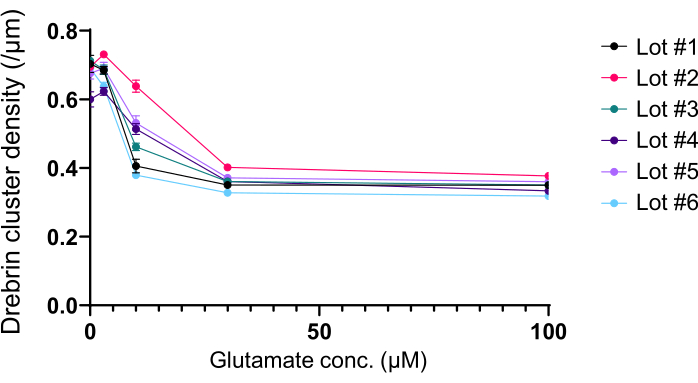
図5:ドレブリンクラスター密度におけるグルタミン酸依存的な用量反応の変化。 異なるロットを用いた6つの実験からの生データ。N = 各濃度(0 μM、3 μM、10 μM、30 μM、および100 μM)に対して4つのウェル。値はSEM±平均値で表されます。 この図の拡大版を表示するには、ここをクリックしてください。

図6:神経細胞の凍結ストックの電気生理学的実験への応用 。 (A)微小電極アレイ(MEA)プレートを用いた電気生理学的実験のためのプロトコル。コーティング:細胞をプレーティングする1日前に、各48ウェルMEAプレートにポリエチレンイミン(PEI:0.1%)溶液をプレコートし、37°Cで1時間インキュベートした。 次いで、MEAプレートを滅菌水で3回洗浄し、1時間乾燥させた。その後、MEAプレートを4°Cで一晩保温した。高密度培養:ニューロンの50,000細胞/ウェルを48ウェルMEAプレートにプレーティングしました。細胞播種工程は、上述のプロトコルのセクション2に記載のように実施した。ラミニン(20 μg/mL)を添加した培地(神経基礎培地に2 v / v%B-27、2.5 mM Glutamax、および100 μg / mLのペニシリン/ストレプトマイシンを追加)を使用してニューロンをプレートしました。その後、ニューロンを37°C、培養液中の5%CO2 で培養した。培地をDIV1上でDIV3までの培養液と完全に交換した。Ara-CをDIV 4(最終0.2 μM)で添加しました。DIV 5以降および週2回以降、培地の50%を培地で交換した。MEAプレートの各ウェル上のニューロンの活性をMEAシステムで記録した。(B)自発的な神経活動は、DIV 21で12.5kHz/チャネルのサンプリングレートでMEAシステムを使用して、5%CO2 雰囲気下37°Cで獲得されました。ウェル内の16チャンネルのうち4チャンネルからの録音が表示されます。すべての録音に、バターワースバンドパスフィルター(200〜3,000 Hz)が適用されました。矢印は、同期バースト発射のタイミングを示します。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
この方法における重要なステップは、細胞懸濁液を解凍することである。細胞懸濁液が温まりすぎる前に細胞懸濁液の移動は非常に重要です。ただし、浸透圧の急激な変化を避けるために、細胞懸濁液を一度に大量の培地に移さないでください。培養液のドロップワイズ添加も、浸透圧の急激な変化を避けるために重要です。
ニューロンは、他の培養容器(24ウェルプレート、8ウェルチャンバー、60 mmディッシュ、またはMEDプローブ)で培養できます。ただし、そのような場合は、Ara-Cの最終濃度と添加時期を調整する必要があります。さらに、ニューロンの密度は、さまざまな種類の実験で最適化する必要があります。例えば、電気生理学的実験には高密度培養が必要であり、その場合、週に2回の培地交換が必要です(図6)。したがって、低密度培養は高密度培養よりも少ないステップで済みます。
低密度の神経細胞培養には、多くの場合、高度な技術が必要です。ただし、すぐに使用できる冷凍ストックを使用すると、この問題が解決されます。記載された方法は、実験者の技能に依存しない。冷凍ストックの品質は安定しており、液体窒素で保存し、最大4年間温度変化を回避すれば安定して培養できます。
培地交換なしで細胞を3週間培養すると、浸透圧の著しい変化や培地の蒸発があるかどうかという疑問が生じます。しかし、培地の蒸発量は少ない(還元率3.6%)ことを確認しています。シナプスタンパク質の局在およびニューロンの形態は、3週間後に正常に見える。したがって、培地交換なしの3週間の培養は、培養ニューロンの状態に影響を与える大きな浸透圧変化を引き起こさない。Ara-C処理後にプレートをインキュベーター内に保管することも、蒸発を最小限に抑える重要なポイントです。
凍結ストックニューロンの使用に関して制限はない。しかしながら、低密度培養法にはいくつかの制限がある。低密度培養は、神経細胞の形態観察、シナプス機能の評価、GFPトランスフェクションに応用できることを確認しました。しかし、我々は生細胞イメージングを検討していない。さらに、前述のように、電気生理学を行うためには高密度培養が必要である。
シナプスの成熟には通常3週間7かかり、培養ニューロンが最後まで適切なシナプスを持っていることを確認することはできません。3週間後にシナプスの成熟が良くない場合は、再度培養する必要があります。実験を開始する前にニューロンの質を知ることで、この3週間を節約できます。したがって、実験を効率的に行うためには、事前にニューロンの質を確認することが最善です。冷凍ストックは、ニューロンの品質を事前にチェックすることを可能にします。冷凍ストックの各バッチは1匹のラットから生成され、各バッチのストックの1つを品質チェックに使用できます。ドレブリンは、ニューロンの品質チェックのための良いマーカーです。説明したように、ドレブリンは成熟ニューロンの脊椎頭に蓄積し、シナプス刺激に反応します。したがって、ドレブリンをマーカーとして使用することで、冷凍ストックのニューロンの品質を確認できます。
この方法は、シナプス状態に対する薬物の効果を評価するために適用することができる。樹状突起棘からのドレブリン流出は、シナプス可塑性の初期段階で発生します22。したがって、薬物治療によって誘発されるドレブリンクラスター減少の検出は、薬物がシナプスを刺激し、シナプス可塑性を引き起こすことを示しています。さらに、還元がNMDAR依存性であるかどうかを特定するために、2-アミノ-5-ホスホノ吉草酸(APV、NMDARアンタゴニスト)を用いた実験が有用である。ドレブリンをマーカーとして用いると、NMDAR依存性も明確に決定される10,15。記載された方法は、薬物スクリーニング、安全性薬理学的研究、およびシナプス機能の評価において有用である。
開示事項
白尾智明はアルツメッド株式会社の代表取締役です。本研究は、AlzMed, Inc.(NKに50万円の「シナプス機能のハイスループット解析」と題するプロジェクト)から資金提供を受けました。
謝辞
実験に協力してくださった神山和美さんと川田真奈美さんに感謝します。本研究は、JSPS科研費(課題番号19K08010)および国立研究開発法人日本医療研究開発機構(AMED)(課題番号JP19bk0104077およびJP22bm0804024)の支援を受けて行われました。
資料
| Name | Company | Catalog Number | Comments |
| 96 well plate | Zeon Corporation | Gifted | |
| 96 well plate | greiner | 655986 | |
| Anti-drebrin antibody (M2F6) | MBL | D029-3 | Mouse monoclonal (dilution 1:1) |
| Anti-MAP2 antibody | Millipore | AB5622 | Rabbit (dilution 1:1000) |
| Anti-mouse Alexa Fluor 568 | Thermo Fisher Scientific | A11031 | Dilution 1: 500 |
| Anti-rabbit Alexa Fluor | Thermo Fisher Scientific | A11008 | Dilution 1: 500 |
| B-27 | Gibco | 17504-044 | 2 v/v% for MEA plates; 50x for normal plates |
| Borax | Sigma | B-9876 | Final concentration 12 mM |
| Boric acid | WAKO | 021-02195 | Final concentration 50 mM |
| Bovine serum albumin | Millipore | 12659-100G | Final concentration: 3% in PBS |
| Confocal quantitative image cytometer CellVoyager CQ1 | YOKOGAWA | Phase contrast images | |
| Cytosine β-D-arabino-furanoside (Ara-C) | Sigma | C-6645 | Diluted in dH2O (final concentration: 0.2 µM) |
| DAPI | FUJIFILM | 340-07971 | Dilution 1:1000 |
| GlutaMAX | Gibco | 35050-061 | 2.5 mM for MEA plates; 400x for normal plates |
| In Cell Analyzer 2200 | Cytiva | Fluorescence images | |
| Laminin | Sigma | 114956-81-9 | Final concentration: 20 µg/mL |
| Maestro | Axion Biosystems | MEA recordings | |
| MEA plate | Axion Biosystems | M768-tMEA-48W | |
| Neurobasal | Gibco | 21103-049 | |
| Paraformaldehyde | nacalai tesque | 26126-25 | Final concentration: 4% in PBS |
| Penicillin/Streptomycin | Gibco | 15140-122 | 100 U/mL for normal plates |
| Penicillin/Streptomycin | nacalai tesque | 26253-84 | 100 µg/mL for MEA plates |
| polyethyleimine | Sigma | 9002-98-6 | Final concentration: 0.1% |
| Poly-L-lysine | Sigma | P2636 | Diluted in the borate buffer (final concentration: 1 mg/mL) |
| SKY Neuron | AlzMed , Inc. | ARH001 | 1.0 x 106 cells/tube |
| Sodium azide | FUJIFILM | 195-11092 | 0.1% |
| SodiumL(+)-Glutamate monohydrate | WAKO | 194-02032 | Diluted in dH2O (final concentrations: 1 µM, 3 µM, 10 µM, 30 µM, 100 µM) |
参考文献
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain Research. 126 (3), 397-342 (1977).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocols. 1 (5), 2406-2415 (2006).
- Roppongi, R. T., Champagne-Jorgensen, K. P., Siddiqui, T. J. Low-density primary hippocampal neuron culture. Journal of Visualized Experiments. (122), e55000 (2017).
- Mizui, T., et al. Drebrin E is involved in the regulation of axonal growth through actin-myosin interactions. Journal of Neurochemistry. 109 (2), 611-622 (2009).
- Mizui, T., et al. Myosin II ATPase activity mediates the long-term potentiation-induced exodus of stable F-actin bound by drebrin A from dendritic spines. PLoS One. 9 (1), 85367 (2014).
- Takahashi, H., Mizui, T., Shirao, T. Down-regulation of drebrin A expression suppresses synaptic targeting of NMDA receptors in developing hippocampal neurons. Journal of Neurochemistry. 97, 110-115 (2006).
- Takahashi, H., et al. Drebrin-dependent actin clustering in dendritic filopodia governs synaptic targeting of postsynaptic density-95 and dendritic spine morphogenesis. The Journal of Neuroscience. 23 (16), 6586-6595 (2003).
- Yamazaki, H., Sasagawa, Y., Yamamoto, H., Bito, H., Shirao, T. CaMKIIbeta is localized in dendritic spines as both drebrin-dependent and drebrin-independent pools. Journal of Neurochemistry. 146 (2), 145-159 (2018).
- Hanamura, K., et al. High-content imaging analysis for detecting the loss of drebrin clusters along dendrites in cultured hippocampal neurons. Journal of Pharmacological and Toxicological Methods. 99, 106607 (2019).
- Mitsuoka, T., et al. Assessment of NMDA receptor inhibition of phencyclidine analogues using a high-throughput drebrin immunocytochemical assay. Journal of Pharmacological and Toxicological Methods. 99, 106583 (2019).
- Ishizuka, Y., Bramham, C. R. A simple DMSO-based method for cryopreservation of primary hippocampal and cortical neurons. Journal of Neuroscience Methods. 333, 108578 (2020).
- Pischedda, F., et al. Cryopreservation of primary mouse neurons: The benefit of neurostore cryoprotective medium. Frontiers in Cellular Neuroscience. 12, 81 (2018).
- Kobayashi, Y., et al. Impairment of ciliary dynamics in an APP knock-in mouse model of Alzheimer's disease. Biochemical and Biophysical Research Communications. 610, 85-91 (2022).
- Kobayashi, Y., et al. Properties of primary cilia in melanin-concentrating hormone receptor 1-bearing hippocampal neurons in vivo and in vitro. Neurochemistry International. 142, 104902 (2021).
- Koganezawa, N., et al. NMDA receptor-dependent and -independent effects of natural compounds and crude drugs on synaptic states as revealed by drebrin imaging analysis. The European Journal of Neuroscience. 53 (11), 3548-3560 (2021).
- Mizui, T., Takahashi, H., Sekino, Y., Shirao, T. Overexpression of drebrin A in immature neurons induces the accumulation of F-actin and PSD-95 into dendritic filopodia, and the formation of large abnormal protrusions. Molecular and Cellular Neurosciences. 30 (1), 149-157 (2005).
- Sekino, Y., et al. Activation of N-methyl-D-aspartate receptor induces a shift of drebrin distribution: disappearance from dendritic spines and appearance in dendritic shafts. Molecular and Cellular Neurosciences. 31 (3), 493-504 (2006).
- Takahashi, H., Yamazaki, H., Hanamura, K., Sekino, Y., Shirao, T. Activity of the AMPA receptor regulates drebrin stabilization in dendritic spine morphogenesis. Journal of Cell Science. 122, 1211-1219 (2009).
- Aoki, C., et al. Drebrin A is a postsynaptic protein that localizes in vivo to the submembranous surface of dendritic sites forming excitatory synapses. The Journal of Comparative Neurology. 483 (4), 383-402 (2005).
- Koganezawa, N., Hanamura, K., Sekino, Y., Shirao, T. The role of drebrin in dendritic spines. Molecular and Cellular Neurosciences. 84, 85-92 (2017).
- Shirao, T., et al. The role of drebrin in neurons. Journal of Neurochemistry. 141 (6), 819-834 (2017).
- Sekino, Y., Koganezawa, N., Mizui, T., Shirao, T. Role of drebrin in synaptic plasticity. Advances in Experimental Medicine and Biology. 1006, 183-201 (2017).
- Togo, K., et al. Postsynaptic structure formation of human iPS cell-derived neurons takes longer than presynaptic formation during neural differentiation in vitro. Molecular Brain. 14 (1), 149 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved