Method Article
Простая и воспроизводимая первичная культура низкой плотности с использованием замороженного запаса эмбриональных нейронов гиппокампа
В этой статье
Резюме
Готовый к использованию замороженный запас нейронов является мощным инструментом для оценки синаптических функций. Здесь мы вводим легкую первичную культуру низкой плотности из замороженного материала с использованием 96-луночной пластины.
Аннотация
Нейронная культура является ценной системой для оценки синаптических функций и скрининга лекарств. В частности, культура низкой плотности первичных нейронов гиппокампа позволяет изучать отдельные нейроны или субклеточные компоненты. Мы показали субклеточную локализацию белка в нейроне с помощью иммуноцитохимии, полярности нейронов, синаптической морфологии и изменения его развития с использованием первичной культуры гиппокампа низкой плотности. В последнее время готовые к использованию замороженные запасы нейронов стали коммерчески доступными. Эти замороженные запасы нейронов сокращают время, необходимое для подготовки экспериментов на животных, а также способствуют сокращению числа используемых животных. Здесь мы вводим воспроизводимый метод первичной культуры низкой плотности с использованием 96-луночной пластины. Мы использовали коммерчески доступный замороженный запас нейронов из эмбрионального гиппокампа крысы. Нейроны могут стабильно культивироваться в течение длительного времени без изменений среды путем уменьшения роста глиальных клеток в определенные моменты времени. Этот высокопроизводительный анализ с использованием культуры низкой плотности позволяет воспроизводить оценки синаптической пластичности на основе визуализации.
Введение
Разработка экспериментальной системы in vitro, которая может оценивать синаптические функции, участвующие в обучении и памяти, имеет важное значение. Нейронная культура является ценной системой для оценки синаптических функций in vitro. Метод нейрональной культуры был впервые использован в 1980-х годах, а в 1990-х годах была разработана культура низкой плотности первичных нейронов гиппокампа 1,2,3 для изучения отдельных нейронов с точки зрения субклеточной локализации белковых компонентов, торговли белками, полярности нейронов, морфологии позвоночника, развития синапсов и пластичности 4,5,6,7,8 . Тем не менее, есть много шагов, связанных с этой техникой: спаривание животных, рассечение эмбрионов, подготовка сосудов культуры и культивирование клеток в течение 3 недель с изменениями среды один раз в неделю. Кроме того, для этого требуются передовые методики3.
Мы разработали замороженные запасы диссоциированных нейронов гиппокампа из эмбрионов крыс 9,10. Замороженные запасы нейронов готовы к использованию, и для культивирования клеток11,12 не требуется никаких передовых методов. Другими словами, культивирование нейронов из замороженных запасов не зависит от техники экспериментатора. Это устраняет необходимость в экспериментах на животных (например, разрешение на эксперименты на животных, организация беременных животных и вскрытие эмбрионов крыс), тем самым уменьшая количество используемых животных. В последнее время высококачественные, готовые к использованию замороженные запасы нейронов стали коммерчески доступными. Здесь мы использовали коммерчески доступные замороженные запасы с эмбрионального дня (E) 18 крысиного гиппокампа 13,14,15. Культивирование нейронов из замороженного запаса не требует обусловленных глией сред или кокультуры с глиальными клетками. Обычные первичные питательные среды без дополнительной сыворотки могут быть использованы для культивирования клеток; следовательно, мы можем получать воспроизводимые данные. Кроме того, нет необходимости в медиаобмене в течение 3 недель после посева клеток, поскольку рост глиальных клеток уменьшается (рисунок 1).
Дендритные шипы являются постсинаптическим компартментом большинства возбуждающих синапсов. Они содержат рецепторные белки, постсинаптические каркасные белки и актиновые цитоскелетные белки. Мы сосредоточились на актин-связывающем белкедребрине 5,6,7,16,17,18. Дребрин накапливается в головке позвоночника в зрелых нейронах19, и мы сообщали о дребрине как маркере синаптического состояния 15,17,20,21,22,23. Проведя анализ высокого содержания с использованием дребрина в качестве считывания, мы недавно сообщили об ингибирующем воздействии аналогов фенциклидина на Глутаматные рецепторы типа N-метил-D-аспарагиновой кислоты (NMDAR)10 и NMDAR-зависимые эффекты природных соединений и сырых лекарств на синаптические состояния15.
Здесь мы подробно расскажем, как культивировать замороженные запасы нейронов при низкой плотности. Кроме того, мы показываем оценку синаптического состояния на основе визуализации дребрина с использованием 96-луночных пластин.
протокол
1. Покрытие пластин
- Покрыть 96-луночную микропластину поли-L-лизином (1 мг/мл, разбавленным в 0,1 М боратного буфера [рН: 8,5]; 100 мкл/лунка) и инкубировать в течение ночи при 37 °C.
ПРИМЕЧАНИЕ: Покрывайте только те колодцы, которые необходимо использовать. В экспериментах, проводимых здесь, используются средние 60 скважин. Боратный буфер получают путем смешивания 50 мМ борной кислоты и 12 мМ бората в стерилизованной воде. - Дважды вымойте пластину стерилизованной водой (250 мкл/лунка).
- Вымойте тарелку один раз свежей питательной средой без добавок (250 мкл/хорошо).
- Высушите тарелку на чистой скамейке в течение 20 минут.
- Оберните пластину алюминиевой фольгой и держите при температуре 4 °C до использования (действительна в течение 1 месяца).
2. Посев клеток
- Добавьте 50 мкл/лунку питательной среды к покрытой пластине и держите ее в инкубаторе 37 °C, 5% CO2 в течение 30 мин до 1 ч. Наполните периферийные колодцы стерилизованной водой (200 мкл/лунка).
ПРИМЕЧАНИЕ: Культуральную среду получают путем добавления 50x B-27, 400x Glutamax и 100 ЕД/мл пенициллина/стрептомицина в нейробазальную среду (подробности см. в Таблице материалов ). - Удалите криовиальный нейрон из резервуара с жидким азотом. Нейроны, используемые здесь, были DMSO-криоконсервированными нейронами11.
- Погрузите криовиал в тепловой блок с температурой 37 °C на срок до 3 мин и частично разморозьте содержимое. Не разогревайте криовиаль слишком долго. Перенесите содержимое в трубку объемом 50 мл, как только оно разморозится.
- Медленно перенесите криовиальное содержимое нейрона в стерильную трубку объемом 50 мл по каплям (50 мкл/с) с помощью пипетки объемом 1 мл с широкопористым кончиком.
- Ополоснуть пустую криовиаль 1 мл питательной среды (комнатной температуры; RT). Перенесите этот 1 мл питательной среды из криовиальной капельной (50 мкл/с) в пробирку объемом 50 мл, содержащую клеточную суспензию.
- Добавьте 9 мл питательной среды (РТ) в 50 мл по каплям (0,5 мл/с) и увеличьте объем до 11 мл. Не повторяйте пипетку, а медленно перемешайте клеточную суспензию.
- Подсчитайте номер ячейки (используйте счетчик клеток или гемоцитометр).
- Переложите всю клеточную суспензию в резервуар и дозируйте клеточную суспензию на пластину с 96 лунками с помощью многоканальной пипетки с широкопористыми наконечниками (1,0 х 104 ячейки / лунка). Чтобы уменьшить испарение питательной среды, заполните периферийные колодцы стерилизованной водой (этап 2.1).
ПРИМЕЧАНИЕ: Это исследование подтверждает, что испарение культуральной среды невелико для 3-недельной культуры без среднего обмена. Коэффициент редукции среды составляет 3,6% (n = 120 скважин). Таким образом, изменение осмоляльности не будет резким в течение 3-недельного инкубационного периода. - Инкубируют нейроны в течение 1-2 ч в инкубаторе 37 °C, 5% CO2 .
- Замените питательную среду 100 мкл предварительно нагретой питательной среды (37 °C) на лунку и поместите ее обратно в инкубатор с температурой 37 °C, 5% CO2 (во время культивирования не требуется изменение среды).
3. Лечение Ара-С
- Через 4 дня in vitro (DIV) добавляют цитозин β-D-арабино-фуранозида (Ara-C) до конечной концентрации 0,2 мкМ на лунку для уменьшения роста глиальных клеток.
4. Медикаментозное лечение
- На 21 день in vitro обработайте клетки препаратами, представляющими интерес.
- Поддерживайте температуру пластины на уровне 37 °C во время медикаментозной обработки.
- Для положительного контроля обработайте клетки 100 мкМ глутаматом (на лунку для конечной концентрации) в течение 10 мин перед фиксацией.
5. Фиксация
- Для фиксации используют 4% параформальдегид в 0,1 М фосфатного буфера (100 мкл/лунка).
- После ~20 мин фиксации промывайте скважины фосфатно-буферным солевым раствором (PBS; 250 мкл/лунка) 2x по 5 мин каждая.
6. Иммуноцитохимия
- Промыть клетки PBS (250 мкл/лунка) 1x в течение 5 мин.
- Пермеабилизируйте клетки 0,1% тритоном X-100 (100 мкл/лунка) в PBS в течение 5 мин.
- Промывайте ячейки PBS (250 мкл/лунка) 3x в течение 5 мин каждая.
- Для блокирования используйте 3% бычьего сывороточного альбумина в PBS (PBSA; 100 мкл/хорошо) в течение 1 ч при RT.
- Инкубировать клетки антидребринными (1:1) и анти-микротрубочками, ассоциированными белками 2 (MAP2) (1:000) (60 мкл/хорошо) при 4 °C в течение ночи.
- Промывайте ячейки PBS (250 мкл/лунка) 4x в течение 5 мин каждая.
- Инкубируют клетки с соответствующими вторичными антителами и 4',6-диамидино-2-фенилиндолом, дигидрохлоридом (DAPI; 1:1000) в ПБСА (60 мкл/лунка) в течение 2 ч при РТ.
- Промывайте ячейки PBS (250 мкл/лунка) 4x в течение 5 мин каждая.
- Хранить клетки в PBS, содержащие 0,1% азида натрия (150 мкл/лунка).
7. Получение и анализ изображений
- Для получения изображений используйте соответствующий микроскоп.
- Для идентификации клеточных тел нейронов используют как MAP2-положительные, так и DAPI-положительные области.
- Для идентификации дендритов нейронов используют MAP2-положительные сигналы без клеточных тел.
- Чтобы идентифицировать кластеры дребрина, используйте дребрино-положительные сигналы вдоль MAP2 положительных дендритов.
Результаты
Следуя протоколу, нейроны культивировали в 96-луночной пластине в течение 21 дня, а затем обрабатывали глутаматом (рисунок 1). Нейроны развивались нормально без обмена питательной средой в течение 3 недель (рисунок 2). Мы обрабатывали клетки несколькими концентрациями глутамата (1 мкМ, 3 мкМ, 10 мкМ, 30 мкМ и 100 мкМ, разведенные в стерилизованной воде) в течение 10 мин и фиксировали их. Была выполнена иммуноцитохимия, а флуоресцентные изображения дребрина и MAP2 были получены с помощью автоматизированного флуоресцентного микроскопа с камерой sCMOS. Как показано на рисунке 3, дребрин-положительные дендритные шипы четко наблюдаются вдоль MAP2-положительных дендритов. Было показано, что стимуляция глутамата вызывает приток Ca2+ через NMDAR, что вызывает исход дребрина из дендритных шипов, что приводит к снижению плотности кластера дребринов 5,17. Соответственно, мы наблюдали дозозависимое снижение плотности кластера дребрина при стимуляции глутамата10 (рисунок 4). Как показано на рисунке 5, этот метод является высоковоспроизводимым, если в качестве маркера синаптических состояний используется дребрин.
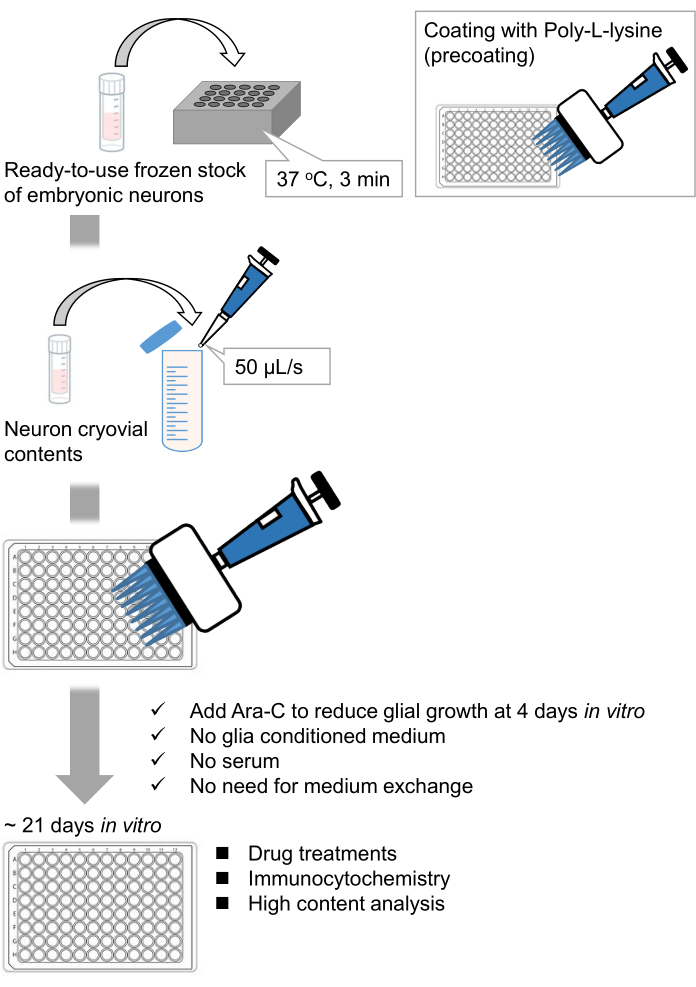
Рисунок 1: Схема метода. Нейроны культивировали в 96-луночной пластине в течение 21 дня, а затем обрабатывали глутаматом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
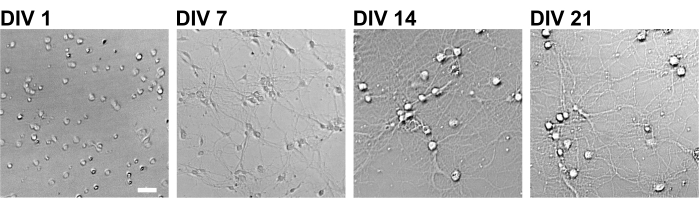
Рисунок 2: Изображения яркого поля культивируемых нейронов с использованием 96-луночной пластины. Фазоконтрастные изображения были получены с каждой стадии развития (DIV 1, 7, 14, 21) с использованием конфокального количественного изображения цитометра. Шкала: 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
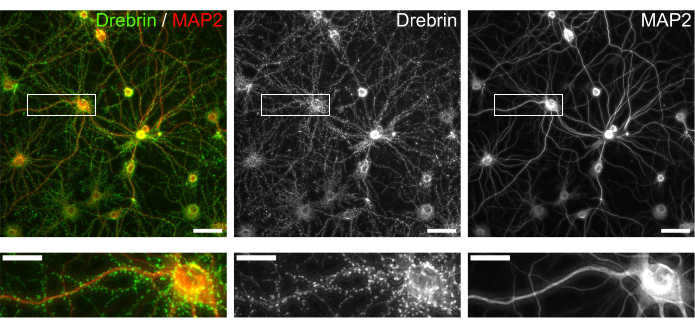
Рисунок 3: Репрезентативные изображения иммуноокрашенных культивируемых нейронов. (слева) Объединенные флуоресцентные изображения дребрина (зеленый) и MAP2 (красный). Каждое флуоресцентное изображение дребрина и MAP2 показывалось на средней и правой панелях соответственно. Белые прямоугольники показывают область, увеличенную ниже. Шкала стержней; верхние панели: 50 мкм, нижние панели: 20 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
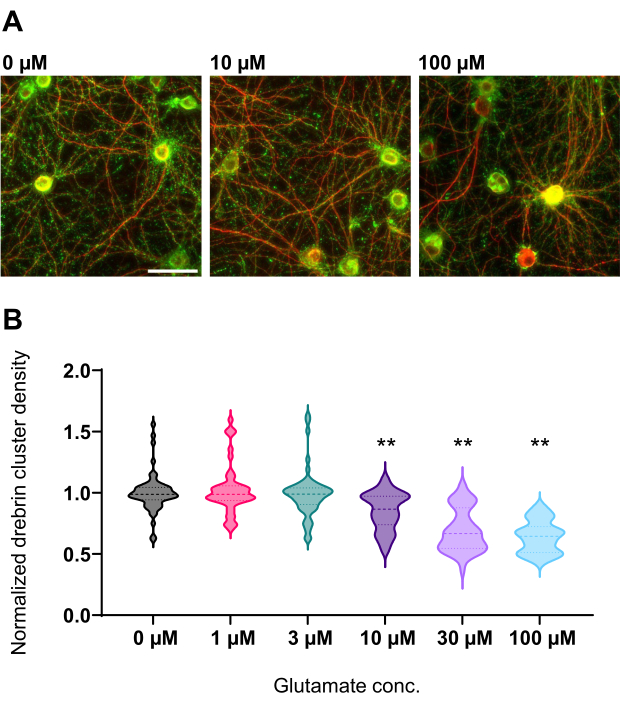
Рисунок 4: Глутамат-зависимые изменения дозы-ответа в нормализованной плотности кластера дребрина. (A) Репрезентативные флуоресцентные изображения, иммуноокрашенные с использованием дребрина (зеленый) и MAP2 (красный) из скважины, которую обрабатывают 0 мкМ, 10 мкМ и 100 мкМ глутамата (слева направо). Шкала бара: 50 мкм. (B) Плотность кластера дребрина нормализовали на среднее контрольное значение (0 мкМ). 0 мкМ, N = 58 скважин; 1 мкМ, N = 46; 3 мкМ, N = 54; 10 мкМ, N = 45; 30 мкМ, Н = 54; 100 мкМ, N = 55, из 13 экспериментов с использованием разных партий. ** P < 0,01 по сравнению с контролем (0 мкМ) по множественному сравнительному тесту Даннетта после ANOVA. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
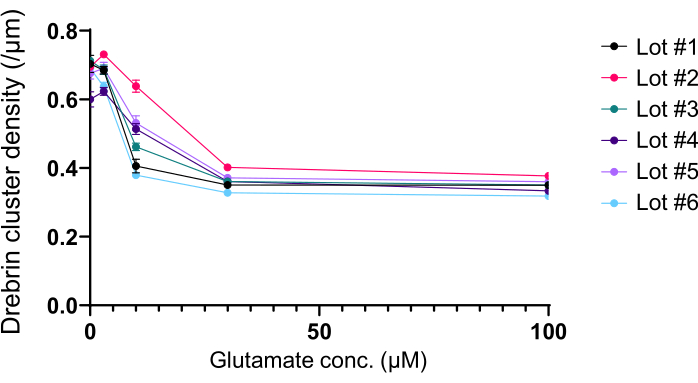
Рисунок 5: Глутамат-зависимые изменения дозы-ответа в плотности кластера дребрина. Необработанные данные из шести экспериментов с использованием разных лотов. N = 4 скважины для каждой концентрации (0 мкМ, 3 мкМ, 10 мкМ, 30 мкМ и 100 мкМ). Значения выражены как среднее ± SEM. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Применение замороженных запасов нейронов к электрофизиологическим экспериментам. (А) Протокол электрофизиологических экспериментов с использованием пластин микроэлектродной решетки (МЭА). Покрытие: За один день до нанесения покрытия на ячейки каждая 48-луночная пластина MEA была предварительно покрыта раствором полиэтиленимина (PEI: 0,1%) и инкубирована в течение 1 ч при 37 °C. Затем пластину MEA промывали 3 раза стерилизованной водой и сушили в течение 1 ч. Затем пластину MEA держали при 4 °C в течение ночи. Культура высокой плотности: 50 000 клеток / лунка нейронов были покрыты 48-луночными пластинами MEA. Стадию посева клеток выполняли, как описано в разделе 2 вышеописанного протокола. Ламинин (20 мкг/мл) добавляли культуральную среду (добавляли 2 v/v% B-27, 2,5 мМ Glutamax и 100 мкг/мл пенициллина/стрептомицина в нейробазальную среду) использовали для покрытия нейронов. После этого нейроны культивировали при 37 °C, 5% CO2 в питательной среде. Носитель полностью обменивался на DIV 1 с культуральной средой до DIV 3. Ara-C был добавлен при DIV 4 (конечные 0,2 мкМ). Начиная с DIV 5 и далее и 2 раза в неделю, 50% средств массовой информации были изменены с помощью культурной среды. Активность нейронов на каждой лунке пластины MEA регистрировалась с помощью системы MEA. (B) Спонтанная нейронная активность была приобретена при 37 °C при 5% атмосфере CO2 с использованием системы MEA с частотой дискретизации 12,5 кГц/канал при DIV 21. Показаны записи с 4 каналов из 16 каналов в колодце. Для всех записей применялся полосовой фильтр Баттерворта (200-3000 Гц). Наконечники стрел показывают время синхронизированной серийной стрельбы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Критическим шагом в этом методе является размораживание клеточной суспензии. Перенос клеточной суспензии до того, как она станет слишком теплой, очень важен. Однако, чтобы избежать быстрого изменения осмоляльности, не переносите клеточную суспензию на большой объем среды сразу. Каплевидное добавление питательной среды также имеет решающее значение, чтобы избежать резких изменений осмотического давления.
Нейроны могут культивироваться в других сосудах культуры: 24-луночных пластинах, 8-луночных камерах, 60-миллиметровых чашках или зондах MED. Однако в этих случаях конечная концентрация и сроки добавления Ara-C должны быть скорректированы. Кроме того, плотность нейронов необходимо оптимизировать в разных типах экспериментов. Например, культура высокой плотности требуется для электрофизиологических экспериментов, и в этом случае медиаобмен необходим два раза в неделю (рисунок 6). Таким образом, культура низкой плотности требует меньше шагов, чем культура высокой плотности.
Культура нейронов низкой плотности часто требует передовых методов; однако использование готовых к использованию замороженных запасов решает эту проблему. Описанный метод не зависит от мастерства экспериментатора. Качество замороженных продуктов стабильно и может стабильно культивироваться, если они хранятся в жидком азоте и избегают перепадов температуры до 4 лет.
Культивирование клеток в течение 3 недель без среднего обмена ставит вопрос о том, наблюдаются ли значительные изменения осмоляльности или испарение культуральной среды. Однако мы подтвердили, что испарение культуральной среды невелико (скорость восстановления 3,6%). Локализация синаптических белков и морфология нейронов кажутся нормальными через 3 недели. Поэтому 3-недельная культура без медиаобмена не вызывает больших изменений осмоляльности, влияющих на состояние культивируемых нейронов. Хранение пластины в инкубаторе после обработки Ara-C также является важным моментом, который минимизирует испарение.
Нет никаких ограничений в отношении использования замороженных стоковых нейронов. Однако существуют некоторые ограничения метода культуры низкой плотности. Мы подтвердили, что культура низкой плотности может быть применена для морфологического наблюдения нейронов, оценки синаптической функции и трансфекции GFP. Тем не менее, мы не исследовали визуализацию живых клеток. Кроме того, как уже говорилось выше, культура высокой плотности требуется для выполнения электрофизиологии.
Созревание синапсов обычно занимает 3 недели7, и мы не можем подтвердить, что культивируемые нейроны имеют правильные синапсы до конца. Если созревание синапса не будет хорошим через 3 недели, нам придется снова культивировать. Зная качество нейронов до начала экспериментов, мы можем сэкономить эти 3 недели. Поэтому для эффективного проведения экспериментов лучше всего заранее проверить качество нейронов. Замороженные запасы дают возможность заранее проверить качество нейронов. Каждая партия замороженных запасов генерируется из одного помета крыс, и мы можем использовать один из запасов из каждой партии для проверки качества. Дребрин является хорошим маркером для проверки качества нейронов. Как описано, дребрин накапливается в головке позвоночника в зрелых нейронах, и он реагирует на синаптическую стимуляцию. Таким образом, мы можем проверить качество нейронов в замороженных запасах, используя дребрин в качестве маркера.
Этот метод может быть применен для оценки влияния препаратов на синаптическое состояние. Исход дребрина из дендритных шипов происходит на начальных стадиях синаптической пластичности22. Таким образом, обнаружение снижения кластера дребринов, вызванного медикаментозным лечением, показывает, что препарат стимулирует синапс и вызывает синаптическую пластичность. Кроме того, чтобы определить, зависит ли восстановление от NMDAR, полезен эксперимент с использованием 2-амино-5-фосфоновалериановой кислоты (APV, антагонист NMDAR). Используя дребрин в качестве маркера, даже NMDAR-зависимость четко определяется10,15. Описанный метод полезен при скрининге лекарств, фармакологических исследованиях безопасности и оценке синаптической функции.
Раскрытие информации
Томоаки Сирао является генеральным директором AlzMed, Inc. Исследование финансировалось AlzMed, Inc. (500 000 иен в NK для проекта под названием «Высокопроизводительный анализ синаптической функции»).
Благодарности
Мы благодарим Кадзуми Камияму и Манами Каваду за помощь в проведении экспериментов. Эта работа была поддержана JSPS KAKENHI (номер гранта 19K08010 для N.K.) и Японским агентством медицинских исследований и разработок (AMED) (номер гранта JP19bk0104077 и JP22bm0804024 для T.S.).
Материалы
| Name | Company | Catalog Number | Comments |
| 96 well plate | Zeon Corporation | Gifted | |
| 96 well plate | greiner | 655986 | |
| Anti-drebrin antibody (M2F6) | MBL | D029-3 | Mouse monoclonal (dilution 1:1) |
| Anti-MAP2 antibody | Millipore | AB5622 | Rabbit (dilution 1:1000) |
| Anti-mouse Alexa Fluor 568 | Thermo Fisher Scientific | A11031 | Dilution 1: 500 |
| Anti-rabbit Alexa Fluor | Thermo Fisher Scientific | A11008 | Dilution 1: 500 |
| B-27 | Gibco | 17504-044 | 2 v/v% for MEA plates; 50x for normal plates |
| Borax | Sigma | B-9876 | Final concentration 12 mM |
| Boric acid | WAKO | 021-02195 | Final concentration 50 mM |
| Bovine serum albumin | Millipore | 12659-100G | Final concentration: 3% in PBS |
| Confocal quantitative image cytometer CellVoyager CQ1 | YOKOGAWA | Phase contrast images | |
| Cytosine β-D-arabino-furanoside (Ara-C) | Sigma | C-6645 | Diluted in dH2O (final concentration: 0.2 µM) |
| DAPI | FUJIFILM | 340-07971 | Dilution 1:1000 |
| GlutaMAX | Gibco | 35050-061 | 2.5 mM for MEA plates; 400x for normal plates |
| In Cell Analyzer 2200 | Cytiva | Fluorescence images | |
| Laminin | Sigma | 114956-81-9 | Final concentration: 20 µg/mL |
| Maestro | Axion Biosystems | MEA recordings | |
| MEA plate | Axion Biosystems | M768-tMEA-48W | |
| Neurobasal | Gibco | 21103-049 | |
| Paraformaldehyde | nacalai tesque | 26126-25 | Final concentration: 4% in PBS |
| Penicillin/Streptomycin | Gibco | 15140-122 | 100 U/mL for normal plates |
| Penicillin/Streptomycin | nacalai tesque | 26253-84 | 100 µg/mL for MEA plates |
| polyethyleimine | Sigma | 9002-98-6 | Final concentration: 0.1% |
| Poly-L-lysine | Sigma | P2636 | Diluted in the borate buffer (final concentration: 1 mg/mL) |
| SKY Neuron | AlzMed , Inc. | ARH001 | 1.0 x 106 cells/tube |
| Sodium azide | FUJIFILM | 195-11092 | 0.1% |
| SodiumL(+)-Glutamate monohydrate | WAKO | 194-02032 | Diluted in dH2O (final concentrations: 1 µM, 3 µM, 10 µM, 30 µM, 100 µM) |
Ссылки
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain Research. 126 (3), 397-342 (1977).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocols. 1 (5), 2406-2415 (2006).
- Roppongi, R. T., Champagne-Jorgensen, K. P., Siddiqui, T. J. Low-density primary hippocampal neuron culture. Journal of Visualized Experiments. (122), e55000(2017).
- Mizui, T., et al. Drebrin E is involved in the regulation of axonal growth through actin-myosin interactions. Journal of Neurochemistry. 109 (2), 611-622 (2009).
- Mizui, T., et al. Myosin II ATPase activity mediates the long-term potentiation-induced exodus of stable F-actin bound by drebrin A from dendritic spines. PLoS One. 9 (1), 85367(2014).
- Takahashi, H., Mizui, T., Shirao, T. Down-regulation of drebrin A expression suppresses synaptic targeting of NMDA receptors in developing hippocampal neurons. Journal of Neurochemistry. 97, 110-115 (2006).
- Takahashi, H., et al. Drebrin-dependent actin clustering in dendritic filopodia governs synaptic targeting of postsynaptic density-95 and dendritic spine morphogenesis. The Journal of Neuroscience. 23 (16), 6586-6595 (2003).
- Yamazaki, H., Sasagawa, Y., Yamamoto, H., Bito, H., Shirao, T. CaMKIIbeta is localized in dendritic spines as both drebrin-dependent and drebrin-independent pools. Journal of Neurochemistry. 146 (2), 145-159 (2018).
- Hanamura, K., et al. High-content imaging analysis for detecting the loss of drebrin clusters along dendrites in cultured hippocampal neurons. Journal of Pharmacological and Toxicological Methods. 99, 106607(2019).
- Mitsuoka, T., et al. Assessment of NMDA receptor inhibition of phencyclidine analogues using a high-throughput drebrin immunocytochemical assay. Journal of Pharmacological and Toxicological Methods. 99, 106583(2019).
- Ishizuka, Y., Bramham, C. R. A simple DMSO-based method for cryopreservation of primary hippocampal and cortical neurons. Journal of Neuroscience Methods. 333, 108578(2020).
- Pischedda, F., et al. Cryopreservation of primary mouse neurons: The benefit of neurostore cryoprotective medium. Frontiers in Cellular Neuroscience. 12, 81(2018).
- Kobayashi, Y., et al. Impairment of ciliary dynamics in an APP knock-in mouse model of Alzheimer's disease. Biochemical and Biophysical Research Communications. 610, 85-91 (2022).
- Kobayashi, Y., et al. Properties of primary cilia in melanin-concentrating hormone receptor 1-bearing hippocampal neurons in vivo and in vitro. Neurochemistry International. 142, 104902(2021).
- Koganezawa, N., et al. NMDA receptor-dependent and -independent effects of natural compounds and crude drugs on synaptic states as revealed by drebrin imaging analysis. The European Journal of Neuroscience. 53 (11), 3548-3560 (2021).
- Mizui, T., Takahashi, H., Sekino, Y., Shirao, T. Overexpression of drebrin A in immature neurons induces the accumulation of F-actin and PSD-95 into dendritic filopodia, and the formation of large abnormal protrusions. Molecular and Cellular Neurosciences. 30 (1), 149-157 (2005).
- Sekino, Y., et al. Activation of N-methyl-D-aspartate receptor induces a shift of drebrin distribution: disappearance from dendritic spines and appearance in dendritic shafts. Molecular and Cellular Neurosciences. 31 (3), 493-504 (2006).
- Takahashi, H., Yamazaki, H., Hanamura, K., Sekino, Y., Shirao, T. Activity of the AMPA receptor regulates drebrin stabilization in dendritic spine morphogenesis. Journal of Cell Science. 122, 1211-1219 (2009).
- Aoki, C., et al. Drebrin A is a postsynaptic protein that localizes in vivo to the submembranous surface of dendritic sites forming excitatory synapses. The Journal of Comparative Neurology. 483 (4), 383-402 (2005).
- Koganezawa, N., Hanamura, K., Sekino, Y., Shirao, T. The role of drebrin in dendritic spines. Molecular and Cellular Neurosciences. 84, 85-92 (2017).
- Shirao, T., et al. The role of drebrin in neurons. Journal of Neurochemistry. 141 (6), 819-834 (2017).
- Sekino, Y., Koganezawa, N., Mizui, T., Shirao, T. Role of drebrin in synaptic plasticity. Advances in Experimental Medicine and Biology. 1006, 183-201 (2017).
- Togo, K., et al. Postsynaptic structure formation of human iPS cell-derived neurons takes longer than presynaptic formation during neural differentiation in vitro. Molecular Brain. 14 (1), 149(2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены