Method Article
カエノラブディティス・エレガンスにおける胚の生存率とひなサイズの測定
要約
ここでは、モデル生物C . elegansを用いて、胚の生存率と生産された胚の総数(ひな)を決定する一般的な方法を提示します。
要約
カエノラブディティスエレガンスは 、減数分裂、受精、および胚発生の研究のための優れたモデル生物です。 C.エレガンスは 自家受精雌雄同体として存在し、子孫の大きなひなを生成します-男性が存在する場合、それらは交雑子孫のさらに大きなひなを生産することができます。減数分裂、受精、および胚形成のエラーは、不妊、生殖能力の低下、または胚の致死性の表現型として迅速に評価できます。この記事では、 C. elegansの胚の生存率とひなのサイズを決定する方法について説明します。個々の修正ヤングレン、オンリーバクトペプトン(MYOB)プレートにワームを選択することによってこのアッセイを設定する方法を示し、生存可能な子孫と生存不可能な胚をカウントするための適切な時間枠を確立し、生きているワーム標本を正確にカウントする方法を説明します。この技術は、自家受精雌雄同体の生存率、および交配ペアによる他家受精を決定するために使用できます。これらの比較的単純な実験は、学部生や大学院1年生などの新しい研究者にも簡単に採用できます。
概要
真核生物における有性生殖は、受精の過程を通して胚を形成するために融合する機能的な配偶子の産生を必要とする。母方と父方の配偶子、卵子(卵子)、精子は、減数分裂と配偶子形成1の特殊な細胞分裂と分化プロセスによって作成されます。減数分裂は単一の二倍体細胞から始まり、元の親細胞の半分の数の染色体を含む娘細胞の形成で終わります。倍数性の減少から、独立した品揃えと交叉組換え による 遺伝物質のシャッフルまで、減数分裂は複数の重要な機能を果たします1。減数分裂内のエラーは、配偶子内の染色体が多すぎたり少なすぎたりする異数性を引き起こす可能性があります。染色体の不均衡は流産やダウン症やエドワーズ症候群2などの発達障害の主な原因であるため、異数性の発生率は人間の健康に多大な影響を及ぼします。
受精は、母方と父方の配偶子が融合して新しい生物を生成するプロセスです3。配偶子 - 配偶子認識は、配偶子表面上のタンパク質によって促進される3。配偶子の互換性のエラーは、精子と卵子の融合が進行できないため、不妊につながります。精子と卵母細胞の融合は、有糸分裂 を介して 単一細胞胚から完全に機能する多細胞生物への発生の旅を始めることができる活動胚の適切な形成につながる多くのイベントを引き起こします4。胚発生を通して、発生を調節する分子イベントは、生物の適切な成長を可能にするために、厳密に制御され、正確なタイミングで調整されなければなりません5。発生初期における適切な細胞分化は、生物が多能性胚から本格的な生物に移行する際に極めて重要である。これらのイベントの複雑さのために、混乱は胚の致死性をもたらす発達障害につながる可能性があります。
カエノラブディティスエレガンスは、減数分裂、受精、および胚発生を研究するための優れたモデル生物です。 C.エレガンスは、男性と雌雄同体の2つの性別を持つ透明な線虫です。自家受精が可能なC.エレガンス雌雄同体は、優勢な性別です6,7。雌雄同体の生殖腺は、精子に貯蔵される4番目の幼虫(L4)段階で最初に精子を産生します。L4から成人期への移行時に、生殖系列は卵母細胞の産生に切り替わり、卵母細胞は保存された精子を介して受精します。雌雄同体で0.2%未満の割合で発生する男性は、精子のみを産生し、雌雄同体と交尾することができます。他家受精時に、男性の精子は卵母細胞の受精において雌雄同体の精子を凌駕します8。これにより、自家受精ストックによるホモ接合変異体の比較的容易な維持と、遺伝的交配による遺伝子操作が可能になります。両性は、男性と女性の生殖系列の減数分裂の違いを調査する研究を可能にします。さらに、C.エレガンスおよびその卵の透明な性質のために、減数分裂、配偶子形成、受精、および胚形成の過程は、蛍光イメージング技術を用いて生きた無傷の動物で研究することができる。
C. elegansの減数分裂、受精、および/または胚発生に関与する可能性のある遺伝子の新しい突然変異を分析する場合、これらのプロセスのエラーは生存可能な子孫の生産の失敗または減少につながることが多いため、重要な最初のステップは胚の生存率とひなのサイズを決定することです。この論文では、自家受精雌雄同体または雌雄雄同体と雄の交配のいずれかから、生殖能力、胚の生存率、およびひなのサイズを評価するためのプロトコルについて説明します。この古典的なアッセイは多くのC.エレガンス研究で使用されていますが、セットアップと正確な定量のための標準化されたプロトコルを提供しています。このプロトコルでは、個々のワームまたはオス/雌雄同体のペアが分離され、交配と子孫の生産が可能になります。子孫の生産および生存率は、生存可能な子孫および非生存可能な胚の数を決定するために、数日間にわたって観察される。実験の終わりに、個々のひなを分析して、胚の生存率と総ひなのサイズを計算します。
プロトコル
注:このプロトコルで使用されるすべての材料の詳細については、 材料表 を参照してください。
1. 実験プレートの準備
- 直径35mmのペトリ皿を、改良ヨングレンダ、バクトペプトンのみ(MYOB)培地で準備します。MYOBプレートを作るには、20 gのバクト寒天培地、2 gのNaCl、0.55 gのTrizma-HCl、0.24 gのTrizma-OH、3.1 gのバクトペプトン、および1.6 mLのコレステロールを1 LのddH2Oに加え、121°Cで40分間オートクレーブします。 55°Cまで冷却し、滅菌技術を使用して、4 mLの溶融媒体を各35 mmペトリ皿に注ぎます。
注:1リットルのMYOBは~250枚のプレートを作り、4°Cで最大6ヶ月間保存できます。反復ごとに最低10個体、各株に3つの反復セットを使用することをお勧めします。 - 滅菌技術を使用して、プレートの中央にOP50細菌の小さなスポット(約50μL)をプレートに播種します。
注:小さな芝生は、小さな斑点がオスと雌雄同体の間の遭遇の増加につながり、交尾の可能性を高めるため、他家受精を評価するために特に重要です。
2.胚生存率アッセイ(雌雄同体の自家受精)
- 1日目
- 各プレートの背面にラベルを付けます。実験全体を通して、各プレートとそれぞれのワームを必ず追跡してください。
注:推奨されるラベリング手法-1日目:ワーム1、1日目:ワーム2、...等。 - 個々のL4ステージ雌雄同体を各プレートに移します。胚や他のワームがプレートに移されていないことを確認してください。ワームが成虫に成長するのを許し、20°Cの標準培養温度で24時間自家子孫を産みます。 3日目にこれらのプレートを採点します。
注:実験の温度は、温度感受性変異の場合に変更することができます。温度感受性変異の場合、胚生存率アッセイは、許容温度(15〜16°C)と非許容温度(24〜26°C)の両方で実施する必要があります。
- 各プレートの背面にラベルを付けます。実験全体を通して、各プレートとそれぞれのワームを必ず追跡してください。
- 2日目
- 新しいプレートのセットにラベルを付けます-2日目:ワーム1、2日目:ワーム2、...等。
- 1日目の個々のワームを新しいプレートに移します。
注:これらのワームは成虫に達しているはずであり、野生型のワームはすでに胚を産み始めているはずです。 - ワームに20°Cまたは他の適切な温度で24時間胚を産ませます。4日目にこれらのプレートを採点します。
- 3日目
- 新しいプレートのセットにラベルを付けます。3日目:ワーム1、3日目:ワーム2、...等。
- 2日目の個々のワームを新しいプレートに移します。20°Cまたは他の適切な温度で24時間子孫を産むようにします。5日目にこれらのプレートを採点します。
注意: 温度が低い場合は、孵化時間が長くなります。それに応じて調整してください。 - 細かいマーカーを使用して、35 mmの蓋にグリッドパターンを描きます。以前にカウントされたワームを追跡するために、カウント用のテストプレートの下にグリッド状の蓋を置きます(図1A-B)。
- 差動セルカウンターを用いて、子孫の有無について1日目プレートをスコアリングする。生きている幼虫と孵化していない胚を数えます。
注:この時点で、生存可能な胚が孵化するのに十分な時間が経過しています。孵化していない胚は死んでいると推定されます。 - 個々の正方形内で、完全に正方形内にある孵化していない胚と生きている幼虫を数えます(図1C-F)。
- 正方形の境界線にあるワームの場合は、ワームヘッドの位置に基づいてカウントします。頭が正方形の上端と左端に触れているワームを数えます(下端または右端に触れているワームは数えないでください。 図1D)。このアッセイでは、未受精卵母細胞をカウントしないでください(図1F)。
- 差動セルカウンターを用いて、子孫の有無について1日目プレートをスコアリングする。生きている幼虫と孵化していない胚を数えます。
- 生きた幼虫と孵化していない胚の数を実験ノートに記録します。
- 4日目
- ステップ2.3.3.1で説明したように、生きている幼虫と孵化していない胚を数えて、2日目のプレートをスコアリングします。生きた幼虫と孵化していない胚の数を実験ノートに記録します。
- 5日目
- ステップ2.3.3.1で説明したように、生きている幼虫と孵化していない胚を数えることによって、3日目のプレートをスコアリングします。生きた幼虫と孵化していない胚の数を実験ノートに記録します。データ解析で説明した方法を用いて得られたデータを解析する。
注:一部の遺伝子変異体は、生殖周期が遅れたり拡大したりすることがあります。3日目のプレートを超えて胚の継続的な産卵について個々の株を監視します。胚産生が4日目までに止まらない場合は、成虫を新しいプレートに移し続けます。
- ステップ2.3.3.1で説明したように、生きている幼虫と孵化していない胚を数えることによって、3日目のプレートをスコアリングします。生きた幼虫と孵化していない胚の数を実験ノートに記録します。データ解析で説明した方法を用いて得られたデータを解析する。
3.胚生存率アッセイ(男性/雌雄同体の他家受精)
- 1日目
- 各プレートの背面にラベルを付けます。実験全体を通して、各プレートとそれぞれのワームを必ず追跡してください。
- 個々のL4雌雄同体ワームを各プレートに移します。胚や他のワームがプレートに移されていないことを確認してください。
注:精子を産生しない fog-2 機能喪失変異体などの女性化株は、雌雄同体の代わりに使用できます。 - 単一のL4オスワームを、L4雌雄同体を含む各ラベル付きプレートに移します。胚や他のワームがプレートに移されていないことを確認してください。
注: plg-1 バリアントオスなどの系統は、これらのオスが交尾後に雌雄同体の外陰部に交尾プラグを沈着させるため、交配が発生したかどうかを識別するために使用できます。 - ワームが20°Cまたは別の適切な温度で24時間交尾して子孫を産むのを待ちます。3日目に生きた幼虫と孵化していない胚についてこれらのプレートをスコアリングします。
- 2日目
- 上記の2日目のように、新しいプレートのセットにラベルを付け、ワームを転送します。この場合、雌雄同体と男性の両方を新しいプレートに移してください。雌雄同体が成人期に達したことを確認してください。
- 雌雄同体が20°Cまたは別の適切な温度で24時間子孫を産むのを待ちます。4日目に生きた幼虫と孵化していない胚についてこれらのプレートをスコアリングします。
- 3日目
- 上記の3日目のように、新しいプレートのセットにラベルを付け、ワームを転送します。雌雄同体と男性の両方を新しいプレートに移してください。
- 20°Cまたは他の適切な温度で24時間子孫を産むことができます。5日目に生胚と孵化していない胚についてこれらのプレートをスコアリングします。
- 差動セルカウンターを使用して、ステップ2.3.3.1で説明したように、1日目のプレートから生きた幼虫と孵化していない胚を数えます。
注意: プレートは4日目に必要になるため、廃棄しないでください。 - 生きた幼虫と孵化していない胚の数を実験ノートに記録します。
- 4日目
- ステップ2.3.3.1で説明したように、2日目のプレートから生きている子孫と孵化していない胚を数えます。生きた幼虫と孵化していない胚の数を実験ノートに記録します。
- 男性の1日目のプレートを確認してください。交配が起こった場合、雌雄同体と雄の予想される遺伝的比率は50:50になるはずです。1日目のプレートにオスが含まれていない場合、オスと雌雄同体の交配は発生しませんでした。この交配ペアを破棄し、この観察結果を実験ノートに記録します。
- 5日目
- ステップ2.3.3.1で説明したように、3日目のプレートから生きた幼虫と孵化していない胚を数えます。生きた幼虫と孵化していない胚の数を実験ノートに記録します。データ分析に記載されている方法を使用して得られたデータを分析します。
4.データ分析
- 式 (1) を使用して、株の特定の生物学的複製の胚生存率を計算します。
注:生きている子孫と孵化していない胚の数は、実験期間全体の毎日の数を合計することによって得られます。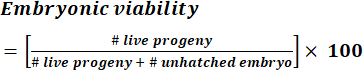 (1)
(1) - 親雌雄同体によって産生された子孫(孵化していない胚および幼虫)の数を合計することにより、特定の株のワームあたりのひなサイズを計算します。式 (2) を使用して平均ひなサイズを計算します。
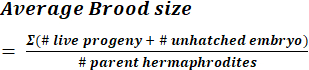 (2)
(2) - 胚の生存率と平均ひなのサイズを、生物学的複製間の平均偏差と標準偏差とともに報告します。コントロールデータと実験データを比較するスチューデントの t検定を実行します。
結果
N2(野生型)と減数分裂に関与する遺伝子に変異を有する2つの株、him-5(e1490)およびspo-11(ok79)について、胚の生存率とひなサイジングアッセイを実施しました。him-5とspo-11の両方が減数分裂の交叉形成に役割を果たすため、これら2つの遺伝子の突然変異により異数性配偶子が形成されます。N2のこの胚生存率アッセイは98.9%の生存率をもたらしましたが、him-5(e1490)とspo-11(ok79)の両方がそれぞれ74.9%と0.8%の割合で子孫生存率の低下を示しました(図2A;p < 0.0005)。これらの結果は、以前に発表された結果7、9と一致している。N2、him-5(e1490)、およびspo-11(ok79)の平均ひなサイズは、それぞれ217、105、および219であると決定されました(図2B)。以前の出版物と一致して、him-5(e1490)は野生型と比較して大幅に減少したひなサイズを持っていますが、spo-11(ok79)は7,9ではありません。
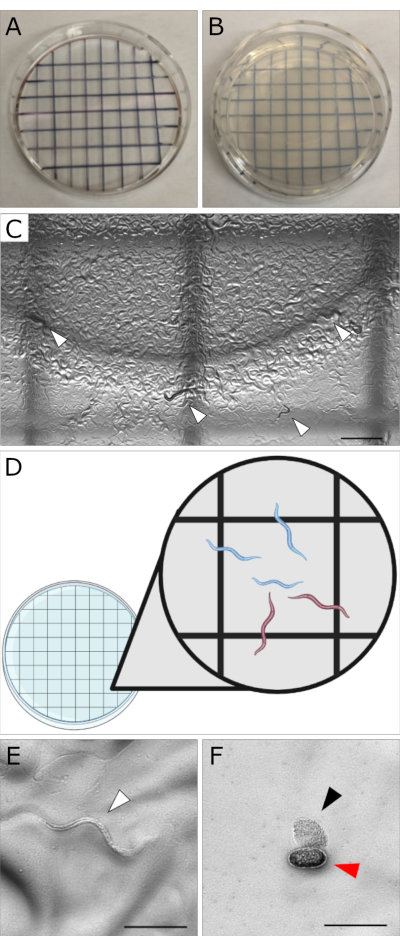
図1:プレート上の計数セットアップと胚形態のデモンストレーション 。 (A)細かいシャーピーを使用して描かれたクロスハッチンググリッドパターンの蓋の画像。(B)カウント用に下にパターン化された蓋が付いた35 mmのMYOBプレート。(C)グリッドの複数のボックスを示す低倍率(10倍)の視野を示す画像。白い矢印は、この視野内のいくつかの幼虫を示しています。カウントは、幼虫と胚の両方を観察するために、より高い倍率(フィールドで1つの正方形のみ)で行われるべきです。スケールバー = 1,000 μm。 (D)35mmプレートの下にグリッドパターンが置かれた蓋の漫画。挿入図は、特定の正方形でどの幼虫が数えられるかを決定するための適切な手法を示します。上から下、左から右に数えます。完全に正方形内にあるワームを数えます。境界に接触するワームは、尾ではなくワームヘッドの位置に基づいてカウントする必要があります。現在のグリッドまたは以前にカウントされたグリッド(つまり、上端と左端)に面しているワームをカウントします。頭が下端または右端に触れているワームを数えないでください。挿入図から、青いミミズはカウントされますが、赤いワームはカウントされません。 (E)健康なN2 L1孵化幼虫の代表的な画像(白い矢じり)。(F)未受精卵母細胞(黒い矢じり)と孵化していない胚(赤い矢じり)の代表的な画像。未受精卵母細胞は、このアッセイではカウントしないでください。スケールバー (E,F) = (100 μm)注: C、 E、 およびF の画像は、ワームプレート上の幼虫、胚、および卵母細胞の外観を示す目的で、カメラを取り付けたZeiss AxioZoom顕微鏡で撮影されました。胚生存率アッセイでは、実体顕微鏡(カメラなし)を使用してプレートを観察しながらカウントを行います。 この図の拡大版を表示するには、ここをクリックしてください。
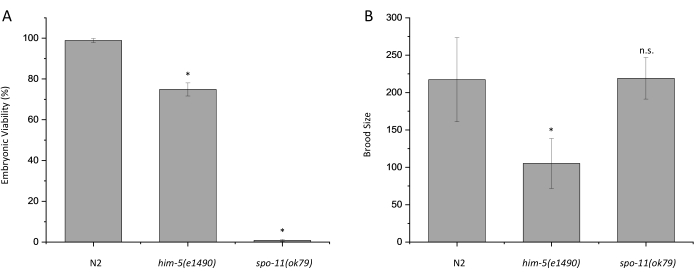
図2:胚の生存率アッセイとひなのサイズの結果を示す代表的なグラフ。 (A)20°CにおけるN2、him-5(e1490)、およびspo-11(ok79)の胚生存率。 (B)20°CでのN2、him-5(e1490)、およびspo-11(ok79)のひなサイズ 。 少なくとも28の雌雄同体の子孫を各株についてスコアリングした。孵化していない胚と幼虫の総数はN2 = 6302、him-5(e1490) = 2,945、spo-11(ok79) = 7,230であった。エラーバーは、3つの個別の反復間の標準偏差を示します。スチューデントのt検定を使用して計算された統計量、n.s. = 有意でない、*p < 0.0005。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
有性生殖種の繁殖には、減数分裂による一倍体配偶子(すなわち卵子と精子)の形成が必要であり、それらは受精時に統一され、二倍体染色体数を回復し、胚発生を開始します。これらのプロセスのいずれかのエラーは、不妊症、胚の致死、および/または先天性欠損症につながる可能性があります。C.エレガンスは、有性生殖を研究するための強力なモデルシステムです。遺伝子変異または遺伝子発現ノックダウン(例えば、RNA干渉)の影響は、上述の胚生存率およびひなサイジングアッセイを用いて比較的迅速かつ容易に評価することができる。これらの方法は、減数分裂染色体分配と受精/卵子活性化に関与する遺伝子の初期特性評価に使用しました10,11,12。胚の生存率またはひなのサイズの観察された減少は、減数分裂、配偶子形成、受精、または胚形成の混乱を示しています。
胚の生存率とひなのサイズは、子孫のカウントと簡単な数学的計算によって比較的簡単に評価されるため、これらは実験室または教室での研究初心者にとって最適な入門実験です。 C.エレガンスの 飼育の容易さと経済的利点により、実験生物学のクラスに特に適しています。学生は、 C.エレガンス 飼育を通じて貴重な研究経験を積み、解剖顕微鏡の使用方法を学び、比較的短い時間(この論文で説明されているプロトコルで約5日間)で答えることができる発生システムで生物学的質問をすることができます。
子孫カウントのタイミングは、胚の生存率アッセイにとって非常に重要です。20°Cでは胚形成に約16時間かかり、生殖成熟成虫は孵化後約60時間でL1幼虫として産卵を開始する。ライフサイクルは速いので、適切なウィンドウ内で子孫を数え、胚が孵化するのに十分な時間を確保し、子孫自身が産卵し始める前にすることが重要です。成長期間は温度によって異なることに注意することも重要です。成長は、24〜25°Cで15〜16°Cよりも約2.1倍速く、20°Cで15〜16°Cよりも約1.3倍速くなります13。このプロトコルでは、成人が新しいプレートに置かれてから48時間後にカウントが発生することをお勧めします。この時間枠は、野生型の発生を伴うすべての胚が孵化するのに十分な時間(>16時間)を有するが、生殖能力のポイントまで老化しないことを保証する。20°C未満の温度で実施されたアッセイは、胚が孵化し、孵化した子孫がMYOBプレート上の細菌の間で観察しやすい幼虫期(L3-L4期)に到達するために延長(動物を4日間移植)する必要がある場合があります。
胚の生存率アッセイとひなのサイジングの制限は、摂動される特定の発生プロセスが容易に明らかにならないことです。ただし、これらの初期アッセイを細胞学的手法でフォローアップして、どのプロセスが影響を受けるかを判断することができます。例えば、成虫を解剖して生殖腺を放出した後、4',6-ジアミジノ-2-フェニルインドール(DAPI)染色を行い、生殖細胞系列内のDNA形態を注意深く分析することで、減数分裂プロセスが破壊されているかどうかを明らかにすることができます。さらに、胚のDAPI染色は、どの段階で胚発生が停止するかを明らかにすることができます。
結論として、我々は、産生された胚の数(ひな)および様々な C.エレガンス 変異体に対して生存可能な胚の割合をアッセイするためのプロトコルを記載した。このアッセイは、自家受精雌雄同体と雄/雌雄同体の交配の両方に使用できます。 C. elegans の短いライフサイクルにより、このプロトコルは1週間未満で完了することができます。胚の生存率アッセイとひなのサイズは、減数分裂、受精、または胚発生に関与する遺伝子の最初の分析として使用でき、より高度な研究者や研究初心者(学部生と大学院1年生)の両方に適したプロトコルです。
開示事項
著者には、宣言する利益相反はありません。
謝辞
Jaramillo-Lambertラボでの作業は、国立衛生研究所NIGMS R35GM142524によってサポートされています。すべての C.エレガンス 株は、国立衛生研究所、P40 OD010440によって資金提供されている Caenorhabditis Genetics Centerによって提供されました。 図 1D は Biorender.com を使用して作成されました。
資料
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 35 mm Petri dishes | Tritech research | T3501 | Semi-stackable, non-vented. |
| Bacto Agar | Becton, Dickinson and Company | 214010 | For MYOB |
| Bacto-Peptone | Gibco | 211677 | For MYOB |
| Cholestrol | Sigma | C8503 | For MYOB |
| Sodium Chloride | J.T. Baker | FW 58.440 | For MYOB |
| Trizma Base | Sigma | T1503 | For MYOB |
| Trizma hydrochloride | Sigma | T3253 | For MYOB |
| Strains | |||
| C. elegans wild type strain | Caenorhabditis Genetics Center | N2 | |
| Escherichia coli | Caenorhabditis Genetics Center | OP50 | |
| him-5(e1490) | Caenorhabditis Genetics Center | DR466 | |
| spo-11(ok79) | Caenorhabditis Genetics Center | AV106 | |
| Equipment/software | |||
| Differential cell counter | Fischer Scientific | 02-670-12 | |
| MicroSoft Excel or Prism | MicroSoft or GraphPad | For recording and creating graphical representations of data. | |
| platinum wire | Tritech research | PT9901 | For making worm picks. 99.5% Platinum, 0.5% Iridium. This comes as 3 ft/pack, which is sufficient for making 36 worm picks (~1 inch platinum wire per pick). |
| Stereomicroscope | Nikon | SMZ-745 | Diascopic base with focus mount, integrated LED module, power cord, 6.7x to 50x Zoom range [WD 115 mm], Widefield Eyepiece C-15x/17 (Note: equivalent stereomicroscopes are available from other manufacturers.) |
| worm pick handle | Tritech research | TWPH1 | For making worm picks. Mount ~1 in platinum wire into worm pick handle. Alternatively, worm picks can be made by mounting platinum wire in a glass Pasteur pipette. |
参考文献
- Hillers, K., Jantsch, V., Martinez-Perez, E., Yanowitz, J. Meiosis. WormBook: the Online Review of C. elegans Biology. , (2017).
- O'Connor, C. Chromosomal abnormalities: aneuploidies. Nature Education. 1 (1), 172 (2008).
- Marcello, M. R., Singaravelu, G., Fertilization Singson, A. Fertilization. Advances in Experimental Medicine and Biology. 757, 321-350 (2013).
- Marcello, M. R., Singson, A. Fertilization and the oocyte-to-embryo transition in C. elegans. BMB Reports. 43 (6), 389-399 (2010).
- Robertson, S., Lin, R. The oocyte-to-embryo transition. Advances in Experimental Medicine and Biology. 757, 351-372 (2013).
- Corsi, A. K., Wightman, B., Chalfie, M. A transparent window into biology: A primer on Caenorhabditis elegans. WormBook: the Online Review of C. elegans Biology. , 1-31 (2015).
- Hodgkin, J., Horvitz, H., Brenner, S. Nondisjunction mutants of the nematode CAENORHABDITIS ELEGANS. Genetics. 91 (1), 67-94 (1979).
- Chu, D. S., Shakes, D. C. Spermatogenesis. Advances in Experimental Medicine and Biology. 757, 171-203 (2013).
- Dernburg, A. F., et al. Meiotic recombination in C. elegans initiates by a conserved mechanism and is dispensable for homologous chromosome synapsis. Cell. 94 (3), 387-398 (1998).
- Bhandari, N., et al. Identification of suppressors of top-2 embryonic lethality in Caenorhabditis elegans. G3. 3 (4), 1183-1191 (2020).
- Jaramillo-Lambert, A., Fabritius, A. S., Hansen, T. J., Smith, H. E., Golden, A. The identification of a novel mutant allele of topoisomerase II in Caenorhabditis elegans reveals a unique role in chromosome segregation during spermatogenesis. Genetics. 204 (4), 1407-1422 (2016).
- Jaramillo-Lambert, A., Golden, A. The C-terminus of SPE-11 is required for proper embryonic development in C. elegans. microPublication Biology. , (2020).
- Stiernagle, T. Maintenance of C. elegans. WormBook: the Online Review of C. elegans Biology. , 1-11 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved