Method Article
アルカリ熱傷による角膜血管新生術のマウスモデル
要約
このプロトコルはマウスのアルカリの焼跡誘発されたcorneal neovascularizationに焦点を合わせる。この方法は、病理学的血管新生と関連する分子メカニズムを研究し、角膜血管新生を予防するための新しい薬理学的薬剤をテストするための、再現性と制御性のある角膜疾患モデルを生成します。
要約
血管新生の病理学的形態である角膜血管新生術(CoNV)は、辺縁部から無血管性角膜への血管およびリンパ管の成長を伴い、透明性と視力に悪影響を及ぼします。アルカリ熱傷は、CoNVにつながる眼の外傷の最も一般的な形態の1つです。このプロトコルでは、再現性を確保するために、制御された方法で水酸化ナトリウム溶液を使用してCoNVを実験的に誘導します。アルカリ燃焼モデルは、CoNVの病理を理解するのに役立ち、角膜の血管性、透明性、およびアクセス性のために、血管新生全般の研究に拡張できます。この研究では、CoNVを解剖顕微鏡下で直接検査し、抗CD31 mAbを使用してフラットマウント角膜を免疫染色することによって分析しました。リンパ管新生は、抗LYVE-1 mAbを用いた免疫染色により、フラットマウント角膜で検出されました。角膜浮腫は、光干渉断層撮影法(OCT)を使用して視覚化および定量化されました。要約すると、このモデルは、既存の血管新生アッセイを進歩させ、病理学的眼および眼外血管新生のための新しい治療戦略を発見するのに役立ちます。
概要
角膜は血管新生特権を確立することによってその透明性を維持する無血管組織です1,2。角膜の損傷は、炎症、血管やリンパ管の発達、線維化を引き起こす可能性があります3。角膜血管新生(CoNV)は視覚障害を引き起こし、世界の失明原因の第2位です4。CoNVは、米国では年間約140万人が罹患しています5。CoNVは、化学熱傷、感染症、炎症、低酸素症など、さまざまな要因によって引き起こされる可能性があります3,6。化学熱傷は最も一般的な眼の緊急事態の1つであり、眼の外傷の約13.2%を占め、即時の評価と治療が必要です7。化学火傷はアルカリまたは酸の火傷である可能性がありますが、アルカリが組織の奥深くに浸透するため、アルカリ火傷はより深刻な損傷を引き起こします8。
アルカリ熱傷のマウスモデルは、CoNVおよび創傷治癒の研究に広く使用されています。角膜ポケット血管新生モデル9,10と比較して、アルカリ熱傷モデルは比較的簡単に作成でき、角膜の炎症、線維症、および上皮増殖の研究にも使用できます。また、これらのモデルは、血管新生の角膜縫合モデルよりも臨床化学熱傷と密接に関連している11。アルカリ燃焼では、無血管性角膜は、炎症と抗血管新生因子と血管新生促進因子の不均衡により血管を発達させます1,2。角膜アルカリ熱傷モデルの欠点は、アルカリ熱傷の面積と重症度を制御することの難しさ、角膜血管新生の変動、および過剰なアルカリ溶液による隣接する組織の意図しない燃焼です。この研究の目的は、水酸化ナトリウム溶液にあらかじめ浸した濾紙を使用して、マウスの角膜アルカリ燃焼モデルを制御することです。このモデルは、血管新生因子、抗血管新生治療薬、および炎症や線維症を調節する可能性のあるその他の因子や試薬の研究に使用できます。
プロトコル
実験手順と安楽死を含むすべての動物研究は、ベイラー医科大学の施設動物ケアおよび使用委員会(IACUC)によってプロトコル番号AN-8790で承認されました。
1. 1 N NaOHの調製
- 15 mLの遠心チューブに4 mLの滅菌脱イオン水を加えます。400 mgの水酸化ナトリウム(NaOH)を秤量し、チューブに慎重に加えます。
- ガラス棒を用いて溶液をゆっくりと攪拌することにより、NaOHを溶解する。チューブに滅菌脱イオン水を加えて容量を10 mLに増やし、チューブを上下に静かに反転させて再度混合します。キャップをしっかりと閉め、溶液を室温で保存します。
- NaOH溶液は、溶液が空気中の二酸化炭素を吸収することで濃度が低下する可能性があるため、毎月新鮮な溶液を調製してください。
- 使用前に必ずNaOH溶液を静かに混合してください。
注意: 薬品フード内で溶液を調製し、適切な個人用保護具(PPE)を着用してください。
2. 4%パラホルムアルデヒド(PFA)溶液の調製
- 30 mL の 1x リン酸緩衝生理食塩水(PBS)をガラスビーカーに加えます。パラホルムアルデヒド(PFA)4gを秤量し、ビーカーに加えます。
- ビーカーを60°Cのホットプレートに置き、攪拌します。1 N NaOH溶液を滴下し、溶液が透明になるまでpHを上げます。
- 1 N 塩酸 (HCl) を使用して pH を確認し、7.4 に調整します。最終容量を 1x PBS で 50 mL に調整します。
- 溶液を冷却してろ過します。溶液を4°Cで保存します。
注意: 適切なPPEを着用しながら、ドラフト内で溶液を調製します。
3.ケタミン/キシラジンカクテルの準備
- 生理食塩水9.4 mLにケタミン0.8 mL(ストック濃度:100 mg/mL)とキシラジン0.16 mL(ストック濃度:100 mg/mL)を加えて、ケタミン/キシラジンカクテルを調製します。
- カクテルを滅菌注射ボトルに入れて室温(RT)で保管します。
4.マウス角膜のアルカリ焼け
- 痛みを和らげるために、手順の30分前にメロキシカム(体重4〜6 mg / kg)を皮下に注射します。.ケタミン/キシラジンカクテル(ケタミン80mg/kgおよびキシラジン16mg/kg体重)のi.p.注射を用いて、マウス(C57BL / 6J、6-8週齢、雄)に麻酔をかけます。
- マウスのつま先をつまんで反射反応(ペダルの引き込み)を確認し、反射がないことを確認します。局所麻酔薬、0.5%プロパラカインを片方の目の角膜表面に1滴、もう片方の目に人工涙液を1滴塗布します。.
- 2mmの生検パンチを使用して、Whatman濾紙ディスクを打ち抜きます。
- 2 μLの1N NaOHを清潔なペトリ皿に加えます。2 mm の濾紙ディスクを 1 N NaOH ドロップの上に置き、15 秒間浸します。
- 鉗子でろ紙を拾い上げ、角膜の中心にあるプロパラカイン処理された目にろ紙を30秒間塗布します。
注意: ろ紙は角膜の中心にのみ触れている必要があり、ろ紙を動かすと隣接する組織に火傷を負う可能性があるため、一度置いたろ紙が動かないように注意する必要があります。 - 滅菌シリンジで20 mLの滅菌生理食塩水で洗い流して目を洗います。
注意: 角膜や周囲の組織にそれ以上の損傷を与えないように、角膜と結膜嚢を完全に洗浄するように注意する必要があります。結膜嚢を洗浄すると、シンブルファロンがさらに予防されます。 - 使い捨てのソフトワイプを使用して、目や周囲から余分な生理食塩水をやさしく拭き取ります。その後、歩行可能になるまで、マウスを温かい加熱パッドの上の回復ケージに入れておきます。
注:マウスは、アルカリ燃焼後3日間毎日監視されます。痛みやストレスの症状が見られる場合は、メロキシカム(体重4〜6 mg / kg)を皮下投与します。.
5.血管新生と混濁の検査と評価
- 麻酔をかけたマウスでは、火傷後10日目に解剖顕微鏡で眼を検査し、解剖スコープに取り付けたカメラで画像を取得し、混濁と血管新生をスコアリングします。
注:カメラを取り付けた通常の解剖スコープで十分です。 - 解剖顕微鏡で角膜を観察しながら、次のスケール12に基づいて火傷後の不透明度をスコアリングします。
0 = 不透明度なし。透明な角膜
1 = 軽度の不透明度。虹彩と瞳孔の領域にわずかなぼやけがある。虹彩と瞳孔が見やすい
2 = 中程度の不透明度。虹彩と瞳孔がかろうじて見える
3 = 不透明度が厳しい。虹彩または瞳孔が見えない
4 =不透明な角膜;虹彩と瞳孔が見えない - 解剖顕微鏡で角膜を観察しながら、次のスケール12に基づいてCoNVをスコアリングします。
0 =血管新生なし。辺縁部から新しい血管はありません
1 =軽度の血管新生;辺縁部に由来する新しい血管
2 =中等度の血管新生;血管は辺縁部から始まり、角膜の中心に向かって成長しています
3 =重度の血管新生;辺縁部から発生し、角膜の中心に到達および/または交差する血管 - スチューデントのt検定を使用して、アルカリ熱傷群と健康な眼群の混濁度と血管新生スコアを統計的に比較します。
- 10日目に呼吸停止後1分まで5%のイソフルラン曝露によりマウスを安楽死させ、続いて子宮頸部脱臼を行い、フラットマウントイメージングのために角膜を採取します。
6. 光干渉断層撮影(OCT)イメージング
- 火傷後10日目に麻酔をかけたマウスの眼の前部のOCT画像を撮影します。視野角30°、IR強度100%のIR +OCT モードを使用して、ボリュームスキャンとしてOCT画像取得を実行します。
- ImageJソフトウェアを使用して角膜の厚さを定量化します。
- 厚さを測定するには、ImageJ ソフトウェアの 線選択 ツールを使用して、角膜中央の前面と後面の間に直線を作成します。
- ソフトウェアツールの [分析>測定 ]をクリックして、値をデータウィンドウに転送します。
- 値をスプレッドシートファイルにコピーし、スチューデントのt検定を使用して、アルカリ焼けした眼球群と健康な眼球群の角膜の厚さを統計的に比較します。
注:角膜の厚さは、角膜前部表面上の点から角膜中心の後角膜表面上の最も近い点までの距離です。
7. フラットマウント角膜におけるCoNVの免疫染色
- アルカリ燃焼後10日目にマウスを安楽死させ、鈍的解剖によって眼球を摘出する。
- 親指と人差し指を使ってまぶたを引き離し、鉗子をアイグローブの下に置きます。鉗子を閉じ、眼球を眼窩からそっと引き抜きます。
- 眼球を1x PBSに入れます。眼球ごとに、最初に辺縁部の下に30Gの針を使用して切開を行い、アイグローブから角膜を取り除きます。
- 角膜マイクロハサミを使用して、切開を出発点として辺縁部の周りを切断し、角膜と辺縁部を地球からゆっくりと分離します。
- 細い絵筆を使って角膜をやさしく掃除し、虹彩を取り除きます。角膜を4%パラホルムアルデヒドで1時間固定します。
- 角膜を室温(室温)で1x PBSで20分間ずつ3回洗浄します。
- ブロッキングバッファー(0.1% Triton-X 100および5%ウシ血清アルブミン[BSA]を添加したPBS1個)中で室温で1時間インキュベートします。
- 角膜を一次抗体を含む抗体溶液に移します。1% BSA、0.1% Triton-X 100、Dylight550標識抗CD31 mAb(1:100)、Alexa Fluor488標識抗LYVE-1 mAb(1:100)を添加した1x PBSで抗体溶液を調製します。
- 4°Cで3日間インキュベートします。 角膜を1x PBSで3回、それぞれ20分間洗浄します。
- ヘキスト染色液(1:1,000)を用いて、暗所で5分間核を染色します。
- 角膜を放射状の切り込みで平らにし、封入剤とカバーガラスを使用して事前に洗浄したスライドガラスに取り付けます。カバーガラスを透明なマニキュアで密封し、スライドを暗所で一晩乾燥させてから、共焦点顕微鏡で分析します。
- 個々のZスタック画像をつなぎ合わせ、共焦点顕微鏡を使用してフラットマウント角膜を画像化します。10倍対物レンズ、488 nmおよび561 nmレーザー、スライスあたり512ピクセル x 512ピクセルの解像度を非共振ガルバノスキャナーで使用します。
- ImageJソフトウェアを使用して、CD31+ 血液およびLYVE-1+ リンパ管の密度を定量化します。
- 血管密度を決定するには、共焦点画像を 8 ビット画像に変換します。
- プラグインから Vascular Density を選択します。
- 画像上の関心領域を選択し、[ OK]をクリックします。測定値が新しいデータウィンドウで開きます。
- 値をスプレッドシートファイルにコピーし、スチューデントのt検定を使用して、アルカリ焼けした眼球群と健康な眼球群の血管密度を統計的に比較します。
注:CD31は、血小板内皮細胞接着分子-1(PECAM-1)とも呼ばれ、血管新生に関与する細胞接着分子であり、初期および成熟血管の内皮細胞で高発現しています13。LYVE-1(リンパ管内皮ヒアルロン酸受容体-1)は、リンパ管内皮細胞上の細胞表面マーカーであり、リンパ管新生マーカーとして用いることができる14。
結果
本研究では、アルカリ熱傷によりマウス眼に角膜血管新生を誘導する方法について記述する。解剖顕微鏡で得られた画像(図1A、B)は、アルカリ熱傷群の角膜の血管新生および混濁スコアの有意な上昇を示しました(P < 0.05;図1C、D)。10日目に採取した角膜を、血管については抗CD31 mAb、リンパ管については抗LYVE-1 mAbでさらに免疫染色しました(図2A-I)。アルカリ熱傷群は、10日後に有意に高い血管密度とリンパ管の密度を示しました(P < 0.001およびP < 0.05;図2J,K)。OCTを用いて画像化・定量化した角膜の厚さ(図3A、B)は、アルカリ熱傷を負っているグループ(P < 0.01;図3C)。
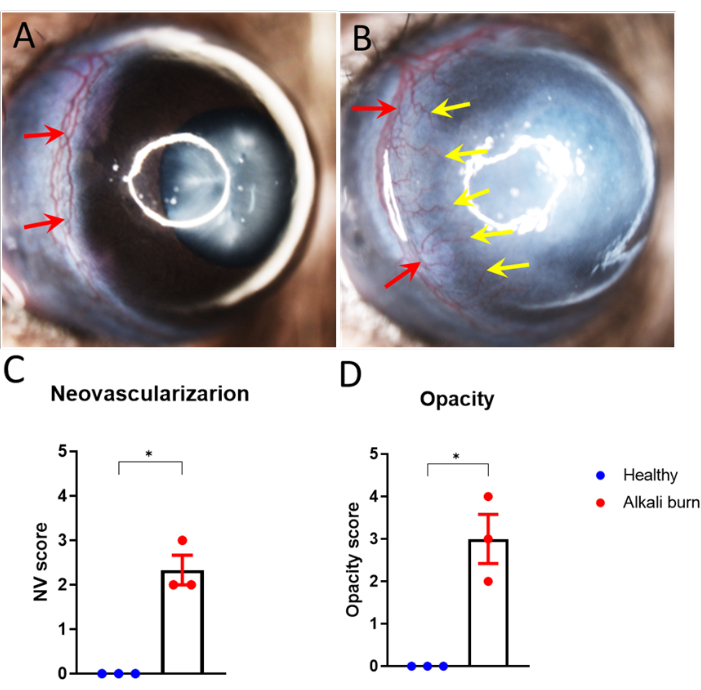
図1:アルカリ熱傷による角膜血管新生と混濁。 (A,B)角膜血管新生は、(B)アルカリ焼けしたマウスの眼(A)では辺縁血管から角膜中心に向かって発芽したが、損傷後10日後には健康な眼ではなかった。(C、D)パネルAおよびBにおける(C)角膜血管新生および(D)混濁の定量化(± SEM;t検定;*P < 0.05;n = 3眼、1眼/マウス)。赤い矢印は辺縁部を表し、黄色の矢印は発芽した新しい血管を示しています。この図の拡大版をご覧になるには、ここをクリックしてください。
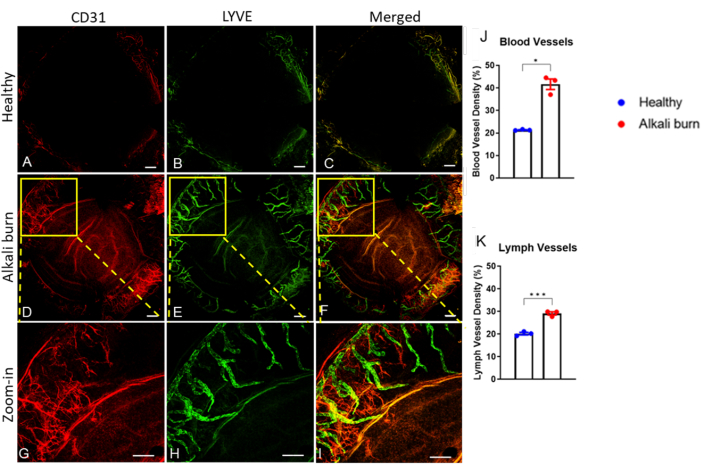
図2:アルカリ熱傷による角膜血管新生とリンパ管新生。 免疫組織化学では、抗CD31および抗LYVE-1 mAbを使用して、それぞれ(A、D、G)血液および(B、E、H)リンパ管が明らかになりました。(A-C)健康なマウスの角膜。(D-I)受傷後10日でアルカリ焼けした角膜。(C,F,I)CD31シグナルとLYVE-1シグナルの重ね合わせ画像。(ジーアイ)パネルD-Fの拡大画像。スケールバー = (A-F) 200 μm および (G-I) 500 μm。 (J,K) パネル A から F における血液およびリンパ管密度の定量化 (± SEM; t 検定; *P < 0.05; ***P < 0.001; n = 3 眼、1 眼/マウス)。この図の拡大版をご覧になるには、ここをクリックしてください。
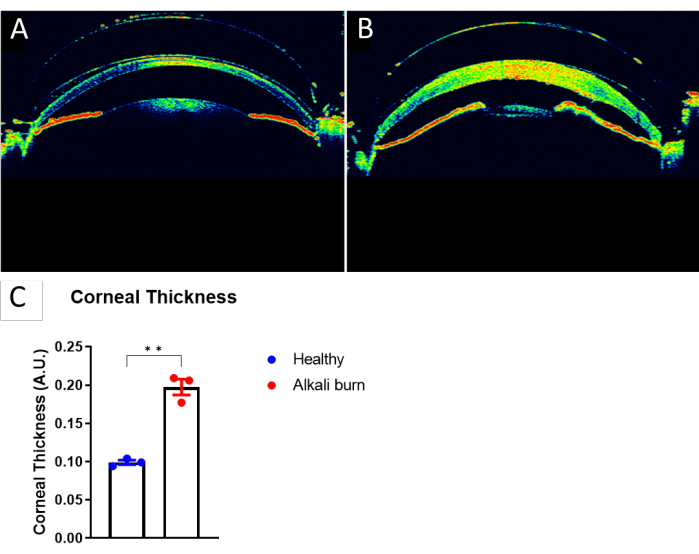
図3:アルカリ焼けによる角膜厚の増加 。 (A)健康なマウスの眼のOCT画像。(B)アルカリ熱傷から10日後のマウス角膜のOCT画像。(C)角膜の中心で測定されたパネル A および Bの角膜厚の定量化(±SEM;t検定、**P < 0.01;n = 3眼、1眼/マウス)。 この図の拡大版をご覧になるには、ここをクリックしてください。
ディスカッション
角膜は血管新生や炎症を研究するのに最適な組織であり、血管新生や血管血管がアクセス可能であり、血管新生を便利に検出して記録することができます。ウサギ、ラット、マウスの角膜熱傷は、角膜血管新生、炎症と混濁、潰瘍、角膜の穿孔、および線維症の研究に使用されています15,16,17。さらに、角膜熱傷のマウスモデルは、マウスがヒトの免疫系と密接に関連する免疫系を持っているため、血管新生と炎症のさまざまな治療戦略をテストするために貴重です18。マウスのゲノムを遺伝子操作する技術が利用できることも、この種をこの種の研究の優れた選択肢にしています19。この研究の課題は、一貫性のある再現性のある病態生理学を提供する角膜熱傷の方法を開発することでした。
アルカリ燃焼モデルは、血管新生、炎症、および線維症を調節する薬物の薬理学的スクリーニングに特に有用です。試薬とリソースの最小限の要件、アルカリ燃焼の実行の簡便さ、およびプロトコルの短い持続時間と結果の直接観察の利点により、マウス角膜のアルカリ燃焼は薬理学的薬物スクリーニングの主要な選択肢となっています。ただし、一貫性と再現性を確保するために、この手順を実行する際には、いくつかの注意事項を考慮する必要があります。まず、濾紙を角膜の中心に配置して、目の他の領域、特に辺縁部、まぶた、結膜を焼かないようにする必要があります。第二に、角膜のアルカリ燃焼から一貫した結果を得るには、NaOHの量と濃度が適切でなければなりません。フィルターは濡れて滴り落ちてはいけませんが、NaOH溶液に浸している必要があります。この方法で使用される溶液のフィルターサイズとフィルタータイプ、および正規性と体積は、NaOHのオーバーフローを回避するように最適化されています。異なるサイズの濾紙を使用したり、NaOHの量を増減したりすると、血管新生に不整合が生じます。第三に、使用後すぐに溶液のチューブキャップを締め、空気/溶液比を下げることにより、NaOH溶液が室内空気中のCO2 を吸収するのを防ぐことが重要です。血管新生の不一致を防ぎ、角膜潰瘍を避けるために、新鮮なアルカリ溶液を使用するように注意する必要があります。.最後に、角膜と眼の周囲組織へのさらなる損傷を防ぐために、眼と結膜からのすべてのNaOH溶液を生理食塩水で広範囲に洗浄する必要があります。角膜と隣接する組織を徹底的に洗浄することで、シンブルファロンも予防されます。
ここに記述されているプロトコルは角膜のangiogenesisのpathophysiologyを調査するための有効で、信頼できる方法である。このプロトコルは、角膜の炎症、線維症、および創傷治癒の研究にさらに使用できます。
開示事項
著者は利益相反がないことを宣言します。
謝辞
この研究は、SRB慈善事業団、国立衛生研究所(NIH)P30EY002520、およびベイラー医科大学眼科への失明予防研究(RPB)からの無制限の機関助成金によって支援されました。WLは、テンプル騎士団眼科財団眼科基金の支援を受けています。
資料
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride Injection | Hospira | KL-7302 | |
| 30 G Needle | McKesson | 16-N3005 | |
| A1R Confocal | Nikon Instruments | ||
| Anti-CD31 | Novus Biologicals | NB100-1642R | |
| Anti-LYVE-1 | Life technologies | 53-0443-82 | |
| ASM Module | Heidelberg Engineering | Anterior segment objective | |
| Biopsy Punch | McKesson | 16-1309 | |
| BSA | Thermoscientific | 9048-46-8 | |
| Coverslip | VWR International | 22X22-1-601640G | |
| Dissection Microscope | AmScope | SM-4TZ-30WY-10M3 | |
| Fluoromount-G | Electron Microscopy Sciences | 17984-25 | |
| Forceps | Fine Science Tools | 15000-02 | |
| Forceps | Fine Science Tools | 11049-10 | |
| Forceps | Fisherbrand | 12-000-157 | |
| Forceps | Roboz | RS-4905 | |
| Gonak Hypromellose | Akorn | 17478006412 | |
| GraphPad Prism 9 | GraphPad Sotware, Inc | ||
| Heating pad | K&H Pet Products | 100213018 | |
| Hoescht | Life Technologies | 62249 | |
| HRA + OCT Spectralis | Heidelberg Engineering | ||
| Insulin Syringe | Mckesson | 102-SN310C31516P | |
| Kimwipe | Kimberly Clark Professional | 34155 | |
| Micro Cover Glass | VWR | 48366-067 | |
| Microscissors | Roboz | RS-5110 | |
| Microscopic Slide | Fisherbrand | 12-550-15 | |
| NaOH | Sigma Aldrich | 55881-500G | |
| Neomycin and Polymyxin B Sulfates and Dexamethasone | Bausch & Lomb | 24208-0795-35 | |
| Normal Serum | Jackson Immuno | 008-000-121 | |
| Paraformaldehyde | Sigma Aldrich | 158127-500G | |
| PBS | Gibco | 20012-027 | |
| Proparacaine HCl | Bausch & Lomb | 24208073006 | |
| Saline | Henry Schein | 1531042 | |
| SMZ125 | Nikon Instruments | ||
| Syringe 10 mL | McKesson | 16-S10C | |
| Triton X-100 | Sigma Aldrich | TX1568-1 | |
| Whatmann Filter Paper | Cytiva | WHA1003323 |
参考文献
- Ellenberg, D., et al. Novel aspects of corneal angiogenic and lymphangiogenic privilege. Progress in Retinal and Eye Research. 29 (3), 208-248 (2010).
- Azar, D. T. Corneal angiogenic privilege: Angiogenic and antiangiogenic factors in corneal avascularity, vasculogenesis, and wound healing (an American Ophthalmological Society thesis). Transactions of the American Ophthalmological Society. 104, 264-302 (2006).
- Rolfsen, M. L., et al. Corneal neovascularization: A review of the molecular biology and current therapies. Expert Review of Ophthalmology. 8 (2), 167-189 (2013).
- Skobe, M., Dana, R. Blocking the path of lymphatic vessels. Nature Medicine. 15 (9), 993-994 (2009).
- Lee, P., Wang, C. C., Adamis, A. P. Ocular neovascularization: An epidemiologic review. Survey of Ophthalmology. 43 (3), 245-269 (1998).
- Su, W., et al. Efficacious, safe, and stable inhibition of corneal neovascularization by AAV-vectored anti-VEGF therapeutics. Molecular Therapy - Methods & Clinical Development. 22, 107-121 (2021).
- Lasagni Vitar, R. M., et al. Epidemiology of corneal neovascularization and its impact on visual acuity and sensitivity: A 14-year retrospective study. Frontiers in Medicine. 8, 733538 (2021).
- Said, D. G., Dua, H. S. Chemical burns acid or alkali, what's the difference. Eye. 34, 1299-1300 (2020).
- Muthukkaruppan, V. R., Auerbach, R. Angiogenesis in the mouse cornea. Science. 2 (4413), 1416-1418 (1979).
- Kenyon, B. M., et al. A model of angiogenesis in the mouse cornea. Investigative Ophthalmology & Visual Science. 37 (8), 1625-1632 (1996).
- Cursiefen, C., Maruyama, K., Jackson, D. G., Streilein, J. W., Kruse, F. E. Time course of angiogenesis and lymphangiogenesis after brief corneal inflammation. Cornea. 25 (4), 443-447 (2006).
- Yoeruek, E., et al. penetration and efficacy of topically applied bevacizumab: Evaluation of eyedrops in corneal neovascularization after chemical burn. Acta Ophthalmologica. 86 (3), 322-328 (2008).
- DeLisser, H. M., et al. Involvement of endothelial PECAM-1/CD31 in angiogenesis. The American Journal of Pathology. 151 (3), 671-677 (1997).
- Johnson, L. A., Prevo, R., Clasper, S., Jackson, D. G. Inflammation-induced uptake and degradation of the lymphatic endothelial hyaluronan receptor LYVE-1. The Journal of Biological Chemistry. 282 (46), 33671-33680 (2007).
- Choi, H., et al. Comprehensive modeling of corneal alkali injury in the rat eye. Current Eye Research. 42 (10), 1348-1357 (2017).
- Chung, J. H., Fagerholm, P., Lindström, B. The behaviour of corneal epithelium following a standardized alkali wound. Acta Ophthalmologica. 65 (5), 529-537 (1987).
- Chang, J. H., Gabison, E. E., Kato, T., Azar, D. T. Corneal neovascularization. Current Opinion in Ophthalmology. 12 (4), 242-249 (2001).
- Alves da Costa, T., Lang, J., Torres, R. M., Pelanda, R. The development of human immune system mice and their use to study tolerance and autoimmunity. Journal of Translational Autoimmunity. 2, 100021 (2019).
- vander Weyden, L., White, J. K., Adams, D. J., Logan, D. W. The mouse genetics toolkit: Revealing function and mechanism. Genome Biology. 12 (6), 224 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved