Method Article
Alkali Yanığı ile Kornea Neovaskülarizasyonu için Bir Fare Modeli
Bu Makalede
Özet
Bu protokol, farelerde alkali yanığın neden olduğu kornea neovaskülarizasyonuna odaklanır. Yöntem, patolojik anjiyogenezi ve ilişkili moleküler mekanizmaları incelemek ve kornea neovaskülarizasyonunu önlemek için yeni farmakolojik ajanları test etmek için tekrarlanabilir ve kontrol edilebilir bir kornea hastalığı modeli oluşturur.
Özet
Anjiyogenezin patolojik bir formu olan kornea neovaskülarizasyonu (CoNV), limbüsten avasküler korneaya kan ve lenf damarlarının büyümesini içerir ve şeffaflığı ve görmeyi olumsuz etkiler. Alkali yanığı, CoNV'ye yol açan en yaygın oküler travma formlarından biridir. Bu protokolde, tekrarlanabilirliği sağlamak için CoNV, kontrollü bir şekilde sodyum hidroksit çözeltisi kullanılarak deneysel olarak indüklenir. Alkali yanık modeli, CoNV'nin patolojisini anlamak için yararlıdır ve korneanın avaskülaritesi, şeffaflığı ve erişilebilirliği nedeniyle genel olarak anjiyogenezi incelemek için genişletilebilir. Bu çalışmada, CoNV, diseksiyon mikroskobu altında doğrudan inceleme ve anti-CD31 mAb kullanılarak düz montajlı korneaların immün boyanması ile analiz edildi. Lenfanjiyogenez, anti-LYVE-1 mAb kullanılarak immün boyama ile düz mount kornealarda tespit edildi. Kornea ödemi optik koherens tomografi (OKT) kullanılarak görüntülendi ve ölçüldü. Özetle, bu model mevcut neovaskülarizasyon testlerinin ilerlemesine ve patolojik oküler ve ekstraoküler anjiyogenez için yeni tedavi stratejilerinin keşfedilmesine yardımcı olacaktır.
Giriş
Kornea, anjiyojenik bir ayrıcalık oluşturarak şeffaflığını koruyan avasküler bir dokudur 1,2. Korneanın hasar görmesi, iltihaplanmaya ve kan ve lenf damarlarının gelişmesine ve ayrıca fibroziseneden olabilir 3. Kornea neovaskülarizasyonu (CoNV) görme bozukluğuna yol açar ve dünya çapında körlüğün ikinci önde gelen nedenidir4. CoNV, Amerika Birleşik Devletleri'nde yılda yaklaşık 1,4 milyon kişiyi etkilemektedir5. CoNV, kimyasal yanıklar, enfeksiyonlar, iltihaplanma ve hipoksi 3,6 dahil olmak üzere çeşitli faktörler tarafından indüklenebilir. Kimyasal yanıklar en sık görülen oküler acillerden biridir ve oküler travmanın yaklaşık %13,2'sini oluşturur ve acil değerlendirme ve tedavi gerektirir7. Kimyasal yanıklar alkali veya asit yanıkları olabilir, ancak alkali yanıklar daha ciddi yaralanmalara neden olur, çünkü alkali dokuya daha derine nüfuz eder8.
Alkali yanığının fare modelleri, CoNV ve yara iyileşmesini incelemek için yaygın olarak kullanılmaktadır. Kornea cep anjiyogenezi modeli 9,10 ile karşılaştırıldığında, alkali yanık modellerinin oluşturulması nispeten basittir ve ayrıca kornea iltihabı, fibroz ve epitel proliferasyonunu incelemek için de kullanılabilir. Bu modeller ayrıca anjiyogenez11'in korneal sütür modellerinden daha klinik kimyasal yanıklarla daha yakından ilişkilidir. Alkali yanığı ile, aksi takdirde avasküler kornea, iltihaplanma ve anti-anjiyojenik ve pro-anjiyojenik faktörlerdeki dengesizlik nedeniyle kan damarları geliştirir 1,2. Korneal alkali yanık modellerinin dezavantajları, alkali yanığın alanını ve şiddetini kontrol etmedeki zorluklar, kornea neovaskülarizasyonundaki varyasyon ve aşırı alkali çözeltisi nedeniyle komşu dokuların istemsiz yanmasıdır. Bu çalışmanın amacı, önceden sodyum hidroksit çözeltisine batırılmış filtre kağıdı kullanılarak farelerde kontrollü bir kornea alkali yanık modelini tanımlamaktır. Bu model, anjiyojenik faktörleri, anti-anjiyojenik terapötik reaktifleri ve inflamasyonu ve fibrozu modüle edebilen diğer faktörleri ve reaktifleri incelemek için kullanılabilir.
Protokol
Deneysel prosedürler ve ötenazi de dahil olmak üzere tüm hayvan çalışmaları, Baylor Tıp Fakültesi'ndeki Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından AN-8790 Protokol Numarası ile onaylandı.
1. 1 N NaOH hazırlanması
- 15 mL'lik bir santrifüj tüpüne 4 mL steril deiyonize su ekleyin. 400 mg sodyum hidroksit (NaOH) tartın ve tüpe dikkatlice ekleyin.
- Çözeltiyi bir cam çubuk kullanarak yavaşça karıştırarak NaOH'yi çözün. Tüpe steril deiyonize su ekleyerek hacmi 10 mL'ye çıkarın ve tüpü hafifçe yukarı ve aşağı çevirerek tekrar karıştırın. Kapağı sıkıca kapatın ve çözeltiyi oda sıcaklığında saklayın.
- Taze çözeltiyi her ay hazırlayın, çünkü NaOH çözeltisinin konsantrasyonu, havadaki karbondioksiti emen çözelti tarafından azaltılabilir.
- Kullanmadan önce daima NaOH çözeltisini hafifçe karıştırın.
DİKKAT: Çözeltiyi kimyasal bir başlık içinde hazırlayın ve uygun kişisel koruyucu ekipman (KKD) kullanın.
2.% 4 paraformaldehit (PFA) çözeltisinin hazırlanması
- Bir cam behere 30 mL 1x fosfat tamponlu salin (PBS) ekleyin. 4 g paraformaldehit (PFA) tartın ve behere ekleyin.
- Beheri karıştırarak 60 °C'de sıcak bir tabakta tutun. Çözelti temizlenene kadar pH'ı yükseltmek için 1 N NaOH çözeltisini damla damla ekleyin.
- 1 N hidroklorik asit (HCl) kullanarak pH'ı kontrol edin ve 7,4'e ayarlayın. Son hacmi 1x PBS ile 50 mL'ye ayarlayın.
- Çözeltiyi soğutun ve süzün. Çözeltiyi 4 °C'de saklayın.
DİKKAT: Uygun KKD giyerken çözeltiyi çeker ocakta hazırlayın.
3. Ketamin / ksilazin kokteylinin hazırlanması
- 9.4 mL saline 0.8 mL ketamin (stok konsantrasyonu: 100 mg/mL) ve 0.16 mL ksilazin (stok konsantrasyonu: 100 mg/mL) ekleyerek ketamin/ksilazin kokteylini hazırlayın.
- Kokteyli steril enjeksiyon şişelerinde oda sıcaklığında (RT) saklayın.
4. Fare korneasında alkali yanığı
- Ağrının giderilmesi için işlemden 30 dakika önce deri altına meloksikam (4-6 mg / kg vücut ağırlığı) enjekte edin. Fareleri (C57BL / 6J, 6-8 haftalık, erkek) ketamin / ksilazin kokteylinin (Ketamin 80 mg / kg ve Xylazine 16 mg / kg vücut ağırlığı) bir ip enjeksiyonu kullanarak uyuşturun.
- Farenin ayak parmaklarını sıkıştırarak refleks tepkisini (pedal çekme) kontrol edin ve refleksin olmadığını onaylayın. Bir gözün kornea yüzeyine bir damla topikal anestezik,% 0.5 proparakain ve diğer göze bir damla suni gözyaşı uygulayın.
- 2 mm'lik bir biyopsi zımbası kullanarak Whatman filtre kağıdı disklerini delin.
- Temiz bir Petri kabına 2 μL 1N NaOH ekleyin. 2 mm'lik filtre kağıdı diskini 1 N NaOH damlasının üzerine koyun ve 15 saniye bekletin.
- Filtre kağıdını forseps ile alın ve filtre kağıdını korneanın ortasındaki proparakain ile tedavi edilmiş göze 30 saniye boyunca uygulayın.
NOT: Filtre kağıdı sadece korneanın ortasına temas etmelidir ve filtre kağıdının hareket ettirilmesi bitişik dokularda yanıklara neden olabileceğinden, yerleştirildikten sonra filtre kağıdının hareket etmemesine özen gösterilmelidir. - Steril bir şırıngada 20 mL steril salin solüsyonu ile yıkayarak gözü yıkayın.
NOT: Korneaya veya çevresindeki dokuya daha fazla zarar vermemek için korneanın konjonktival kese ile birlikte iyice yıkanmasına özen gösterilmelidir. Konjonktival kesenin yıkanması semblefaronu daha da önleyecektir. - Tek kullanımlık yumuşak mendiller kullanarak fazla tuzlu suyu gözlerden ve çevresinden nazikçe silin. Daha sonra, fareleri ambulatuvar olana kadar ılık bir ısıtma yastığı üzerinde bir kurtarma kafesinde tutun.
NOT: Fareler, alkali yanığından sonra 3 gün boyunca günlük olarak izlenir. Ağrı veya stres belirtileri görülürse, meloksikam (4-6 mg / kg vücut ağırlığı) deri altına uygulanır.
5. Neovaskülarizasyon ve opaklığın incelenmesi ve değerlendirilmesi
- Anestezi uygulanmış farelerde, yanıktan sonraki 10. günde gözleri diseksiyon mikroskobu altında inceleyin ve opaklığı ve neovaskülarizasyonu puanlamak için diseksiyon kapsamına bağlı bir kamera kullanarak görüntüler elde edin.
NOT: Kamera takılıyken normal bir diseksiyon kapsamı yeterlidir. - Korneayı diseksiyon mikroskobu ile gözlemlerken, yanıktan sonraki opaklığı aşağıdaki ölçek12'ye göre puanlayın:
0 = Opaklık yok; korneayı temizle
1 = Hafif opaklık; iris ve öğrenci bölgelerinde hafif bulanıklık; iris ve göz bebeği kolayca görülebilir
2 = Orta derecede opaklık; iris ve göz bebeği zar zor görülebilir
3 = Şiddetli opaklık; iris veya göz bebeği görünmüyor
4 = Opak kornea; iris ve göz bebeği görünmüyor - Korneayı diseksiyon mikroskobu ile gözlemlerken, CoNV'yi aşağıdaki ölçek12'ye göre puanlayın:
0 = Neovaskülarizasyon yok; Limbus'tan yeni damar yok
1 = Hafif neovaskülarizasyon; Limbustan kaynaklanan yeni damarlar
2 = Orta derecede neovaskülarizasyon; Kan damarları limbustan kaynaklanır ve korneanın merkezine doğru büyür
3 = Şiddetli neovaskülarizasyon; Limbustan kaynaklanan ve korneanın merkezine ulaşan ve/veya geçen kan damarları - Alkali yanığı ve sağlıklı göz grupları arasındaki opaklık ve neovaskülarizasyon skorlarını istatistiksel olarak karşılaştırmak için bir Öğrenci t-testi kullanın.
- Fareleri 10. günde, solunum durduktan 1 dakika sonrasına kadar% 5'te izofluran maruziyeti ile ötenazi yapın, ardından servikal çıkık yapın ve düz montajlı görüntüleme için korneaları toplayın.
6. Optik koherens tomografi (OCT) görüntüleme
- Yanıktan sonraki 10. günde anestezi uygulanmış farelerde gözlerin ön segmentinin OCT görüntülerini alın. 30° görüş alanı ve %100 IR yoğunluğu ile IR + OCT modunu kullanarak OCT görüntü alımını hacim taraması olarak gerçekleştirin.
- ImageJ yazılımını kullanarak korneaların kalınlığını ölçün.
- Kalınlığı ölçmek için, merkezi korneadaki ön ve arka yüzeyler arasında düz bir çizgi oluşturmak için ImageJ yazılımındaki Çizgi Seçimi aracını kullanın.
- Değerleri veri penceresine aktarmak için yazılım araçlarında Analiz Et > Ölç'e tıklayın.
- Değerleri bir elektronik tablo dosyasına kopyalayın ve bir Öğrenci t-testi kullanarak alkali yanığı ve sağlıklı göz grupları arasındaki kornea kalınlığını istatistiksel olarak karşılaştırın.
NOT: Korneanın kalınlığı, kornea ön yüzeyindeki bir noktadan kornea merkezindeki arka kornea yüzeyine en yakın noktaya olan mesafedir.
7. Düz monteli kornealarda CoNV için immün boyama
- Alkali yanığından sonraki 10. günde farelere ötenazi yapın ve künt diseksiyonla gözleri enüklee edin.
- Başparmak ve işaret parmaklarını kullanarak göz kapaklarını ayırın ve forsepsleri göz küresinin altına yerleştirin. Forsepsleri kapatın ve göz küresini yavaşça yörüngeden çekin.
- Gözbebeklerini 1x PBS'ye yerleştirin. Her göz küresi için, önce limbus bölgesinin altında 30 G'lık bir iğne kullanarak bir kesi yaparak korneayı göz küresinden çıkarın.
- Kesi başlangıç noktası olacak şekilde kornea mikro makası kullanarak limbus bölgesini kesin ve kornea ile limbusu küreden yavaşça ayırın.
- İrisi çıkarmak için ince bir boya fırçası kullanarak korneaları nazikçe temizleyin. Korneaları 1 saat boyunca% 4 paraformaldehit içinde sabitleyin.
- Korneaları oda sıcaklığında (RT) 1x PBS'de her biri 20 dakika boyunca üç kez yıkayın.
- RT'de 1 saat boyunca bir bloke edici tamponda (% 0.1 Triton-X 100 ve% 5 sığır serum albümini [BSA] ile desteklenmiş 1x PBS) inkübe edin.
- Korneaları primer antikorlar içeren bir antikor çözeltisine aktarın. Antikor solüsyonunu %1 BSA, %0.1 Triton-X 100, Dylight550-konjuge anti-CD31 mAb (1:100) ve Alexa Fluor488-konjuge anti-LYVE-1 mAb (1:100) ile takviye edilmiş 1x PBS'de hazırlayın.
- 4 °C'de 3 gün inkübe edin. Korneaları 1x PBS'de her biri 20 dakika boyunca üç kez yıkayın.
- Karanlıkta 5 dakika boyunca Hoechst boyama solüsyonu (1:1.000) kullanarak çekirdekleri boyayın.
- Korneaları radyal kesimlerle düzleştirin ve montaj ortamı ve lameller kullanarak önceden temizlenmiş bir cam kızak üzerine monte edin. Lamelleri şeffaf oje ile kapatın ve konfokal mikroskopi ile analiz edilmeden önce slaytları gece boyunca karanlıkta kurutun.
- Düz monte edilmiş korneaları, tek tek Z-yığını görüntülerini dikerek konfokal mikroskopi kullanarak görüntüleyin; Rezonanssız galvano tarayıcılarda 10x objektif, 488 nm ve 561 nm lazerler ve dilim başına 512 piksel x 512 piksel çözünürlük kullanın.
- ImageJ yazılımını kullanarak CD31+ kan ve LYVE-1+ lenf damarlarının yoğunluğunu ölçün.
- Vasküler yoğunluğu belirlemek için konfokal görüntüleri 8 bitlik bir görüntüye dönüştürün.
- Eklentilerden Vasküler Yoğunluk'u seçin.
- Görüntüde ilgilendiğiniz bölgeyi seçin ve Tamam'a tıklayın. Ölçümler yeni bir veri penceresinde açılacaktır.
- Değerleri bir elektronik tablo dosyasına kopyalayın ve bir Öğrenci t-testi kullanarak alkali yanığı ile sağlıklı göz grupları arasındaki vasküler yoğunluğu istatistiksel olarak karşılaştırın.
NOT: Trombosit endotel hücre adezyon molekülü-1 (PECAM-1) olarak da adlandırılan CD31, anjiyogenezde yer alan bir hücre adezyon molekülüdür ve erken ve olgun kan damarlarının endotel hücrelerinde yüksek oranda eksprese edilir13. LYVE-1 (lenfatik damar endotelyal hyaluronan reseptörü-1), lenfatik endotel hücreleri üzerinde bir hücre yüzeyi belirtecidir ve bir lenfanjiyogenez belirteciolarak kullanılabilir 14.
Sonuçlar
Bu çalışma, alkali yanığı ile fare gözünde kornea anjiyogenezini indüklemek için bir yöntemi açıklamaktadır. Diseksiyon mikroskobu ile elde edilen görüntülerde (Şekil 1A,B) alkali yanık grubunda kornealarda neovaskülarizasyon ve opaklık skorlarında anlamlı artış görüldü (P < 0.05; Şekil 1C,D). 10. günde toplanan kornealar, sırasıyla kan damarları için anti-CD31 mAb ve lenf damarları için anti-LYVE-1 mAb ile immün boyandı (Şekil 2A-I). Alkali yanık grubu, 10 gün sonra önemli ölçüde daha yüksek kan ve lenf damarı yoğunlukları gösterdi (sırasıyla P < 0.001 ve P < 0.05; Şekil 2J,K). OKT kullanılarak görüntülenen ve ölçülen kornea kalınlığı (Şekil 3A,B), alkali yanığı olan grupta anlamlı olarak daha yüksek gözlendi (P < 0.01; Şekil 3C).
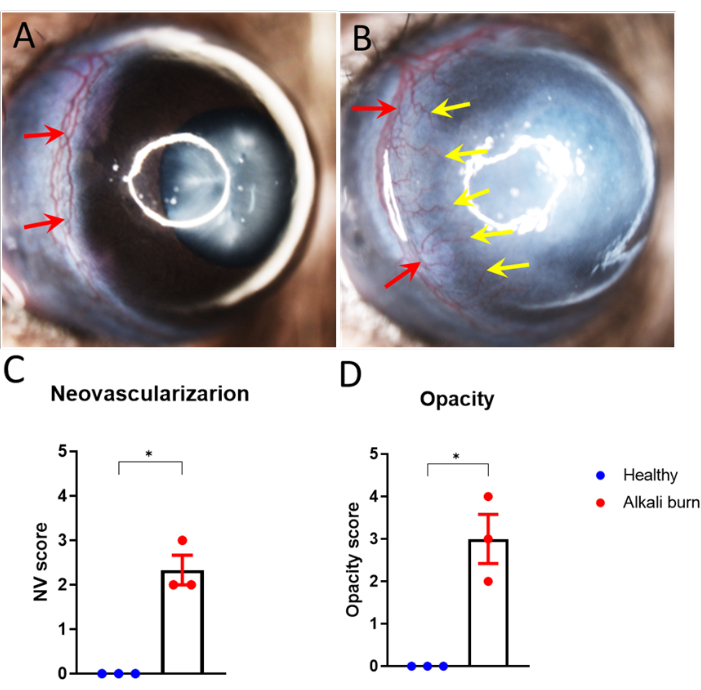
Şekil 1: Alkali yanığına bağlı kornea neovaskülarizasyonu ve opaklık. (A,B) Kornea neovaskülarizasyonu, yaralanmadan 10 gün sonra (B) alkali yanıklı fare gözünde (A) limbus damarlarından kornea merkezine doğru filizlendi, ancak sağlıklı bir göz değil. (C,D) A ve B panellerinde (C) kornea neovaskülarizasyonu ve (D) opaklığının ölçülmesi (± SEM; t-testi; *P < 0.05; n = 3 göz, 1 göz/fare). Kırmızı oklar limbusu, sarı ok ise filizlenen yeni damarları gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
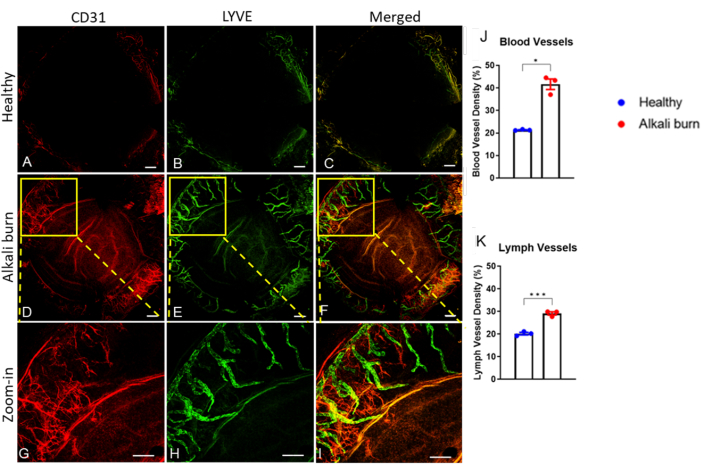
Şekil 2: Alkali yanığının neden olduğu kornea neovaskülarizasyonu ve lenfanjiyogenez. İmmünohistokimyada anti-CD31 ve anti-LYVE-1 mAbs kullanılarak sırasıyla (A,D,G) kan ve (B,E,H) lenf damarları saptandı. (A-C) Sağlıklı fare korneası. (D-I) Yaralanmadan 10 gün sonra alkali yanmış kornea. (C,F,I) CD31 ve LYVE-1 sinyallerinin üst üste bindirilmiş görüntüleri. (G-I) D-F panelleri için yakınlaştırılmış görüntüler. Ölçek çubukları = (AF) 200 μm ve (G-I) 500 μm. (J,K) Belirtildiği gibi AF panellerinde kan ve lenf damarı yoğunluğunun ölçülmesi (± SEM; t-testi; *P < 0.05; ***P < 0.001; n = 3 göz, 1 göz/fare). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
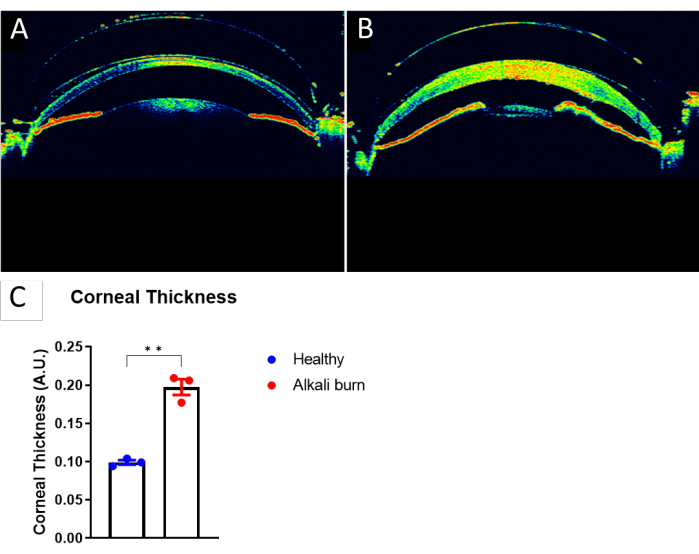
Şekil 3: Alkali yanığının neden olduğu kornea kalınlığındaki artış . (A) Sağlıklı bir fare gözünün OCT görüntüsü. (B) Alkali yanığından 10 gün sonra fare korneasının OCT görüntüsü. (C) Korneanın merkezinde ölçüldüğü şekliyle A ve B panellerinde kornea kalınlığının ölçülmesi (± SEM; t-testi; **P < 0.01; n = 3 göz, 1 göz/fare). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Kornea, anjiyogenez ve inflamasyonu incelemek için mükemmel bir dokudur, çünkü erişilebilir ve avaskülerdir, bu da neovaskülarizasyonun kolayca tespit edilebileceği ve belgelenebileceği anlamına gelir. Tavşanlarda, sıçanlarda ve farelerde kornea yanığı, kornea anjiyogenezini, inflamasyonu ve opaklığı, ülserasyonu, korneanın delinmesini ve fibrozu incelemek için kullanılmıştır15,16,17. Ayrıca, kornea yanığının fare modeli, anjiyogenez ve iltihaplanma için çeşitli terapötik stratejileri test etmek için değerlidir, çünkü fareler insanlarınkiyle yakından ilişkili bir bağışıklık sistemine sahiptir18. Fare genomunu genetik olarak manipüle etmek için tekniklerin mevcudiyeti de türü bu tür bir çalışma için mükemmel bir seçim haline getirmektedir19. Bu araştırmadaki zorluk, tutarlı, tekrarlanabilir patofizyoloji sağlayan bir kornea yanığı yöntemi geliştirmek olmuştur.
Alkali yanık modeli, anjiyogenez, inflamasyon ve fibrozu modüle eden ilaçların farmakolojik taraması için özellikle yararlıdır. Reaktifler ve kaynaklar için minimum gereksinimler, alkali yakma işleminin gerçekleştirilmesinin basitliği ve protokolün kısa süresinin faydaları ve sonuçların doğrudan gözlemlenmesi, fare korneasında alkali yanığını farmakolojik ilaç taraması için birincil seçenek haline getirir. Bununla birlikte, tutarlılığı ve tekrarlanabilirliği sağlamak için bu prosedürü gerçekleştirirken birkaç önlem dikkate alınmalıdır. İlk olarak, gözün diğer bölgelerini, özellikle limbus, göz kapaklarını ve konjonktivayı yakmamak için filtre kağıdı korneanın ortasına yerleştirilmelidir; ikinci olarak, NaOH'nin hacmi ve konsantrasyonu, korneadaki alkali yanığından tutarlı sonuçlar elde etmek için uygun olmalıdır. Filtre ıslak damlamamalı, NaOH çözeltisine batırılmış olmalıdır. Filtre boyutu ve filtre tipi ile bu yöntemde kullanılan çözeltinin normalliği ve hacmi, NaOH taşmasını önlemek için optimize edilmiştir. Farklı boyutta bir filtre kağıdı veya daha yüksek veya daha düşük hacimde NaOH kullanılması neovaskülarizasyonda tutarsızlıklara neden olur. Üçüncü olarak, kullanımdan sonra çözeltinin tüp kapağını hemen sıkarak ve hava/çözelti oranını düşürerek NaOH çözeltisinin oda havasındakiCO2'yi emmesini önlemek önemlidir. Neovaskülarizasyonda tutarsızlıkları önlemek ve kornea ülserasyonunu önlemek için taze alkali solüsyonların kullanılmasına özen gösterilmelidir. Son olarak, kornea ve gözün çevresindeki dokulara daha fazla zarar gelmesini önlemek için tüm NaOH solüsyonunun gözden ve konjonktivadan salinle kapsamlı bir şekilde yıkanması gerekir. Korneanın ve komşu dokuların iyice yıkanması da semblefaronu önleyecektir.
Burada tarif edilen protokol, kornea anjiyogenezinin patofizyolojisini incelemek için etkili ve güvenilir bir yöntemdir. Bu protokol ayrıca kornea iltihabı, fibroz ve yara iyileşmesini incelemek için de kullanılabilir.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmezler.
Teşekkürler
Bu çalışma, SRB Charitable Corporation, Ulusal Sağlık Enstitüleri (NIH) P30EY002520 ve Körlüğü Önleme Araştırmaları'ndan (RPB) Baylor Tıp Fakültesi Oftalmoloji Bölümü'ne sınırsız bir kurumsal hibe tarafından desteklenmiştir. W.L., Tapınak Şövalyeleri Göz Vakfı Oftalmoloji Vakfı tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride Injection | Hospira | KL-7302 | |
| 30 G Needle | McKesson | 16-N3005 | |
| A1R Confocal | Nikon Instruments | ||
| Anti-CD31 | Novus Biologicals | NB100-1642R | |
| Anti-LYVE-1 | Life technologies | 53-0443-82 | |
| ASM Module | Heidelberg Engineering | Anterior segment objective | |
| Biopsy Punch | McKesson | 16-1309 | |
| BSA | Thermoscientific | 9048-46-8 | |
| Coverslip | VWR International | 22X22-1-601640G | |
| Dissection Microscope | AmScope | SM-4TZ-30WY-10M3 | |
| Fluoromount-G | Electron Microscopy Sciences | 17984-25 | |
| Forceps | Fine Science Tools | 15000-02 | |
| Forceps | Fine Science Tools | 11049-10 | |
| Forceps | Fisherbrand | 12-000-157 | |
| Forceps | Roboz | RS-4905 | |
| Gonak Hypromellose | Akorn | 17478006412 | |
| GraphPad Prism 9 | GraphPad Sotware, Inc | ||
| Heating pad | K&H Pet Products | 100213018 | |
| Hoescht | Life Technologies | 62249 | |
| HRA + OCT Spectralis | Heidelberg Engineering | ||
| Insulin Syringe | Mckesson | 102-SN310C31516P | |
| Kimwipe | Kimberly Clark Professional | 34155 | |
| Micro Cover Glass | VWR | 48366-067 | |
| Microscissors | Roboz | RS-5110 | |
| Microscopic Slide | Fisherbrand | 12-550-15 | |
| NaOH | Sigma Aldrich | 55881-500G | |
| Neomycin and Polymyxin B Sulfates and Dexamethasone | Bausch & Lomb | 24208-0795-35 | |
| Normal Serum | Jackson Immuno | 008-000-121 | |
| Paraformaldehyde | Sigma Aldrich | 158127-500G | |
| PBS | Gibco | 20012-027 | |
| Proparacaine HCl | Bausch & Lomb | 24208073006 | |
| Saline | Henry Schein | 1531042 | |
| SMZ125 | Nikon Instruments | ||
| Syringe 10 mL | McKesson | 16-S10C | |
| Triton X-100 | Sigma Aldrich | TX1568-1 | |
| Whatmann Filter Paper | Cytiva | WHA1003323 |
Referanslar
- Ellenberg, D., et al. Novel aspects of corneal angiogenic and lymphangiogenic privilege. Progress in Retinal and Eye Research. 29 (3), 208-248 (2010).
- Azar, D. T. Corneal angiogenic privilege: Angiogenic and antiangiogenic factors in corneal avascularity, vasculogenesis, and wound healing (an American Ophthalmological Society thesis). Transactions of the American Ophthalmological Society. 104, 264-302 (2006).
- Rolfsen, M. L., et al. Corneal neovascularization: A review of the molecular biology and current therapies. Expert Review of Ophthalmology. 8 (2), 167-189 (2013).
- Skobe, M., Dana, R. Blocking the path of lymphatic vessels. Nature Medicine. 15 (9), 993-994 (2009).
- Lee, P., Wang, C. C., Adamis, A. P. Ocular neovascularization: An epidemiologic review. Survey of Ophthalmology. 43 (3), 245-269 (1998).
- Su, W., et al. Efficacious, safe, and stable inhibition of corneal neovascularization by AAV-vectored anti-VEGF therapeutics. Molecular Therapy - Methods & Clinical Development. 22, 107-121 (2021).
- Lasagni Vitar, R. M., et al. Epidemiology of corneal neovascularization and its impact on visual acuity and sensitivity: A 14-year retrospective study. Frontiers in Medicine. 8, 733538 (2021).
- Said, D. G., Dua, H. S. Chemical burns acid or alkali, what's the difference. Eye. 34, 1299-1300 (2020).
- Muthukkaruppan, V. R., Auerbach, R. Angiogenesis in the mouse cornea. Science. 2 (4413), 1416-1418 (1979).
- Kenyon, B. M., et al. A model of angiogenesis in the mouse cornea. Investigative Ophthalmology & Visual Science. 37 (8), 1625-1632 (1996).
- Cursiefen, C., Maruyama, K., Jackson, D. G., Streilein, J. W., Kruse, F. E. Time course of angiogenesis and lymphangiogenesis after brief corneal inflammation. Cornea. 25 (4), 443-447 (2006).
- Yoeruek, E., et al. penetration and efficacy of topically applied bevacizumab: Evaluation of eyedrops in corneal neovascularization after chemical burn. Acta Ophthalmologica. 86 (3), 322-328 (2008).
- DeLisser, H. M., et al. Involvement of endothelial PECAM-1/CD31 in angiogenesis. The American Journal of Pathology. 151 (3), 671-677 (1997).
- Johnson, L. A., Prevo, R., Clasper, S., Jackson, D. G. Inflammation-induced uptake and degradation of the lymphatic endothelial hyaluronan receptor LYVE-1. The Journal of Biological Chemistry. 282 (46), 33671-33680 (2007).
- Choi, H., et al. Comprehensive modeling of corneal alkali injury in the rat eye. Current Eye Research. 42 (10), 1348-1357 (2017).
- Chung, J. H., Fagerholm, P., Lindström, B. The behaviour of corneal epithelium following a standardized alkali wound. Acta Ophthalmologica. 65 (5), 529-537 (1987).
- Chang, J. H., Gabison, E. E., Kato, T., Azar, D. T. Corneal neovascularization. Current Opinion in Ophthalmology. 12 (4), 242-249 (2001).
- Alves da Costa, T., Lang, J., Torres, R. M., Pelanda, R. The development of human immune system mice and their use to study tolerance and autoimmunity. Journal of Translational Autoimmunity. 2, 100021 (2019).
- vander Weyden, L., White, J. K., Adams, D. J., Logan, D. W. The mouse genetics toolkit: Revealing function and mechanism. Genome Biology. 12 (6), 224 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır