Method Article
果肉をふるいにかけて畑で未熟なテフリチドショウジョウバエを検出する
要約
野外での未熟なテフリチドショウジョウバエの検出を増やすことは、これらの破壊的な害虫の個体数を排除するためのタイムリーな努力を引き起こす可能性があります。晩齢幼虫の検出は、宿主果実を袋に入れてマッシュアップし、果肉を一連のふるいに通す方が、手作業で切断して目視検査を行うよりも速く正確です。
要約
テフリチダエ科のショウジョウバエは、世界で最も破壊的で侵略的な農業害虫の一つです。多くの国は、初期の人口を排除するために高価な根絶プログラムを実施しています。根絶プログラムでは、繁殖個体群を強く示し、侵入の空間的範囲を確立するのに役立つため、幼虫を検出するために協調した努力が払われます。未熟なライフステージの検出は、害虫のさらなる拡大を封じ込め、防止するための追加の管理および規制措置を引き起こします。伝統的に、幼虫の検出は、個々の宿主の果実を切り取り、それらを視覚的に調べることによって達成されます。この方法は、限られた数の果物しか処理できず、幼虫を見逃す可能性が高いため、労働集約的です。i)宿主果実をビニール袋に入れてつぶす、ii)一連のふるいを通してパルプを濾す、iii)保持した果肉を黒糖水溶液に入れる、iv)表面に浮かぶ幼虫を集めることを組み合わせた抽出技術を試験した。この方法は、 アナストレファ・サスペンサが自然に蔓延している野外で収集されたグアバを使用してフロリダで評価されました。ショウジョウバエ根絶プログラムをより代表する低個体群を模倣するために、ハワイのマンゴーとパパイヤには、既知の少数の バクトロセラ背部幼虫 が蔓延していました。この方法の適用性は、 B. dorsalis が自然に蔓延するグアバの野外でテストされ、緊急ショウジョウバエプログラム中に労働者が経験した条件下で方法を評価しました。野外試験と実験室試験の両方で、果肉のマッシュアップとふるい分けは、果物を切るよりも効率的(必要な時間が短く)で、感度が高かった(より多くの幼虫が見つかりました)。パルプを黒糖水溶液に浮遊させることは、初期の幼虫を検出するのに役立ちました。重要なテフリチド宿主の果肉をマッシュアップしてふるいにかけると、緊急プログラム中に幼虫を検出する可能性が高くなる可能性があります。
概要
テフリットショウジョウバエは最も破壊的な農業害虫の1つであり、アナストレファ属、バクトロセラ属、およびセラチス属が最もリスクが高い1。1)歴史的な侵入とそれに関連する境界画定および根絶プログラム、2)入国港でのショウジョウバエ宿主材料の高い到着率、および3)繁殖個体群の確立に有利な気候条件に基づいて、多くの地域がエキゾチックなショウジョウバエの定着のリスクが高い。カリフォルニア州では、毎年複数のテフリチドの侵入と検出が発生しています2。前世紀にわたって世界中でテフリチドに対する200以上の侵入と根絶プログラムがあり、これはここ数十年で大幅に加速しています3。これらのプログラムの大部分は、侵入するショウジョウバエを根絶することに成功していますが3,4、これらの侵入の経済的および環境的負担は依然として高く、確立の可能性は常に存在します。最近の壊滅的な例は、アフリカ大陸5でのバクトセラ背部の感染です。
緊急ショウジョウバエプログラムでは、侵入種の繁殖個体群を検出して制御するために協調的な努力が払われます。たとえば、フロリダ州は、(実を結ぶ宿主植物の滴下)土壌ドレンチを適用し、交尾した雌および/または幼虫が見られる場所の半径200 mの宿主果実を除去することによって、テフリチドの侵入に対応します6。これらの行動と戦術は、土壌中の幼虫と蛹を殺し、その地域内の果物から卵と幼虫を取り除くのに役立ちます。いくつかの根絶プログラムでは、かなりの量の宿主果実が除去されます。2015年には、フロリダ6でのB.背筋根絶プログラム中に100,000kg以上の果物が破壊されました。隔離地域だけでも、生産者と関連産業への経済的損失は1,070万ドルを超えると推定されました7。
検疫エリアでテフリチドの幼虫を見つけるために、昆虫学者の小さなチームが、メスのハエの検出エリアの半径200 mで宿主の果実を収集し、幼虫6について各果物を切断して目視検査します。限られたスタッフリソースと数百の可能なホストでは、特に商業生産地域と住宅ヤードの両方で植物の多様性が高い地域では、タスクは困難になります。さらに、宿主の果実を切るときに幼虫が見逃されることがあります。入国地での果実の切断を評価した研究では、感染した果実を数週間保持し、蛹化基質に見られる幼虫と蛹を数える場合と比較して、果実を切ることはA.サスペンサの検出にそれほど効果的ではないことがわかりました8。
蔓延を検出するための果物の切断に代わるものがあります9,10,11,12,13。例えば、ブラウンシュガーの浮遊と温水法はどちらも、収穫されたサクランボ9,10で西洋のサクランボバエを検出するために使用される受け入れられた手順です。黒糖法は、砕いた果実を砂糖水溶液に入れ、上に浮かぶ幼虫を集めることです。ブラウンシュガーフローテーション法は、ショウジョウバエの害虫を検疫するためにパッキングハウスを必要とする輸出サクランボの規制規則を満たすために特別に開発されました。植物衛生をサポートするための黒糖水浮遊、塩水浮遊、または沸騰を含む承認された米国-カナダブルーベリー認証プログラムもあります14。砂糖とお湯の浮遊の精度をテストするとき、研究者はふるい分け法を使用して、何匹の幼虫が見逃されているかを判断しました9,10,11,12,13。ある研究では、砕いたブルーベリーを塩溶液に混ぜ、再利用可能なコーヒーフィルターで溶液をろ過すると、塩と砂糖の溶液の表面を視覚的に検査するよりもショウジョウバエの鈴木幼虫の検出に4倍優れていることが示されました14。さらに、ガスクロマトグラフィーは、カンキツ15中のA.サスペンサ幼虫の検出に使用された。これらのアプローチは、現地調査での適用性についてテストされていません。
私たちの目標は、ふるい分けと砂糖水浮遊を使用して野外でテフリチド幼生を見つける方法を開発し、テストすることでした。この方法は、従来のフルーツカット方法よりも未熟なショウジョウバエの検出を可能にし、ショウジョウバエ根絶プログラム中の繁殖個体群のタイムリーな制御をサポートします。
プロトコル
1.フルーツセレクション
- 調査する地域で利用可能な果物を決定します。
- 標的テフリチド種の既知の宿主のリストに基づいて宿主果実を選択する。
- マンゴー、パパイヤ、グアバなどの柔らかい果肉の熟した果実を選びましょう。トロピカルアーモンドなどの熟していない果物や硬い果肉の果物は、果物の切断などの別の方法で検査する必要があります。
- 損傷の兆候、産卵痕、およびソフトスポットがある木の落ちた、熟しすぎた果物、または熟した果物を選択します。
- 一度に約2Lの果物を処理します(たとえば、5つのグアバまたは5つの中型のマンゴーがこの方法の適切なサンプルを構成します)。一度に処理できる果物の数は、果物のサイズによって異なります(図1A)。
2.マッシュ
- 果物を大きく切り、4Lのジップロック収納バッグに入れます(図1B)。
- 水が刻んだ果物を25〜50 mm覆うまで、袋に水を加えます(図1C)。
- すべての果肉が皮から外れ、滑らかな粘稠度(つまり、大きな塊がない)になるまで、果物を手でそっと絞ります(図1D)。
3.後期の収集のためのふるい分け
- ふるいを積み重ねます。大量の果物(~一度に5つの果物)を処理するには大きなふるい(直径457 mm)を使用し、個々の果物または小さなサンプル(<5つの果物)には小さなふるい(直径305 mm)を使用します。
- 小さなメッシュ(No.20;0.85 mm)のふるいの上に大きなメッシュ(No.8;2.36 mm)のふるいでふるいを重ねます。初期の齢を検出するために、スタックの下部に3番目のふるい(No.45;0.35 mm)を置きます(図1E)。
- パルプを上部のふるいに注ぎます(図1F)。
- 細かいパルプがふるいを通過するまで、蛇口、ホース、またはボトルからの水を使用して、ふるいの積み重ねを通してパルプを完全に洗浄します(図1G)。
- 上部のふるいを視覚的にスキャンして、皮または大きな果物片で保持されている可能性のある晩齢幼虫を探します(図1H)。
- 後期幼虫について2番目のふるいを注意深く調べます。細かいパルプが多い場合は、追加のすすぎが必要になる場合があります。
- 幼虫の鉗子でふるいから幼虫を集め、70%EtOHを含むバイアルに入れます。
4.初期のインスターコレクションのための砂糖の浮遊
- 453 g(1箱)のダークブラウンシュガーを2 Lの水道水に溶かして砂糖溶液を事前に混合すると、Brixの読み取り値は19°10になります。
- 細かいメッシュのふるい(例:No.20およびNo.45)からふるいの端までパルプを水道水で洗い、材料をプラスチック製の皿(11 L)に移動します。
- パルプが25〜50 mm覆うまで黒糖溶液を加え、消泡剤を2滴加えます。パルプを黒糖溶液に約5分間置きます。
- 幼虫の鉗子で溶液の表面に浮遊する幼虫を70%EtOHを含むバイアルに集める。
5.幼虫のキュレーション
- 後で検査して識別できるように、収集場所、日付、果物の種類、コレクターをバイアルにラベル付けします。
結果
野外で収集された果物からの初期および後期 のアナストレファサスペンサ 抽出
この実験では、検出された幼虫の割合とそれらを検出するのに必要な平均時間に関して、果肉の切断とマッシュ、ふるい分け、および浮遊(MSF)法を比較しました。 アナストレファ・サスペンサの幼虫が大量に蔓延しているグアバは、フロリダ大学、食品農業科学研究所、熱帯研究教育センター、フロリダ州ホームステッドにある植物から収集されました。果実を無作為に5群に分類し,1)手切り法または2)MSF法の2つの幼虫抽出法のうちの1つに割り付けた。各抽出方法を用いて肉眼で見える全ての幼虫を採取する時間を記録した。
手切り法は、根絶プログラムで現在使用されている方法に従った。5人の労働者(n = 5)のそれぞれに5つの果物が割り当てられ、果物を細かく切り、果肉を視覚的に検査することにより、幼虫のすべての段階を検索しました。目視検査で幼虫が見逃されたかどうかを判断するために、手でカットされた果物片を解剖顕微鏡(10x)を使用して再検査しました。
MSF法では、5つの果物を大きな断片(50〜80 cm)にカットし、ジップロックバッグに入れ、すべての果肉が皮から剥がれ、果肉が滑らかな粘稠度になるまで(つまり、大きな塊がなくなるまで)手で軽く絞りました。マッシュアップされた果実は、一連の大きな(45.7 cm)真ちゅう製のふるいを通して濾されました。最大のメッシュ(8番)が上部に積み重ねられ、次に20番と45番のメッシュふるいが続きました。この処理に割り当てられたスタッフは、シンクの蛇口に接続されたホースからの水を使用して、メッシュを通してパルプを洗浄しました。晩齢幼虫はふるいに見えた。小さいインスターは果肉と混合されていたため、見たり取り出したりするのが困難でした。したがって、ふるいからのパルプ/幼虫混合物は、1Lの黒糖水溶液とともにバケツに入れられました。幼虫はすぐに水面に浮かんだ。溶液を穏やかに撹拌し、そして5分後、幼虫をバケツから取り出しそして計数した。果実を処理する時間は、マッシュアップ、ふるい分け、および砂糖水溶液からの幼虫の除去の組み合わせでした。手作業による切断法またはふるい分け法および浮遊法で見つかった幼虫の数に関するデータは、Kruskal-Wallisノンパラメトリック検定(p = 0.05)16を使用して分析されました。
MSF法は、手作業で切断するよりも多くの幼虫(図2A)と1分あたりの幼虫数(図2B)を多く生成しました。この研究では、異なる齢の検出は定量化されていませんが、すべての齢(1齢、2齢、3齢)がふるいを使用して見つかったのに対し、後の齢(2齢と3齢)のみが手作業で切断されたことがわかりました。以前に切断され目視検査されたサンプルを解剖顕微鏡スコープで再検査したところ、果実に寄生している晩齢幼虫の40%が見逃されました。しかし、以前の齢は主に再検査で発見されました。
この実験は、MSF法を使用することが、非常に感染している果物の幼虫を見つけるのにより効果的かつ効率的であることを示しました。ただし、幼虫の数が少ない果物は、侵入種が非常にまれな根絶プログラムで遭遇する可能性が高くなります。したがって、我々は、宿主果実に既知の、少数の幼虫が蔓延している実験室研究を実施した。
低 バクトセラ背 蔓延をシミュレートするためのマンゴーとパパイヤの手動蔓延
この実験では、検出された幼虫の割合と、蔓延が比較的少ない場合にそれらを検出するのに必要な時間に関して、果物の切断方法とMSF法を比較しました。手動侵入は、存在する幼虫の数が確実にわかっているため、各方法の有効性を評価するための実験ツールとして使用されました。
コルクボーラー(直径1.0 cm)を使用して、ショウジョウバエの幼虫のない個々のマンゴーとパパイヤの果実に5つの穴を開けました。1匹の2齢後半から3齢前半の B. dorsalis幼虫 を、果実のサブセットの5つの穴のそれぞれに配置しました。穴は果物から穴を開けた部分を使用してキャップされ、残りの果物は幼虫を挿入せずにキャップされ、手動の侵入を視覚的にシミュレートしました。果実を27°Cで48時間保持し,幼虫の発育を可能にした。実験は、ハワイ島ヒロのARS研究所(n = 5人の労働者)とハワイのオアフ島のAPHIS-PPQ研究所(n = 4人の労働者)で実施されました。
果物の切断のために、各労働者は5つのマンゴー(1匹は1匹の幼虫が蔓延し、4匹は蔓延していない)と4匹のパパイヤ(1匹は蔓延し、3頭は蔓延していない)を与えられました。労働者は各果物を個別に細かく切り、未熟なショウジョウバエがないか果肉を継続的に検査しました。パルプが徹底的に検査されたとき、検索は中止されました。見つかった幼虫の総数と、各労働者がすべての果物を切断して処理するために費やした時間を記録しました(図3)および(図4)。
各労働者は、マッシュまたはふるい分け(果物の切断を含まない)のために別の同様の果物のセット(5つのマンゴーと4つのパパイヤ)を受け取り、前述のように2個が蔓延しました。パルプを最上部の篩に注ぎ、蛇口からの水を使用して篩のスタックを通して洗浄し、プロトコルに記載されているように幼虫を除去した。実験は、浮遊ステップを取り除くことで感度を失うことなくプロセスの速度が向上するかどうかを決定するために、砂糖浮遊ありと砂糖浮遊なしの2回実施されました(つまり、すべてまたはほとんどの幼虫が見つかりました)(図3)。見つかった幼虫の数と、各労働者が切断、MSF、またはMS法で果物を処理するために費やした時間を記録しました。
マンゴーとパパイヤの両方で、完全なMSF法(浮遊を含む)は、幼虫の検出数が多く、果物の切断よりも速かった(表1)。伝統的な果物の切断方法を使用している労働者は、マンゴーとパパイヤに置かれた幼虫のそれぞれ32%と35%を逃しました(表1)。MSF技術を使用して果物をまとめて処理するには、個々のマンゴーをカットするよりも30%短い時間で済み、個々のパパイヤをカットするよりも35%短い時間が必要でした(図3)。MSF法では、パパイヤ(図3C)とマンゴー(図3D)を果実切断法と比較して、毎分より多くの幼虫が見つかりました。見つかったすべての幼虫は生きていました。
幼虫の形態学的同定は、後期の齢でのみ可能です。上記の実験を繰り返したが,浮遊手順を省略し,幼虫の回復率が高く,果実処理速度が速くなるかどうかを調べた。MS法(浮遊を省略)は、切断および目視検査と比較して、パパイヤ(図4A)およびマンゴー(図4B)の幼虫検出数が多くなりました。さらに、この技術は、パパイヤ(図4C)とマンゴー(図4D)をカットして目視検査するよりも高速でした。MSF法から浮遊ステップを取り除くと、晩齢幼虫を見つける時間がパパイヤで90%、マンゴーで48%短縮されました(表2)。見つかった幼虫の割合は両方の方法で高く、MSで一貫して高かった(浮遊は省略)。パパイヤについては、幼虫の80%および85%がそれぞれMSFおよびMS法から回収された(表1 および 表2)。マンゴーについては、それぞれ88%および95%がMSFおよびMS法から回収された(表1 および 表2)。
果樹法とMSF法の圃場比較
この実験の目的は、緊急ショウジョウバエプログラムを模倣して、野外条件下での果実切断法とMSF法を比較することでした。果実処理は、2つの幼虫抽出方法の圃場準備をテストするために、実験室の利便性とインフラストラクチャなしで実施されました。作業は、ヒロ近郊のUSDA-ARS熱帯植物遺伝資源および疾患研究ユニットGermplasmにあるグアバ果樹園で行われました。蔓延の兆候を示す合計40のグアバを収集し、2つのグループに分けました。合計20個のグアバを切断/目視検査した後、MSF(浮上を含む)を行い、MSF法と比較した切断方法の感度を評価することができました。解剖は上記のように進行した。検出されたとき、幼虫は取り除かれ、数えられました。4人の労働者がそれぞれ5グアバを解剖し、切断と検査に要した時間を各労働者について記録した。MSFの切断後を上記と同様に行ったが、8番篩と20番篩に加えて3番目の小目篩(No.40、0.420 mm)を使用して小さな幼虫を回収した。20個のグアバの2番目のセットを2つのジップロックバッグ(バッグあたり10個の果物)に入れ、MSFのみ(つまり、切断なし)にかけ、果物の切断に必要な時間とMSFを比較できました。上記のように、この手順では3つのふるいを使用した。見つかった幼虫の数と果物を処理する合計時間(果実を袋に入れて5分間マッシュアップ/ふるい分け/砂糖溶液に浮かべる)が記録されました。
実験室で見つかったように、果物の切断は果物の蔓延を過小評価し、非常に変動し、MSF法を使用して回収できるものよりも25%〜83%少ない幼虫を検出しました(表3)。さらに、幼虫の数が少ないサンプルでは、MSFは500%多くの幼虫を回収し、より高いアッセイ感度を提供し、寄生生物を特定する可能性が高くなりました。果物は、切断と比較してMSF法を使用してはるかに高速に処理されました。5個の果物をカットして検査するには、MSF で 10個の果物を処理するのとほぼ同じ時間が必要でした。

図1:ショウジョウバエ幼虫抽出プロトコルの手順。 (A)一度に約2容量Lの果物を処理します(たとえば、5つのグアバまたは5つの中型マンゴーがこの方法の適切なサンプルを構成します)。(B)果物を大きく切り、4Lのジップロック収納バッグに入れます。(C)刻んだ果物を25〜50 mm覆うまで袋に水を加えます。 (D)すべての果肉が皮から外れ、滑らかな粘稠度になるまで(つまり、大きな塊がなくなるまで)、果物を手でそっと絞ります。(E)大きなメッシュ(No.8;2.36 mm)のふるいを上に置き、続いて小さなメッシュ(No.20;0.85 mm)のふるいを重ねます。初期の齢の場合は、スタックの下部に3番目のふるい(No.45;0.35 mm)を置きます。(F)パルプを一番上のふるいに注ぎます。(G)細かいパルプが最初のふるいを通過するまで、蛇口、ホース、またはボトルからの水を使用して、ふるいの積み重ねを通してパルプを完全に洗浄します。(H)上部のふるいを視覚的にスキャンして、皮や大きな果物片と一緒に保持されている可能性のある晩年の幼虫を探します。 この図の拡大版を表示するには、ここをクリックしてください。
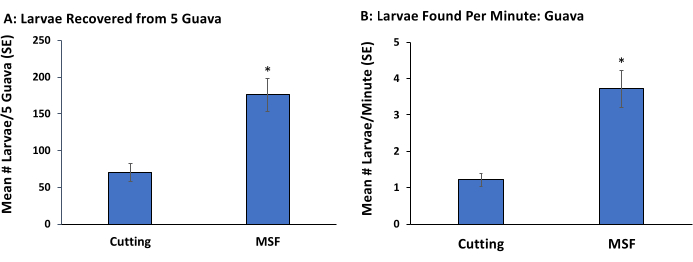
図2:野外で採集された果実からの初期および後期のアナストレファサスペンサ抽出。5つのグアバ果実から採取したアナストレファ・サスペンサ幼虫の平均数±(平均[SE]の標準誤差)を、切断して目視検査(切断:70.4±11.9)または果肉を一連の3つの篩で洗浄した後、果肉を糖水溶液に浸した(MSF:175.6±21.91)(A)。切断(1.21 ± 0.16)およびMSF(3.71 ± 0.50)によって処理された5グアバから毎分収集された幼虫の平均数(±SE)(B)。各方法は5回再現され、バーの上のアスタリスクは、クラスカル-ウォリス検定に基づく幼虫の数(χ2 = 6.81、p < 0.01)と処理時間(χ2 = 6.80、p < 0.01)の有意差を示します。この図の拡大版を表示するには、ここをクリックしてください。
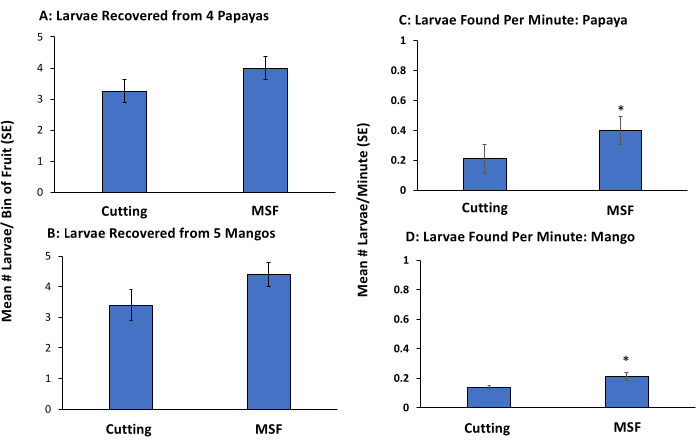
図3:マンゴーとパパイヤの手動蔓延を使用した完全なマッシュふるい浮上法の検証 バクトセラ背部への低蔓延をシミュレートします。パパイヤ(伐採:3.25 ± 0.51, MSF: 4.0 ± 0.4)(A)およびマンゴー(刈り取り:3.4 ± 0.51, MSF: 4.4 ± 0.4)の果実と1分間に採取された幼虫数(±SE)の平均数(±±C)およびマンゴー(切断:0.14 ± 0.01, MSF: 0.21 ± 0.03)(D)±).切断法またはMSF法(浮遊を含む、n = 5)を使用して処理された果実には、5匹の3齢幼虫が手作業で寄生しました。バーの上のアスタリスクは、クラスカル-ウォリス検定に基づく果物の切断と比較した場合、パパイヤ(χ2 = 5.39、p = 0.02)およびマンゴー(χ2 = 3.94、p = 0.05)で見つかった幼虫の数の有意差を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
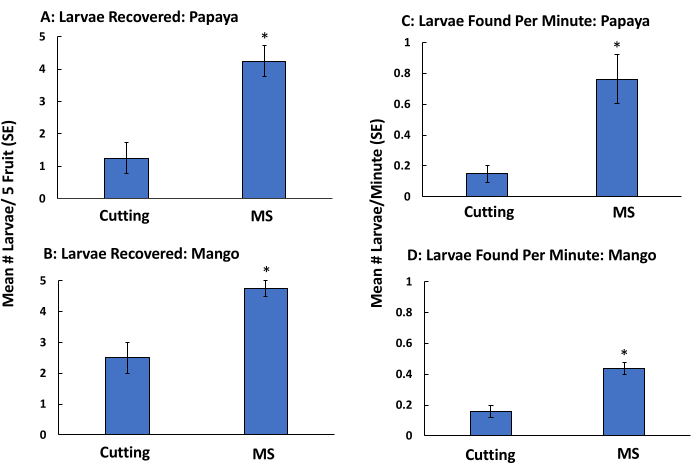
図4:マンゴーとパパイヤの手動蔓延を使用したマッシュふるい分け法(浮遊除去)の検証 バクトセラ背部への低蔓延をシミュレートします。 パパイヤ(切断:0.25 ± 0.48, MS: 4.25 ± 0.48)(A)とマンゴー(切断:2.5 ± 0.5, MS:4.75 ± 0.25)(B)の果実と1分間に採取された幼虫数(±SE)は、パパイヤ(切断:0.15 ± 0.05, MS: 0.76 ± 0.15)(C)とマンゴー(切断:0.16 ± 0.04, MS:0.44 ± 0.04)(D)の果実と1分間に平均収集された幼虫数(SE)です。±果実に手作業で5匹の3齢のBactrocera dorsalis幼虫を寄生させ、切断して目視検査(切断)して処理するか、袋に入れて篩で洗い流しました(ムッシングとふるい分けのみ、浮遊なし、n = 4)。バーの上のアスタリスクは、パパイヤ(χ2 = 5.46、p = 0.02)とマンゴー(χ2 = 5.25、p = 0.02)で見つかった幼虫の数と、パパイヤ(χ2 = 5.39、p = 0.02)とマンゴー(χ2 = 5.39、p =0.02)の処理時間について、クラスカル-ウォリス検定に基づいて、果物の切断と比較した有意差を示しています。この図の拡大版を表示するには、ここをクリックしてください。
| 果物 | # 加工フルーツ | #Larvae が追加されました | 処理方法 | #Larvae 見つかりました | 処理時間 (分)* | % 回収率 |
| マンゴー | 25 | 25 | 切断 | 17 | 158 | 68% |
| マンゴー | 25 | 25 | ティッカー | 22 | 113 | 88% |
| パパイヤ | 16 | 20 | 切断 | 13 | 62 | 65% |
| パパイヤ | 16 | 20 | ティッカー | 16 | 40 | 80% |
| *合計時間は5人以上の労働者を合計しました。 | ||||||
表1:切断および目視検査(切断)または完全マッシュ、ふるい分け、および浮遊(MSF)法による果実の回収数と処理時間。 試験果実には、退屈して蓋をした果実のみを混合した5匹の3齢幼虫(5つのマンゴーのうち1つ、4つのパパイヤのうち1つ)を手動で寄生させた。
| 果物 | # 加工フルーツ | #Larvae が追加されました | 処理方法 | #Larvae 見つかりました | 処理時間 (分)* | % 回収率 |
| マンゴー | 20 | 20 | 切断 | 10 | 66 | 50% |
| マンゴー | 20 | 20 | さん | 19 | 44 | 95% |
| パパイヤ | 16 | 20 | 切断 | 5 | 38 | 25% |
| パパイヤ | 16 | 20 | さん | 17 | 25 | 85% |
| *合計時間は4人以上の労働者を合計しました。 | ||||||
表2:回収された幼虫の数と、切断またはマッシュアンドふるい分けのみによって果実を処理する時間、浮遊は省略(MS)。 試験果実には、退屈して蓋をした果実のみを混合した5匹の3齢幼虫(マンゴーの5個に1個、パパイヤの4個に1個)を手動で寄生させた。
| 作業者/メソッド | 処理 #Fruit | 処理時間 (分) | #Larvae 切断が見つかりました | #Larvae MSF * を見つけました。 | 切断によって見つかった総数の幼虫の割合 |
| 作業者1:切断 | 5 | 18 | 33 | 14 | 70% |
| 作業者2:切断 | 5 | 18 | 1 | 5 | 17% |
| 作業者3:切断 | 5 | 26 | 9 | 11** | 75% |
| 作業者4:切断 | 5 | 20 | 24 | ||
| ワーカー 5: MSF | 10 | 22 | 該当なし | 22 | 該当なし |
| ワーカー 6: MSF | 10 | 18 | 該当なし | 37 | 該当なし |
| *切断および目視検査からのパルプをMSF法を使用して再度処理し、見逃された後期2〜3齢 幼虫の数を決定しました | |||||
| ** MSF法による加工前にプールされた労働者2および3の果実の果肉 | |||||
表3:果実を切断して目視検査(切断)するか、果実をマッシュアップ、ふるい分け、浮遊(MSF)することによって、野外で収集されたグアバで見つかった幼虫の数。
ディスカッション
私たちの目標は、野外でテフリットの幼虫を見つけるための効率的かつ効果的な方法を開発することでした。根絶プログラムを開始したり、検疫エリアを設定したりする動機は、繁殖個体群を示す交配した雌または幼虫6の検出です。果物を切断して視覚的に検索する現在の方法は、通常、個別に検査できるよりもはるかに多くの宿主果実が存在するため、幼虫を見つけるのに非効率的です。さらに、テフリチドの個体数は、新たな侵入の地域では少ない可能性が高く、大量の果物で幼虫を見つける可能性は非常に困難です。たとえば、フロリダでの2015年の バクトセラ背部 根絶プログラムでは、54の異なる宿主種が特定され、4,000を超える果物がカットされました。この根絶プログラムでは、マンゴーには数匹の幼虫しか見つからず、他の宿主が蔓延していることは見つかりませんでした6。その結果、MSF/MS法は、果肉(マンゴー、グアバ、パパイヤ)を大量に含む果実を大量に加工する場合、果実の切断と比較して、A. suspensa および B. dorsalisの 幼虫の検出において、より感度が高く、高速であることがわかりました。マッシュアンドふるい分け法を使用して検査できる宿主果実の量が多いほど、まれな幼虫の検出の増加と相まって、侵入が早期に発見される可能性が高くなる可能性があります。繁殖個体群の早期発見は、根絶の可能性を高め、プログラムのコストを削減する可能性があります。
私たちの実験は、果物を切って目視検査する労働者によって検出された幼虫の数がかなり異なることを示しました。果物を切る労働者は、マンゴーとパパイヤにそれぞれ置かれた B.dorsalis 幼虫の50%と75%を逃しました。対照的に、マンゴーとパパイヤの果実を処理するためにMS法を使用して見逃された幼虫は、それぞれ5%と15%だけでした。同様に、入国港での果物の切断を評価した研究では、検査官によって発見された感染した果物と幼虫の数にかなりのばらつきがあることが示されました8。この研究では、経験豊富な港湾検査官が、果物をカットして目視検査したときに、 A.サスペンサ 幼虫の64%〜99%、感染した果物の16%〜82%を見逃したことが示されました8。私たちの結果は、マッシュアンドふるい分け法が、労働者が感染した果物の検出を見逃す可能性を減らす可能性があることを示唆しています。
砂糖とお湯の浮遊は、サクランボとブルーベリーにショウジョウバエがいないことを保証するためのシステムアプローチ方法で受け入れられているプロトコルです14。貨物のサブセットが溶液に粉砕され、検査官が砂糖溶液の表面を卵と幼虫の存在について視覚的にスクリーニングします。個々の果物を切るよりも多くの果物を処理できますが、これらの技術を使用して幼虫を見つける確率は、検査官の能力、存在する幼虫の段階と数、および果物の種類によって影響を受けます8。我々は、他のテフリチドと同様に、B. dorsalisとA. suspensaが果肉から外れて表面に浮かぶことを見出しました。興味深いことに、形態学的に同定できるため、緊急および除菌プログラムの対象となるより大きな後期幼虫では、糖の浮遊を含めて、方法の精度が向上しないことが判明しました。実際、浮遊法を追加すると、パパイヤで90%、マンゴーで48%の処理時間が長くなりました。処理時間の増加と追加の材料(つまり、水、ビン、砂糖など)は、フィールドで大きな齢を検索するときにこのステップを追加することを運用上サポートしていません。砂糖の浮遊法は、入港地や梱包所など、初期の齢を含むすべての段階を検出することが目的である場合に適している可能性があります。細かいメッシュのふるいで砂糖溶液をろ過すると、卵と初期の幼虫の幼虫を最も正確に検出できる可能性があります11,12。
MSおよびMSF技術は、簡単にすりつぶされ、大量の果肉を含む果物に適しています。テフロイドの幼虫は果肉に穴を掘る傾向があり、視覚的な検出が困難になります。MSおよびMSF法の重要な側面は、幼虫を果肉から分離することです。ふるい分けプロセスはパルプを除去し、幼虫をふるいスクリーンにさらします。同様に、砂糖水法は、幼虫を浮かせることによって幼虫を果肉から分離し、果肉は鍋の底に沈む。MSまたはMSF法によってパルプから分離された幼虫は、ふるいスクリーンまたは水面上を移動するのを容易に観察される。マッシュ、ふるい分け、およびオプションで浮遊する方法は、重要な宿主果実のテフリチド幼虫の検出速度と精度を大幅に改善しましたが、このプロセスはすべての果物に適しているとは限りません。たとえば、グリーンアボカドなどの硬い果肉を含む宿主の果物や、トロピカルアーモンドなどの種子/ピットが大きく、果肉の量が比較的少ない果物は、手作業による切断や目視検査による処理が容易になる場合があります。
MS法とMSF法は、比較的少数の果物(5〜10個)を処理すると高速であることがわかりました。大量の果物が処理された場合、その差は大きくなる可能性があり、これは緊急ショウジョウバエプログラムに必要かつ典型的である可能性があります。浮遊ステップを取り除くと、大きなテフリチド幼生(>3 mm)を見つける精度を損なうことなく、検出速度がさらに向上しました。これらの手法を現場に持ち込むことができることを示し、緊急ショウジョウバエプログラム中に労働者が経験する状況をシミュレートしました。私たちの研究は、MS法が後期幼虫のタイムリーな検出とその後のテフリチド繁殖集団の根絶を可能にする可能性があることを示しています。MSFは、現在根絶プログラムの対象となっていない卵子や初期齢の検出に利用できる可能性がある。
開示事項
著者は、利益相反がないことを宣言します。
謝辞
フロリダ大学でグアバの処理を支援してくれたシルビア・デュラン、テリ・アレン、ホセ・アレグリア、アレハンドラ・キャノン、ハワイで人工的に蔓延している果物の評価に協力してくれたリック・クラシマ、ジャン・オースト、ブルース・イナフク、そして原稿の以前のバージョンについて有益なコメントをしてくれたマイケル・スタルバーグに感謝します。このプロジェクトは、USDA APHISとフロリダ大学協力協定によって部分的に資金提供され、USDA-ARS(プロジェクト2040-22430-027-00D)によって部分的に支援されました。この予備出版物の調査結果と結論は、USDAによって正式に配布されたものではなく、政府機関の決定または方針を表すと解釈されるべきではありません。この出版物での商号または商用製品の言及は、特定の情報を提供することのみを目的としており、USDAによる推奨または承認を意味するものではありません。USDAは機会均等の提供者および雇用者です。
資料
| Name | Company | Catalog Number | Comments |
| Anti foamer | MicroLubrol | ML200-50-4 | MicroLubrol 2000 Fluid Pure Silicone Oil, https://www.microlubrol.com |
| Brown Sugar | Dominos | 1 lb Box Dark Brown Sugar Crystals, https://www.dominosugar.com/products/dark-brown-sugar | |
| Cutting Boards | KitchenAid | KE703NOSMGA | KitchenAid Classic Nonslip Plastic Cutting Board, 12x18-Inch, https://www.amazon.com/KitchenAid-Classic-Nonslip-Plastic-11x14-Inch/dp/B09117L774/ref=sxin_24_ac_d_mf_brs?ac_md=2-1-S2l0Y2hlbkFpZA%3D%3D-ac_d_mf_brs_brs&content-id=amzn1.sym.1ad31f34-ba12-4dca-be4b-f62f7f5bb10d%3Aamzn1.sym.1ad31f34-ba12-4dca-be4b-f62f7f5bb10d&crid=UXMLNC72BL0 M&cv_ct_cx=cutting%2Bboards&keywords=cutting%2Bboards &pd_rd_i=B091118V8T&pd_rd_r= 4c48b4ad-4d4d-4b4b-8799-fc7313 2f8e34&pd_rd_w=li862&pd_rd_wg =KogbB&pf_rd_p=1ad31f34-ba12-4dca-be4b-f62f7f5bb10d&pf_rd_r=9ATJD6W QBF9DVRY889MP&qid=1673911 429&refresh=1&sprefix=cutting%2Bboards%2Caps%2C198&sr=1-2-8b2f235a-dddf-4202-bbb9-592393927392&th=1 |
| Dish Pans | Sterilite | 06578012 | White 12 qrt Dishpan, https://www.amazon.com/STERILITE-06578012-Sterilite-White-Dishpan/dp/B0039V2G5E/ref=sr_1_1?crid=2SMBMLFJF18U&keywords= white+12+qt+dishpan+sterilite&qid=1673911729&s=home -garden&sprefix=white+12+qr+dishpan+sterlite%2Cgarden%2C184&sr=1-1 |
| EthOH | Fisher Scientific | BP8202500 | Ethanol Solution 96%, Molecular Biology Grade, https://www.fishersci.com/shop/products/ethanol-solution-96-molecular-biology-grade-fisher-bioreagents/BP8202500 |
| Glass Vials | Fisher Scientific | 0333921H | Fisherbrand Class B Clear Glass Threaded Vials With Closures, https://www.fishersci.com/shop/products/class-b-clear-glass-threaded-vials-with-closures-packaged-separately/0333921H |
| Knives | Zyliss | 31380 | 5.25" Utility Knife, https://www.amazon.com/ZYLISS-Utility-Kitchen-5-5-Inch-Stainless/dp/B00421ATJK/ref=sr_1_7?crid=2U27KE1HTG5N1&keywords= fruit%2Bcutting%2Bknives&qid=1673911609&s= home-garden&sprefix=fruit%2Bcutting%2Bknives%2Cgarden%2C145&sr=1-7&th=1 |
| No. 20 Mesh sieves | Hogentogler & Co. Inc. | 4221 | U.S. Standard Testing Sieves, https://www.hogentogler.com/sieves/18-inch-sieves.asp |
| No. 45 Mesh sieves | Hogentogler & Co. Inc. | 4226 | U.S. Standard Testing Sieves, https://www.hogentogler.com/sieves/18-inch-sieves.asp |
| No. 8 Mesh sieves | Hogentogler & Co. Inc. | 4215 | U.S. Standard Testing Sieves, https://www.hogentogler.com/sieves/18-inch-sieves.asp |
| Soft Forceps | DR Instruments | DRENTF01 | DR Instruments Featherweight Entomology Forceps, https://www.amazon.com/DR-Instruments-DRENTF01-Featherweight-Entomology/dp/B008RBLO8Q |
| Zipper Lock Storage Bags | Ziploc | 682254 | Ziploc brand 2 gal Clear Freezer Bags, https://www.amazon.com/Ziploc-Freezer-Bag-Gallon-100/dp/B01NCDWR8A/ref=sr_1_1_sspa?crid=3SQFBT64Z76ES&keywords= ziploc+freezer+bags+2+gallon&qid=1674504602& |
参考文献
- White, I. M., Elson-Harris, M. M. . Fruit Files of Economic Significance: Their Identification and Bionomics. , (1992).
- Papadopoulos, N. T., Plant, R. E., Carey, J. R. From trickle to flood: the large-scale, cryptic invasion of California by tropical fruit flies. Proceedings of the Royal Society B: Biological Sciences. 280 (1768), 20131466 (2013).
- Suckling, D. M., et al. Eradication of tephritid fruit fly pest populations: outcomes and prospects. Pest Management Science. 72 (3), 456-465 (2016).
- Mcinnis, D. O., et al. Can polyphagous invasive tephritid pest populations escape detection for years under favorable climatic and host conditions. American Entomologist. 63 (2), 89-99 (2017).
- Mutamiswa, R., Nyamukondiwa, C., Chikowore, G., Chidawanyika, F. Overview of oriental fruit fly, Bactrocera dorsalis (Hendel) (Diptera: Tephritidae) in Africa: From invasion, bio-ecology to sustainable management. Crop Protection. 141, 105492 (2021).
- Steck, G., et al. Oriental fruit fly eradication in Florida 2015-2016: program implementation, unique aspects, and lessons learned. American Entomologist. 65 (2), 108-121 (2019).
- Alvarez, S., Evans, E., Hodges, A. W. Estimated costs and regional economic impacts of the oriental fruit fly (Bactrocera dorsalis) outbreak in Miami-Dade County, Florida. University of Florida Institute of Food and Agricultural Sciences Extension. , (2016).
- Gould, W. Probability of detecting Caribbean fruit fly (Diptera: Tephritidae) infestation by fruit dissection. Florida Entomologist. 73 (3), 502-507 (1995).
- Yee, W. L. Detection of Rhagoletis indifferens (Diptera: Tephritidae) larvae using brown sugar flotation and hot water methods. Journal of Applied Entomology. 136 (7), 549-560 (2012).
- Yee, W. L. Comparison of the brown sugar, hot water, and salt methods for detecting western cherry fruit fly (Diptera: Tephritidae) larvae in sweet cherry. Florida Entomologist. 97 (2), 422-430 (2014).
- Van Timmeren, S., Diepenbrock, L. M., Bertone, M. A., Burrack, H. J., Isaacs, R. A filter method for improved monitoring of Drosophila suzukii (Diptera: Drosophilidae) larvae in fruit. Journal of Integrated Pest Management. 8 (1), 23 (2017).
- Van Timmeren, S., Davis, A. R., Isaacs, R. Optimization of a larval sampling method for monitoring Drosophila suzukii (Diptera: Drosophilidae) in blueberries. Journal of Economic Entomology. 114 (4), 1690-1700 (2021).
- Balagawi, S., et al. Evaluation of brown sugar flotation for detecting Queensland and Mediterranean fruit fly (Diptera: Tephritidae) infestation in Australian cherries. Crop Protection. 151, 105823 (2022).
- CFIA (Canadian Food Inspection Agency). Directive D-02-04: The Blueberry Certification Program and domestic phytosanitary requirements to prevent the spread of blueberry maggot (Rhagoletis mendax) within Canada. 2 Revision 10. CFIA (Canadian Food Inspection Agency). , (2020).
- Kendra, P. E., et al. Gas chromatography for detection of citrus infestation by fruit fly larvae (Diptera: Tephritidae). Postharvest Biology and Technology. 59 (2), 143-149 (2011).
- SAS Institute Inc. SAS 9.4 Guide to Software Updates and Product Changes. SAS Institute Inc. , (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved