Method Article
Просеивание фруктовой мякоти для обнаружения незрелых плодовых мушек Tephritid в поле
В этой статье
Резюме
Увеличение обнаружения неполовозрелых плодовых мушек тефритид в полевых условиях может привести к своевременным усилиям по уничтожению популяций этих разрушительных вредителей. Обнаружение личинок позднего возраста происходит быстрее и точнее при измельчении плодов хозяина в пакете и пропускании мякоти через ряд сит, чем ручная резка и визуальный осмотр.
Аннотация
Плодовые мушки семейства Tephritidae являются одними из самых разрушительных и инвазивных сельскохозяйственных вредителей в мире. Многие страны проводят дорогостоящие программы искоренения для уничтожения зарождающихся групп населения. Во время программ искоренения предпринимаются согласованные усилия по обнаружению личинок, поскольку это убедительно указывает на размножающуюся популяцию и помогает установить пространственную степень заражения. Обнаружение незрелых стадий жизни инициирует дополнительные меры контроля и регулирования для сдерживания и предотвращения дальнейшего распространения вредителя. Традиционно обнаружение личинок осуществляется путем разрезания отдельных плодов-хозяев и их визуального осмотра. Этот способ является трудоемким, так как перерабатывать можно только ограниченное количество плодов, а вероятность пропустить личинку высока. Был протестирован метод экстракции, который сочетает в себе: i) измельчение плодов-хозяев в пластиковом пакете, ii) процеживание мякоти через ряд сит, iii) помещение оставшейся мякоти в водный раствор коричневого сахара и iv) сбор личинок, которые всплывают на поверхность. Метод был оценен во Флориде с гуавой, собранной в полевых условиях, естественно зараженной Anastrepha suspensa. Чтобы имитировать низкие популяции, более репрезентативные для программы уничтожения плодовых мух, манго и папайя на Гавайях были заражены известным небольшим количеством личинок Bactrocera dorsalis . Применимость метода была проверена в полевых условиях на гуаве, естественным образом зараженной B. dorsalis , для оценки метода в условиях, с которыми сталкивались рабочие во время экстренной программы плодовых мух. Как в полевых, так и в лабораторных испытаниях измельчение и просеивание мякоти было более эффективным (требовало меньше времени) и более чувствительным (обнаружено больше личинок), чем нарезка фруктов. Плавание мякоти в водном растворе коричневого сахара помогло обнаружить личинок более раннего возраста. Измельчение и просеивание фруктовой мякоти важных хозяев тефритид может увеличить вероятность обнаружения личинок во время экстренных программ.
Введение
Плодовые мушки Tephritid являются одними из самых разрушительных сельскохозяйственных вредителей, причем наибольший риск представляют роды Anastrepha, Bactrocera и Ceratitis 1. Многие районы подвержены высокому риску укоренения экзотических плодовых мух, что обусловлено 1) историческими вторжениями и связанными с ними программами разграничения и уничтожения, 2) высокой скоростью прибытия материала хозяев плодовой мухи в порты ввоза и 3) климатическими условиями, благоприятными для создания воспроизводящихся популяций. В штате Калифорния ежегодно происходят многочисленные вторжения и обнаружения тефритид2. За последнее столетие во всем мире было совершено более 200 вторжений и программ по искоренению тефритидов, и в последние десятилетия этот показатель значительно ускорился3. Хотя подавляющее большинство этих программ успешно искореняют вторгшуюся плодовую муху3,4, экономическое и экологическое бремя этих вторжений остается по-прежнему высоким, и возможность укоренения всегда присутствует; недавним катастрофическим примером является инфекция Bactrocera dorsalis на африканском континенте5.
Во время чрезвычайных программ плодовых мушек предпринимаются согласованные усилия по обнаружению и контролю размножающихся популяций вторгшихся видов. Например, штат Флорида реагирует на вторжения тефритид, применяя пропитку почвы (под капельной линией плодоносящих растений-хозяев) и удаляя плоды-хозяева в радиусе 200 м вокруг мест, где встречаются спаренные самки и/или личинки6. Эти действия и тактика служат для уничтожения личинок и куколок в почве и удаления любых яиц и личинок с фруктов в этом районе. В некоторых программах эрадикации удаляется значительное количество плодов-хозяев. В 2015 году более 100 000 кг фруктов было уничтожено во время программы уничтожения B. dorsalis во Флориде6. Экономические потери производителей и связанных с ними отраслей только в карантинной зоне оцениваются более чем в 10,7 млн долларовСША 7.
Чтобы найти личинок тефритид в карантинных зонах, небольшая группа энтомологов собирает плоды-хозяева в радиусе 200 м вокруг зоны обнаружения мух-самок, а также разрезает и визуально осматривает каждый плод на наличие личинок6. При ограниченных кадровых ресурсах и сотнях возможных хозяев задача становится сложной, особенно в районах, где разнообразие растений как в коммерческих производственных зонах, так и в жилых дворах велико. Кроме того, личинки могут быть пропущены при срезании плодов-хозяев. В исследовании, оценивавшем срезку плодов в портах ввоза, было обнаружено, что срезание фруктов не так эффективно обнаруживает A. suspensa по сравнению с выдержкой зараженных плодов в течение нескольких недель и подсчетом личинок и куколок, обнаруженных в субстрате для окукливания8.
Существуют альтернативы срезке плодов для обнаружения заражения 9,10,11,12,13. Например, флотация коричневого сахара и метод горячей воды являются общепринятыми процедурами, используемыми для обнаружения западных вишневых плодовых мушек в собранной вишне 9,10. Метод коричневого сахара заключается в помещении измельченных плодов в раствор сахарной воды и сборе личинок, которые всплывают наверх. Метод флотации коричневого сахара был разработан специально для соблюдения нормативных правил для экспортируемой вишни, которые требуют от упаковочных предприятий мониторинга карантинных вредителей плодовой мухи. Существует также утвержденная американо-канадская программа сертификации черники, которая включает флотацию в воде из коричневого сахара, флотацию в соленой воде или кипячение для поддержки фитосанитарии14. При проверке точности флотации сахара и горячей воды исследователи использовали метод просеивания, чтобы определить, сколько личинок пропущено 9,10,11,12,13. Исследование показало, что смешивание измельченной черники в солевом растворе и фильтрация раствора через многоразовый кофейный фильтр в четыре раза лучше обнаруживали личинок Drosophila suzukii, чем визуальный осмотр поверхности растворов соли и сахара14. Кроме того, газовая хроматография была использована для обнаружения личинок A. suspensa в цитрусовых15. Эти подходы не были проверены на применимость в полевых обследованиях.
Наша цель состояла в том, чтобы разработать и протестировать метод поиска личинок тефритид в полевых условиях с помощью просеивания и флотации сахарной воды. Этот метод позволяет более эффективно обнаруживать неполовозрелых плодовых мушек, чем традиционный метод срезки плодов, поддерживая своевременный контроль размножающихся популяций во время программ уничтожения плодовых мух.
протокол
1. Выбор фруктов
- Определите, какие фрукты имеются в обследуемом районе.
- Выберите плод-хозяин на основе списка известных хозяев для целевых видов тефритид.
- Выбирайте спелые фрукты с мягкой мякотью, такие как манго, папайя и гуава. Незрелые фрукты или фрукты с твердой мякотью, такие как тропический миндаль, следует осматривать другим методом, например, нарезкой фруктов.
- Выбирайте опавшие, перезрелые или спелые плоды на деревьях с признаками повреждения, шрамами от яйцекладки и мягкими пятнами.
- Обработайте примерно 2 л фруктов за один раз (например, 5 гуав или 5 манго среднего размера являются достаточными образцами для этого метода). Количество плодов, которые можно обработать за один раз, зависит от размера плодов (рис. 1А).
2. Мушинг
- Нарежьте фрукты крупными кусочками и поместите их в пакет для хранения с застежкой-молнией объемом 4 л (рис. 1B).
- Добавляйте воду в пакет, пока вода не покроет нарезанные фрукты на 25-50 мм (рис. 1В).
- Аккуратно сожмите плод вручную, пока вся мякоть не отделится от кожуры и не приобретет гладкую консистенцию (т. е. без больших кусков) (рис. 1D).
3. Просеивание для сбора позднего возраста
- Сложите сита. Используйте большие сита (диаметр 457 мм) для обработки большого количества фруктов (~ 5 плодов одновременно) и меньшие сита (диаметр 305 мм) для отдельных фруктов или более мелких образцов (< 5 плодов).
- Уложите сито с большой сеткой (No 8; 2,36 мм) на мелкое сито (No 20; 0,85 мм). Для обнаружения ранних возрастов поместите третье сито (No 45; 0,35 мм) на дно стопки (рис. 1E).
- Вылейте мякоть в верхнее сито (рис. 1F).
- Тщательно промойте мякоть через стопку сит водой из крана, шланга или бутылки до тех пор, пока мелкая мякоть не пройдет через сита (рис. 1G).
- Визуально просканируйте верхние сита на наличие личинок позднего возраста, которые могли сохраниться вместе с кожурой или любыми крупными кусочками фруктов (рис. 1H).
- Внимательно осмотрите второе сито на наличие личинок позднего возраста. При большом количестве мелкой мякоти может потребоваться дополнительное ополаскивание.
- Соберите личинок с решет с помощью личиночной щипцов и поместите их во флаконы с 70% EtOH.
4. Флоатация сахара для сбора в раннем возрасте
- Предварительно смешайте сахарный раствор, растворив 453 г (1 коробка) темно-коричневого сахара в 2 л водопроводной воды, что дает значение по шкале Брикса 19 ° 10.
- Вымойте мякоть из более мелкоячеистых сит (например, No 20 и No 45) до края сита водопроводной водой, затем переместите материал в пластиковую посуду (11 л).
- Добавьте раствор коричневого сахара до тех пор, пока он не покроет мякоть на 25-50 мм, и добавьте 2 капли пеногасителя. Оставьте мякоть в растворе коричневого сахара примерно на 5 минут.
- Личинки всплывают на поверхность раствора с помощью личиночной щипцов во флаконы с 70% EtOH.
5. Курирование личинок
- Маркируйте флакон с указанием места сбора, даты, типа фруктов и коллекционера для последующего изучения и идентификации.
Результаты
Ранний и поздний возраст Anastrepha suspensa экстракция из собранных в полевых условиях фруктов
В этом эксперименте мы сравнили методы нарезки фруктов и измельчения, просеивания и флоатирования (MSF) в отношении доли обнаруженных личинок и среднего времени, необходимого для их обнаружения. Гуава, сильно зараженная личинками Anastrepha suspensa, была собрана с растения, расположенного в Университете Флориды, Институте пищевых и сельскохозяйственных наук, Тропическом научно-образовательном центре, Хомстед, Флорида. Плоды были случайным образом отсортированы по 5 групп и отнесены к 1 из 2 методов экстракции личинок: 1) ручная резка или 2) метод MSF. Было зафиксировано время сбора всех личинок, видимых невооруженным глазом, с использованием каждого метода экстракции.
Метод ручной резки следовал методу, который в настоящее время используется в программе искоренения. Каждому из 5 рабочих (n=5) было поручено по 5 плодов для поиска всех стадий личинок, разрезав плоды на более мелкие кусочки и визуально осмотрев мякоть. Чтобы определить, были ли пропущены личинки при визуальном осмотре, кусочки фруктов, нарезанные вручную, были повторно проверены с помощью препарирующего микроскопа (10x).
Для метода MSF 5 плодов нарезали крупными кусочками (50-80 см), помещали в пакеты с застежкой-молнией и осторожно сжимали вручную, пока вся мякоть не выбивалась из кожуры и мякоть не имела гладкую консистенцию (т.е. без больших кусков). Измельченные фрукты процеживали через ряд больших (45,7 см) латунных сит. Самая большая сетка (No 8) была уложена сверху, за ней следовали сито No 20 и сетчатое сито No 45. Персонал, назначенный для этой обработки, промывал мякоть через сетку, используя воду из шланга, подключенного к крану раковины. Личинки позднего возраста были видны в ситах. Меньшие возрасты были смешаны с мякотью, что затрудняло их просмотр и удаление. Поэтому смесь мякоти и личинок из сит помещали в ведра с 1 л водного раствора коричневого сахара. Личинки тут же всплыли на поверхность. Раствор аккуратно размешивали, а через 5 мин вынимали личинки из ведер и пересчитывали. Время обработки плодов представляло собой комбинацию измельчения, просеивания и удаления личинок из раствора сахарной воды. Данные о количестве личинок, обнаруженных с помощью методов ручной резки или просеивания и флотации, были проанализированы с помощью непараметрического критерия Крускала-Уоллиса (p = 0,05)16.
Метод MSF дал большее количество личинок (рис. 2A) и больше личинок в минуту (рис. 2B), чем ручная резка. Хотя обнаружение различных возрастов не было количественно определено в этом исследовании, мы заметили, что все возрасты (первый, второй и третий) были обнаружены с использованием сит, тогда как только более поздние возрасты (второй и третий) были замечены с использованием ручной резки. Когда ранее разрезанные и визуально проверенные образцы были повторно исследованы с помощью микроскопического микроскопа, 40% личинок позднего возраста, заражающих плоды, были пропущены. Однако более ранние возрасты были в основном обнаружены при повторном осмотре.
Этот эксперимент показал, что использование метода MSF более эффективно и действенно для поиска личинок в сильно зараженных плодах. Тем не менее, фрукты, зараженные меньшим количеством личинок, чаще встречаются в программе искоренения, где вторгшиеся виды будут очень редкими. Поэтому мы провели лабораторное исследование, в котором плод-хозяин был заражен известным небольшим количеством личинок.
Ручное заражение манго и папайей для имитации низкого заражения Bactrocera dorsalis
В этом эксперименте сравнивались методы срезки плодов и MSF в отношении доли обнаруженных личинок и времени, необходимого для их обнаружения, когда заражение было относительно низким. Ручное заражение использовалось в качестве экспериментального инструмента для оценки эффективности каждого метода, поскольку количество присутствующих личинок было известно с уверенностью.
Пробковый мотылек (диаметром 1,0 см) был использован для проделывания 5 отверстий в отдельных плодах манго и папайи, в которых не было личинок плодовой мухи. В каждую из 5 отверстий подмножества плода помещали по одной личинке B. dorsalis в конце второго - начале третьего возраста. Отверстия закрывали с помощью кусочка, просверленного от плода, а оставшиеся плоды закрывали без вставки личинки, чтобы визуально имитировать ручное заражение. Плоды выдерживали при 27 ° C в течение 48 часов, чтобы обеспечить развитие личинок. Эксперимент проводился в лаборатории ARS в Хило, остров Гавайи (n = 5 рабочих) и лаборатории APHIS-PPQ на острове Оаху, Гавайи (n = 4 рабочих).
Для срезки плодов каждому рабочему давали 5 манго (1 зараженный 1 личинкой и 4 не зараженных) и 4 папайи (один зараженный и 3 не зараженных). Рабочий разрезал каждый плод по отдельности на все более мелкие кусочки и постоянно проверял мякоть на наличие незрелых плодовых мушек. Поиски были прекращены, когда целлюлоза была тщательно осмотрена. Было зафиксировано общее количество найденных личинок и время, затраченное каждым рабочим на обработку всех плодов путем срезки (рис. 3) и (рис. 4).
Каждый рабочий получал еще один аналогичный набор фруктов (5 манго и 4 папайи) для измельчения или просеивания (без разрезания фруктов), причем 2 части были заражены, как описано ранее. Мякоть высыпали в верхнее сито и промывали через стопку сит с использованием воды из крана и удаляли личинки, как описано в протоколе. Эксперимент проводился дважды, с флотацией сахара и без флотации сахара, чтобы определить, увеличит ли удаление стадии флотации скорость процесса без потери чувствительности (т. е. были обнаружены все или большинство личинок) (рис. 3). Регистрировалось количество найденных личинок и время, затраченное каждым рабочим на обработку плодов методом черенкования, MSF или MS.
Как для манго, так и для папайи метод полного MSF (включая флотацию) приводил к большему количеству обнаружений личинок и был быстрее, чем срезание плодов (таблица 1). Рабочие, использующие традиционный метод резки фруктов, пропустили 32% и 35% личинок, помещенных в манго и папайю, соответственно (таблица 1). Переработка фруктов оптом с использованием технологии MSF требовала на 30% меньше времени, чем нарезка отдельных манго, и на 35% меньше времени, чем нарезка отдельных папайи (рис. 3). При использовании метода MSF для папайи (рис. 3C) и манго (рис. 3D) было обнаружено больше личинок в минуту по сравнению с методом нарезки фруктов. Все найденные личинки были живы.
Морфологическая идентификация личинок возможна только для поздних возрастов. Мы повторили описанный выше эксперимент, но исключили процедуру флотации, чтобы определить, остается ли восстановление личинок высоким и увеличивается ли скорость обработки плодов. Метод MS (без флотации) привел к большему количеству обнаружений личинок папайи (рис. 4A) и манго (рис. 4B) по сравнению с огранкой и визуальным осмотром. Кроме того, этот метод был быстрее, чем резка и визуальный осмотр папайи (рис. 4C) и манго (рис. 4D). Удаление стадии флотации из метода MSF сократило время поиска личинок позднего возраста на 90% для папайи и на 48% для манго (табл. 2). Процент обнаруженных личинок был высоким для обоих методов и был неизменно выше для РС (флотация опущена). Для папайи 80% и 85% личинок были извлечены методами MSF и MS соответственно (Таблица 1 и Таблица 2). Для манго 88% и 95% были извлечены методами MSF и MS соответственно (Таблица 1 и Таблица 2).
Полевое сравнение методов нарезки плодов и MSF
Цель этого эксперимента состояла в том, чтобы сравнить методы обрезки плодов и MSF в полевых условиях, имитируя программу экстренной плодовой мухи. Переработка плодов проводилась без удобства и инфраструктуры лаборатории для проверки полевой готовности двух методов экстракции личинок. Работа проводилась в саду гуавы, расположенном в Отделе исследований генетических ресурсов тропических растений и болезней Министерства сельского хозяйства США-ARS Зародышевая плазма недалеко от Хило. В общей сложности было собрано 40 гуавов с признаками заражения и разделено на 2 группы. В общей сложности 20 гуав были подвергнуты резке/визуальному осмотру с последующим проведением MSF (включая флотацию), что позволило оценить чувствительность метода резки по сравнению с методом MSF. Вскрытие происходило, как описано выше. При обнаружении личинок удаляли и подсчитывали. Четверо рабочих препарировали по 5 гуав, и время, необходимое для резки и осмотра, было записано для каждого рабочего. MSF после резки проводили, как указано выше, за исключением того, что для сбора более мелких личинок использовалось третье сито с меньшими ячейками (No 40, 0,420 мм) в дополнение к ситам No 8 и No 20. Вторая партия из 20 гуав была помещена в 2 пакета с застежкой-молнией (по 10 фруктов в пакете) и подвергнута только MSF (т.е. без нарезки), что позволило сравнить время, необходимое для резки фруктов, с MSF. Как указано выше, в этой процедуре использовались три сита. Регистрировалось количество обнаруженных личинок и общее время обработки плодов (измельчение и выдержка плода в течение 5 мин в пакете/просеивание/плавание в сахарном растворе).
Как было обнаружено в лаборатории, срезка плодов недооценивала заражение плодами и сильно варьировалась, обнаруживая на 25-83% меньше личинок, чем то, что можно было бы извлечь с помощью методов MSF (таблица 3). Кроме того, в образце с низким количеством личинок MSF восстановила на 500% больше личинок, что обеспечило более высокую чувствительность анализа и больше шансов идентифицировать зараженный организм. Фрукты обрабатывались намного быстрее методом MSF по сравнению с черенкованием; На срезку и проверку 5 плодов ушло примерно столько же времени, сколько на обработку 10 плодов с помощью MSF.

Рисунок 1: Этапы протокола экстракции личинок плодовой мухи. (А) Обработать примерно 2 л по объему плодов за один раз (например, 5 гуав или 5 средних манго представляют собой адекватные образцы для этого метода). (B) Нарежьте фрукты крупными кусочками и поместите их в пакет для хранения с застежкой-молнией объемом 4 л. (C) Добавьте воду в пакет до тех пор, пока вода не покроет нарезанные фрукты на 25-50 мм. (D) Аккуратно сожмите плоды вручную, пока вся мякоть не отделится от кожуры и не приобретет однородную консистенцию (т.е. без больших кусков). (E) Укладывается сито с большой ячейкой (No 8; 2,36 мм) сито, а затем сито с мелкими ячейками (No 20; 0,85 мм). Для ранних возрастов поместите третье сито (No 45; 0,35 мм) на дно стопки. (F) Вылейте мякоть в верхнее сито. (G) Тщательно промойте мякоть через стопку сит водой из крана, шланга или бутылки до тех пор, пока мелкая мякоть не пройдет через первое сито. (H) Визуально просканируйте верхние сита на наличие личинок позднего возраста, которые могли сохраниться вместе с кожурой или любыми крупными кусочками фруктов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
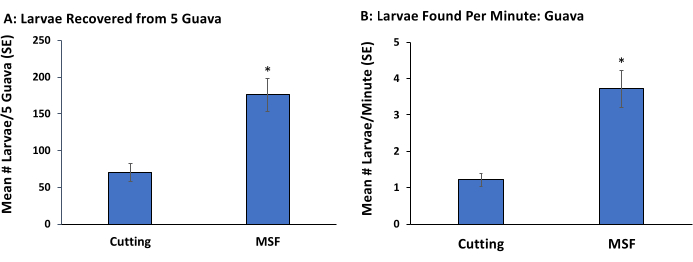
Рисунок 2: Ранняя и поздняя стадия Anastrepha suspensa экстракция из собранных в полевых условиях фруктов. Среднее количество (± стандартной погрешности среднего значения [SE]) личинок Anastrepha suspensa из пяти плодов гуавы, собранных путем разрезания и визуального осмотра (срезка: 70,4 ± 11,9) или промывки мякоти через серию из трех сит с последующим замачиванием мякоти в растворе сахарной воды (MSF: 175,6 ± 21,91) (A). Среднее количество личинок (±SE), собираемых в минуту из 5 гуав, обработанных черенкованием (1,21 ± 0,16) и MSF (3,71 ± 0,50) (B). Каждый метод был повторен 5 раз, а звездочки над столбцами указывают на значимые различия по количеству личинок (χ 2 = 6,81, p < 0,01) и времени обработки (χ2 = 6,80, p < 0,01) на основе теста Крускала-Уоллиса. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
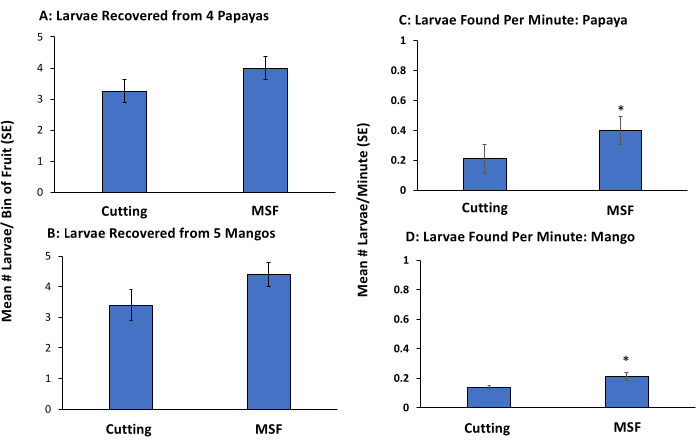
Рисунок 3: Валидация метода полного просеивания-просеивания-флотации с использованием ручного заражения манго и папайей для имитации низкого заражения Bactrocera dorsalis. Среднее количество личинок Bactrocera dorsalis (±SE), обнаруженных в папайе (огранка: 3,25 ± 0,51, MSF: 4,0 ± 0,4) (A) и манго (отрубка: 3,4 ± 0,51, MSF: 4,4 ± 0,4) (B) и среднее количество личинок (±SE), собранных в минуту из папайи (отрубка: 0,21 ± 0,1, MSF: 0,4 ± 0,15) (C) и манго (отрубка: 0,14 ± 0,01, MSF: 0,21 ± 0,03) (D). Плоды, которые были обработаны с использованием методов черенкования или MSF (включая флотацию, n = 5), вручную заражены личинками 5 третьего возраста. Звездочки над столбцами указывают на значительные различия в количестве личинок, обнаруженных в папайе (χ 2 = 5,39, p = 0,02) и манго (χ2 = 3,94, p = 0,05) по сравнению с обрезкой плодов на основе тестов Крускала-Уоллиса. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
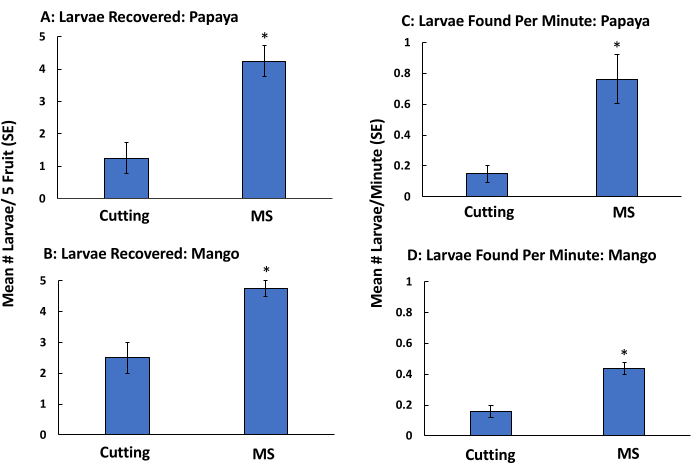
Рисунок 4: Валидация метода просеивания каши (флотация удалена) с использованием ручного заражения манго и папайей для имитации низкого заражения Bactrocera dorsalis. Среднее количество личинок (±SE), обнаруженных в плодах папайи (огранка: 1,25 ± 0,48, MS: 4,25 ± 0,48) (A) и манго (огранка: 2,5 ± 0,5, MS: 4,75 ± 0,25) (B) и среднее количество личинок, собираемых в минуту (±SE) в папайе (отрубка: 0,15 ± 0,05, MS: 0,76 ± 0,15) (C) и манго (отрубка: 0,16 ± 0,04, MS: 0,44 ± 0,04) (D). Плоды вручную заражали личинками Bactrocera dorsalis 5 третьего возраста и обрабатывали разрезанием и визуальным осмотром (нарезкой) или измельчали в мешочке и промывали через сита (только измельчение и просеивание, без флотации, n = 4). Звездочки над столбцами указывают на значительные различия в количестве личинок, обнаруженных в папайе (χ 2 = 5,46, p = 0,02) и манго (χ 2 = 5,25, p = 0,02) и времени обработки папайи (χ 2 = 5,39, p = 0,02) и манго (χ 2 = 5,39, p = 0,02) по сравнению с нарезкой плодов на основе тестов Крускала-Уоллиса. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Фрукт | # Переработанные фрукты | #Larvae добавлено | Способ обработки | #Larvae найдено | Время обработки (мин)* | % Восстановление |
| Манго | 25 | 25 | Режущий | 17 | 158 | 68% |
| Манго | 25 | 25 | MSF | 22 | 113 | 88% |
| Папайя | 16 | 20 | Режущий | 13 | 62 | 65% |
| Папайя | 16 | 20 | MSF | 16 | 40 | 80% |
| *Общее время суммировалось с 5 работниками. | ||||||
Таблица 1: Количество извлеченных личинок и время обработки плодов методом резки и визуального осмотра (нарезки) или полного измельчения, просеивания и всплытия (MSF). Испытуемый плод был вручную заражен 5 личинками третьего возраста, смешанными со скучающими и закрытыми только плодами (1 из 5 манго, 1 из 4 папайи).
| Фрукт | # Переработанные фрукты | #Larvae добавлено | Способ обработки | #Larvae найдено | Время обработки (мин)* | % Восстановление |
| Манго | 20 | 20 | Режущий | 10 | 66 | 50% |
| Манго | 20 | 20 | ГОСПОЖА | 19 | 44 | 95% |
| Папайя | 16 | 20 | Режущий | 5 | 38 | 25% |
| Папайя | 16 | 20 | ГОСПОЖА | 17 | 25 | 85% |
| *Общее время суммировалось с 4 работниками. | ||||||
Таблица 2: Количество извлеченных личинок и время обработки плодов только путем нарезки или измельчения и просеивания, без учета флотации (МС). Испытуемые плоды были вручную заражены личинками пяти третьего возраста, смешанными со скучающими и закрытыми только фруктами (1 из 5 манго, 1 из 4 папайи).
| Рабочий/метод | #Fruit обработанных | Время обработки (мин) | #Larvae найденная резка | #Larvae нашли MSF* | % от общего количества личинок, обнаруженных при черенковании |
| Рабочий 1: резка | 5 | 18 | 33 | 14 | 70% |
| Рабочий 2: резка | 5 | 18 | 1 | 5 | 17% |
| Рабочий 3: резка | 5 | 26 | 9 | 11** | 75% |
| Рабочий 4: резка | 5 | 20 | 24 | ||
| Работник 5: MSF | 10 | 22 | Н.А. | 22 | Н.А. |
| Работник 6: MSF | 10 | 18 | Н.А. | 37 | Н.А. |
| * Мякоть от резки и визуального осмотра обрабатывается повторно с использованием метода MSF для определения количества пропущенных личинок позднего 2-3-го возраста | |||||
| ** Мякоть рабочих 2 и 3 плодов, объединенных перед обработкой методом MSF | |||||
Таблица 3: Количество личинок, обнаруженных в гуаве, собранной в полевых условиях, при разрезании и визуальном осмотре плодов (нарезка) или при измельчении, просеивании и плавании (MSF) плодов.
Обсуждение
Наша цель состояла в том, чтобы разработать эффективный и действенный способ поиска личинок тефритид в полевых условиях. Мотивацией запуска программы искоренения или создания карантинной зоны является обнаружение спаренной самки (самок) или личинок6, что указывает на размножающуюся популяцию. Современный метод резки и визуального поиска плодов неэффективен для поиска личинок, поскольку обычно присутствует гораздо больше плодов-хозяев, чем можно осмотреть по отдельности. Кроме того, популяции тефритид, вероятно, невелики в районе новой инвазии, что делает шансы найти личинок в большом количестве фруктов невероятно трудными. Например, в 2015 году во Флориде в рамках программы по уничтожению Bactrocera dorsalis было идентифицировано 54 различных вида-хозяина и срезано более 4000 плодов. В этой программе уничтожения в манго было обнаружено всего несколько личинок, и не было обнаружено никаких других хозяев, зараженных6. Мы обнаружили, что метод MSF/MS был более чувствительным и быстрым в обнаружении личинок A. suspensa и B. dorsalis при обработке плодов с большим количеством мякоти (манго, гуава и папайя) навалом по сравнению с нарезкой фруктов. Большее количество плодов-хозяев, которые можно осмотреть с помощью метода измельчения и просеивания, в сочетании с увеличением обнаружения редкой личинки может увеличить вероятность того, что заражение будет обнаружено на ранней стадии. Раннее обнаружение размножающейся популяции может увеличить вероятность искоренения и снизить затраты на программу.
Наши эксперименты показали, что количество личинок, обнаруженных рабочими, срезающими и визуально осматривающими плоды, значительно варьировало. Рабочие, срезающие фрукты, пропустили 50% и 75% личинок B. dorsalis , помещенных в манго и папайю соответственно. Напротив, только 5% и 15% личинок были пропущены с использованием метода MS для обработки плодов манго и папайи соответственно. Аналогичным образом, исследование, посвященное оценке срезания плодов в портах въезда, показало, что наблюдались значительные различия в количестве зараженных фруктов и личинок, обнаруженных инспекторами8. Исследование показало, что опытные портовые инспекторы пропустили 64-99% личинок A. suspensa и 16-82% зараженных плодов при разрезании и визуальном осмотре плодов8. Наши результаты показывают, что метод измельчения и просеивания может снизить вероятность того, что рабочий пропустит обнаружение зараженного фрукта.
Флоатинг сахара и горячей воды являются принятыми протоколами в методе системного подхода для обеспечения того, чтобы вишня и черника были свободны от плодовых мушек14. Часть партии измельчается в растворе, после чего инспектор визуально проверяет поверхность сахарного раствора на наличие яиц и личинок. Хотя большее количество плодов может быть обработано по сравнению с обрезкой отдельных плодов, вероятность обнаружения личинок с использованием этих методов по-прежнему зависит от способностей инспектора, стадии и количества присутствующих личинок, а также типа плода8. Мы обнаружили, что, как и другие тефритиды, B. dorsalis и A. suspensa вытесняются из мякоти плода и всплывают на поверхность. Интересно, что мы обнаружили, что с более крупными личинками позднего возраста, которые являются мишенью в программах экстренной помощи и искоренения, поскольку они могут быть идентифицированы морфологически, включая флотацию сахара, не повысили точность метода. Фактически, добавление метода флотации увеличило время обработки на 90% для папайи и на 48% для манго. Увеличенное время обработки плюс дополнительные материалы (например, вода, бункеры, сахар и т. д.) не поддерживают добавление этого шага при поиске крупных возрастов в полевых условиях. Метод флотации сахара может быть подходящим, когда цель состоит в том, чтобы обнаружить все стадии, включая ранние стадии, такие как в портах входа и упаковочных цехах. Фильтрация сахарного раствора с помощью мелкоячеистого сита, скорее всего, обеспечит наиболее точное обнаружение яиц и ранних личиночных возрастов11,12.
Методы MS и MSF хорошо работают с фруктами, которые легко измельчаются и имеют большой объем мякоти. Личинки тефритид, как правило, зарываются в мякоть плода, что затрудняет визуальное обнаружение. Важнейшим аспектом методов MS и MSF является отделение личинок от пульпы. В процессе просеивания мякоть удаляется, таким образом подвергая личинок воздействию ситовых решеток. Точно так же метод сахарной воды отделяет личинок от мякоти, заставляя личинок плавать, в то время как мякоть опускается на дно кастрюли. Личинки, отделенные от пульпы методами MS или MSF, легко наблюдаются движущимися по сито-ситу или поверхности воды. Несмотря на то, что метод измельчения, просеивания и, возможно, плавающего метода значительно улучшил скорость и точность обнаружения личинок тефритид в важных плодах-хозяевах, этот процесс может не подходить для всех фруктов. Например, плоды-хозяева с твердой мякотью, такие как зеленый авокадо, или фрукты с крупными семенами/косточками и относительно небольшим количеством мякоти, такие как тропический миндаль, может быть легче обработать путем ручной резки и визуального осмотра.
Мы обнаружили, что методы MS и MSF были быстрее, когда обрабатывалось относительно небольшое количество фруктов (5-10). Разница, вероятно, была бы больше, если бы обрабатывалось большее количество фруктов, что может быть необходимо и типично для программ экстренной плодовой мухи. Удаление шага флотации еще больше увеличило скорость обнаружения без ущерба для точности обнаружения крупных личинок тефритид (>3 мм). Мы показали, что эти методы могут быть применены в полевых условиях, которые имитируют условия, с которыми сталкиваются рабочие во время экстренной программы плодовых мух. Наши исследования показывают, что методы РС могут позволить своевременно обнаруживать личинок позднего возраста и последующее искоренение размножающихся популяций тефритидов. MSF может быть использована для обнаружения яйцеклеток и ранних стадий, которые в настоящее время не охвачены программами уничтожения.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Мы хотели бы поблагодарить Сильвию Дюран, Тери Аллен, Хосе Алегрию и Алехандру Кэнон за помощь в переработке гуавы в Университете Флориды, Рика Курашиму, Жана Аута и Брюса Инафуку за помощь в оценке искусственно зараженных фруктов на Гавайях, а также Майкла Стулберга за полезные комментарии к более ранним версиям рукописи. Этот проект частично финансировался Министерством сельского хозяйства США, APHIS и Соглашением о сотрудничестве Университета Флориды и частично поддерживался USDA-ARS (проект 2040-22430-027-00D). Выводы и заключения, содержащиеся в этой предварительной публикации, не были официально распространены Министерством сельского хозяйства США и не должны толковаться как представляющие какое-либо определение или политику агентства. Упоминание торговых наименований или коммерческих продуктов в этой публикации предназначено исключительно для предоставления конкретной информации и не подразумевает рекомендации или одобрения со стороны Министерства сельского хозяйства США. Министерство сельского хозяйства США является поставщиком равных возможностей и работодателем.
Материалы
| Name | Company | Catalog Number | Comments |
| Anti foamer | MicroLubrol | ML200-50-4 | MicroLubrol 2000 Fluid Pure Silicone Oil, https://www.microlubrol.com |
| Brown Sugar | Dominos | 1 lb Box Dark Brown Sugar Crystals, https://www.dominosugar.com/products/dark-brown-sugar | |
| Cutting Boards | KitchenAid | KE703NOSMGA | KitchenAid Classic Nonslip Plastic Cutting Board, 12x18-Inch, https://www.amazon.com/KitchenAid-Classic-Nonslip-Plastic-11x14-Inch/dp/B09117L774/ref=sxin_24_ac_d_mf_brs?ac_md=2-1-S2l0Y2hlbkFpZA%3D%3D-ac_d_mf_brs_brs&content-id=amzn1.sym.1ad31f34-ba12-4dca-be4b-f62f7f5bb10d%3Aamzn1.sym.1ad31f34-ba12-4dca-be4b-f62f7f5bb10d&crid=UXMLNC72BL0 M&cv_ct_cx=cutting%2Bboards&keywords=cutting%2Bboards &pd_rd_i=B091118V8T&pd_rd_r= 4c48b4ad-4d4d-4b4b-8799-fc7313 2f8e34&pd_rd_w=li862&pd_rd_wg =KogbB&pf_rd_p=1ad31f34-ba12-4dca-be4b-f62f7f5bb10d&pf_rd_r=9ATJD6W QBF9DVRY889MP&qid=1673911 429&refresh=1&sprefix=cutting%2Bboards%2Caps%2C198&sr=1-2-8b2f235a-dddf-4202-bbb9-592393927392&th=1 |
| Dish Pans | Sterilite | 06578012 | White 12 qrt Dishpan, https://www.amazon.com/STERILITE-06578012-Sterilite-White-Dishpan/dp/B0039V2G5E/ref=sr_1_1?crid=2SMBMLFJF18U&keywords= white+12+qt+dishpan+sterilite&qid=1673911729&s=home -garden&sprefix=white+12+qr+dishpan+sterlite%2Cgarden%2C184&sr=1-1 |
| EthOH | Fisher Scientific | BP8202500 | Ethanol Solution 96%, Molecular Biology Grade, https://www.fishersci.com/shop/products/ethanol-solution-96-molecular-biology-grade-fisher-bioreagents/BP8202500 |
| Glass Vials | Fisher Scientific | 0333921H | Fisherbrand Class B Clear Glass Threaded Vials With Closures, https://www.fishersci.com/shop/products/class-b-clear-glass-threaded-vials-with-closures-packaged-separately/0333921H |
| Knives | Zyliss | 31380 | 5.25" Utility Knife, https://www.amazon.com/ZYLISS-Utility-Kitchen-5-5-Inch-Stainless/dp/B00421ATJK/ref=sr_1_7?crid=2U27KE1HTG5N1&keywords= fruit%2Bcutting%2Bknives&qid=1673911609&s= home-garden&sprefix=fruit%2Bcutting%2Bknives%2Cgarden%2C145&sr=1-7&th=1 |
| No. 20 Mesh sieves | Hogentogler & Co. Inc. | 4221 | U.S. Standard Testing Sieves, https://www.hogentogler.com/sieves/18-inch-sieves.asp |
| No. 45 Mesh sieves | Hogentogler & Co. Inc. | 4226 | U.S. Standard Testing Sieves, https://www.hogentogler.com/sieves/18-inch-sieves.asp |
| No. 8 Mesh sieves | Hogentogler & Co. Inc. | 4215 | U.S. Standard Testing Sieves, https://www.hogentogler.com/sieves/18-inch-sieves.asp |
| Soft Forceps | DR Instruments | DRENTF01 | DR Instruments Featherweight Entomology Forceps, https://www.amazon.com/DR-Instruments-DRENTF01-Featherweight-Entomology/dp/B008RBLO8Q |
| Zipper Lock Storage Bags | Ziploc | 682254 | Ziploc brand 2 gal Clear Freezer Bags, https://www.amazon.com/Ziploc-Freezer-Bag-Gallon-100/dp/B01NCDWR8A/ref=sr_1_1_sspa?crid=3SQFBT64Z76ES&keywords= ziploc+freezer+bags+2+gallon&qid=1674504602& |
Ссылки
- White, I. M., Elson-Harris, M. M. . Fruit Files of Economic Significance: Their Identification and Bionomics. , (1992).
- Papadopoulos, N. T., Plant, R. E., Carey, J. R. From trickle to flood: the large-scale, cryptic invasion of California by tropical fruit flies. Proceedings of the Royal Society B: Biological Sciences. 280 (1768), 20131466 (2013).
- Suckling, D. M., et al. Eradication of tephritid fruit fly pest populations: outcomes and prospects. Pest Management Science. 72 (3), 456-465 (2016).
- Mcinnis, D. O., et al. Can polyphagous invasive tephritid pest populations escape detection for years under favorable climatic and host conditions. American Entomologist. 63 (2), 89-99 (2017).
- Mutamiswa, R., Nyamukondiwa, C., Chikowore, G., Chidawanyika, F. Overview of oriental fruit fly, Bactrocera dorsalis (Hendel) (Diptera: Tephritidae) in Africa: From invasion, bio-ecology to sustainable management. Crop Protection. 141, 105492 (2021).
- Steck, G., et al. Oriental fruit fly eradication in Florida 2015-2016: program implementation, unique aspects, and lessons learned. American Entomologist. 65 (2), 108-121 (2019).
- Alvarez, S., Evans, E., Hodges, A. W. Estimated costs and regional economic impacts of the oriental fruit fly (Bactrocera dorsalis) outbreak in Miami-Dade County, Florida. University of Florida Institute of Food and Agricultural Sciences Extension. , (2016).
- Gould, W. Probability of detecting Caribbean fruit fly (Diptera: Tephritidae) infestation by fruit dissection. Florida Entomologist. 73 (3), 502-507 (1995).
- Yee, W. L. Detection of Rhagoletis indifferens (Diptera: Tephritidae) larvae using brown sugar flotation and hot water methods. Journal of Applied Entomology. 136 (7), 549-560 (2012).
- Yee, W. L. Comparison of the brown sugar, hot water, and salt methods for detecting western cherry fruit fly (Diptera: Tephritidae) larvae in sweet cherry. Florida Entomologist. 97 (2), 422-430 (2014).
- Van Timmeren, S., Diepenbrock, L. M., Bertone, M. A., Burrack, H. J., Isaacs, R. A filter method for improved monitoring of Drosophila suzukii (Diptera: Drosophilidae) larvae in fruit. Journal of Integrated Pest Management. 8 (1), 23 (2017).
- Van Timmeren, S., Davis, A. R., Isaacs, R. Optimization of a larval sampling method for monitoring Drosophila suzukii (Diptera: Drosophilidae) in blueberries. Journal of Economic Entomology. 114 (4), 1690-1700 (2021).
- Balagawi, S., et al. Evaluation of brown sugar flotation for detecting Queensland and Mediterranean fruit fly (Diptera: Tephritidae) infestation in Australian cherries. Crop Protection. 151, 105823 (2022).
- CFIA (Canadian Food Inspection Agency). Directive D-02-04: The Blueberry Certification Program and domestic phytosanitary requirements to prevent the spread of blueberry maggot (Rhagoletis mendax) within Canada. 2 Revision 10. CFIA (Canadian Food Inspection Agency). , (2020).
- Kendra, P. E., et al. Gas chromatography for detection of citrus infestation by fruit fly larvae (Diptera: Tephritidae). Postharvest Biology and Technology. 59 (2), 143-149 (2011).
- SAS Institute Inc. SAS 9.4 Guide to Software Updates and Product Changes. SAS Institute Inc. , (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены