Method Article
集中治療室における電気インピーダンス断層撮影法による肺機能のモニタリング
* これらの著者は同等に貢献しました
要約
電気インピーダンス断層撮影法は、非侵襲的で放射線を使用しないリアルタイムの肺換気モニタリングツールです。胸部のインピーダンス変化を測定することで、呼吸ごとに空気の分布を可視化することができます。当初は換気モニタリングを目的としていましたが、電気インピーダンス断層撮影法は、生理食塩水の静脈内注射による灌流も測定できます。
要約
電気インピーダンス断層撮影法(EIT)は、連続的でリアルタイムの換気モニタリングのための、画期的で非侵襲的で放射線のないイメージング技術です。また、肺灌流モニタリングにも応用されています。EIT は、胸部のインピーダンス変化の測定と処理から、肺全体の換気と灌流パターンを定量化します。これは、臨床医が肺機能の呼吸ごとの変化を視覚化するための強力なツールです。
EIT の革新的なアプリケーションは、息止め中の高張液注射の速度論的分析を使用して肺灌流を評価する能力です。このソリューションは、胸部が肺血管系を循環するときに、胸部にインピーダンス変化を引き起こします。この間接的な方法により、灌流パターンの推定が可能になり、ベッドサイドでの肺血流ダイナミクスの理解に大きく貢献します。
EITは、モニタリングのためのツールであるだけでなく、気胸や気管支挿管などの呼吸器疾患の診断にも重要な役割を果たします。これは、侵襲的な人工呼吸器を受けている患者における換気/灌流 (V/Q) の不一致の病因を特定するのに役立ちますが、これは他の診断ツールでは不可能です。さらに、EITは、呼気終末陽圧(PEEP)滴定や一回換気量など、人工呼吸器の設定の個々の最適化を支援し、クリティカルケアにおける酸素化と肺の健康を改善します。
要約すると、EITはベッドサイドの肺モニタリングと診断のパラダイムシフトを表しています。その非侵襲的な性質とデータの即時性により、EITは現代の呼吸器医学において不可欠なツールとなっています。EITは、その用途が拡大する中、特に集中治療室における呼吸器ケアの理解とアプローチを進める上で極めて重要な役割を果たします。
概要
電気インピーダンス断層撮影法(EIT)は、時間の経過に伴うインピーダンスの変化を地形画像に変換する肺モニタリング技術です。これは、胴体を横切って円周方向に配置された電極から低電気交流電流(5〜10mA)を注入することによって達成されます(図1A)。インピーダンスは、この電流の流れに対する組織の反対を反映しています。吸気時にはインピーダンスが増加しますが、呼気時には減少します。インピーダンスの同様の変化は、静脈内輸液の存在下でも発生します。例えば、血液に比べて電気伝導率が高い流体を中央カテーテルから注入すると、電気インピーダンス1,2,3,4がそれに応じて減少します。
実用性のために、EITの電極(16個または32個)をベルト上に配置し、患者の胸部の周囲、特に4番目 と5番目の 肋間腔の間に配置します。この配置により、肺の最適な視界が得られ、横隔膜の干渉が減少します。測定プロセスでは、2つの異なる電極がプリセット電流を順番に注入し、残りの電極は対応する電圧測定値のレシーバーとして機能します。このプロセスは、電極のペアごとに急速に繰り返され、20〜50Hzの周波数で胸部の周りを回転します。この急速な回転が、EITが高い時間分解能を持つ理由です。胸部EITデバイスは、各測定サイクルから胸部断面の電気インピーダンスの分布を計算し、これらの値を2次元画像に変換します。この画像は、専用のモニターにリアルタイムで表示されます。
EITにはいくつかの臨床応用があります。インピーダンス技術に基づいて、特に造影剤を投与して肺インピーダンスの変動を作り出す場合に、胸部内の空気の分布と灌流の分布を監視することが可能です。人工呼吸器を装着した患者のPEEP設定を決定することは、肺の損傷を最小限に抑えるために困難であり、不可欠です。さらに、換気と灌流の変化を経時的に追跡する機能は、長期的な患者モニタリングのための貴重なデータを提供します。この側面は、患者の状態が急速に進化する可能性のあるダイナミックな臨床環境において非常に重要です5。
EITは、フローセンサーを通じて得られる全球力学や、EITデバイスが人工呼吸器に接続されている場合に人工呼吸器からのデータの可視化を容易にするだけでなく、過膨張や局所崩壊に関する重要な情報も提供する6,7,8,9。生成された画像は、肺に関する機能的な情報を提供しますが、解剖学的診断を目的としたものではなく、放射線を放出するものではありません。米国では、EITデバイスENLIGHT 2100が現在、米国食品医薬品局(FDA)によって承認された唯一の製品です。他の企業は現在、成人、子供、および新生児の集団でのEITの使用についてFDAの承認を取得する過程にあります。この論文では、ENLIGHT 2100デバイスのハードウェア(ベルトやスクリーンなど)、換気、および灌流マップを使用しました。
EITセットのセットアップには、モニター自体の他に、電極のベルト、フローセンサー、および参照ケーブルの3つの重要な機器が含まれています。 電極のベルト は、断層撮影の二次元画像を取得するために使用されます。EIT 肺画像は、胸部の周囲サイズと製造元の仕様に応じて、32 x 32、24 x 24、16 x 16 ピクセルなどのさまざまな解像度の 2 次元表現に構築されます。画像は、再構成アルゴリズムを使用した電圧測定から生成されます。 フローセンサー は1人の患者が使用するように設計されており、成人と小児の患者用と新生児用の2つのサイズがあります。成人小児用フローセンサーは40mL未満の潮汐量を測定できませんが、新生児センサーは0〜100mLの潮汐量を記録できます。フローセンサーがない場合、EITはインピーダンスデータのみを表示します。フローセンサーを患者に接続すると、インピーダンス波形のデータを圧力、流量、体積のパラメータと同期させることが可能になります。 リファレンスケーブル は再利用可能で、電流の注入値の基準点として機能します。
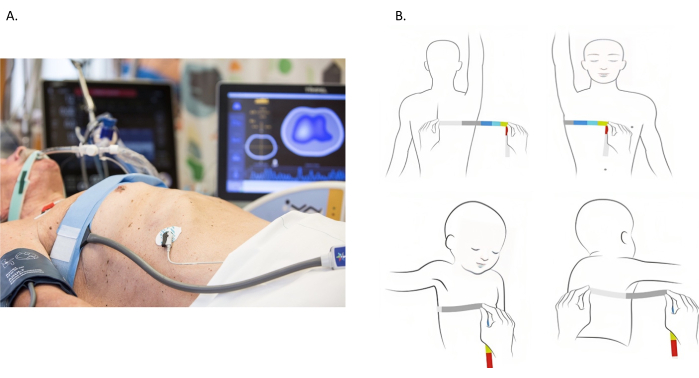
図1:電気インピーダンス断層撮影電極ベルトの配置。(A) 第 4および第 5 肋間腔の胸部周囲に配置された電気インピーダンス断層撮影電極ベルト。(B)胸部の測定。胸部は、胸全体に巻尺を巻き付けて測定します。しかし、ほとんどの患者は寝たきりであり、胸部全体の測定は不可能です。別のアプローチを画像に示します。胸部周囲は、棘突起から胸骨まで評価されます。次に、胸の反対側の部分を考慮して測定値を2倍にします。この図の拡大版を表示するには、ここをクリックしてください。
このビデオペーパーの主な焦点は、EIT画像の録画と解釈に習熟するために必要な知識とスキルを読者に提供することです。この目標を追求するために、EIT の原則の概要を説明し、肺内の空気分布のリアルタイム視覚化機能を紹介し、灌流評価での拡張アプリケーションを探ります。これらの目標を達成することにより、視聴者が自信を持ってEITテクノロジーを肺評価に活用できるようにすることを目指しています。
プロトコル
この論文で提供された画像は匿名化されており、ClinicalTrials.gov で番号NCT04497454で登録され、地元の倫理委員会(サンパウロインコール大学/ HC-FMUSP 4001231、ブラジル)によって承認された進行中のプロトコルの一部です。
1. EITデバイスの利用開始方法
- EITベルトと配置
- 正確なベルトサイズを選択するために、胸壁を測定します。
- 測定テープを使用して、4番目 と5番目の 肋間腔の間の胸部周囲を測定します(図1B)。大きな胸の患者では、ベルトをより高い肋間腔に移動します。
- 電極ベルトを導電性ゲルで使い捨ての材料で覆います。
注:これにより、髪の毛の多い患者でも患者の皮膚への付着が保証され、インピーダンス信号の捕捉が容易になります。 - ベルトを患者の胸壁の4番目 と5番目の 肋間スペース(測定された周囲と同じ)に配置し、ベルトを配置するときに電極が重ならないようにします。
- 画像再構成アルゴリズムはベルトサイズに比例した前方のギャップを許可するため、背面に隙間のない連続性を維持します。
- ベルトの装着時には、患者様を背部に回して背中にアクセスします。気道、すべての留置静脈または動脈ライン、およびドレーンを固定し、医療専門家が提供する特定のガイドラインに従ってください。
- フローセンサーをYピースの近くの換気回路に接続し、センサーを上に向けて配置して、液体の蓄積と信号の干渉を防ぎます(図2A)。
- 参照電極を心電図(ECG)電極に接続します。
注:リファレンスケーブルなしで患者を監視することはできません(図2B)。- 成人および小児の患者の場合は、電極を腹部または肩に配置します。
- 新生児の患者さんは、電極を脚に装着します。
- EIT をオンにして、患者の人口統計データを入力します (図 3)。
- モニタリングを開始し、患者の動きを避けます。モニター開始後、参照画像が生成され、換気画面が表示されます(図4)。 動的画像 と 換気マップの 2 つの画像が生成されます。
注:録音中は、患者の動きがベルトに干渉しないようにすることが重要です。 - EITデバイスのPEEP滴定ツールのステップバイステップ
- メイン画面のアイコンからPEEP滴定ツールを選択します。
- ツールオプションにアクセスするには、[ ツールオプション ]アイコンをクリックします。
- 時間間隔を設定して、滴定中のPEEP変化の時間間隔を調整し、各条件で換気を安定させます。
注:時間間隔は、患者の状態(例:血行動態の不安定性)とデバイスの指示。 - PEEP 変化の自動検出の [しきい値 ] を調整します。
- PEEP 滴定画面で Start を押して滴定を開始し、PEEP 変化の調整時間に基づいてカウントダウンを開始します。
- プロンプトが表示されたら、プロトコルに従って人工呼吸器の PEEP 値を調整します。デバイスはこの変更を自動的に検出し、新しいカウントダウンを開始します。
- PEEP の変更を監視する - PEEP の変更ごとに画面が更新されます。自動検出に失敗した場合は、手動で停止し、手順にコメントします。オプションで、コメントを入力するか、滴定に名前を付けます。その後、PEEP滴定グラフが表示されます。
- EITデバイス上の 灌流ツールの ステップバイステップ
- 患者様の準備
- 十分な鎮静を確保し、必要に応じて神経筋の遮断を行います。これは、呼吸努力が手順を中断する可能性があるためです。
注:患者は、機械的な換気モニタリングにもかかわらず、検出できない呼吸努力を示す可能性があります。
- 十分な鎮静を確保し、必要に応じて神経筋の遮断を行います。これは、呼吸努力が手順を中断する可能性があるためです。
- 手順を開始します。EITソフトウェア内の [スタート ]アイコンをクリックして、手順を開始します。
- 換気サイクル認識
- ソフトウェアがいくつかの換気サイクルを認識して、ベースラインデータを確立するようにします。
- 無呼吸と注射。
- 0 cmH2Oの圧力サポートを使用して、持続的気道陽圧法(CPAP)または圧力サポート換気(PSV)モードに切り替えます。これを20秒以上維持します。この期間中、7.5%高張生理食塩水または8.4%重炭酸塩水10 mLを中心静脈アクセスカテーテルを介して内頸静脈または鎖骨下静脈に迅速かつ一貫して注入します。.
- 換気を回復します。 注射が完了したら、通常の換気設定に戻します。
- 画像の再構成
- EITアルゴリズムに、心臓と肺を流れるコントラストの初回通過速度論に基づいて灌流画像を再構築させます。
- 患者様の準備
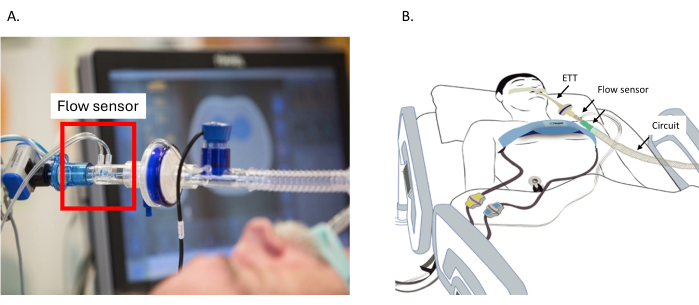
図2:フローセンサーの配置。 (A)回路とETTの間のフローセンサーの配置。(B)胸部の周りのベルトはEITデバイスに接続されています。フローセンサーはETTと回路の間に接続されています。本体の電極に接続されたリファレンスケーブル。略語:ETT=気管内チューブ。 この図の拡大版を表示するには、ここをクリックしてください。
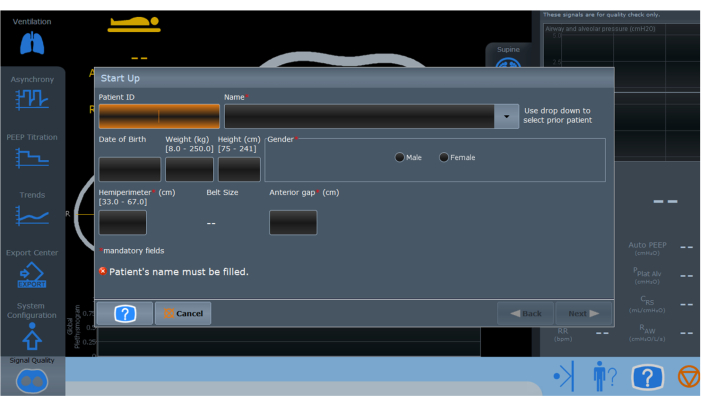
図3:電気インピーダンス断層撮影監視装置の初期化画面。 赤いアスタリスクでマークされたフィールドは、適切なセットアップと操作のために入力する必要がある必須情報を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
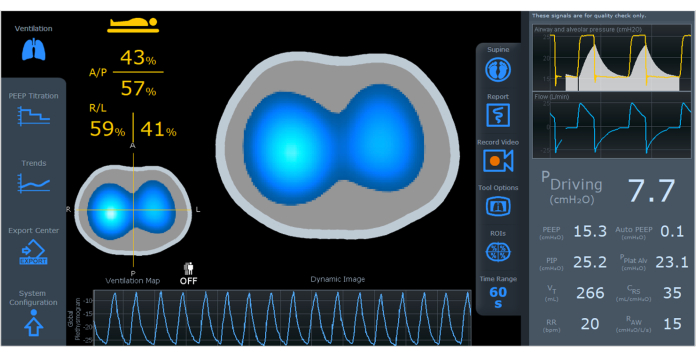
図4:ダイナミック画像、換気マップ、プレチスモグラムを表示したEIT画面。 画面の左側には、地域ごとに分割された換気分布((A/P、R/L))があります。画面の右側には、駆動圧力、PEEP、自動PEEP、PIP、PPlat Alv、VT、CRS、RR、RAWなどの換気パラメータがあります。略語:EIT =電気インピーダンス断層撮影;A/P=前方/後方、R/L=右/左;PEEP = 正終末呼気圧;PIP = ピーク吸気圧;PPlat Alv = 肺胞プラトー圧;VT = 潮汐量;CRS = 呼吸器系のコンプライアンス;RR = 呼吸数;RAW = 気道抵抗。この図の拡大版を表示するには、ここをクリックしてください。
結果
換気モニタリング
動的画像(図4)は、地域の変化を表すために、濃い青(最も換気が少ない)から白(最も換気されている)までの色を使用して、換気中の空気分布のリアルタイムの変化を示しています。灰色の領域は、換気に変化がないことを示します。ダイナミックな画像により、肺内時定数の違いや逆説的なパターンの存在を迅速に特定することができます。呼吸周期中の空気の変動が限られている領域は、過度の膨張または崩壊した領域が原因である可能性があることに注意することが重要です。
「換気マップ」(図4)は、呼吸サイクル中に定義された断面に空気量がどのように分布するかを示しています。明るい青色は、吸気と呼気の間のインピーダンス信号の変化に比例する一回換気量の大部分を受け取る肺領域を示します。逆に、濃い青はボリュームの変動が少ないエリアを表します。換気マップにより、肺内の局所換気分布を評価できます。肺は前部/後部と右/左の領域に分かれており、画面4上の特定の領域の詳細な評価とプレチスモグラフの表示が可能です。
プレチスモグラム胸部インピーダンス変動曲線(図4)は、潮汐量に対応する波の振幅を表し、ベースラインは肺通気または機能的残存容量(FRC)または呼気終了肺容量(EELV)に相当します。曝気情報は、胸腔内総空気量の相対的な変化を推定できます。
画面右側の気道パラメータ(図4)は、フローセンサーによってキャプチャされ、波形グラフと数値として表示されます。駆動圧力、自動PEEP、肺胞プラトー圧、コンプライアンス、抵抗(右側の数値列)などのパラメータは、制御されたサイクル中に計算されます。パラメータPEEP、ピーク圧力、一回換気量、および呼吸数は、すべてのサイクルで表示されます。近位流量センサーを使用すると、機械式人工呼吸器のブランドやモデルに関係なく、換気データとインピーダンスデータを同じ画面に統合できます。
PEEP滴定ツール(図5)
患者は、PEEP滴定に影響を与える可能性のある自発的な呼吸の努力や動きを避けて、人工呼吸器と同期させる必要があります。これは、適切な鎮静剤、および必要に応じて麻痺剤で到達することができます。フローセンサーと人工呼吸器のチューブは、正確な監視を維持するために、液体や分泌物などの障害物がないようにする必要があります。
EITは、局所換気の変化を検出し、流量計と統合すると、気道圧、潮汐量、流量などの局所呼吸力学を推定することができます。これは、地域のコンプライアンスの変化を計算することにより、さまざまなPEEPレベルでの崩壊した領域と超膨張した領域の割合として結果を表示します。一部の著者は、過膨張の割合 (図 5 の白い曲線と図 6 の白い領域) と崩壊の割合 (図 5 の青い曲線と図 6 の青い領域) の間の交差点まで PEEP を滴定することを提案しました。このPEEPレベルでは、過膨張領域と虚脱領域(図5のオレンジ色の曲線)と肺機能の両方の発生が最小限に抑えられています。進行中の研究では、過膨張と虚脱の間の交差点に設定されたPEEPが臨床的に有利であるかどうかを調査しています。
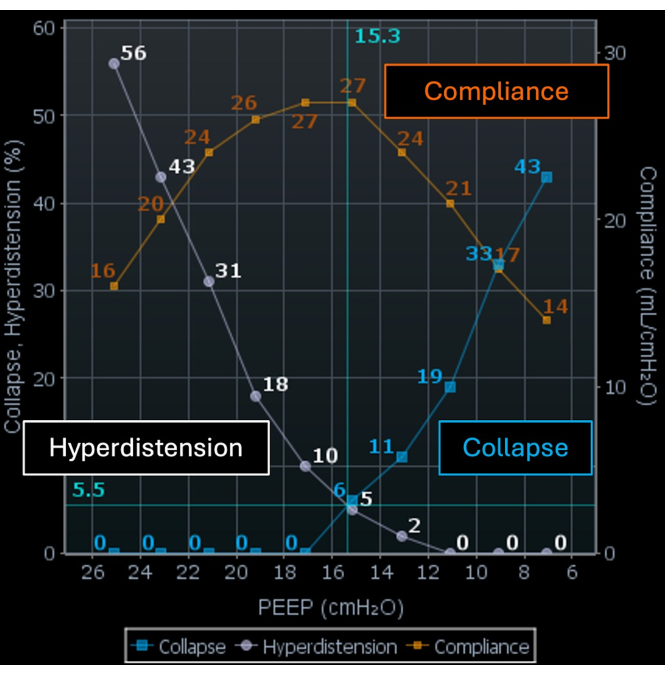
図5:EIT画面上のPEEP滴定ツール。 オレンジ色の曲線はコンプライアンス、白い曲線は過膨張、青色の曲線は崩壊を表します。略語:EIT =電気インピーダンス断層撮影;PEEP = 正の呼気終末圧。 この図の拡大版を表示するには、ここをクリックしてください。
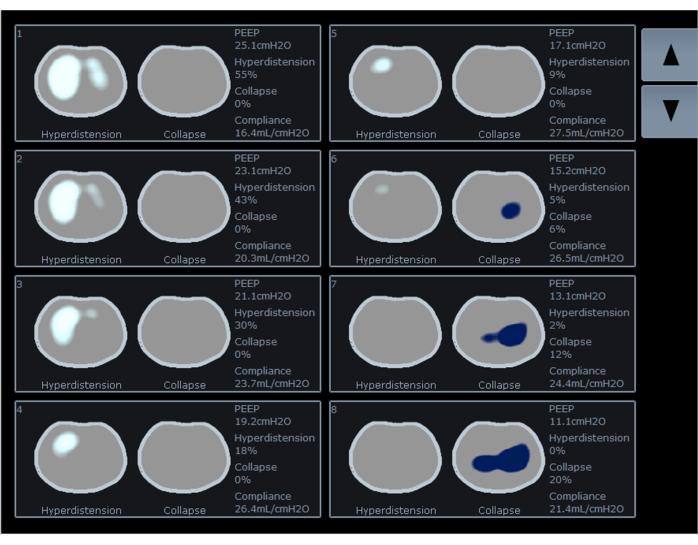
図6:EIT画面上の過膨張率(白)と崩壊率(青)、およびさまざまなPEEP値のコンプライアンスの表示。 略語:EIT =電気インピーダンス断層撮影;PEEP = 正の呼気終末圧。 この図の拡大版を表示するには、ここをクリックしてください。
EIT による肺灌流の評価: 医療提供者向けガイド
電気インピーダンス断層撮影法(EIT)は、最近、電気伝導率の変化を測定することにより、肺換気の貴重なモニタリングツールとして認識されています。EITは主に肺内の空気分布の評価に焦点を当てていますが、革新的な技術を通じて肺灌流に関する貴重な洞察を提供することもできます。
胸部の血液の動きによるインピーダンスの変化は、換気に関連するものよりもはるかに小さい振幅です。したがって、EITは従来、灌流の測定に使用されていませんでした。ただし、高張生理食塩水の静脈内注射と息止め操作の組み合わせを含む特定の方法では、血流に関連するインピーダンスの変化を分離および増幅できます。この溶液が血管を通過すると、血液の電気的特性が変化し、EITはそれを検出できます。EIT は、このソリューションが肺血管系を循環するときに発生するインピーダンスの変化を観察することにより、灌流パターンを間接的に推測できます。このアプローチにより、肺内の換気と灌流の両方を同時により深く理解することができます10。このツールは、米国および/または地元の病院の規制および/または法的機関の規制当局による他の国の承認に従って、研究目的でのみ使用できます。
肺灌流の可視化
高張生理食塩水または重炭酸ナトリウムのような高い電気伝導率を有する溶液の静脈内注射は、肺血管系11,12,13内の血流を視覚化するのを助ける。灌流が高い領域は、灌流されていない領域と比較して異なるインピーダンスパターンを示します。EITのこの革新的なアプリケーションは、換気イメージングと並行して灌流の相対的な評価を可能にし、肺機能の包括的なビューを提供し、通常は肺灌流を調節する治療法で治療される灌流欠陥によって引き起こされる低酸素血症と、換気戦略や体位変更で対処されることが多い換気障害によって引き起こされる低酸素血症を区別するのに役立ちます。このアプリケーションにより、確立された治療(吸入一酸化窒素、抗凝固剤、血栓溶解薬など)に反応した局所肺灌流の変化をモニタリングすることもできます。
灌流ツール
EIT内の灌流ツールは、制御された人工呼吸器中の肺血流を視覚化するために特別に設計されています。これは、短時間の無呼吸期間中に高張生理食塩水を静脈に注射することを含みます。結果の画像は、胸部の断面に黄色(灌流が高いことを示す)から濃い赤(灌流が低いことを示す)までの色で、肺灌流の分布を示しています( 図7を参照)。
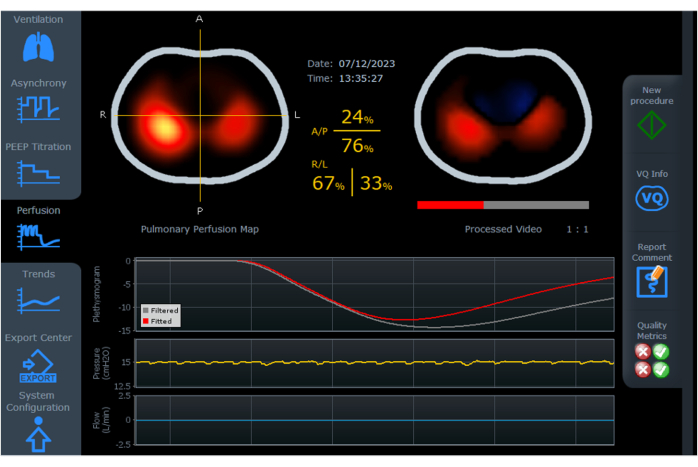
図7:胸部の異なる領域への灌流の分布の割合の変動。 示されているのは、前部、後部、右部、左部への灌流のバリエーションを示しており、胸部の断面の色は黄色(高灌流)から暗赤色(下部灌流)の範囲です。また、処理されたビデオをオンラインで実行し、心臓を青い色で流れ、その後肺に赤色でコントラストを流すことも可能です。略語:A =前方;P =後部;R =正しい;L =左。 この図の拡大版を表示するには、ここをクリックしてください。
オンライン分析とオフライン分析
EITは、プレチスモグラムと肺全体の空気の分布を継続的に測定します。インピーダンスの変動は潮汐量の変化を反映しており、肺の地域評価を可能にします。プレチスモグラムは、吸気と呼気中の肺容積の変化をグラフィカルに表します(図8)。空気の変化は、肺のさまざまな部分で測定できます。これは、地域の換気を評価するEITの最も有利な測定の1つです。
EITデバイスは、肺領域全体をマッピングするための32 x 32マトリックスを作成します。このマトリックスは、肺全体を覆うグリッドに運ばれます。グリッド内の各小さな正方形 (ピクセルと呼ばれます) には、抵抗率またはインピーダンスの値が割り当てられます。インピーダンス値の変化は、肺の特定の部分の肺活量の変化に対応します。
EITは、専用のソフトウェアを使用して、これらのインピーダンス値の変化を取得し、画像を生成します。この画像は、カラースケールで表される体積の変動の大きさを理解するのに役立ちます。明るい青は音量が大きいことを意味し、濃い青は音量が少ないことを示します。インピーダンスの変動や潮汐量の変化は灰色で表されています(図8)。基本的に、それは地図として機能し、これらの変化が肺のどこで発生したかを正確に特定します。
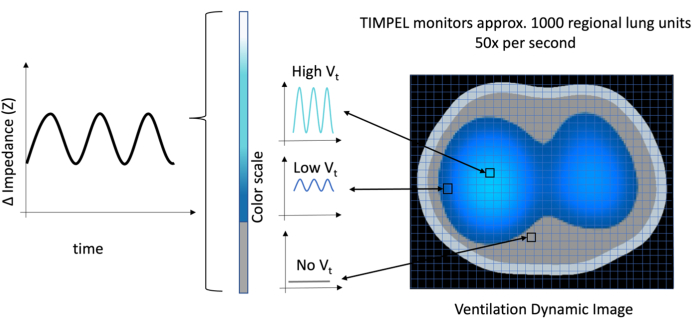
図8:マトリックス32 x 32の各ピクセル、合計1,024ピクセルを示す換気ダイナミック画像。 換気の振幅は、波の振幅と色の強度で表され、灰色は音量なし、明るい青から濃い青に遷移してそれぞれ音量が大きいものから小さいものを表します。 この図の拡大版を表示するには、ここをクリックしてください。
EITが有益である可能性のある臨床状況は数多くあります。例えば、肺の損傷につながる可能性のある合併症や状態(無気肺、過膨張、気胸など)の早期発見などです。無気肺は、入院患者に最もよく見られる病状の1つです。これには、肺組織の部分的または完全な崩壊が伴い、肺の容積が減少し、ガス交換が損なわれます。無気肺は、図9Aに示すようにEITによって検出できます。図 9A と図 9B は、同じ患者からの換気マップ画像で、13 分未満の間隔で撮影されたものです。図9Aでは、インピーダンスの変化の23%のみが後部領域で発生しており、この領域で観察される明るい青と濃い青の領域が減少していることでも確認できます。PEEP が 4 cmH 2 O から 10 cmH2O に増加した後、図 9B は、後肺の換気が 23% から 43% に増加したことを示しています。Figure 9Aと比較して、患者は、18.8から27.6mL/cmH2Oへのコンプライアンスの増加を示す。さらに、駆動圧力の低下があり、潮汐量およびPEEPのさらなる増加が肺14,15に追加のストレスを課さないことを示している。
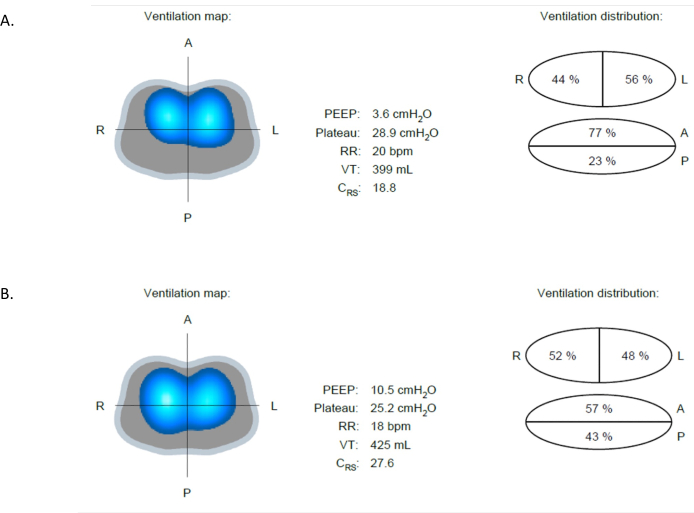
図9:異なるPEEP値での換気の違い (A)PEEP 4 cmH2Oでは、画像は前部(換気が高い)領域と後部(換気が少ない)領域の間の換気の違いを示しています。(B)PEEPが4から10 cmH2Oに増加した後、後部領域の換気の改善が明らかです。略語:PEEP =正終末呼気圧。 この図の拡大版を表示するには、ここをクリックしてください。
過膨張とは、肺組織がその生理学的能力を超えて過剰に拡張または伸張し、肺胞や周囲の構造に損傷を与える可能性があることを指します。肺を膨らませるために人工呼吸器から加えられる圧力が高すぎると、過度の膨張が発生する可能性があります。換気処置中に局所的な肺インピーダンスを監視することで、過度の膨張や肺の損傷を回避できます16。図10Aでは、患者は22cmH2OのPEEPを受けていますが、図10Bでは、PEEPは12cmH2Oに減少しています。図10Bでは、EITの換気ダイナミック画像は、前肺の明るい青と濃い青色の領域の増加を示しており、換気の増加を示しています。同時に、肺後部の明るい青色と濃い青色の領域が減少しており(67%から43%)、図10Aの22cmH2Oという高いPEEPに関連する過膨張の緩和を示唆しています。この例は、EITが過膨張を特定し、肺全体の肺保護換気を促進する能力を示しています9。
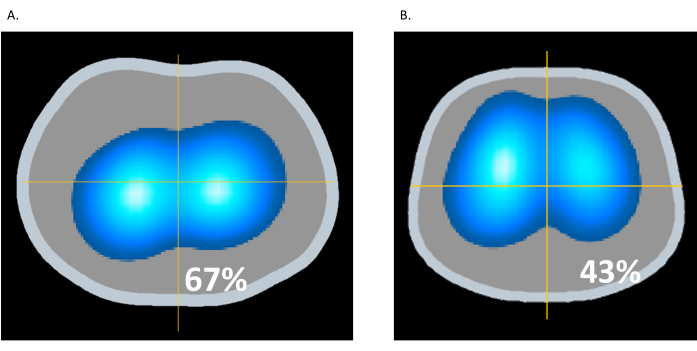
図10:PEEPの変更点。 (A)22cmH2OのPEEP;(B)12 cmH2OのPEEP この図の拡大版を表示するには、ここをクリックしてください。
気胸は、胸膜腔内、肺と胸壁との間の空間に空気が存在することを特徴とする状態です。この空気の蓄積は、肺の虚脱、縦隔シフト、および血行動態の崩壊につながる可能性があります。EIT を使用すると、換気ダイナミック イメージ 17,18,19 に示されているように、胸部インピーダンスの変化をリアルタイムで観察できます。換気ダイナミック画像には、気胸の疑いを示す「位相がずれている」兆候が1つあります。「位相がずれている」記号は、肺のインピーダンス変化が呼吸周期と正しく一致していない視覚的な表示を指します。正常な呼吸周期では、肺のインピーダンス変化は吸入期と呼気期と同期しているはずです。気胸が発生すると、インピーダンスの変化が通常の吸入および呼気段階と同期していないため、換気ダイナミックイメージは予想されるパターンからの逸脱を示します。さらに、プレチスモグラフのベースラインの上昇は、PEEPの減少にもかかわらず、呼気終末肺インピーダンス(EELI)の増加を意味し、気胸の存在をさらに示している可能性があります(図11)。
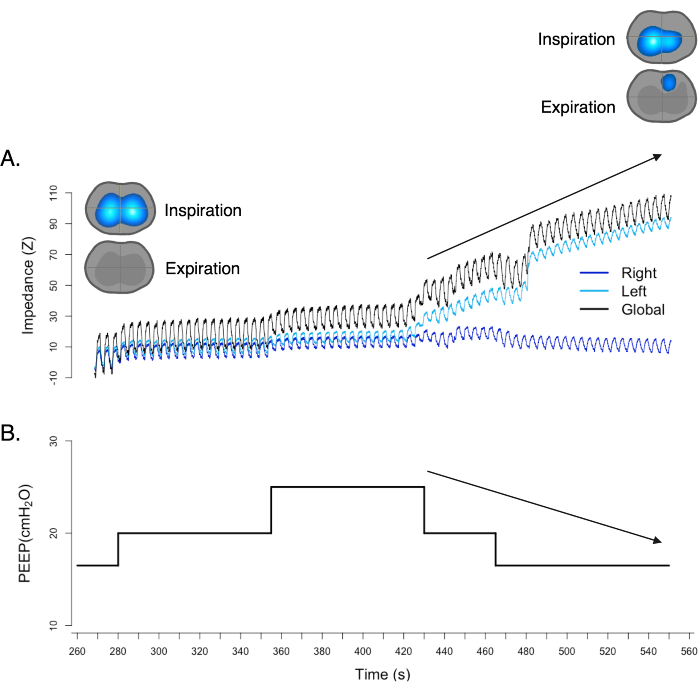
図11:換気マップの「位相がずれている」兆候。 同時に、プレチスモグラフは、PEEPの減少にもかかわらず、ベースラインの上昇を示します。どちらの知見も、気胸の存在を強く支持し、確認しています。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
呼吸器障害と侵襲的人工呼吸器を含む支持的介入の必要性は、入院患者によく見られます。したがって、換気と肺灌流のモニタリングは、迅速かつ個別化された診断と治療に不可欠です。X線やCTスキャンなどの標準的なイメージング技術とは対照的に、EITは、肺とその局所特性の非侵襲的で放射線を使わないイメージングをリアルタイムで提供します1,2,3,4,20。EITは、これらの機能により、集中治療室と手術室の両方のベッドサイドで役立ちます。EITは、換気モニタリングを提供するだけでなく、肺灌流を分析する能力も提供しますが、これは現在、日常的な臨床診療では実現不可能です6,7,8。
人工呼吸器では、肺を保護することが治療の重要な目標です。目標の1つは、肺胞の損傷につながる可能性のある肺の無気肺や過膨張を回避することです。通常、PEEPは無気肺を予防し、肺活量を維持するために投与されます。「PEEP滴定」として知られる個々の患者に最適なPEEPを特定することは、特に急性呼吸窮迫症候群(ARDS)、肥満、腹部高血圧症などの状態では重要な方法です21,22。
従来のPEEP滴定法は、酸素化と肺の力学に依存しています。ただし、このアプローチでは、肺の局所的な変化や、肺の領域が過度に膨張しているか虚脱しているかは考慮されていません。EITなどの高度な技術により、吸気と呼気中の肺のベッドサイドで詳細なリアルタイムイメージングが可能になります。EITを使用したPEEP滴定は、実質の過膨張と虚脱を最小限に抑えながら、酸素化と肺の力学を最適化することができます23,24,25,26,27,28。
最近では、EITの灌流ツールが開発され、局所的な肺血流を詳細に評価し、医師や医療従事者が換気と灌流の関係を推定できるようになりました。EITによって評価された肺灌流は、換気調整および酸素化に対する反応、ならびに肺血管拡張薬療法に対する反応を決定するためにも使用されている9,23,25,29,30,31。さらに、EITは大きな肺灌流障害も検出でき、血栓塞栓症の存在を示唆しています32,33。
EITにはいくつかの禁忌があります。まず、EITは現在、ペースメーカーまたは植込み型除細動器を使用している患者には推奨されていません。現在のところ、EIT信号とペースメーカー機能の電気的干渉を評価した研究はありません。次に、インピーダンス信号は、重大な縦隔肺や皮下肺気腫などの条件によって変化し、換気および灌流マップの正しい解釈を損なう可能性があります。最後に、ベルトが皮膚と密接に接触しているという要件は、胸部包帯34を有する患者にEITを使用する際の課題を提示する。
特定のシナリオでは、灌流ツールの使用を避け、注意を払うことが重要です:昇圧剤の投与量が増加している患者。高ナトリウム血症の患者;活動性気胸および/または気管支胸膜瘻の患者;新生児および小児患者。従来の換気イメージングと並行して灌流評価にEITを利用することで、医療従事者は肺機能をより深く理解することができ、さまざまな臨床現場での患者の診断と治療に役立ちます。
特定の集団に関する考慮事項
EITテクノロジーの原則は、新生児、小児、および成人患者に適用され、それに応じて胸部周囲とベルトサイズが対応します。新生児用のベルトは使い捨てで、大人の48時間ではなく24時間配置することをお勧めします。この集団に関連する小さな潮汐量(3mLから100mLまで)を測定し、対応する1mLのデッドスペースを持つことができる特定のフローセンサーが作成されました。
オンラインモニタリングでは、肺を事前定義された関心領域(ROI)などに分類します。4つの半分(左、右、前方、および後)、または4つの水平層。ただし、オフライン分析では、ピクセル単位など、詳細な分析の機会が増える可能性があります。EITからのすべてのデータは、製品情報管理(PIM)と呼ばれる独自の形式で保存されます。PIMファイルには、断層撮影再構成前の測定電圧、フィルタリングされていない信号、換気パラメータなど、前処理された情報がカプセル化されています。オフライン分析のためにPIMファイルを抽出するには、EITデバイスのスロットにUSBドライブを接続します。次に、インデックス患者を選択します。オフライン解析は、肺生理学を理解するために必要なすべての詳細なデータを提供するため、便利です。
ベッドサイドの診断ツールとして、EITは無気肺、過膨張、気胸などの状態の診断を支援することができます。EITは、臨床症状や身体検査に加えて、これらの診断に関する詳細な情報を提供しています。EIT は、従来の調査と比較して、より迅速な情報検索を可能にします。この機能により、医師やその他の医療従事者は、患者24,35,36,37を診断し、迅速に治療することができます。
EITの使用方法と解釈方法を学ぶことは、臨床現場で有益であることが証明されているため、不可欠です。その非侵襲的な性質とリアルタイムのモニタリング機能により、EITはさまざまな医療現場の医療臨床医にとって貴重なツールとなっています。
開示事項
Glasiele Alcala、Caio C. A. Morais、Marcus Victorはコンサルティング料を受け取り、Carolyn La Vitaは、この研究で使用されたデバイスを製造しているTimpelから証言料を受け取りました。Marcelo B. P. AmatoはTimpelの少数株主です。他の著者のいずれも利益相反を持っていません。
謝辞
この論文に貢献してくださった共著者の皆様に心から感謝するとともに、この原稿を機材とサポートで寛大にサポートしてくださったTIMPEL Medicalに感謝いたします。
資料
| Name | Company | Catalog Number | Comments |
| EIT equipment (ENLIGHT2100) | Timpel Medical | ||
| Belts | Timpel Medical | ||
| Belt coverage | Timpel Medical | ||
| Flow sensor | Philips | ||
| Reference Cable | Timpel Medical | ||
| Solution with high electrical conductivity (eg. hypertonic saline, sodium bicarbonate) | Not applicable |
参考文献
- Costa, E. L., Lima, R. G., Amato, M. B. Electrical impedance tomography. Curr Opin Crit Care. 15 (1), 18-24 (2009).
- Frerichs, I., et al. Chest electrical impedance tomography examination, data analysis, terminology, clinical use and recommendations: consensus statement of the TRanslational EIT developmeNt stuDy group. Thorax. 72 (1), 83-93 (2017).
- Borges, J. B., et al. Regional lung perfusion estimated by electrical impedance tomography in a piglet model of lung collapse. J Appl Physiol (1985). 112 (1985), 225-236 (2012).
- Victorino, J. A., et al. et al. Imbalances in regional lung ventilation: a validation study on electrical impedance tomography. Am J Respir Crit Care Med. 169 (7), 791-800 (2004).
- Heines, S. J. H., et al. Pulmonary pathophysiology development of COVID-19 assessed by serial Electrical Impedance Tomography in the MaastrICCht cohort. Sci Rep. 12 (1), 14517 (2022).
- Nascimento, M. S., et al. Effect of general anesthesia and controlled mechanical ventilation on pulmonary ventilation distribution assessed by electrical impedance tomography in healthy children. PLoS One. 18 (3), e0283039 (2023).
- Zhao, Z., Fu, F., Frerichs, I. Thoracic electrical impedance tomography in Chinese hospitals: a review of clinical research and daily applications. Physiol Meas. 41 (4), 01 (2020).
- Kobylianskii, J., Murray, A., Brace, D., Goligher, E., Fan, E. Electrical impedance tomography in adult patients undergoing mechanical ventilation: A systematic review. J Crit Care. 35, 33-50 (2016).
- Costa, E. L., et al. Bedside estimation of recruitable alveolar collapse and hyperdistension by electrical impedance tomography. Intensive Care Med. 35 (6), 1132-1137 (2009).
- Mendes, P. V., et al. Lung perfusion during veno-venous extracorporeal membrane oxygenation in a model of hypoxemic respiratory failure. Intensive Care Med Exp. 10 (1), 15 (2022).
- Gaulton, T. G., et al. Regional lung perfusion using different indicators in electrical impedance tomography. J Appl Physiol (1985). 135 (3), 500-507 (2023).
- Martin, K. T., et al. Electrical impedance tomography identifies evolution of regional perfusion in a porcine model of acute respiratory dstress syndrome. Anesthesiology. 139 (6), 815-826 (2023).
- Xin, Y., et al. Improving pulmonary perfusion assessment by dynamic contrast-enhanced computed tomography in an experimental lung injury model. J Appl Physiol (1985). 134 (6), 1496-1507 (2023).
- vander Burg, P. S., Miedema, M., de Jongh, F. H., van Kaam, A. H. Unilateral atelectasis in a preterm infant monitored with electrical impedance tomography: a case report. Eur J Pediatr. 173 (12), 1715-1717 (2014).
- Riva, T., et al. Evaluation of atelectasis using electrical impedance tomography during procedural deep sedation for MRI in small children: A prospective observational trial. J Clin Anesth. 77, 110626 (2022).
- He, H., et al. Influence of overdistension/recruitment induced by high positive end-expiratory pressure on ventilation-perfusion matching assessed by electrical impedance tomography with saline bolus. Crit Care. 24 (1), 586 (2020).
- Girrbach, F., et al. Detection of posttraumatic pneumothorax using electrical impedance tomography-An observer-blinded study in pigs with blunt chest trauma. PLoS One. 15 (1), e0227518 (2020).
- Yang, Y., et al. Bedside electrical impedance tomography in early diagnosis of pneumothorax in mechanically ventilated ICU patients - a single-center retrospective cohort study. J Clin Monit Comput. 37 (2), 629-637 (2023).
- Kallio, M., et al. Electrical impedance tomography reveals pathophysiology of neonatal pneumothorax during NAVA. Clin Case Rep. 8 (8), 1574-1578 (2020).
- Pereira, S. M., et al. Individual positive end-expiratory pressure settings optimize intraoperative mechanical ventilation and reduce postoperative atelectasis. Anesthesiology. 129 (6), 1070-1081 (2018).
- Jimenez, J. V., Weirauch, A. J., Culter, C. A., Choi, P. J., Hyzy, R. C. Electrical impedance tomography in acute respiratory distress syndrome management. Crit Care Med. 50 (8), 1210-1223 (2022).
- Becher, T., et al. Individualization of PEEP and tidal volume in ARDS patients with electrical impedance tomography: a pilot feasibility study. Ann Intensive Care. 11 (1), 89 (2021).
- Barbas, C. S. V., Amato, M. B. P. Electrical impedance tomography to titrate PEEP at bedside in ARDS. Respir Care. 67 (8), 1061-1063 (2022).
- Maciejewski, D., Putowski, Z., Czok, M., Krzych, L. J. Electrical impedance tomography as a tool for monitoring mechanical ventilation. An introduction to the technique. Adv Med Sci. 66 (2), 388-395 (2021).
- Jonkman, A. H., et al. Lung recruitment assessed by electrical impedance tomography (RECRUIT): A multicenter study of COVID-19 acute respiratory distress syndrome. Am J Respir Crit Care Med. 208 (1), 25-38 (2023).
- Jimenez, J. V., et al. Electric impedance tomography-guided PEEP titration reduces mechanical power in ARDS: a randomized crossover pilot trial. Crit Care. 27 (1), 21 (2023).
- Sella, N., et al. Electrical impedance tomography: A compass for the safe route to optimal PEEP. Respir Med. 187, 106555 (2021).
- Slobod, D., et al. Integrating electrical impedance tomography and transpulmonary pressure monitoring to personalize PEEP in hypoxemic patients undergoing pressure support ventilation. Crit Care. 26 (1), 314 (2022).
- Spina, S., et al. Modulation of pulmonary blood flow in patients with acute respiratory failure. Nitric Oxide. 136-137, 1-7 (2023).
- Cenci, S., Santiago, R. S., Bittner, E. A., Berra, L. Assessing regional lung perfusion changes to inhaled pulmonary vasodilators by electrical impedance tomography. Am J Respir Crit Care Med. 208 (9), e39-e40 (2023).
- Ekkapat, G., Ribeiro De Santis Santiago, R., Victor, M., Berra, L. Electrical impedance tomography for assessing the impact of inhaled nitric oxide on pulmonary artery pressure. Anesthesiology. , (2024).
- He, H., et al. Bedside evaluation of pulmonary embolism by saline contrast electrical impedance tomography method: A prospective observational study. Am J Respir Crit Care Med. 202 (10), 1464-1468 (2020).
- He, H., et al. Three broad classifications of acute respiratory failure etiologies based on regional ventilation and perfusion by electrical impedance tomography: a hypothesis-generating study. Ann Intensive Care. 11 (1), 134 (2021).
- Ribeiro De Santis Santiago, R., et al. Lung imaging acquisition with electrical impedance tomography: Tackling common pitfalls. Anesthesiology. 139 (3), 329-341 (2023).
- Zhou, R., et al. Electrical impedance tomography to aid in the identification of hypoxemia etiology: Massive atelectasis or pneumothorax? A case report. Front Med (Lausanne). 9, 970087 (2022).
- Rubin, J., Berra, L. Electrical impedance tomography in the adult intensive care unit: clinical applications and future directions. Curr Opin Crit Care. 28 (3), 292-301 (2022).
- Tomicic, V., Cornejo, R. Lung monitoring with electrical impedance tomography: technical considerations and clinical applications. J Thorac Dis. 11 (7), 3122-3135 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved