Method Article
在重症监护病房使用电阻抗断层扫描监测肺功能
* 这些作者具有相同的贡献
摘要
电阻抗断层扫描是一种无创、无辐射、实时肺通气监测工具。通过测量胸部的阻抗变化,它可以在每次呼吸的基础上可视化空气的分布。电阻抗断层扫描最初用于通气监测,也可以通过静脉注射生理盐水来测量灌注。
摘要
电阻抗断层扫描 (EIT) 是一种开创性的、无创的、无辐射的成像技术,用于连续、实时的通气监测。它在肺灌注监测中也有应用。EIT 通过测量和处理胸部阻抗变化来量化整个肺部的通气和灌注模式。它是临床医生可视化肺功能每次呼吸变化的有力工具。
EIT 的一个创新应用是它能够使用屏气期间高渗溶液注射的动力学分析来评估肺灌注。该解决方案在通过肺血管系统循环时在胸腔中产生阻抗变化。这种间接方法允许估计灌注模式,为我们了解床旁的肺血流动力学做出了重大贡献。
EIT 不仅是一种监测工具,而且对于气胸和支气管插管等呼吸系统病变的诊断也至关重要。它可以帮助确定接受有创机械通气的患者通气/灌注 (V/Q) 不匹配的病因,这是其他诊断工具无法实现的。此外,EIT 可以帮助个体优化呼吸机设置,例如呼气末正压 (PEEP) 滴定和潮气量,从而改善重症监护中的氧合和肺部健康。
总之,EIT 代表了床边肺部监测和诊断的范式转变。其非侵入性和数据即时性使 EIT 成为现代呼吸医学中不可或缺的工具。随着其应用的增长,EIT 将在促进我们对呼吸护理的理解和方法方面发挥关键作用,尤其是在重症监护环境中。
引言
电阻抗断层扫描 (EIT) 是一种肺部监测技术,可将阻抗随时间的变化转化为地形图像。这是通过从圆周放置在躯干上的电极注入低交流电 (5-10 mA) 来实现的(图 1A)。阻抗反映了组织对这种电流流动的抵抗力。吸气时,阻抗增加,而呼气时阻抗降低。在存在静脉输液的情况下,阻抗也会发生类似的变化。例如,当通过中心导管注射与血液相比具有更高导电性的液体时,电阻抗会相应降低 1,2,3,4。
为了实用起见,EIT 的电极(数量为 16 或 32 个)放置在腰带上,然后将其放置在患者的胸部周围,特别是在第 4 和第 5 肋间隙之间。这种放置提供了肺部的最佳视野,并减少了横膈膜的干扰。在测量过程中,两个不同的电极依次注入预设电流,而其余电极充当相应电压读数的接收器。每对电极都快速重复此过程,以 20-50 Hz 的频率围绕胸部旋转。这种快速旋转是 EIT 具有高时间分辨率的原因。胸部 EIT 设备从每个测量周期中计算胸部横截面中的电阻抗分布,并将这些值转换为二维图像。然后,此图像将实时显示在专用显示器上。
EIT 有多种临床应用。基于阻抗技术,可以监测胸腔内空气的分布和灌注的分布,特别是当使用造影剂以产生肺阻抗变化时。确定机械通气患者的 PEEP 设置既具有挑战性,又对于减少肺损伤至关重要。此外,它能够跟踪通气和灌注随时间的变化,为纵向患者监测提供了宝贵的数据。在患者病情可能迅速变化的动态临床环境中,这方面至关重要5。
EIT 不仅有助于可视化通过流量传感器或呼吸机获得的数据(如果 EIT 设备与呼吸机连接),还可以提供有关过度膨胀和局部崩溃的重要信息 6,7,8,9。生成的图像提供有关肺部的功能信息,但不用于解剖学诊断,也不会发出辐射。在美国,EIT 设备 ENLIGHT 2100 是目前唯一获得美国食品和药物管理局 (FDA) 批准的设备。其他公司现在正在获得 FDA 批准,以便在成人、儿童和新生儿人群中使用 EIT。在本文中,我们使用了 ENLIGHT 2100 设备的硬件(例如皮带和屏幕)、通气和灌注图。
除了监测仪本身之外,EIT 套件设置还包括三个基本设备,即电极带、流量传感器和参考电缆。 电极带 用于获得断层扫描二维图像。EIT 肺部图像被构建成具有不同分辨率的二维表示,例如 32 x 32、24 x 24 或 16 x 16 像素,具体取决于胸部围长大小和制造商的规格。使用重建算法从电压测量中生成图像。 该流量传感器 专为单个患者使用而设计,有两种尺寸:一种用于成人和儿童患者,另一种用于新生儿。成人儿童流量传感器无法测量小于 40 mL 的潮气量,而新生儿传感器可以记录 0 至 100 mL 的潮气量。如果没有流量传感器,EIT 仅显示阻抗数据。一旦流量传感器连接到患者,就可以将阻抗波形中的数据与压力、流量和体积参数同步。 参考电缆 可重复使用,并用作电流注入值的参考点。
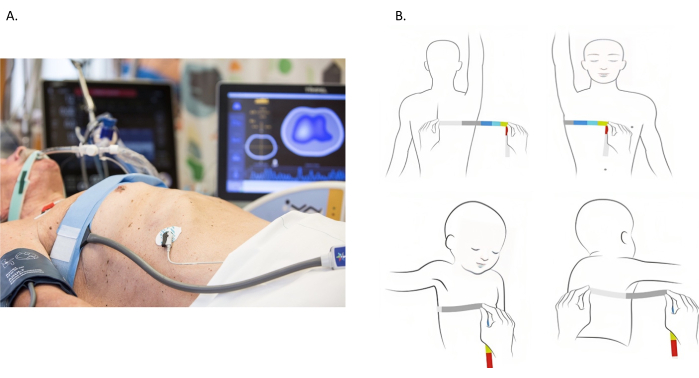
图 1:电阻抗断层扫描电极带的放置。(A) 在第 4 和第 5 肋间隙放置在胸部周围的电阻抗断层扫描电极带。(B) 测量胸部。通过将卷尺缠绕整个胸部来测量胸部。然而,大多数患者卧床不起,测量整个胸部是不可行的。图像中说明了另一种方法。从棘突到胸骨评估胸围。然后将测量值加倍以考虑胸部的对侧部分。请单击此处查看此图的较大版本。
本视频论文的主要重点是为读者提供熟练记录和解释 EIT 图像所需的知识和技能。为了实现这一目标,我们将概述 EIT 原理,展示其肺部空气分布的实时可视化功能,并探索其在灌注评估中的扩展应用。通过实现这些目标,我们的目标是使观众能够自信地利用 EIT 技术进行肺部评估。
研究方案
本文中提供的图像是匿名的,并且是正在进行的协议的一部分,在 ClinicalTrials.gov 注册编号为 NCT04497454并得到当地伦理委员会(巴西圣保罗大学 Incor/HC-FMUSP 4001231)的批准。
1. 如何开始使用 EIT 设备
- EIT 传送带和放置
- 测量胸壁以准确选择输送带尺寸。
- 使用卷尺测量第 4 和第 5 肋间隙之间的胸椎周长(图 1B)。对于乳房大的患者,将腰带移至较高的肋间间隙。
- 用带有导电凝胶的一次性材料覆盖电极带。
注意:这可确保粘附在患者的皮肤上,即使是那些头发很多的患者,也有助于捕获阻抗信号。 - 将腰带放在患者胸壁的第 4 和第 5 肋间隙(与测量的周长相同),并确保放置腰带时电极没有重叠。
- 保持连续性,背部没有间隙,因为图像重建算法允许与皮带尺寸成正比的前间隙。
- 在放置安全带期间,转动患者以接触背部。保护气道、所有留置静脉或动脉管路和引流管,并遵循医疗保健专业人员提供的具体指南。
- 将流量传感器连接到靠近 Y 形件的通风回路上,并将其与传感器朝上放置,以防止液体积聚和信号干扰(图 2A)。
- 将参比电极连接到心电图 (ECG) 电极。
注意:在没有参考电缆的情况下无法监测患者(图 2B)。- 对于成人和儿童患者,将电极放在腹部或肩部。
- 对于新生儿患者,将电极放在腿部。
- 打开 EIT 并输入患者人口统计数据(图 3)。
- 开始监测并避免任何患者移动;开始监测后,生成参考图像并显示通风屏幕(图 4)。生成两个图像: 动态图像 和 通风图。
注意: 在录制过程中,避免患者的任何移动干扰皮带至关重要。 - EIT 设备上的 PEEP 滴定工具的分步作
- 从主屏幕图标中选择 PEEP Titration Tool(PEEP 滴定工具)。
- 通过单击 Tool Options 图标来访问 Tool Options。
- 设置 Time Intervals (设置时间间隔 ) 以调整滴定期间 PEEP 变化的时间间隔,以稳定每种情况下的通气。
注意:时间间隔取决于患者的病情(例如,血流动力学不稳定)和设备的说明。 - 调整 Threshold 值以自动检测 PEEP 变化。
- 按 PEEP Titration 屏幕上的 Start(开始)开始滴定,以根据 PEEP 变化的调整时间启动倒计时。
- 出现提示时,根据方案调整呼吸机上的 PEEP 值。设备将自动检测此更改并开始新的倒计时。
- 监视 PEEP 更改 - 屏幕会随着每个 PEEP 更改而更新。如果自动检测失败,请手动停止并注释该过程。(可选)提供注释或命名滴定。然后将显示 PEEP 滴定图。
- EIT 设备上的 灌注工具 的分步作
- 患者准备
- 确保足够的镇静剂,必要时进行神经肌肉阻滞,因为任何呼吸努力都可能扰乱手术。
注意:尽管进行了机械通气监测,患者仍可能表现出无法检测到的呼吸努力。
- 确保足够的镇静剂,必要时进行神经肌肉阻滞,因为任何呼吸努力都可能扰乱手术。
- 启动该过程。单击 Start 开始 EIT 软件中的图标。
- 通气周期识别
- 让软件识别几个通气周期以建立基线数据。
- 呼吸暂停和注射
- 切换到持续气道正压通气 (CPAP) 或压力支持通气 (PSV) 模式,压力支持为 0 cmH2O。 保持此状态 20 秒以上。在此期间,通过颈内静脉或锁骨下静脉的中心静脉通路导管快速持续地注射 10 mL 7.5% 高渗盐水溶液或 8.4% 碳酸氢盐。
- 恢复通气。 注射完成后,恢复正常通气设置。
- 图像重建
- 让 EIT 算法根据流经心脏和肺部的造影剂的首次通过动力学重建灌注图像。
- 患者准备
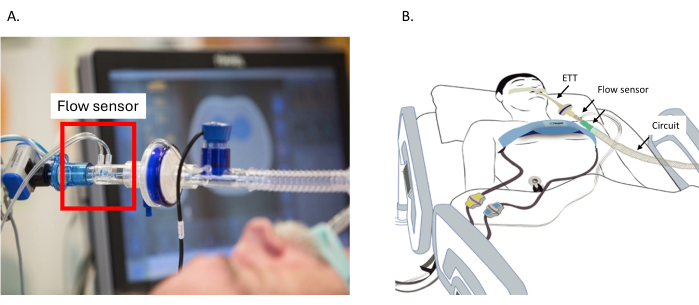
图 2:流量传感器的放置。 (A) 在回路和 ETT 之间放置流量传感器。(B) 胸部周围的腰带连接到 EIT 装置。流量传感器连接在 ETT 和回路之间。连接到腹部电极的参比电缆。缩写:ETT = 气管插管。 请单击此处查看此图的较大版本。
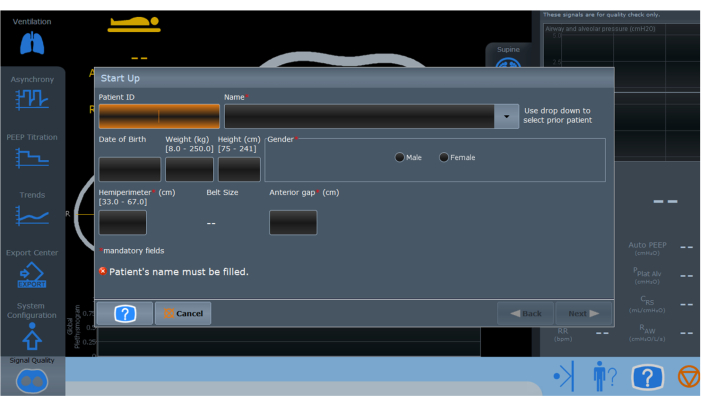
图 3:电阻抗断层扫描监测设备的初始化屏幕。 标有红色星号的字段表示必须填写的必填信息才能正确设置和作。 请单击此处查看此图的较大版本。
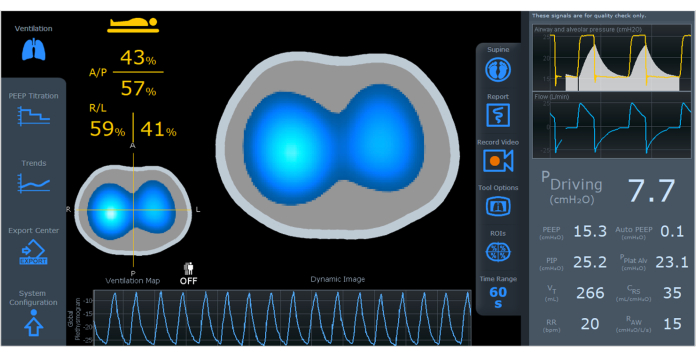
图 4:EIT 屏幕显示动态图像、通气图和体积描记图。 在屏幕的左侧,有按区域 ((A/P, R/L) 划分的通风分布。在屏幕的右侧,有通风参数,包括驱动压力、PEEP、自动 PEEP、PIP、PPlat Alv、VT、CRS、RR 和 RAW。缩写: EIT = 电阻抗断层扫描;A/P=前/后,R/L=右/左;PEEP = 呼气正压;PIP = 吸气峰压;PPlat Alv = 肺泡平台压;VT = 潮气量;CRS = 呼吸系统顺应性;RR = 呼吸频率;RAW = 气道阻力。请单击此处查看此图的较大版本。
结果
通风监测
动态图像(图 4)使用从深蓝色(通风最少)到白色(通风最多)的颜色显示通风期间空气分布的实时变化,以表示区域变化。灰色区域表示通风没有变化。动态图像允许快速识别肺内时间常数的差异和悖论模式的存在。重要的是要注意,在呼吸周期中空气变化有限的区域可能是由过度膨胀或塌陷区域引起的。
"通风图"(图 4)说明了在呼吸循环期间,空气量如何在定义的横截面上分布。亮蓝色表示接收大部分潮气量的肺部区域,这与吸气和呼气之间阻抗信号的变化成正比。相反,深蓝色表示体积变化较小的区域。通气图可以评估肺内的区域通气分布。肺部分为前/后和右/左区域,允许进行详细评估并在屏幕上显示特定区域的体积描记器4。
体积描记图胸阻抗变化曲线(图 4)表示对应于潮气量的波幅,基线相当于肺曝气量或功能残气量 (FRC) 或呼气末肺容积 (EELV)。曝气信息可以估计胸腔内总气量的相对变化。
屏幕右侧的气道参数(图 4)由流量传感器捕获,并以波形图和数字显示。在受控循环期间计算驱动压力、自动 PEEP、肺泡平台压、柔度和阻力(在右侧的数字列中)等参数。PEEP、峰值压力、潮气量和呼吸频率参数将在所有周期中显示。使用近端流量传感器可以将通气和阻抗数据集成到同一屏幕上,无论机械呼吸机的品牌或型号如何。
PEEP 滴定工具(图 5)
患者应与呼吸机同步,避免可能影响 PEEP 滴定的自主呼吸努力和运动。这可以通过足够的镇静剂来实现,如有必要,可以使用麻痹剂。流量传感器和呼吸机管应没有任何障碍物,例如液体和分泌物,以保持准确监测。
EIT 检测区域通气的变化,当与流量计集成时,能够估计区域呼吸力学,包括气道压力、潮气量和流量。它通过计算区域顺应性变化,将结果表示为不同 PEEP 水平的塌陷和过度扩张区域的百分比。一些作者建议将 PEEP 滴定到过度膨胀百分比(图 5 中的白色曲线和图 6 中的白色区域)和塌陷百分比(图 5 中的蓝色曲线和图 6 中的蓝色区域)之间的交叉点。在这个 PEEP 水平下,过度膨胀和塌陷区域(图 5 中的橙色曲线)和肺功能的发生率最低。正在进行的研究正在调查设置在高膨胀和虚脱之间交叉点的 PEEP 是否具有临床优势。
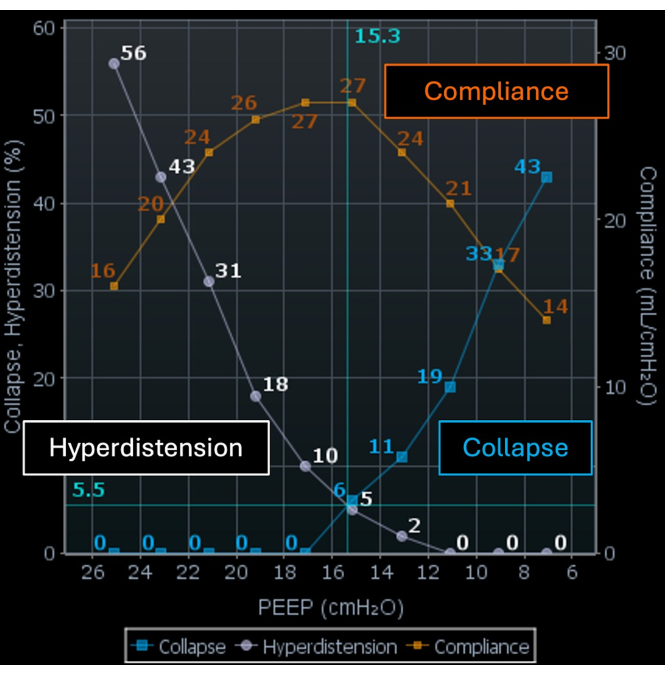
图 5:EIT 屏幕上的 PEEP 滴定工具。 橙色曲线表示顺应性,白色曲线表示腹胀,蓝色曲线表示虚脱。缩写: EIT = 电阻抗断层扫描;PEEP = 呼气末正压。 请单击此处查看此图的较大版本。
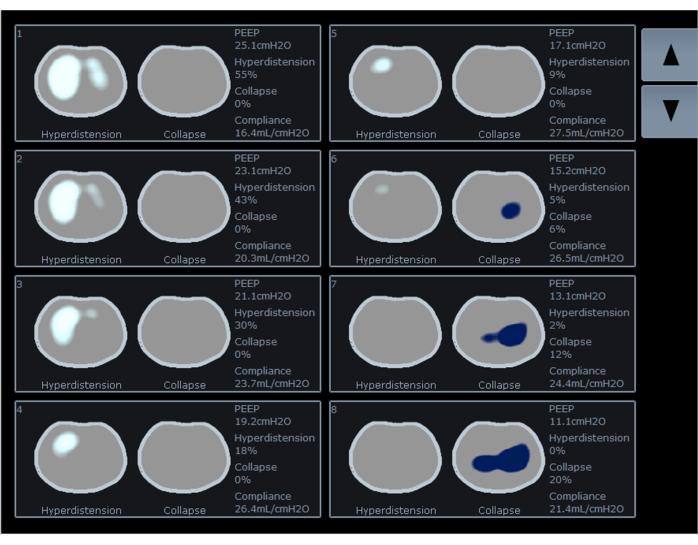
图 6:在 EIT 屏幕上显示高膨胀(白色)和塌陷(蓝色)的百分比,以及不同 PEEP 值的顺应性。 缩写: EIT = 电阻抗断层扫描;PEEP = 呼气末正压。 请单击此处查看此图的较大版本。
使用 EIT 评估肺灌注:医疗保健提供者指南
电阻抗断层扫描 (EIT) 最近被认为是一种有价值的肺通气监测工具,通过测量电导率的变化。虽然 EIT 主要侧重于评估肺内的空气分布,但它也可以通过创新技术为肺灌注提供有价值的见解。
血液在胸腔中运动引起的压力变化的幅度比与通气相关的变化要小得多。因此,EIT 传统上不用于测量灌注。然而,某些涉及静脉注射高渗盐水溶液并结合屏气作的方法可以隔离和放大与血流相关的阻抗变化。当这种溶液穿过血管时,它会改变血液的电特性,EIT 可以检测到这些特性。EIT 可以通过观察该解决方案在肺血管系统中循环时引起的阻抗变化来间接推断灌注模式。这种方法使我们能够更深入地了解同时在肺内的通气和灌注10。该工具仅用于美国和/或根据当地医院的规定和/或其他国家/地区的法律机构监管机构的批准进行研究。
可视化肺灌注
静脉注射具有高导电性的溶液,例如高渗盐水或碳酸氢钠,有助于可视化肺血管内的血流 11,12,13。与灌注较少的区域相比,灌注较高的区域表现出不同的阻抗模式。EIT 的这种创新应用允许在通气成像的同时对灌注进行相对评估,提供肺功能的全面视图,这有助于区分由灌注缺陷引起的低氧血症,通常使用调节肺灌注的疗法治疗,与由通气障碍引起的低氧血症,通常通过通气策略或位置变化来解决。此应用程序还允许监测响应既定治疗(例如吸入一氧化氮、抗凝剂和溶栓药物)的区域肺灌注的变化。
灌注工具
EIT 中的灌注工具专门设计用于在受控机械通气期间可视化肺血流。它涉及在短暂的呼吸暂停期间将高渗盐水溶液注射到静脉中。生成的图像显示了胸部横截面中肺灌注的分布,颜色范围从黄色(表示灌注较高)到深红色(表示灌注较低)(见 图 7)。
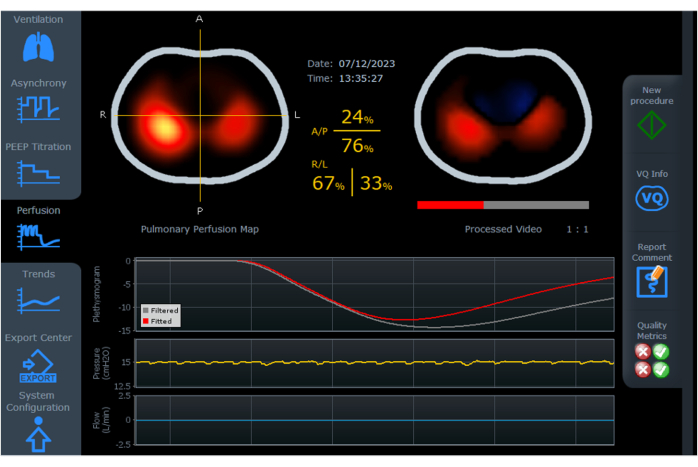
图 7:灌注分布到胸部不同区域的百分比变化。 显示了前、后、右和左灌注的变化,胸部横截面的颜色范围从黄色(较高灌注)到深红色(较低灌注)。还可以在线运行处理后的视频,以蓝色显示流经心脏的对比,然后以红色流经肺部。缩写: A = 前;P = 后;R = 右;L = 左。 请单击此处查看此图的较大版本。
在线和离线分析
EIT 持续测量体积描记图和整个肺部的空气分布。阻抗变化反映了潮气量的变化,从而能够对肺部进行区域评估。体积描记图以图形方式表示吸气和呼气期间的肺容量变化(图8)。可以在肺部的不同部位测量空气的变化。这是 EIT 最有利的测量方法之一,因为它评估了区域通风。
EIT 设备创建一个 32 x 32 的矩阵来映射整个肺部区域。该基质被输送到覆盖整个肺的网格中。网格中的每个小方块(称为像素)都被分配了一个电阻率或阻抗值。阻抗值的变化对应于肺特定部位肺体积的变化。
使用专用软件,EIT 获取阻抗值的这些变化并生成图像。这张图片帮助我们了解体积变化的大小,用色标表示。亮蓝色表示高音量,深蓝色表示低音量。阻抗没有变化或潮气量没有变化用灰色表示(图 8)。从本质上讲,它的作用就像一张地图,精确定位这些变化在肺部发生的位置。
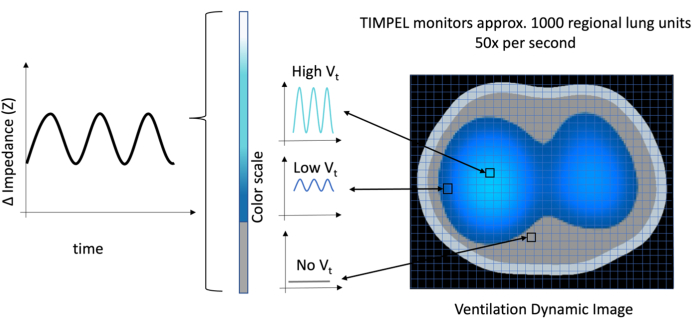
图 8:通风动态图像,展示了 32 x 32 矩阵中的每个像素,总计 1,024 个像素。 通风的振幅由波的振幅和颜色的强度表示,灰色表示没有音量,从亮蓝色过渡到深蓝色分别表示高音量到低音量。 请单击此处查看此图的较大版本。
EIT 在许多临床情况下可能是有益的。例如,早期识别可能导致肺损伤的并发症和病症,例如肺不张、过度膨胀和气胸。肺不张是住院患者中最常见的病症之一。它涉及肺组织的部分或完全塌陷,减少肺容量并损害气体交换。肺不张可以通过 EIT 检测到,如图 9A 所示。图 9A 和图 9B 是来自同一患者的通气图图像,相隔不到 13 分钟。在图 9A 中,只有 23% 的阻抗变化发生在后部区域,这也可以从该区域观察到的亮蓝色和深蓝色区域的减少中看出。在 PEEP 从 4 cmH 2 O 增加到 10 cmH2O 后,图 9B 显示后肺通气量增加,从 23% 增加到 43%。与图 9A 相比,患者的顺应性从 18.8 mL/cmH 2 O 增加到 27.6 mL/cmH2O。值得注意的是,这种增加发生在双侧后部区域,这从后部浅蓝色和深蓝色区域增加中可以明显看出(图 9B)。此外,驱动压力降低,表明潮气量和 PEEP 的进一步增加不会对肺部施加额外的压力14,15。
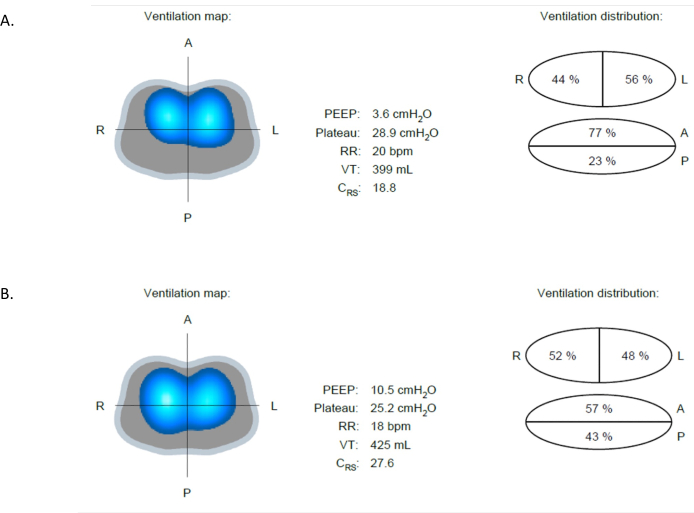
图 9:不同 PEEP 值下的通气差异。 (A) 在 PEEP 4 cmH2O 时,图像显示了前部(通气性较强)和后部(通气性较差)区域之间的通气差异。(B) 在 PEEP 从 4 cmH 2 O 增加到 10 cmH2O 后,后部区域的通气明显改善。缩写:PEEP = 正端呼气压。 请单击此处查看此图的较大版本。
过度膨胀是指肺组织过度扩张或拉伸超过其生理能力,导致对肺泡和周围结构的潜在损害。当机械呼吸机施加的用于给肺部充气的压力过高时,可能会发生过度膨胀。在通气过程中监测区域肺阻抗可避免过度膨胀和肺损伤16。在图 10A 中,患者的 PEEP 为 22 cmH2O,而在 图 10B 中,PEEP 降低到 12 cmH2O。在图 10B 中,来自 EIT 的通气动态图像显示前肺浅蓝色区域和深蓝色区域增加,表明通气增加。同时,后肺的浅蓝色和深蓝色区域减少(从 67% 减少到 43%),表明与图 10A 中 22 cmH2O 的较高 PEEP 相关的过度膨胀得到缓解。这个例子显示了 EIT 识别过度膨胀并促进跨肺肺保护性通气的能力9。
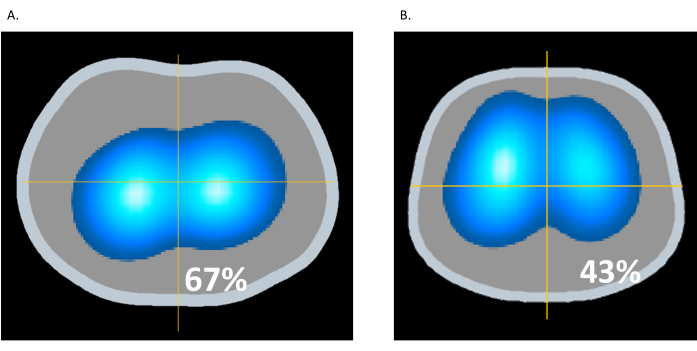
图 10:PEEP 的变化。 (A) PEEP 为 22 cmH2O;(B) 12 cmH2O 的 PEEP。 请点击此处查看此图的较大版本。
气胸是一种以胸膜腔(肺和胸壁之间的空间)中存在空气为特征的疾病。这种空气积聚可导致肺塌陷、纵隔移位和血流动力学衰竭。使用 EIT,可以实时观察到胸阻抗的变化,如通气动态图像 17,18,19 所示。通气动态图像中有一个体征显示疑似气胸,称为"异相"体征。"异相"标志是指肺部阻抗变化与呼吸周期不正确对齐的视觉指示。在正常的呼吸周期中,肺部的阻抗变化应与吸气和呼气阶段同步。当发生气胸时,通气动态图像将显示与预期模式的偏差,因为阻抗变化与正常的吸气和呼气阶段不同步。此外,尽管 PEEP 降低,但体积描记器基线的升高意味着呼气末肺阻抗 (EELI) 的增加,可能进一步表明气胸的存在(图11)。
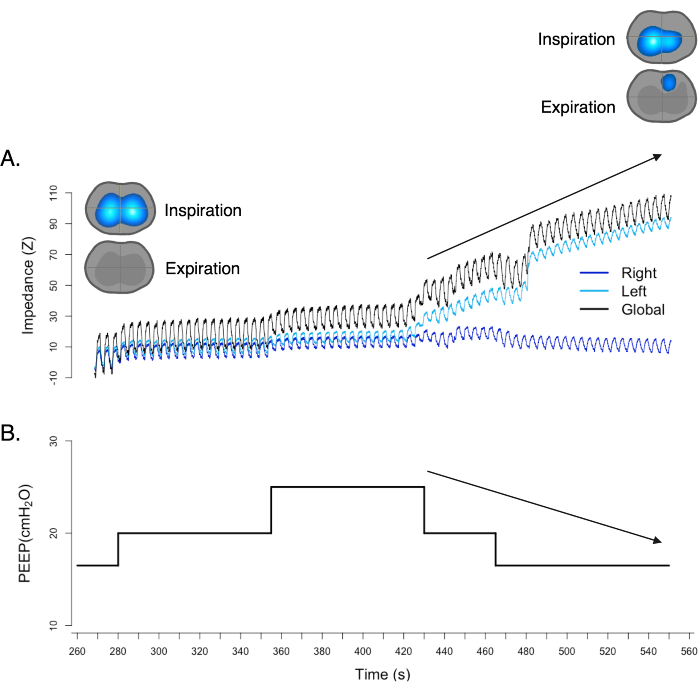
图 11:通风图中的"异相"标志。 同时,尽管 PEEP 降低,但体积描记器显示基线升高。这两个发现都强烈支持并证实了气胸的存在。 请单击此处查看此图的较大版本。
讨论
呼吸障碍和需要支持性干预(包括有创机械通气)在住院患者中很常见。因此,监测通气和肺灌注对于及时和个性化的诊断和治疗至关重要。与 X 射线和计算机断层扫描 (CT-scan) 等更标准的成像技术相反,EIT 提供肺部及其区域特征的实时无创、无辐射成像 1,2,3,4,20。由于这些功能,EIT 在重症监护病房和手术室的床边都很有用。EIT 不仅提供通气监测,而且还提供分析肺灌注的能力,这在目前常规临床实践中是不可行的 6,7,8。
在机械通气期间,保护肺部是一个关键的治疗目标。目标之一是避免肺不张和肺过度膨胀,这可能导致肺泡损伤。通常,PEEP 用于预防肺不张和维持肺容量。确定个体患者的最佳 PEEP,称为"PEEP 滴定"是一种至关重要的方法,尤其是在急性呼吸窘迫综合征 (ARDS)、肥胖和腹高血压等情况下21,22。
PEEP 滴定的常规方法依赖于氧合和肺力学。然而,这种方法没有考虑局部肺部变化以及肺部区域是否过度膨胀或塌陷。EIT 等先进技术可在吸气和呼气期间对肺部进行床边详细、实时成像。使用 EIT 的 PEEP 滴定可以优化氧合和肺力学,同时最大限度地减少实质过度膨胀和塌陷 23,24,25,26,27,28。
最近,EIT 的灌注工具已被开发出来,以提供对区域肺血流的详细评估,使医生和医务人员能够估计通气-灌注关系。通过 EIT 评估的肺灌注也用于确定对通气调整和氧合的反应以及对肺血管扩张剂治疗的反应 9,23,25,29,30,31。此外,EIT 还可以检测大的肺灌注缺损,表明存在血栓栓塞32,33。
EIT 有一些禁忌症。首先,目前不建议使用起搏器或植入式除颤器的患者进行 EIT。目前,还没有研究评估 EIT 信号和起搏器功能的电干扰。其次,阻抗信号可能会因严重纵隔气肿或皮下肺气肿等情况而改变,从而损害对通气和灌注图的正确解释。最后,腰带与皮肤紧密接触的要求对使用胸部绷带的患者使用 EIT 提出了挑战34。
在某些情况下,谨慎行事并避免使用灌注工具至关重要:接受增加剂量的血管加压药的患者;高钠血症患者;活动性气胸和/或支气管胸膜瘘患者;新生儿和儿科患者。利用 EIT 进行灌注评估以及传统的通气成像,使医疗保健提供者能够更深入地了解肺功能,从而有助于在各种临床环境中诊断和治疗患者。
特定人群的注意事项
EIT 技术的原则适用于新生儿、儿科和成人患者,胸部围和腰带尺寸相应。新生儿腰带是一次性的,建议放置 24 小时,而不是成人的 48 小时。已经创造了一种特殊的流量传感器,能够测量与该群体相关的小潮气量(从 3 mL 到 100 mL),并且相应的死腔为 1 mL。
例如,在线监测将肺部分类为预定义的感兴趣区域 (ROI)。四半(左、右、前和后)或四个水平层。但是,离线分析可以提供更多深入分析的机会,例如逐个像素。来自 EIT 的所有数据都以称为产品信息管理 (PIM) 的专有格式存储。PIM 文件封装了预处理信息,包括断层扫描重建前测得的电压、未过滤的信号和通气参数。要提取 PIM 文件进行离线分析,请将 USB 驱动器插入 EIT 设备上的插槽;然后,选择索引 patient。离线分析非常有用,因为它提供了了解肺生理学所需的所有详细数据。
作为床旁诊断工具,EIT 可以帮助诊断肺不张、过度膨胀和气胸等疾病。除了临床表现和体格检查外,EIT 还提供这些诊断的详细信息。与传统调查相比,EIT 可以更快地检索信息。这种能力使医生和其他医务人员能够诊断和及时治疗患者 24,35,36,37。
学习如何使用和解释 EIT 是必不可少的,因为它在临床实践中被证明是有益的。其非侵入性和实时监测功能使 EIT 成为各种医疗环境中医疗保健临床医生的宝贵工具。
披露声明
Glasiele Alcala、Caio C. A. Morais 和 Marcus Victor 收到了咨询费,而 Carolyn La Vita 则从 Timpel 那里获得了推荐费,Timpel 制造了本研究中使用的设备。Marcelo B. P. Amato 是 Timpel 的少数股东。其他作者都没有任何利益冲突。
致谢
我们衷心感谢所有合著者对本文的贡献,并感谢 TIMPEL Medical 为本文提供的慷慨支持。
材料
| Name | Company | Catalog Number | Comments |
| EIT equipment (ENLIGHT2100) | Timpel Medical | ||
| Belts | Timpel Medical | ||
| Belt coverage | Timpel Medical | ||
| Flow sensor | Philips | ||
| Reference Cable | Timpel Medical | ||
| Solution with high electrical conductivity (eg. hypertonic saline, sodium bicarbonate) | Not applicable |
参考文献
- Costa, E. L., Lima, R. G., Amato, M. B. Electrical impedance tomography. Curr Opin Crit Care. 15 (1), 18-24 (2009).
- Frerichs, I., et al. Chest electrical impedance tomography examination, data analysis, terminology, clinical use and recommendations: consensus statement of the TRanslational EIT developmeNt stuDy group. Thorax. 72 (1), 83-93 (2017).
- Borges, J. B., et al. Regional lung perfusion estimated by electrical impedance tomography in a piglet model of lung collapse. J Appl Physiol (1985). 112 (1985), 225-236 (2012).
- Victorino, J. A., et al. et al. Imbalances in regional lung ventilation: a validation study on electrical impedance tomography. Am J Respir Crit Care Med. 169 (7), 791-800 (2004).
- Heines, S. J. H., et al. Pulmonary pathophysiology development of COVID-19 assessed by serial Electrical Impedance Tomography in the MaastrICCht cohort. Sci Rep. 12 (1), 14517 (2022).
- Nascimento, M. S., et al. Effect of general anesthesia and controlled mechanical ventilation on pulmonary ventilation distribution assessed by electrical impedance tomography in healthy children. PLoS One. 18 (3), e0283039 (2023).
- Zhao, Z., Fu, F., Frerichs, I. Thoracic electrical impedance tomography in Chinese hospitals: a review of clinical research and daily applications. Physiol Meas. 41 (4), 01 (2020).
- Kobylianskii, J., Murray, A., Brace, D., Goligher, E., Fan, E. Electrical impedance tomography in adult patients undergoing mechanical ventilation: A systematic review. J Crit Care. 35, 33-50 (2016).
- Costa, E. L., et al. Bedside estimation of recruitable alveolar collapse and hyperdistension by electrical impedance tomography. Intensive Care Med. 35 (6), 1132-1137 (2009).
- Mendes, P. V., et al. Lung perfusion during veno-venous extracorporeal membrane oxygenation in a model of hypoxemic respiratory failure. Intensive Care Med Exp. 10 (1), 15 (2022).
- Gaulton, T. G., et al. Regional lung perfusion using different indicators in electrical impedance tomography. J Appl Physiol (1985). 135 (3), 500-507 (2023).
- Martin, K. T., et al. Electrical impedance tomography identifies evolution of regional perfusion in a porcine model of acute respiratory dstress syndrome. Anesthesiology. 139 (6), 815-826 (2023).
- Xin, Y., et al. Improving pulmonary perfusion assessment by dynamic contrast-enhanced computed tomography in an experimental lung injury model. J Appl Physiol (1985). 134 (6), 1496-1507 (2023).
- vander Burg, P. S., Miedema, M., de Jongh, F. H., van Kaam, A. H. Unilateral atelectasis in a preterm infant monitored with electrical impedance tomography: a case report. Eur J Pediatr. 173 (12), 1715-1717 (2014).
- Riva, T., et al. Evaluation of atelectasis using electrical impedance tomography during procedural deep sedation for MRI in small children: A prospective observational trial. J Clin Anesth. 77, 110626 (2022).
- He, H., et al. Influence of overdistension/recruitment induced by high positive end-expiratory pressure on ventilation-perfusion matching assessed by electrical impedance tomography with saline bolus. Crit Care. 24 (1), 586 (2020).
- Girrbach, F., et al. Detection of posttraumatic pneumothorax using electrical impedance tomography-An observer-blinded study in pigs with blunt chest trauma. PLoS One. 15 (1), e0227518 (2020).
- Yang, Y., et al. Bedside electrical impedance tomography in early diagnosis of pneumothorax in mechanically ventilated ICU patients - a single-center retrospective cohort study. J Clin Monit Comput. 37 (2), 629-637 (2023).
- Kallio, M., et al. Electrical impedance tomography reveals pathophysiology of neonatal pneumothorax during NAVA. Clin Case Rep. 8 (8), 1574-1578 (2020).
- Pereira, S. M., et al. Individual positive end-expiratory pressure settings optimize intraoperative mechanical ventilation and reduce postoperative atelectasis. Anesthesiology. 129 (6), 1070-1081 (2018).
- Jimenez, J. V., Weirauch, A. J., Culter, C. A., Choi, P. J., Hyzy, R. C. Electrical impedance tomography in acute respiratory distress syndrome management. Crit Care Med. 50 (8), 1210-1223 (2022).
- Becher, T., et al. Individualization of PEEP and tidal volume in ARDS patients with electrical impedance tomography: a pilot feasibility study. Ann Intensive Care. 11 (1), 89 (2021).
- Barbas, C. S. V., Amato, M. B. P. Electrical impedance tomography to titrate PEEP at bedside in ARDS. Respir Care. 67 (8), 1061-1063 (2022).
- Maciejewski, D., Putowski, Z., Czok, M., Krzych, L. J. Electrical impedance tomography as a tool for monitoring mechanical ventilation. An introduction to the technique. Adv Med Sci. 66 (2), 388-395 (2021).
- Jonkman, A. H., et al. Lung recruitment assessed by electrical impedance tomography (RECRUIT): A multicenter study of COVID-19 acute respiratory distress syndrome. Am J Respir Crit Care Med. 208 (1), 25-38 (2023).
- Jimenez, J. V., et al. Electric impedance tomography-guided PEEP titration reduces mechanical power in ARDS: a randomized crossover pilot trial. Crit Care. 27 (1), 21 (2023).
- Sella, N., et al. Electrical impedance tomography: A compass for the safe route to optimal PEEP. Respir Med. 187, 106555 (2021).
- Slobod, D., et al. Integrating electrical impedance tomography and transpulmonary pressure monitoring to personalize PEEP in hypoxemic patients undergoing pressure support ventilation. Crit Care. 26 (1), 314 (2022).
- Spina, S., et al. Modulation of pulmonary blood flow in patients with acute respiratory failure. Nitric Oxide. 136-137, 1-7 (2023).
- Cenci, S., Santiago, R. S., Bittner, E. A., Berra, L. Assessing regional lung perfusion changes to inhaled pulmonary vasodilators by electrical impedance tomography. Am J Respir Crit Care Med. 208 (9), e39-e40 (2023).
- Ekkapat, G., Ribeiro De Santis Santiago, R., Victor, M., Berra, L. Electrical impedance tomography for assessing the impact of inhaled nitric oxide on pulmonary artery pressure. Anesthesiology. , (2024).
- He, H., et al. Bedside evaluation of pulmonary embolism by saline contrast electrical impedance tomography method: A prospective observational study. Am J Respir Crit Care Med. 202 (10), 1464-1468 (2020).
- He, H., et al. Three broad classifications of acute respiratory failure etiologies based on regional ventilation and perfusion by electrical impedance tomography: a hypothesis-generating study. Ann Intensive Care. 11 (1), 134 (2021).
- Ribeiro De Santis Santiago, R., et al. Lung imaging acquisition with electrical impedance tomography: Tackling common pitfalls. Anesthesiology. 139 (3), 329-341 (2023).
- Zhou, R., et al. Electrical impedance tomography to aid in the identification of hypoxemia etiology: Massive atelectasis or pneumothorax? A case report. Front Med (Lausanne). 9, 970087 (2022).
- Rubin, J., Berra, L. Electrical impedance tomography in the adult intensive care unit: clinical applications and future directions. Curr Opin Crit Care. 28 (3), 292-301 (2022).
- Tomicic, V., Cornejo, R. Lung monitoring with electrical impedance tomography: technical considerations and clinical applications. J Thorac Dis. 11 (7), 3122-3135 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。