Method Article
針ガイド下非対称両側総頸動脈狭窄症に基づく血管性認知障害および認知症のマウスモデル
要約
非対称性両側総頸動脈狭窄症の針法は、血管認知障害と認知症のマウスモデルを作成するために提案されています。これにより、以前に確立されたモデルと比較して長期的な結果が得られ、ライブMRIと互換性があります。手順を示す視覚的表現は、手術を習得するためのガイダンスを提供します。
要約
血管性認知障害および認知症(VCID)は、血管性脳損傷に起因します。VCIDの高い発生率は、人口の高齢化に伴って上昇し続けると予想されるため、この疾患の堅牢な動物モデルを確立することが重要です。この論文は、頸動脈アテローム性動脈硬化症によって引き起こされるヒトの慢性脳低灌流を模倣する非対称両側総頸動脈狭窄症に基づくVCIDのマウスモデルを作成する新しい方法を提示します。
簡単に言うと、総頸動脈(CCA)は、7-0シルク縫合糸を使用して異なるゲージ針(右のCCAに32G、左のCCAに34G)に結紮され、その後すぐに針を抜去されます。残りの縫合リングは、白質損傷、微小梗塞、および反応性神経膠症に関連する持続的な血流減少と長期的な認知障害を引き起こし、VCIDの病因を密接に模倣しています。重要なことに、この針モデルでは、臨床表現は時間とともに元に戻らず、信頼性の高い長期的な認知障害を提供します。さらに、手術後24週間の生存率は81.6%であり、これは、血流の減少が同程度のVCIDの他の確立されたモデルと比較して高くなっています。
その他の利点としては、材料費が安いことや、金属が埋め込まれていないため、生きた動物の脳損傷を監視するためのMRIとの互換性があります。VCIDの針モデルを採用する際の主な課題は、マウスCCAの直径が0.6mm未満で非常に壊れやすいため、高度な手術技術を開発する必要があることです。したがって、手術の高品質な視覚的表現は、研究者がこの技術を習得し、VCIDの理解を深めるのに役立ち、VCIDに関連する壊滅的な認知機能低下を減らすための新しい治療法の開発につながる可能性があります。
概要
血管性認知障害および認知症(VCID)は、認知機能低下の2番目に多い原因です。VCIDの病因とその危険因子の理解に向けては、否定できない進歩が進んでいるにもかかわらず、神経血管機能障害が認知能力の低下にどのように寄与するかのメカニズムは曖昧なままです。脳虚血を誘発してヒトVCID1の臨床表現を模倣するために、さまざまな複雑さの多数のげっ歯類モデルが確立されています。これらのモデルの一部は、一過性の脳低灌流の作成に基づいています。しかし、それらのほとんどは、ヒト患者2のVCIDにつながる主なメカニズムである慢性脳低灌流を誘発することによって生成されます。
慢性脳低灌流は、重篤であるがしばしば致命的な結果を引き起こす両側頸動脈閉塞症(BCAO)または両側頸動脈狭窄症(BCAS)のいずれかを使用して導入できます。BCASは通常、2つの方法のいずれかを使用して実行されます:両方のCCAの周りに同一のマイクロコイルを配置し、対称性狭窄を引き起こします3。または、アメロイドコンストリクターとマイクロコイルを左右のCCAの周りにそれぞれ埋め込むことにより、左右のCCAに徐々に閉塞し、血流が~50%減少します。どちらの方法の欠点も、狭窄が重すぎる場合やCCAが閉塞している場合の死亡率が高いこと、および体内に金属が存在するために生きた動物のMRIスキャンと互換性がないことです。いくつかの遺伝的マウスモデルも確立されています1,5,6,7,8。その他のオプションには、皮質下梗塞を伴う脳常染色体優性動脈症および白質脳症マウスモデル9,10が含まれます。それにもかかわらず、提案されたモデルのいずれも、ヒト患者に見られる虚血性損傷の全範囲を模倣していないため、更新されたVCIDモデルの探索が続けられています。
この論文は、マウスで非対称の両側総頸動脈狭窄症(ABCS)を誘発する新しい外科的方法を提示します。ここで、CCA狭窄は絹糸を使用して行われ、CCAをさまざまな直径の針に結紮し、その後すぐに針を抜くことによって制御されます11。その結果、正確な直径の縫合リングがCCA上に永久に残り、慢性的な狭窄を確実にします。対称法よりもABCSを使用する利点は、右側に中程度の低灌流がより良い生存を保証し、左側にもっと顕著な低灌流が長期的な神経学的および病理学的表現を保証することです。このニードルモデルは、従来のBCASモデル11 に比べて、持続的な結果、死亡率の低下、超低コスト、柔軟性、特別な分析アプローチを使用する可能性など、いくつかの利点があります。
これらの利点を詳しく説明すると、3つのライゲーションは、焦点狭窄ではなくCCA狭窄の断片を引き起こし、マウスの~90%で持続的な低灌流、白質損傷、および認知機能低下を引き起こします。針マウスの死亡率は~17%で、私たちの経験に基づいて16週間で~30%の死亡率を示す服部のアメロイドリストリクター/マイクロコイルモデル4の死亡率よりも低かった。各BCASモデルは、高価なマイクロコイルまたはアメロイドリストリクターのために通常約100ドルの費用がかかりますが、ニードルモデルはマウスあたり約1ドルしかかかりません。さらに、針のゲージは、どちらの側の血流制限に関する研究固有の要件に応じて変更することができます。現在の論文で提示されたバリエーションでは、針モデルは、閉塞を伴わない片側性永久狭窄によって引き起こされる重度の頸動脈狭窄症の病態生理学を模倣しています。これは、クリニック11 で疾患の最も一般的な表現です。さらに、従来のBCASモデルで使用されているアメロイドリストリクターとマイクロコイルは金属でできているため、 in vivo MRIが行われると、金属が脳ではなく胸部に埋め込まれているにもかかわらず、重大なアーティファクトが発生する可能性があります。金属の存在がイメージングにどの程度影響するかを正確に予測するのは難しいかもしれません。
一般に、マイクロコイル移植後に行われる in vivo MRIは、通常、単純な解剖学的イメージングであり、複数の傷害の定量的分析には適していませんが、これはVCID研究にとって非常に望ましいものです。対照的に、ここで紹介する針モデルはシルク縫合糸のみを使用し、あらゆる種類の in vivo MRIに完全に対応しています。これは、2つの理由で重要です:(1)MRIは、小さな脳病変、微小出血、または表在性シデローシス12に非常に敏感であるため、CTスキャンなどの他の分析方法よりも好まれます(2)VCID研究は、病変の進行/治癒のダイナミクスを追跡することで間違いなく利益を得ることができるため、 in vivo MRIは ex vivo MRIよりも優先されるべきです。 特に提案された新しい治療法に対応して。さらに、機能的(fMRI)を針モデルで実行して、脳の低灌流に応答する神経血管結合の完全性に関する重要な洞察を提供できます。したがって、 in vivo MRIを使用する可能性は、特に薬力学研究において、病変のサイズと位置と認知機能、および神経血管結合との間の複雑な相関関係の詳細な分析への道を開きます。
プロトコル
すべての動物プロトコルは、ピッツバーグ大学の動物管理・使用委員会によって承認され、国立衛生研究所の実験動物の世話と使用に関するガイドに従って実施されました。すべてのサバイバル手術では、無菌技術を維持しなければなりません。提示された実験では、体重25-30gの12週齢の雄C57BL/6Jマウスを使用しました。
1.材料と作業スペースの準備
- 針片(長さ~4 mm、右CCAは32 G、左CCAは34 G)を準備します。針の鋭い端を硬い表面に注意深く叩いて針の先端を少し鈍くし、針ホルダーを使用して針をプラスチック片から慎重に分離します。7-0シルク縫合糸を1〜2cmの長さに事前にカットします。
- 手術器具、針片、縫合糸をオートクレーブまたはその他の適切な方法で滅菌します。
2. 手術を行う
- マウスの重量を量り、25%O2 と72%N2Oの混合物で3%イソフルランで換気されたチャンバーにマウスを2〜3分間置いて麻酔を誘発します。
- マウスを滅菌手術用シートで覆われた加熱パッドの上(腹側を上にして)置き、体温を一定(37°C)に保ち、25%O2 と74%N2Oの混合物である1%イソフルランで換気用のフェイスマスクを固定します。
- 首の上の毛皮を電気シェーバーで剃ります。細い髪を粘着テープまたはキーボード掃除機できれいにします。
- 手術部位をベタジン溶液(10%ヨウ素)で消毒します。70%エタノールで皮膚を脱ヨウ素化します。dinsinfectionを3回繰り返します。つま先をしっかりとつまむ(ペダル反射)に反応しないことにより、麻酔のレベルが適切であることを確認してください。
- 手術部位をドレープします。次に、気管に沿って垂直正中線を切開し、マイクロ鉗子で両側甲状腺を分離します。滅菌済みの小さなスキンリトラクターで皮膚と組織を引き離します。
- 顕微鏡下で、角度のついたピンセットを使用して、迷走神経と鞘からCCAの1つを慎重に露出させ、鈍く解剖します。CCAが鉗子に付着する傾向がある場合は、滅菌水またはリン酸緩衝生理食塩水(PBS)を使用して切開部位を濡らします。必要に応じて、姿勢をサポートするために小さなプラスチック製の注射器を首の下に置きます。
注意: CCAを破裂させないように細心の注意を払ってください。 - 角度の付いたピンセットを使用して、3つのプレカットシルク縫合糸片(サイズ7-0)をCCA(1 mm間隔)の下に通します。
- 縫合糸の片片の1つにCCAの周りに非常に緩いダブルノットをドラフトします。
注:手術部位と縫合糸を滅菌水またはPBSで濡らすと、結び目の作成に役立つ場合があります。 - 針の断片(右のCCAは32 G、左のCCAは34 G)をCCAと平行に、緩い結び目の内側に置きます(図1A)。血流が観察されなくなるまで、針とCCAの両方の周りの一次結び目を慎重に締め、二次結び目で固定します。すぐに針を引き抜いて部分的な血流を回復し、縫合糸の端をトリミングします。
注:外科医は、結び目が完成した後、縫合糸の端を非常に慎重にトリミングする必要があります。結び目に近づけて切りすぎると、結び目が緩む可能性があります。さらに、針を抜いた後もCCAを観察して、結び目の下流で血流がまだ有効になっていることを確認することが重要です。針を抜いた後にCCAが非常に青白く見える場合は、CCAが過度に圧縮されていることを意味します。 - 同じCCA上の2番目の 縫合糸と3番目の 縫合糸の糸について、互いに約1mm離れて、手順2.8〜2.9を繰り返します(図1B)。
- 32 G のニードルフラグメントを使用して、反対の CCA でステップ 2.6 から 2.10 を繰り返します。
- 両方のCCAが効率的に結紮されているかどうかを慎重に調べます:3つの縫合バンドすべてが所定の位置にしっかりと結ばれているが、血流を完全に遮断するほどきつくないことを確認します(CCAが結び目の下流で青白くないことを確認してください)。各CCAの3つの縫合バンドが互いに約1mm離れていることを確認してください。
- 滅菌モノフィラメント縫合糸を使用して皮膚を閉じます。
- 手術直後、術後の痛みを和らげるために、100〜150μLのケトプロフェン(1 mg / mLストック、5 mg / kg体重)を腹腔内に注射します。.手術の24時間後と48時間後にこの注射を繰り返します。.
- マウスを37°Cのホメオサームブランケットの上に置き、動物を動物施設に戻す前に2時間連続的にモニタリングします。
注:偽の手順の場合、手順2.7〜2.12は省略する必要があります。
3. モデルの検証
注:脳損傷は in vivo MRIで分析され、さらにLuxol fast blue(LFB)染色および行動試験で検証されました。
- 脳血液灌流のイメージング。
- 1〜1.5%イソフルランを使用してマウスを麻酔します。手術部位をベタジン溶液(10%ヨウ素)で滅菌します。次に、70%エタノールで皮膚を脱ヨウ素化します。
- 動物の頭蓋骨を定位フレームに固定します。頭皮の前頭骨から後頭骨まで正中線矢状切開を行い、頭蓋骨を露出させ、滅菌生理食塩水で頭蓋骨表面を洗浄します。
- 2次元レーザースペックルシステムを使用して、頭蓋骨の10cm上に電荷結合デバイスカメラを配置します。頭蓋切除部位にプローブホルダーをかざし、しっかりと固定します。
- 手術の5分前と注射針の放出直後、または手術の7日後、14日後、21日後、28日後、35日後、42日後に血液灌流画像を撮影します。
- 滅菌モノフィラメント縫合糸を使用して皮膚を閉じます。術後の痛みを和らげるために、100〜150μLのケトプロフェン(1 mg / mLストック、5 mg / kg体重)を腹腔内に注射します。.この注入を24時間と48時間繰り返します。.
- インビボ MRI検査
- 1〜1.5%イソフルランを使用してマウスに麻酔をかけ、呼吸を継続的に監視し、画像取得中に暖かい空気で温度を37°Cに維持します。
- 9.4Tスキャナー、86 mm Txコイル、および4チャンネルマウス脳レシーバーアレイを使用してin vivo MRIを実行し、関連ソフトウェアを実行します。ポジショニングスキャンとパイロットスキャンに続いて、Rapid Acquisition with Relaxation Enhancement(RARE)シーケンスを使用してT2強調画像(T2WI)を取得し、エコー時間/繰り返し時間(TE/TR)= 40/4,000 ms、平均 = 8,256 × 256マトリックス、スライス厚さ0.5 mmのスライス16個、RARE係数 = 4、視野角(FOV) 20 x 20 mmのパラメータで取得します。
- T2WIと同じ形状とパラメータを使用してエコー平面イメージング(EPI)-DTIイメージングシーケンスを使用してDiffusion Tensor Imaging(DTI)データを収集しますが、 TR/TE = 2,300/22 ms、取得マトリックス = 128 x 128、2セグメント、5つのA0画像、30の非同線拡散画像、Δ/δ = 10/3 ms、b値= 1,000 s/mm2。
- DSI Studioソフトウェア(http://dsistudio.labsolver.org/)を使用してDTIデータを解析し、拡散スカラーパラメータ(フラクショナル異方性(FA)、平均拡散率(MD)、軸方向拡散率(AD)、半径方向拡散率(RD))の違いを探します。脳梁 (CC)、外部カプセル (EC)、内部カプセル (IC)、線毛、前交連 (AC)、帯状回 (Cing)、海馬 (海馬)、皮質 (C)、線条体 (Str) の関心領域 (ROI) を両方の半球から描画します。
- ルクソールファストブルー(LFB)染色
- 脳切片の準備:脳を4%PFAで24時間固定し、脳が沈むまで脳を30%ショ糖に浸します。ドライアイスの上のOCTコンパウンドに脳を埋め込みます。スライド式ミクロトームで厚さ20 μmの冠状脳スライスを切断します。脳切片を保存溶液(PBS中の30%グリセロール/ 30%エチレングリコール)に保存します。.
- 脳切片をLFB(0.1%アルコール溶液)に浸し、56°Cで一晩保ち、蒸留水で洗浄します。
- 0.05%炭酸リチウムで脳切片をインキュベートし、等級付けされたアルコールで脱水します。
- 切片を0.5%クレシルバイオレットで5分間染色し、70%エタノールで分化します。
- 染色した脳切片を封入剤でマウントします。
- 修正されたモリス水迷路テストによる認知機能評価
- 円形のタンクに水(25 °C、深さ33 cm)を入れ、プールの北、東、南、または西の端から31 cm、水位から1.2 cm下、プールの正方形~10 x 10 cm2 プレキシガラスプラットフォームを沈めます。
注:このプラットフォームは、テストの全期間にわたって同じ場所に留まる必要があります。 - 天井に取り付けられたビデオカメラの電源を入れます。マウスをタンクに入れ(水面でドロップリリースしないでください)、壁に面して、北東、南東、南西、または北西のいずれかから開始します。マウスを最大90秒間泳がせて、水没したプラットフォームを見つけます。
- プラットフォームが見つかった場合は、マウスを水中のプラットフォームに30秒間留まらせます。プラットフォームが見つからない場合は、マウスをそこに30秒間置きます。
- マウスを5分間休ませ、水泳の試行(ステップ3.4.2〜3.4.3)を2回繰り返します。
- マウスを布で乾かし、加熱電球の下のケージに戻します。
- 毎日3回の水泳トライアルを5日間連続で繰り返します。
- ビデオ映像を使用して、エスケープの遅延 (各試行でプラットフォームを見つけるのにかかる時間) を計算します。
- テストの最終日に、プラットフォームを取り外し、プラットフォームが以前に配置されていた象限でマウスが費やした時間を記録します。
- 円形のタンクに水(25 °C、深さ33 cm)を入れ、プールの北、東、南、または西の端から31 cm、水位から1.2 cm下、プールの正方形~10 x 10 cm2 プレキシガラスプラットフォームを沈めます。
結果
長期の非対称性脳低灌流
CCAの血流は、前述したように、最後の(第3の)結紮から針を放出する前および直後に測定した11。血流は、左のCCAで~70%、右のCCAで~50%減少しました。脳血液灌流は、2次元レーザースペックルを使用して動的に監視されました。この手術により、両半球で脳の低灌流が引き起こされ、左半球がより深刻な影響を受けました(図2)。脳低灌流は、手術後少なくとも 24 週間維持されます11。
死亡率の低下
雄マウスの6週間にわたる生存率は81.6%でした(図3)。マウスは、手術後の最初の1週間で死亡する傾向が強かった。
脳損傷のin vivo MRI検出
T2強調画像は、ABCS手術を受けたマウスの海馬(Hippo)、外部被膜(EC)、内部被膜(IC)、脳梁(CC)、および線条体(Str)の低信号または高信号領域を明らかにし、脳損傷を示しています(図4A)。ABCSマウスのDTIのDEC(Directionally Encoded Color)マップでは、シャムと比較した場合、構造的損傷が観察されました(図4B)。
定量解析の結果、ABCSマウスは、左カバ、IC、前交連(AC)、帯状回(Cg)、フィンブリア(Fi)において、偽と比較して有意に低い分画異方性(FA)を示したことが示されました(P < 0.05対偽)。これは、左半球の白質微細構造の損傷を示しています(左上のパネル、 図4C)。ABCSマウスの右CgおよびFiのFAも減少した(P<0.05対偽)。ABCSマウスでは、左のICとFiのFAが右のFAよりも有意に低かった(P < 0.05、左対右)。
同様に、ABCSマウスの左EC、IC、Str、およびFiでは、偽と比較して軸索拡散率(AD)が有意に低いことが示され、軸索損傷が示唆されました(右上のパネル、 図4C (P<0.05対偽))。左のStrのみが、偽マウスと比較してABCSマウスで平均拡散率(MD)の減少を示しました(左下パネル、 図4C)。放射状拡散率(RD)の違いは、ABCSマウスの左CC、Str、およびFiで観察され(右下のパネル、 図4C)、これらの領域の炎症と細胞性の増加を示唆しています13。
両半球の非対称性脳損傷と左半球の白質領域の損傷
脳損傷は、前述の手順14 (図5)を使用してLFB染色でさらに分析されました。より低い検出力の画像では、ECおよびStrに明るい青色の染色が示され、これらの領域での脱髄が示唆されました。高解像度画像は、偽マウスがECで直系オリゴデンドロサイトを持つよく組織化された有髄軸索を示したことを示しました。しかし、軸索は消失し、ABCSマウスのECでは、青色に染色された細胞が広く広がっていることが観察されました。偽マウスは、Str.しかし、繊維束は薄く、小さく染色され、その完全性が損なわれました。一部の繊維束はABCSマウスで空胞化されました。ABCSマウスのACでは、繊維束が歪んでおり、束間マトリックスが著しく厚くなっていました。要約すると、ABCS手術は軸索の脱髄と損傷を引き起こします。白質の損傷は主に左半球で発生します。
学習と記憶機能障害
針ABCS手術は、モリス水迷路テスト中に水没したプラットフォームを見つける時間(脱出までの遅延)の増加が示すように、重大な学習障害をもたらしました(図6)。この障害は、手術後少なくとも24週間は関係していました。メモリも大きな影響を受けており、プラットフォームが取り外された後にターゲット象限で費やされる時間が減少したことで示されています。
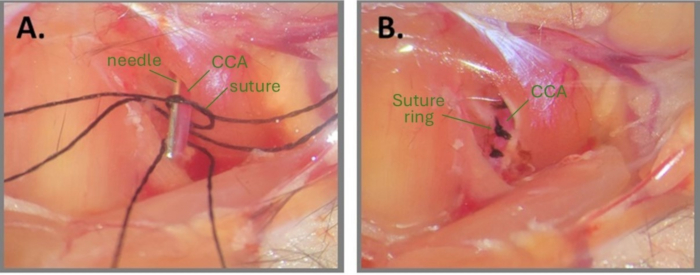
図1:ABCSを作成するための針手術のステップ(A)左のCCAが露出し、CCAの下に3つの絹の縫合糸が通されています。縫合糸片の1つに緩い結び目を描き、針をCCAと平行に配置します。(B)3つの縫合リングを約1mm離して配置します。略語:ABCS =非対称両側総頸動脈狭窄;CCA = 総頸動脈。この図の拡大版を表示するには、ここをクリックしてください。

図2:針ABCSモデルにおける持続性の非対称性脳低灌流。 手術後の脳血流の動的モニタリング。持続性脳低灌流は両方の半球で観察でき、左側でより深刻です。黒いアスタリスクは、低灌流領域を示します。略語:ABCS =非対称両側総頸動脈狭窄症。 この図の拡大版を表示するには、ここをクリックしてください。

図3:針ABCS手術後の生存率。 この手術により、6週間で81.6%の生存率が得られました。死亡は主に術後最初の週に発生しました。略語:ABCS =非対称両側総頸動脈狭窄症。 この図の拡大版を表示するには、ここをクリックしてください。
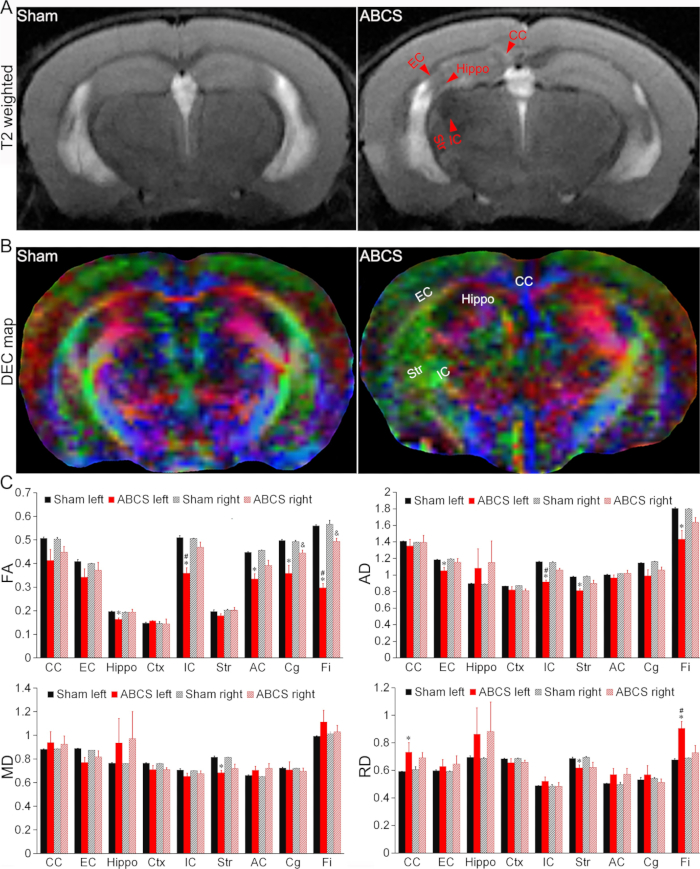
図4:針ABCSモデルにおける脳損傷のin vivo MRI検出 (A)偽マウスとABCSマウスからの代表的なT2強調画像。赤い矢印は、低信号または高信号の領域を示します。(B)針ABCS手術の2週間後のin vivo DTIの代表的なDECマップ。色は拡散の主軸の方向性を示しています(赤=左/右、緑=背側/腹側、青=吻側/尾側)。(C)偽マウスおよびABCSマウスの定量分析(一元配置ANOVA)。* は p < 0.05 ABCS 対 sham (左半球) を表します。# は p < 0.05 の左と右を表します。& は p < 0.05 ABCS 対 sham (右半球) を表します。データはSEM±平均として表示されます。偽マウスの場合はn = 4、ABCSマウスの場合はn = 4です。略語:ABCS =非対称両側総頸動脈狭窄;海馬=海馬;EC = 外部カプセル;IC =内部カプセル;CC = 脳梁;Str = 線条体;DEC = 方向エンコードされた色。DTI = 拡散テンソルイメージング;FA = 分数異方性;MD = 平均拡散率AD =軸方向の拡散率;RD = 放射状拡散率。この図の拡大版を表示するには、ここをクリックしてください。
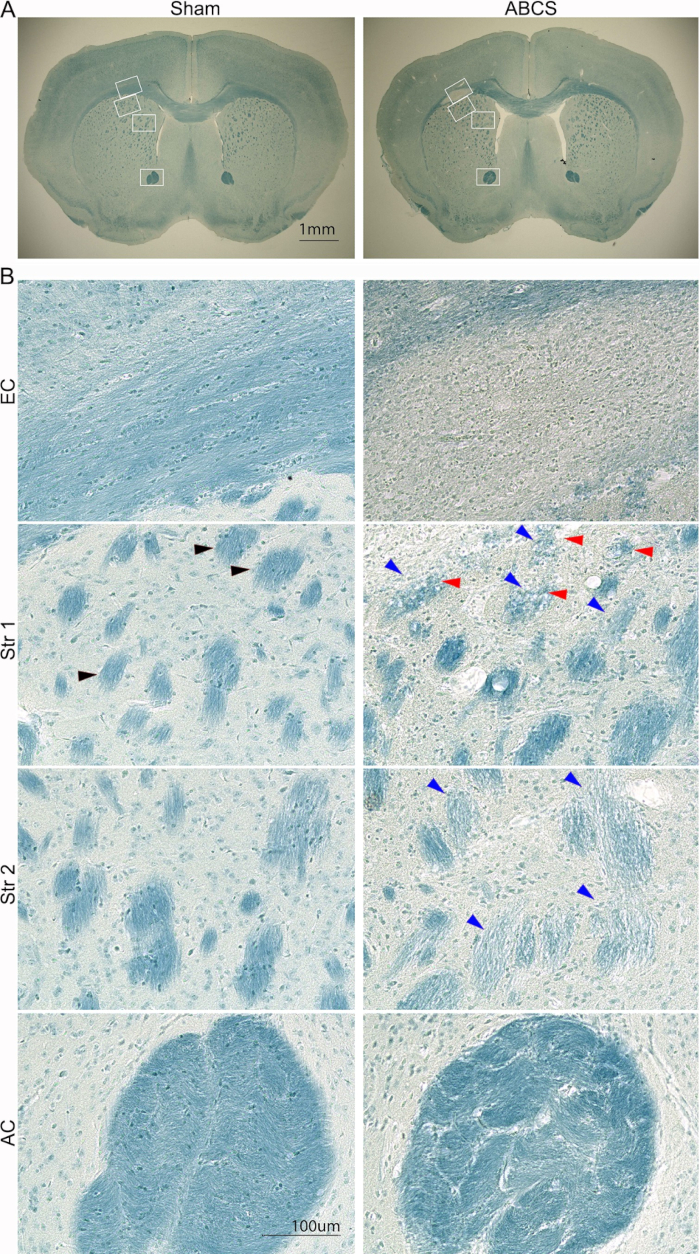
図5:針ABCS手術の6週間後の脳切片の代表的なLFB染色。(A)偽マウスおよびABCSマウスからのLFB染色の低倍率画像。白いボックスは 、Bの高解像度画像に対応する位置を示します。(B)EC(上面パネル)とStr位置1および2(中央パネル)およびAC(下面パネル)からの高解像度画像(200倍)。黒い矢印は、通常のファイバーバンドルを示しています。青い矢印は、損傷したファイバーバンドルを指しています。赤い矢印は空胞化した繊維を示しています。スケールバー = 1 mm (A)、100 μm (B)。略語:ABCS =非対称両側総頸動脈狭窄;LFB = ルクソールファストブルー;EC = 外部カプセル;Str = 線条体;AC = 前交連。 この図の拡大版を表示するには、ここをクリックしてください。
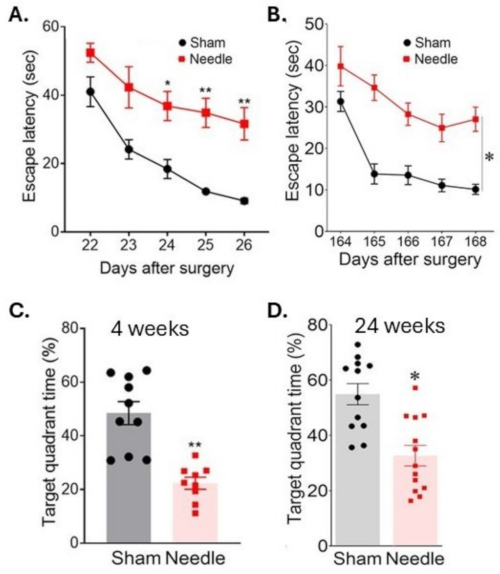
図6:水迷路テストにおける空間学習と記憶評価。 空間学習は、手術の (A) 3 週間後と (B) 24 週間後に、プラットフォームを連続して配置する時間を測定することにより評価されました。記憶は、(C) 手術の 4 週間後と (D) 24 週間後に、プラットフォームが取り外された後のターゲット象限で過ごした時間を測定することにより評価されました。この手術は、認知機能の長期的な混乱をもたらしました。データは、SEM±平均、*p < 0.05針対偽針として表されました。**p < 0.01 対 sham;二元配置ANOVAとNeuman-Keulsポストホック。偽の場合は n = 10、針群の場合は n = 10 です。この図は、Weng et al.11から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
非対称 CCA 狭窄を使用した VCID 誘導のいくつかの方法が説明されており、それらのすべては、迷走神経からの CCA の重要かつ重要な外科的段階的分離と、狭窄のためにアクセス可能にするための CCA の鞘と露出を共有しています。ライゲーション前のCCAの外科的曝露に関する質の高い視覚的ガイダンスを提供する一方で、他のマウスおよびラットの手術のコンテキストでオンラインで利用可能なCCA単離に関する追加のビデオを視聴するように研究者に指示したいと思います15,16,17,18。CCAは脳に酸素化された血液を供給する主要な動脈であるため、CCAを圧迫または破裂させないように特に注意する必要があります。
手術のもう一つの重要なステップで習得する必要があるのは、緩い結び目を起草し、針でCCAの周りをさらに締め、その後針を抜くことです。麻酔をかけたマウスでこのステップを実行する前に、針だけでこの手順を練習することを強くお勧めします。これにより、繊細な鉗子の動きをマスターし、マウスを傷つけるリスクなしに縫合糸での操作を完成させることができます。結び目は、針の取り外し中にバラバラにならないようにしっかりと固定する必要があり、針を保持するのに十分なきつく、鉗子を使用して針を結び目のある縫合糸から滑り込ませることができるほど緩くする必要があります。
重要なことに、各CCAの単一の結紮は、血流を確実に減少させ、長期的な脳低灌流を維持するのに十分ではないことがわかりました11。考えられる説明の1つは、単一の結紮が点狭窄を引き起こし、それが局所的な圧力上昇を引き起こす可能性が高く、血流の減少を補うために血流の速度が増加するというものかもしれません。狭窄の断片を作成するために、互いに~1mm離れた3つの結紮を行うことをお勧めします。3つのライゲーションを使用する追加の利点は、追加の針の取り外し中に結び目の1つが緩んだ場合のプルーフメカニズムとして結び目が役立つことです。実際、同じCCAの3つの異なるライゲーションによって引き起こされる狭窄の断片は、モデルの一貫性を高め、マウスの約90%で持続的な脳低灌流につながります。さらに、フラグメント狭窄は、ヒト患者のアテローム性動脈硬化症によって引き起こされるCCA狭窄を模倣しており、焦点狭窄と比較してより正確に、針モデルの臨床的関連性を高めます。
最初の結紮が終了した後、CCAの血流が部分的に回復したことを確認するために、針を速やかに抜去し、その後、2回目と3回目の結紮に順次進むことを強くお勧めします。針を3つの結び目すべての内側に持たせて3つの結紮をすべて終了することは、血流が完全に閉塞する時間を大幅に増やすため、お勧めしません。通常、針を抜く前に1分以上CCAを完全に閉塞することはお勧めしません。この推奨事項は、マウスが両方のCCAの60秒閉塞の3セッション後に機能障害の兆候を示さなかったという報告に基づいています19。私たちのモデルでは、外科医は一度に1つのCCAに取り組み、両方のCCAを同時に閉塞するよりも寛容ですが、このタイムラインに従って、両側の慢性的な低灌流ではなく、長期の閉塞によって引き起こされるアーティファクトを除外することをお勧めします。
この針モデルでは、さまざまな直径の針を使用して(体重または血流制限の特定の要件に基づいて)結び目のある縫合糸の直径を調整できますが、私たちの経験では、右半球の低灌流が重度ではなく中程度の場合、マウスの生存率は高かった。一方、左半球での持続的な重度の低灌流は、長期的な病理学的および神経学的転帰をもたらしました。したがって、右のCCAをライゲーションするために太い針を使用し(右半球で中等度の低灌流を引き起こす)、左のCCAをライゲーションするために細い針を使用する(左半球で重度の低灌流を引き起こす)ことにより、非対称ライゲーションを行うことをお勧めします。
最後に、研究者は、主に脳血管の解剖学的構造の違いにより、マウスの系統が異なれば、虚血性または外傷性の傷害から異なる結果が得られる可能性があることに注意する必要があります20,21。今日では多くの研究で新規のトランスジェニックマウスの作製が求められているため、実験デザインのどの段階でもBCAO手術が必要な場合は、バックグラウンド株を慎重に検討する必要があります。例えば、C57BL/6系統とSV129系統は、脳卒中研究のためのトランスジェニック動物を作製するための一般的なバックグラウンドの選択肢である21。しかし、C57BL/6マウスは、SV129マウス20,21を含む、試験された他の系統と比較して虚血に対してはるかに感受性が高いことが十分に文書化されています。実際、マウス系統の影響は、VCID21を誘導するために使用された技術の効果よりもさらに重要である可能性があるという証拠があります。したがって、げっ歯類の虚血性脳損傷を誘発するすべての実験を通じて、マウスの背景を一貫して保つことが非常に重要になります。重要なことに、研究者は、選択基準として0.5のスコアを持つ神経学的スコアリングシステム22を使用して、生きた動物における手術結果の効率を評価できる。脳損傷は、軽度の局所的な傷害の後でも脳の損傷に非常に敏感なIba1免疫染色を使用してさらに確認することができます。
要約すると、VCIは、多くの臨床表現と原因を同じ傘の下に統合する複雑な用語であることを覚えておくことが重要です。したがって、研究者は、研究したいVCIの側面に基づいてどのモデルを選択すべきかを常に念頭に置く必要があります。すべてのVCI症状に対して単一の普遍的なモデルは存在し得ません。CCA狭窄モデルは、主要な動脈からの血流を厳しく制限するため、動脈硬化性狭窄症の患者を模倣します。C57BL/6Jマウスで非対称BCASを作成する新しい針法は、VCIDを模倣する信頼性の高い方法であり、以前に報告された方法に比べていくつかの利点があります(特に高い柔軟性、低い死亡率、長期的な結果、最小限のコスト、およびライブMRIモニタリング)。他のモデルよりも優れているため、VCIDの進行に関する知識をさらに進歩させるために使用できるだけでなく、VCIDの進行を治療または遅らせるための潜在的な治療薬をスクリーニングするための基礎としても役立ちます。BCASの他の報告方法と同様に、針モデルには、この視覚的なデモンストレーションをガイドとして使用して、時間とともに習得できる高度な手術スキルが必要です。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
このプロジェクトは、国立衛生研究所/NINDSの助成金RF1NS117509(G.Cao)およびVAメリットレビュー助成金BX003923およびBX006454(G.Cao)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | BD | 309659 | IP injection of ketoprofen |
| 2.5 mm blunt retractor tips | Kent Scientific Corporation | SURGI-5016-2 | 2 needed |
| Andis Ion T-Blade Pet Trimmer | Andis | BTF3 | To shave fur |
| Betadine Solution | Avrio Health L.P. | NDC 67618-150-17 | |
| Braided silk suture, 5-0 | Teleflex Medical | 106-S | For suturing skin |
| Braided silk suture, 7-0 | Teleflex Medical | 103-S | For ligating CCAs |
| Camera | Med Associates, Inc | VID-CAM-MONO-7 | For model validation |
| cover glass | Fisherbrand | 12-541-012 | For model validation |
| cresyl violet | Thermo Scientific | C581-25 | For model validation |
| Dispensing Tip, Needle, Flex, 34 Gauge, 1/4" OAL | Jensen Global | JG34-0.25HPX | For the left CCA |
| DSIStudio | https://dsi-studio.labsolver.org; for DTI data analysis | ||
| Dumont Tweezers; Pattern #1 | Roboz Surgical Instrument Co | RS-4960 | 2 needed |
| Dumont Tweezers; Pattern #5, 45 Degree Angle | Roboz Surgical Instrument Co | RS-5058 | 2 needed |
| Ethanol | Fisher Scientific | 64-17-5 | Dilute to 70% |
| ethylene glycol | Thermo Scientific | E178-4 | For model validation |
| Eye Needle, Size #4; 3/8 Circle, Cutting Edge, 11 mm Chord Length | Roboz Surgical Instrument Co | RS-7981-4 | For suturing skin |
| E-Z Anesthesia Classic System | E-Z systems | EZ-7000 | |
| glycerol | Thermo Scientific | AAA16205AP | For model validation |
| Homeothermic Monitoring System | Harvard Bioscience | K 022258 | |
| Imaging system EVOS FL Auto | Life Technologies | AMAFD2000 | For model validation |
| Isoflurane | Covetrus | 11695-6777-2 | |
| Ketoprofen | Zoetis | 5487 | |
| Leica M320 F12 clinic and surgery microscope | Leica | M320 F12 | |
| Lidocaine and Prilocaine Cream, USP 2.5%/2.5% | Padagis | NDC 0574-2042-30 | Generic to EMLA cream |
| lithium carbonate | Thermo Scientific | L119-500 | For model validation |
| Luxol fast blue | Thermo Scientific | AC212170250 | For model validation |
| microscope slides | Fisherbrand | 12-550-403 | For model validation |
| Microtome | Leica | SM2010R | For model validation |
| Morris Water Maze with the hidden platform | Maze Engineers | https://maze.conductscience.com/portfolio/morris-water-maze/ | |
| M-Prove Portable Balance | Sartorius | AY711 | Scales for weiging the mouse |
| MRI with ParaVision 6.0.1 | Bruker | AV3HD 9.4T | For model validation |
| Multi gas flow meter | Aalborg Instruments | GMR2-010334 | for low flow rate gas blending (N2O and O2) |
| Nano Ultra Fine Pen Needles - 32G 4mm | BD | 58320883 | For the right CCA |
| O.C.T. | Thermo Scientific | 23-730-571 | For model validation |
| Paraformaldehyde, 4% | Thermo Scientific | J61899.AK | For model validation |
| PBS | Thermo Scientific | BP399500 | For model validation |
| PeriCam PSI System with Aperiflux probe holder | Perimed Inc | PeriCam PSI HR | For model validation |
| permount | Thermo Scientific | SP15-100 | For model validation |
| Round Handle Forceps; Micro Suturing With Tying Platform; Curved | Roboz Surgical Instrument Co | RS-5264 | To help with cutting and suturing the skin |
| Small Animal Heat Lamp, 75 Watt | Morganville Scientific | HL0100 | For model validation |
| Small cotton-tipped applicators | Fisher Scientific | 23-400-118 | |
| Spring Scissors - 8mm Cutting Edge | Fine Science tools | 15024-10 | |
| Student Halsey Needle Holder | Fine Science tools | 91201-13 | 3 needed: 2 for holding skin retractors and 1 for suturing the skin |
| Sucrose | Thermo Scientific | A15583.36 | For model validation |
| Universal Camera Ceiling Mount | Med Associates, Inc | ENV-598 | For model validation |
| water bath | VWR | 89032-226 | For model validation |
参考文献
- Tuo, Q. Z., Zou, J. J., Lei, P. Rodent models of vascular cognitive impairment. J Mol Neurosci. 71 (5), 1-12 (2021).
- Zhou, Z., et al. Deeper cerebral hypoperfusion leads to spatial cognitive impairment in mice. Stroke Vasc Neurol. 7 (6), 527-533 (2022).
- Shibata, M., Ohtani, R., Ihara, M., Tomimoto, H. White matter lesions and glial activation in a novel mouse model of chronic cerebral hypoperfusion. Stroke. 35 (11), 2598-2603 (2004).
- Hattori, Y., et al. A novel mouse model of subcortical infarcts with dementia. J Neurosci. 35 (9), 3915-3928 (2015).
- Janson, J., et al. Increased risk of type 2 diabetes in Alzheimer disease. Diabetes. 53 (2), 474-481 (2004).
- Herzig, M. C., et al. Abeta is targeted to the vasculature in a mouse model of hereditary cerebral hemorrhage with amyloidosis. Nat Neurosci. 7 (9), 954-960 (2004).
- Miao, J., et al. Cerebral microvascular amyloid beta protein deposition induces vascular degeneration and neuroinflammation in transgenic mice expressing human vasculotropic mutant amyloid beta precursor protein. Am J Pathol. 167 (2), 505-515 (2005).
- Moechars, D., et al. Early phenotypic changes in transgenic mice that overexpress different mutants of amyloid precursor protein in brain. J Biol Chem. 274 (10), 6483-6492 (1999).
- Wallays, G., et al. Notch3 Arg170Cys knock-in mice display pathologic and clinical features of the neurovascular disorder cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy. Arterioscler Thromb Vasc Biol. 31 (12), 2881-2888 (2011).
- Cognat, E., Cleophax, S., Domenga-Denier, V., Joutel, A. Early white matter changes in CADASIL: evidence of segmental intramyelinic oedema in a pre-clinical mouse model. Acta Neuropathol Commun. 2, 49 (2014).
- Weng, Z., et al. A novel needle mouse model of vascular cognitive impairment and dementia. J Neurosci. 43 (44), 7351-7360 (2023).
- Biesbroek, J. M., Biessels, G. J. Diagnosing vascular cognitive impairment: Current challenges and future perspectives. Int J Stroke. 18 (1), 36-43 (2023).
- Winklewski, P. J., et al. Understanding the physiopathology behind axial and radial diffusivity changes-what do we know. Front Neurol. 9, 92 (2018).
- Jing, Z., et al. Neuronal NAMPT is released after cerebral ischemia and protects against white matter injury. J Cereb Blood Flow Metab. 34 (10), 1613-1621 (2014).
- Yang, S. T., et al. Adult mouse venous hypertension model: common carotid artery to external jugular vein anastomosis. J Vis Exp. (95), e50472 (2015).
- Speetzen, L. J., Endres, M., Kunz, A. Bilateral common carotid artery occlusion as an adequate preconditioning stimulus to induce early ischemic tolerance to focal cerebral ischemia. J Vis Exp. (75), e4387 (2013).
- Lee, D., et al. A murine model of ischemic retinal injury induced by transient bilateral common carotid artery occlusion. J Vis Exp. (165), (2020).
- Schleimer, K., et al. Training a sophisticated microsurgical technique: interposition of external jugular vein graft in the common carotid artery in rats. J Vis Exp. (69), e4124 (2012).
- Speetzen, L. J., Endres, M., Kunz, A. Bilateral common carotid artery occlusion as an adequate preconditioning stimulus to induce early ischemic tolerance to focal cerebral ischemia. J Vis Exp. (75), e4387 (2013).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Wellons, J. C., et al. A comparison of strain-related susceptibility in two murine recovery models of global cerebral ischemia. Brain Res. 868 (1), 14-21 (2000).
- Cao, G., et al. In Vivo delivery of a Bcl-xL fusion protein containing the TAT protein transduction domain protects against ischemic brain injury and neuronal apoptosis. J Neurosci. 22 (13), 5423-5431 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved