개별 가스가 서로 화학적으로 반응하지 않는 한, 가스혼합물의 개별 가스는 서로의 압력에 영향을 미치지 않습니다. 혼합물의 각 가스는 용기에 단독으로 존재하는 경우 가해지는 것과 동일한 압력을 가합니다. 혼합물에 있는 각 개별 가스에 의해 가해지는 압력은 그것의 부분적인 압력이라고 합니다.
이는PA가 가스 A의 부분압력인 경우, 3개의 상이한 가스 A, B 및 C를 포함하는 혼합물에서; PB는 가스 B의 부분 압력; PC는 가스 C의 부분 압력입니다. 그런 다음 총 압력은 방정식 1에 의해 제공됩니다.
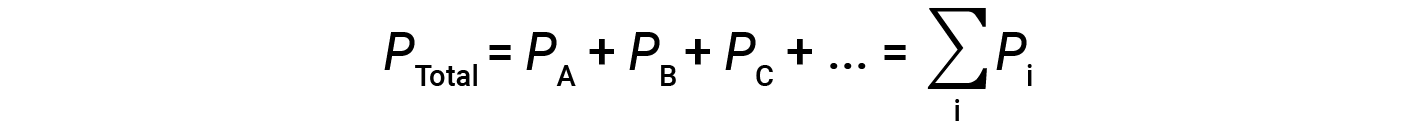
이것은 부분적으로 압력의 달튼의 법칙입니다 : 이상적인 가스의 혼합물의 총 압력은 구성 요소 가스의 부분 압력의 합계와 동일합니다.
n A, nB및 nC를 혼합물내의 각 가스의 두더지 수로 보자. 각 가스가 이상적인 가스 방정식에 순종하는 경우 부분 압력은 다음과 같이 기록될 수 있습니다.
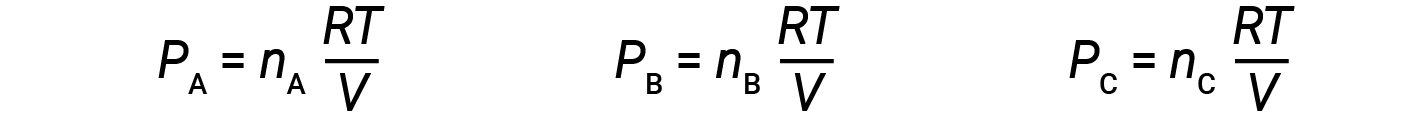
모든 가스는 동일한 온도에 있고 동일한 부피를 차지하기 때문에 방정식 1로 대체하면 다음을 제공합니다.
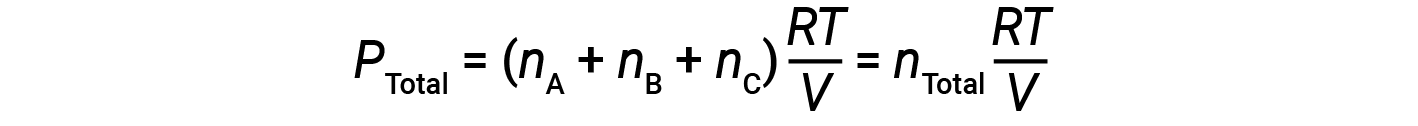
방정식은 일정한 온도와 일정한 부피에서 가스 샘플의 총 압력이 존재하는 가스의 총 두더지 수에 의해 결정된다는 것을 나타냅니다.
가스의 혼합물의 경우, 두더지 분획이라고 불리는 양을 도입하는 것이 편리하며, 이는 존재하는 모든 물질의 총 두더지 수로 나눈 혼합물에서 특정 물질의 두더지 수로 정의된다. 수학적으로, B및 C와 혼합물에서 물질 A의 두더지 분수는
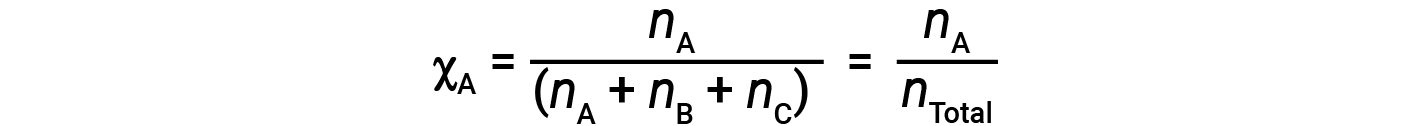
마찬가지로 B와 C의 두더지 분수는;
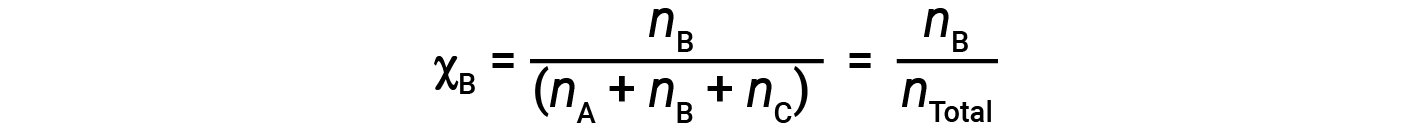
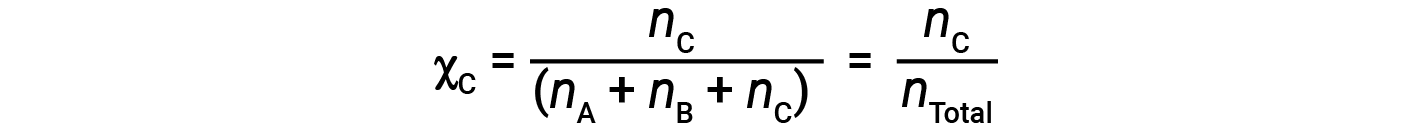
A의 두더지 분수와 부분 압력에 대한 방정식을 결합하면 다음과 같은 수식이 있습니다.
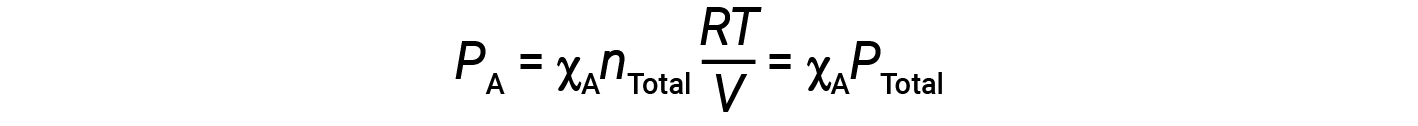
가스 A의 부분 압력은 두더지 분획을 통해 가스 혼합물의 총 압력과 관련이 있습니다.
즉, 가스혼합물의 가스의 압력은 두더지 분획의 생성물이며 혼합물의 총 압력이다.
이 텍스트는 Openstax, 화학 2e, 섹션 9.3: 기체 물질의 스토이치오메트리, 혼합물 및 반응에서 채택됩니다.
장에서 5:

Now Playing
5.4 : 혼합기체 - 돌턴의 분압 법칙
기체
38.3K Views

5.1 : 압력과 압력의 측정
기체
34.9K Views

5.2 : 기체 법칙
기체
64.1K Views

5.3 : 이상기체 법칙의 응용: 몰질량, 밀도, 부피
기체
55.5K Views

5.5 : 화학양론과 기체
기체
23.9K Views

5.6 : 기체 분자 운동론: 기본 가정
기체
32.7K Views

5.7 : 기체 분자 운동론과 기체 법칙
기체
31.8K Views

5.8 : 분자 속도와 운동에너지
기체
26.7K Views

5.9 : 분출과 확산
기체
28.2K Views

5.10 : 실제기체 - 이상기체 법칙에서 도출
기체
34.0K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유