일부 고체는 승화로 알려진 공정을 통해 액체 상태를 우회하여 기체 상태로 직접 전환할 수 있습니다. 실온 및 표준 압력에서, 드라이 아이스 (솔리드 CO2)숭고한 조각, 이제까지 어떤 액체를 형성하지 않고 점차적으로 사라지는 것처럼 보입니다. 눈과 얼음은 물의 용융점 아래 온도에서 승화, 바람에 의해 가속 될 수있는 느린 과정과 높은 고도에서 감소 대기압. 고체 요오드가 따뜻해지면 고체 숭고한 보라색 증기가 형성됩니다. 승화의 역은 기체 물질이 액체 상태를 우회하여 고체 상태에서 직접 응축되는 과정인 증착이라고 합니다. 서리의 형성은 증착의 예입니다.
기화와 마찬가지로 승화 과정은 분자 간 매력을 극복하기 위해 에너지의 입력이 필요합니다. 따라서 승화는 종외상 전환입니다. 승화의 엔탈피인 ΔH서브는물질의 두더지 1개를 고체로부터 기체 상태로 변환하는 데 필요한 에너지이다. 예를 들어, 이산화탄소의 승화는 다음과 같은 것으로 표현됩니다.

마찬가지로, 증착의 역방향 프로세스에 대한 엔탈피 변화는 크기가 같지만 승화에 대한 서명과 는 반대입니다. 증착은 분자 간 힘의 형성을 수반하기 때문에, 그것은 퇴행성 위상 전이이다.

주어진 단계 전환을 달성하기 위해 분자 간 매력을 극복해야하는 정도를 고려하십시오. 고체를 액체로 변환하려면 이러한 어트랙션을 부분적으로만 극복해야 합니다. 기체 상태로의 전환은 완전히 극복되어야 합니다. 그 결과, 물질에 대한 융합의 엔탈피는 기화의 엔탈피보다 적습니다. 이 동일한 논리는 주어진 물질에 대한 모든 위상 변경의 엔탈피 사이의 대략적인 관계를 도출하는 데 사용할 수 있습니다. 완전히 정확한 설명은 아니지만, 승화는 헤스의 법칙을 적용하기 위해 순차적으로 용융의 순차적 2단계 과정으로 모델링될 수 있다. 이러한 방식으로 볼 때, 물질에 대한 승화의 엔탈피는 융합과 기화의 엔탈피의 합으로 추정될 수 있다.
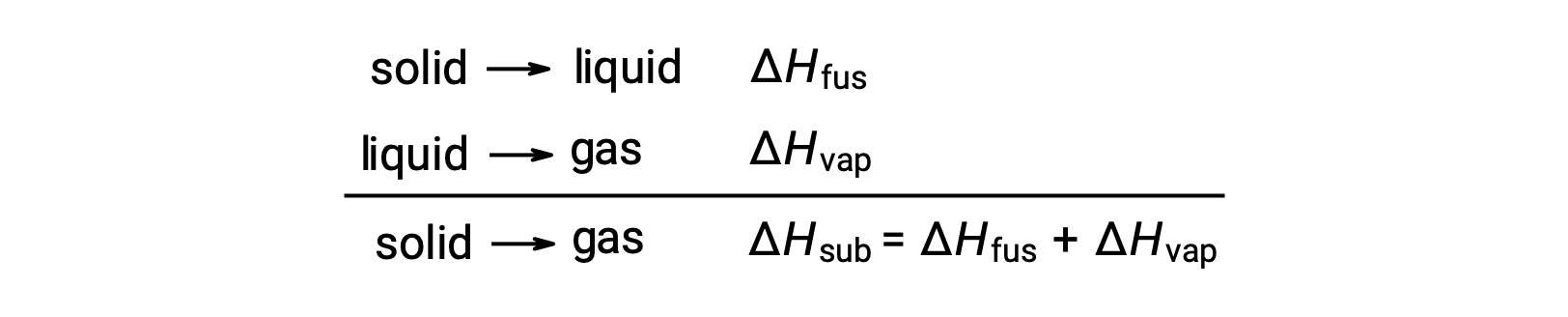
Copyright © 2025 MyJoVE Corporation. 판권 소유