엔트로피는 상태 기능이므로 화학 반응(ΔS°rxn)에대한 표준 엔트로피 변화는 제품과 반응제 간의 표준 엔트로피의 차이로부터 계산될 수 있다.
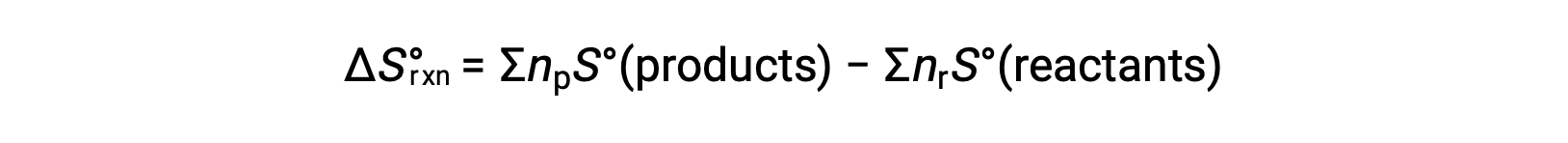
여기서 np 및 nr은 제품 및 반응제의 균형 잡힌 방정식에서 stoichiometric 계수를 각각 나타낸다.
예를 들어,실온에서 다음 반응을 위한 ΔS°rxn
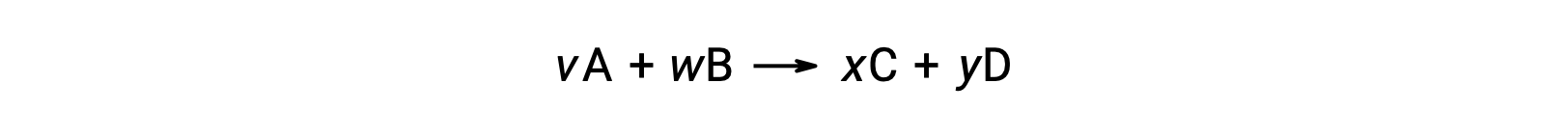
다음과 같이 계산됩니다.
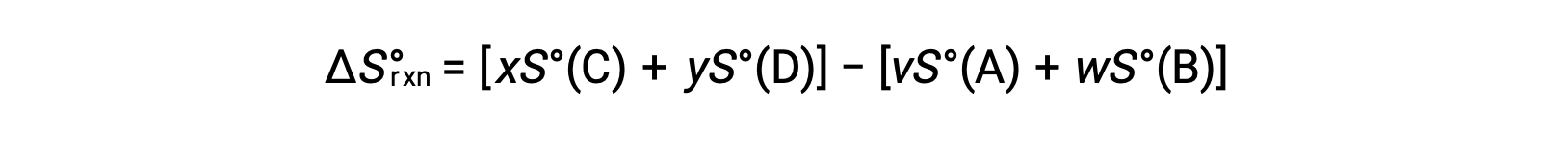
표준 엔트로피의 부분 목록이 표에 제공됩니다.
| 물질 | S° (J / mol· K) |
| C(s,흑연) | 5.740 |
| C(s,다이아몬드) | 2.38 |
| CO(g) | 197.7 |
| CO2 (g) | 213.8 |
| CH4 (g) | 186.3 |
| C2H4 (g) | 219.5 |
| C2H6 (g) | 229.5 |
| CH3OH(l) | 126.8 |
| C2H5OH(l) | 160.7 |
| H2 (g) | 130.57 |
| H(g) | 114.6 |
| H2O(g) | 188.71 |
| H2O(l) | 69.91 |
| HCI(g) | 186.8 |
| H2S(g) | 205.7 |
| O2 (g) | 205.03 |
ΔS°의 결정
기체 H2O의 1 두더지가 액체 H2O의 1 두더지로 변경되는 물의 응축을 고려하십시오.
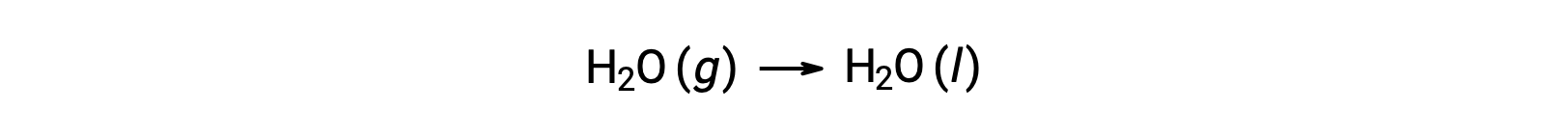
반응에 대한 표준 엔트로피 변화, ΔS°rxn은 표준 어음 엔트로피 및 스토이치오메트릭 계수를 사용하여 계산된다.
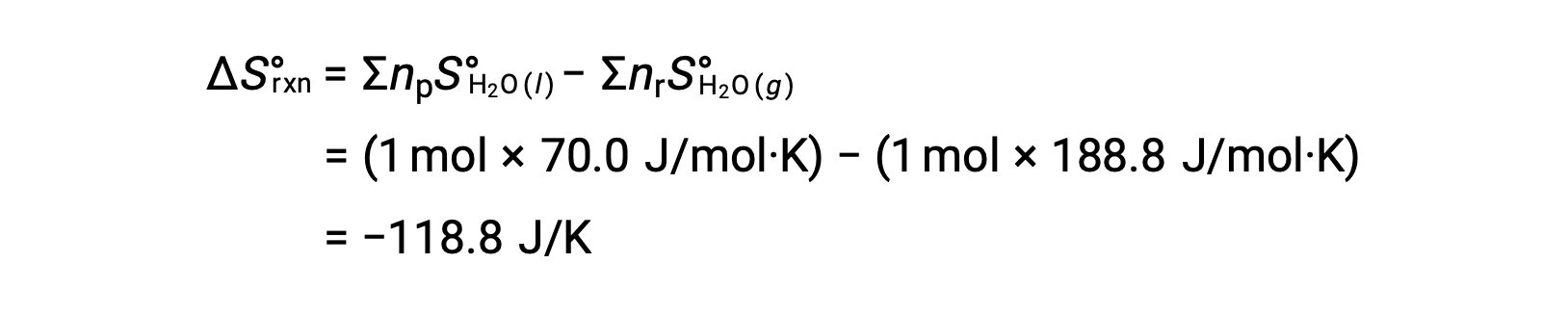
ΔS°rxn의 값은 이 위상 전환(응축)에 예상대로 음수입니다.
두 번째 예로, 메탄올, CH3OH의 연소를 고려하십시오.
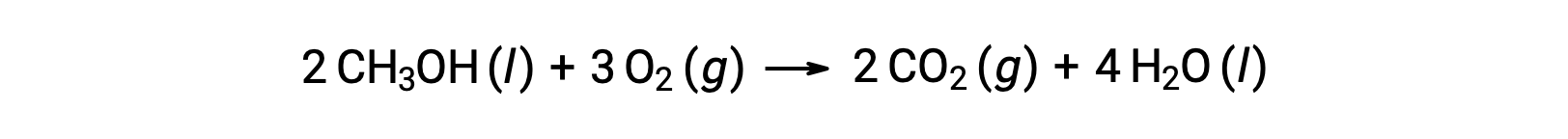
반응의 표준 엔트로피 변화를 계산하기 위해 동일한 절차가 수행됩니다.
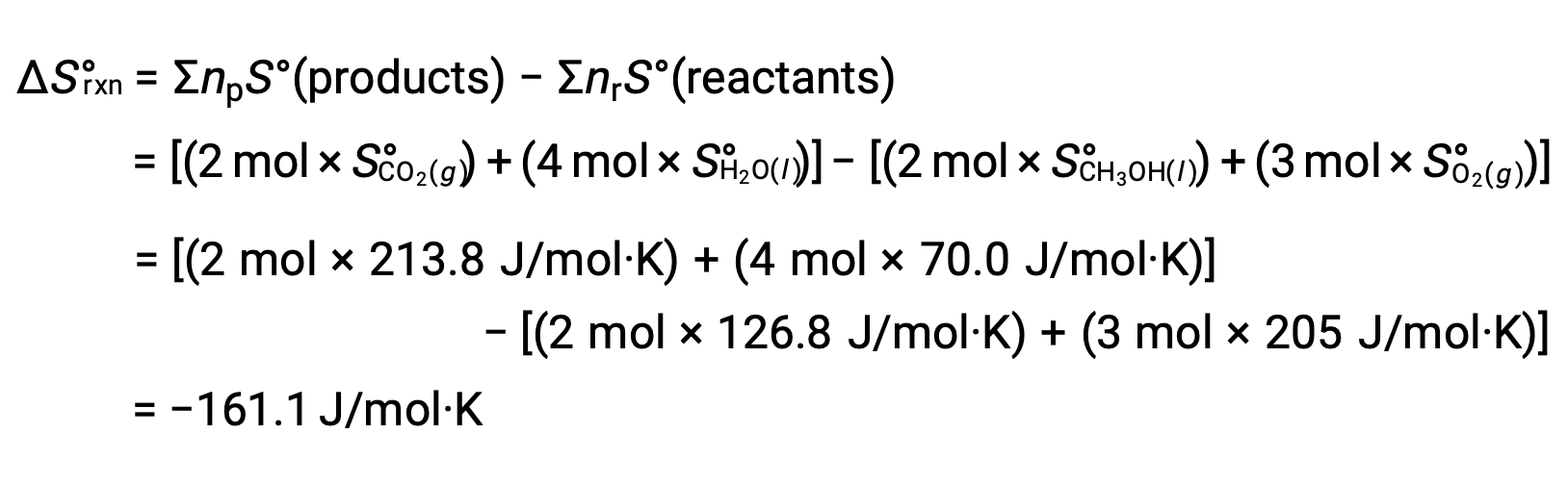
이 텍스트는 Openstax, 화학 2e, 제 16.2 장: 열역학의 두 번째 및 세 번째 법칙에서 채택됩니다.
Copyright © 2025 MyJoVE Corporation. 판권 소유