JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
라이브를 떠올리 Drosophila Glial - 신경근육학 융티온
요약
우리는 공촛점 현미경과 형광 염료를 사용하여 라이브 파리 애벌레의 소설 내부 아웃 조직 준비에 Glia - 신경근육학 시냅스의 구조 기능을 설명했다. 우리는 HRP에 형광 기본 항체 살 신경 터미널로 표시하고, 또한 형광 Dextrans와 perisynaptic 공간을 시각.
초록
우리의 프로젝트는 개발 애벌레의 날아 신경근육학의 버렸네에서 GFP 분류 glial 구조를 발견. 라이브 glial - 신경 근육 시냅스의 개발 봐, 우리가 사는 그대로 애벌레의 기능을 가진 애벌레 조직 준비를 개발뿐만 아니라, 좋은 광학 특성을했다. 이 새로운 준비도 버렸네에 perfusates의 액세스 허용. 우리는 파리 애벌레를 사용하여 인공 hemolymph에서 그들을 열중하고, 그들을 재미하여 정상적인 신체 리듬 수축을 완화. 다음 우리는 각 동물의 후부 세그먼트를 해부하고 뭉툭한 곤충 핀으로 뱃속을 통해 뒤로 입 부분을 밀고. 이것은 양말 안에 아웃을 바꾼 것처럼, 애벌레 신체 벽 everted. 우리는 울트라 미세 해부 가위로 절개를 완료하기 때문에 신체 벽 근육의 내장 측면을 노출. NMJ에 glial 구조는 glial 특정 발기인의 통제하에 멤브레인 대상으로 GFP를 표명했다. 근육의 포스트 시냅스 막, SSR (Subsynaptic Reticula)는 synaptically dsRed 대상으로 표시됩니다. 우리는 심하게 모터 신경 터미널 버렸네의 세 번째 부분을 라벨을해야했습니다. 이렇게하려면 우리는 멀리 붉은 발광 flurophore에 복합, HRP에 기본 항체 적용. 모터 신경 터미널과 SSR 사이 perisynaptic 공간으로 염료 확산 속성에 대한 테스트하기 위해, 우리는 멀리 붉은 발광 flurophore 및 회수 이미지를 복합 대형 Dextran 분자의 솔루션을 적용.
프로토콜
1 부 : 조직 준비
- 우리의 목표는 신경 시스템이 그대로 비행 유충의 조직 준비이지만, 본문 벽 근육의 내부 표면은 인공 hemolymph에 노출되며, 가까운 좋은 광학 현미경 커버 슬립에 위치하실 수 있습니다. 즉, 애벌레 준비 밖으로 안으로.
기존의 조직 준비는 절삭 달아 및 신체 벽 근육을 스트레칭하고, 때로는 신경계의 일부를 제거 참여 이후, 우리는 다른 접근이 필요했습니다.
우리가 구조 기능과 버렸네에서 시간이 지남에 따라 구조적인 변화를 잘 보라 얻을 싶어서 안으로 아웃 동물을 원했고, 우리는 신경계를 지키고 싶었어요. 우리는 또한 조직을 스트레칭 방지하려고하고, 근육 트위치 및 이미지를 망치 할거라 스트레치 수용체를 활성화. - 첫째, 동물을 무대. 셋째 애벌레 먹이 및 세 번째 애벌레 완더링 것은 우리가 W3 애벌레에서 보여주는 거고 그럼 해부하다에 크고 쉽습니다. 이 동물은 터비 표현형을 가지고 있으며, 다양한이므로 에버트하기 쉽습니다.
우리는 우리가 적극적으로 W3 애벌레를 포함하여 크롤 링 봤다 애벌레를 사용합니다. - 이중 소주 H2O의 배양 접시에있는 매우 부드러운 페인트 브러쉬와 구더기의 표면을 청소하십시오. 클린 애벌레 더 광학을 가지고 있고 청소 박테리아를 감소시킵니다.
- 3 ML 얼음 추위에 대한 HL - 6의 작은 페트리 접시, 그리고 인공 hemolymph에 동물을 전송합니다. 동물이 이동 중지하고, (5 분) 끝날 때까지 얼음 접시를 넣어.
- 한 손으로 그리고 다른 봄 가위에 아주 좋은 팁 포셉 잡아. 내 지배적인 손으로 가위를 사용합니다. 본문 벽 전체의 압력을 equlibrate하기 위해 가위로 시체 벽에 작은 구멍을 만듭니다.
- 아래 접시의 바닥에 포셉와 함께 부드럽게 동물을 보유하고 뒷부분이 세그먼트를 잘라. 내장 멀리 해부하다 지방 몸은 가능성 뱃속 밖으로 이동합니다. 또한이 조직을 버려야.
- 좋은 포셉 함께 그릇 바닥으로부터 유충을 잡아. 에서 # 0 곤충 핀을 보유 (뭉툭한 끝)와 애벌레의 입 부분에 대해 그것을 밀어. 밖으로 안쪽에 양말 어져 같은 뱃속을 통해 입 부분을 밀어.
- 조직 밖으로 내부는 그림과 같이 표시됩니다 : 아래. 울트라 미세 해부 도구를 사용하여, 신체 벽에서 지방 몸과 trachioles 멀리 해부하다. trachioles 당겨하지 진짜 열심히 노력하거나, 신경 계통을 분리합니다. trachioles을 추출하면 신체 근육 벽에 구멍을 찢어 것입니다.
당신이 할 수만큼 지방 시신을 제거합니다. 이러한 구조 모두는 조직의 광학 품질을 방해. 이 준비를하기 전에 커피를 건너 뛰도록 할 수 있습니다. - 작업이 완료되면 근육은 반투명, 불투명 또는 흰색되지 않습니다. 당신은 조미료없이 HL - 6에 조직 준비를 넣으면 CNS의 모터 패턴 발생기가 작동되기 때문에, 적당한 온도에서, 그것은 가능성이 리드미컬 계약 것입니다.
분명히 계약 또는 부정기 계약 신체 벽 근육과 preps를 사용하지 마십시오.
신체 벽 밖으로 그대로 내부는 즉시 지느러미 및 복부 midlines 따라 반으로 접어 경향, 준비는 시각화에 대한 왼쪽이나 오른쪽으로 '헤미 - 동물 "를 제공하므로. - 1.9에는 워너 챔버와 같은 작은 볼륨 상업 회의소, 또는 다리를 커버 슬립 배열과 현미경 슬라이드 중 하나의 조직을 탑재합니다. 장착 조직에 대한 제안 제 3을 참조하십시오.
2 부 : HRP에 대한 찬란 표시 주요 항체로의 연결을 부통 라벨.
- 배양 접시에 드롭 HL - 6의 HRP에 대한 찬란 표시 주요 안티 - 본문 50 마이크로 리터 넣어. 염료 목욕의 내부 아웃 바디 벽면 준비 젖어. 당신은 5 분 후에 신경 터미널 라벨을 참조하지만, 완전하고 밝은 라벨 약 10-20 분 품어 수 있습니다.
- 상온에서 HL - 6의 10-30초에 대한 염료의에서 린스. 비 바운드 염료 때문에 세정주기가 적극 필요가 없다, 빨리 떨어져 rinses.
- 염료 농도와 필요에 따라 배양 시간을 다릅니다.
파트 3 : dextran flurophore 공액와 Perisynaptic 공간 라벨링
- 희석 찬란 복합 dextran 염료 HL - 6의 희석. 우리의 목적을 위해 잘 작동 집중했습니다 :
- 당신이 당신의 세포외 공간에 색소 접근의 타이밍에 대해 우려하지 않는 경우, "다리를"coverslip (4 부 참조)에 염료의 20 마이크로 리터 드롭을 넣고 색소 목욕탕에서 준비를 입금.
4 부 : 시각화 (공촛점 현미경 포함)에 대한 조직을 장착.
당신이 준비 (단기 관측)를 perfuse 필요는 없다거나 HL - 6 작은 목욕의 볼륨을 유지하려는 경우, 두 다리를 슬라이드 메서드를 사용하여
당신의 준비를 perfuse 싶다면, 재관류 챔버를 사용해보십시오. 우리는 MO를 사용워너 악기에서 dified 상공 회의소.
모두 수행에 대한 세부 정보.
두 다리를 슬라이드에 준비를 장착.
- 매우 깨끗한 현미경 슬라이드를 사용하십시오. 슬라이드에 Superglue이 광장, 18mm (# 1.5) coverslips. coverslips의 가장자리 사이에 2mm의 간격을 둡니다.
- 접착제가 완전히 마른하자, 또는 그것은 당신의 준비 주위 수성 매체를 통해 이상한 필름을 형성합니다.
- coverslips의 가장자리 사이의 애벌레 밖으로 안으로 위치. 당신은 애벌레가 대형이며 이미지 수집 시스템은 제한된 픽셀 배열이있다면 대각선의 준비를 위치해야 할 수도 있습니다.
- 18mm # 1.5 coverslip, (아주 깨끗한)로 조직을 커버. 슬라이드 최소한의 바셀린과 조직 측면 전표를 붙인 "가기"coverslip을 준수합니다.
- 상단 coverslip에 1.3379의 굴절률 (여러분이 HL - 6을 사용하는 경우)와 카길 사용자 지정 목적 기름 한 방울을 넣고이 어셈블리를 뒤집어.
- 목표쪽으로 당신의 현미경, 석유 측면에서 조직 어셈블리를 위치하고 목표를 중점을두고 있습니다.
수정된 재관류 챔버의 조직을 장착. - RC 20 챔버의 바닥을 형성 접착제 1.5 coverslip. RC - 20 지침에 따라 같은 챔버에서 조직을 놓습니다. 챔버의 지붕을 형성하는 대신 coverslip의 Nytex 메쉬의 조각을 사용합니다.
제 5 부 : 대표 결과 :
- 인사이드 - 아웃 조직 준비 해부 순서 :
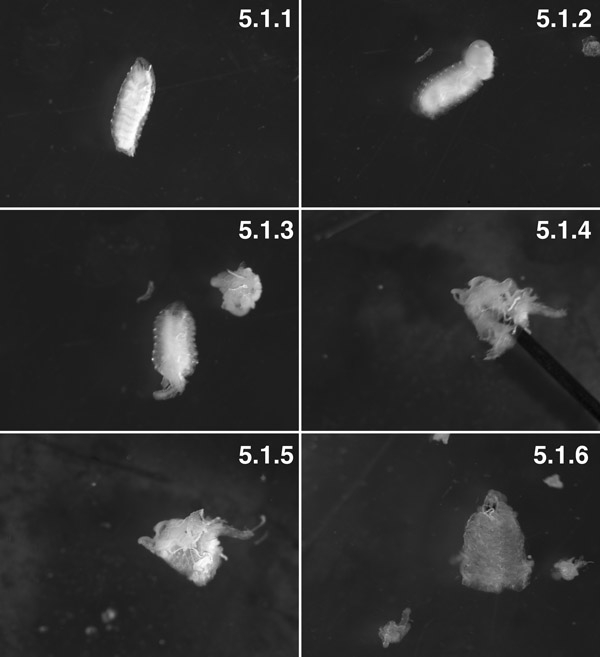
W3 애벌레, 세탁 ( "터비"표현형) (5.1.1). W3 애벌레, 해부 후부 두 세그먼트. 당신은 횡단 바디 벽면 압력 (화살표)의 뱃속에서 밀쳐 지방 시신을 볼 수 있습니다. 절개 전에 몸을 벽에 일분 (5.1.2)에 작은 구멍을 만들어 내장 "분화"를 최소화하기 위해보십시오. 내장과 함께 준비 밖으로 안으로 준비 (5.1.3)을 켜기 전에 해부 했어요. 준비 (5.1.4)의 루멘 내부 핀 (화살표)로 대부분 everted 준비,. 근육은 밖에서 지금과 표피 일부 지방 몸과 (5.1.5) 첨부 trachioles 함께 내부에 있습니다. 거의 모든 지방 몸과 해부 trachioles (5.1.6)와 완벽하게 해부 조직 준비.
- 애벌레 NMJ에서 안티 - HRP를 사용하여 라벨 살고 있습니다. glial 확장 (밖 준비 내부)로 대표 W3 애벌레 신경 근육 버렸네. 모터 신경 부통 터미널은 Cy5에 복합이다 HRP (마젠타), 대한 안티 몸을 기본으로 표시됩니다. glial 프로세스는 GFP (녹색)으로 표시됩니다.
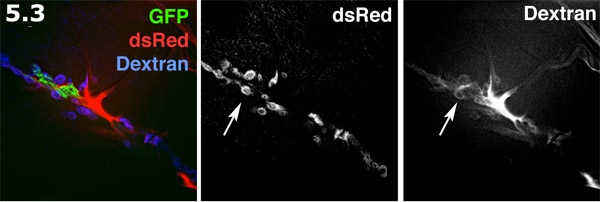
- Perisynaptic 공간 찬란 준비 밖으로 안으로 알렉사 680 dextran과 시각. glial 과정 (녹색)가 막 타겟 GFP와 함께 표시됩니다. 근육 표면에 포스트 시냅스 SSR (파란색)은 dsRed와 함께 표시됩니다. 알렉사 dextran (적색) 양식 세포 분야에 중점을두고 있습니다. dextran 염료 perisynaptic 공간에 도넛 모양의 웅덩이를 형성합니다. dextran 라벨 및 라벨 dsRed SSR은 회색으로 표시됩니다. perisynaptic 공간 (화살표)를 강조 여러 도넛 모양의 염료 풀을합니다.
Access restricted. Please log in or start a trial to view this content.
토론
이 절차는 라이브 표시된 단백질 및 세포 프로세스의 장기 이미징을 허용합니다. 우리가 설명에서 현장 조직 준비는 손상과 기능 CNS, PNS 및 반사 회로를했다. 이 조직 준비는 애벌레 몸 벽 근육이 늘어는 표준 애벌레 플라이 근육 프로토콜 (그것이 밖으로 고정된 경우) 이상의 장점이 있습니다. 스트레칭하면 시냅스 형태를 왜곡하고 반사 기반의 수축을 일으킬 수있다. 준비 밖으로 우리의 ?...
Access restricted. Please log in or start a trial to view this content.
감사의 말
이 프로젝트는 CIHR와 NSERC에 의해 후원되었다. 우리는 dsRed 표시된 SSR (BJ 선)와 UBC 바이오 이미징 시설을 표현 파리 변종의 생성에 기여를위한 바브 Jusiak을 인정하고 싶습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments | |
| HL-6: Artifical Drosophila hemolymph, with 5 mM L-glutamate added, and 2 mM Calcium. | Reagent | N/A | NA | 5 mM L-glutamate blocked muscle contractions. We used Molecular grade L-Glutamate (Sigma).2 mM Calcium is close to physiological Calcium levels in natural larval hemolymph.References: Macleod et al 2002 and Macleod 2004 |
| Dextran, Alex Fluor 680; 10,000 MW, anionic, fixable | Reagent | Molecular Probes, Life Technologies | D34680 | Use a small volume perfusion chamber to keep the total volume of dye low |
| Anti-HRP-CY5 conjugate (goat) | Reagent | Jackson ImmunoResearch | 123-175-021 | Dilute 2.0 mg into 1 ml ddH2O; aliquot into 4 microliter aliquots. Freeze at –20C. Dilute one aliquot into 100 microliters of HL-6 |
| Alexa 647 antibody labeling kit | Reagent | Molecular Probes, Life Technologies | A10475 | We prepared a total of 80 micro liters of conjugated primary antibody, and stored as 2 microliter aliquots. We diluted each aliquot into 100 microliter of HL-6 for labeling. |
| Custom Formulated Objective Oil, refractive index 1.3379 | Reagent | Cargill Labs | Custom Formulated | |
| Ultra Fine Forceps | Tool | Fine Science Tools | 11252-23 or 11295-20 | |
| Spring scissors | Tool | Fine Science Tools | 91500-09 | |
| Ultra fine clipper scissors | Tool | Fine Science Tools | 15200-00 | |
| Perfusion Chamber RC 20 Series | Tool | Warner Instruments | 64-02222 | |
| Spinning Disc confocal | Microscope | Quorum Technologies | Quorum Wave FX | Mounted on a Leica DMI6000 Inverted Microscope |
참고문헌
- Macleod, G. T., Marin, L., Charlton, M., Atwood, H. L. Synaptic Vesicles: Test for a role in presynaptic Calcium regulation. J. Neurosci. 24, 2496-2505 (2004).
- Macleod, G. T., Hegstro, M., Wojtowicz, M., Charlton, M. P., Atwood, H. L. Fast Calcium signals in Drosophila motor neuron terminals. J. Neurophysiology. 88, 2659-2663 (2002).
- Morales, M., Ferrus, A., Martinez-Padron, M. Presynaptic calcium-channel currents in normal and csp mutant Drosophila peptidergic terminals. Eur J Neurosci. 11, 1818-1826 (1999).
- Stork, T., Engelen, D., Krudewig, A., Silies, M., Bainton, R. J., Kla¨mbt, C. Organization and Function of the Blood–Brain Barrier in Drosophila. J. Neurosci. 28, 587-597 (2008).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유